 |
|
���������� ������:: ��� :: ������� ������ :: ����� ����� �������� :: ������ ����� ���� :: ������� ��� ���������� :: �������� ����� :: ������ ����� :: ������ ���� :: ������� ���� :: ������� ������ ���������� �����:: ���������� �� ������� Windows XP :: ������� �������� :: ��������� ������ :: ������ ������ :: ������� ������ :: ����� ���� :: ������ � ������ ����������� :: ���������� ���������, ��� Der Irrgarten von Andorra :: ��� �������, ���������� �������! (����� ���������� ����) :: �� ������ |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 2)Кобаламины Кобалами'ны,природные биологически активные кобальторганические соединения. Структурной основой К. является корриновое кольцо, состоящее из 4 пиррольных ядер, у которых атомы азота связаны с центральным атомом кобальта. Наиболее известно три К., различающиеся природой заместителя при атоме кобальта: цианкобаламин,или витамин B 12, и его коферментные формы (см. Коферменты ) :метилкобаламин и 5'-дезоксиаденозилкобаламин. Витамин В 12 -продукт жизнедеятельности кишечной флоры.Если по какой-либо причине всасывание витамина B 12нарушается, у человека (или животного) развивается авитаминоз B 12. К. отлагаются в печени в виде 5’'-дезоксиаденозилкобаламина, принимающего участие в ряде ферментативных реакций, сопровождающихся внутримолекулярными перегруппировками. Метилкобаламин участвует в биосинтезе аминокислоты метионина, метана и уксусной кислоты. В промышленном масштабе витамин B 12получают методом микробиологического синтеза. Кобальт Ко'бальт(лат. Cobaltum), Со, химический элемент первой триады VIII группы периодической системы Менделеева; атомный номер 27, атомная масса 58,9332; тяжёлый металл серебристого цвета с розоватым отливом. В природе элемент представлен одним устойчивым изотопом 59Со; из полученных искусственно радиоактивных изотопов важнейший 60Со. Историческая справка. Окись К. применялась в Древнем Египте, Вавилоне, Китае для окрашивания стекол и эмалей в синий цвет. Для той же цели в 16 в. в Западной Европе стали пользоваться цафрой, или сафлором, - серой землистой массой, которая получалась при обжиге некоторых руд, носивших название «кобольд». Эти руды выделяли при обжиге обильный ядовитый дым, а из продукта их обжига выплавить металл не удавалось. Средневековые рудокопы и металлурги считали это проделками мифических существ - кобольдов (от нем. Kobold - домовой, гном). В 1735 шведский химик Г. Брандт, нагревая в горне с дутьём смесь цафры с углем и флюсом, получил металл, который назвал «корольком кобольда». Вскоре это название было изменено на «кобольт», а затем на «кобальт». Распространение в природе. Содержание К. в литосфере 1,8·10 -3% по массе. В земной коре он мигрирует в магмах, горячих и холодных водах. При магматической дифференциации К. накапливается главным образом в верхней мантии: его среднее содержание в ультраосновных породах 2·10 -2%. С магматическими процессами связано образование так называемых ликвационных месторождений кобальтовых руд. Концентрируясь из горячих подземных вод, К. образует гидротермальные месторождения; в них Со связан с Ni, As, S, Cu. Известно около 30 минералов К. (см. Кобальтовые руды ) . В биосфере К. преимущественно рассеивается, однако на участках, где есть растения - концентраторы К., образуются кобальтовые месторождения. В верхней части земной коры наблюдается резкая дифференциация К. - в глинах и сланцах в среднем содержится 2·10 -3% К., в песчаниках 3·10 -5, в известняках 1·10 -5. Наиболее бедны К. песчаные почвы лесных районов. В поверхностных водах К. мало, в Мировом океане его лишь 5·10 -8%. Будучи слабым водным мигрантом, К. легко переходит в осадки, адсорбируясь гидроокисями марганца, глинами и др. высокодисперсными минералами. Физические и химические свойства. При обычной температуре и до 417°С кристаллическая решётка К. гексагональная плотноупакованная (с периодами а = 2,5017
Конфигурация внешних электронных оболочек атома К. 3 d 74s 2.В соединениях К. проявляет переменную валентность. В простых соединениях наиболее устойчив Со (II), в комплексных - Со (III). Для Со (I) и Co (IV) получены только немногочисленные комплексные соединения.При обыкновенной температуре компактный К. стоек против действия воды и воздуха. Мелко раздробленный К., полученный восстановлением его окиси водородом при 250 °С (пирофорный К.), на воздухе самовоспламеняется, превращаясь в СоО. Компактный К. начинает окисляться на воздухе выше 300 °С; при красном калении он разлагает водяной пар: Со + H 2O = CoO + H 2. С галогенами К. легко соединяется при нагревании, образуя галогениды СоХ 2. При нагревании К. взаимодействует с S, Se, Р, As, Sb, С, Si, В, причём состав получающихся соединений иногда не удовлетворяет указанным выше валентным состояниям (например, Со 2Р, Co 2As, CoSb 2, Со 3С, CoSi 3). В разбавленных соляной и серной кислотах К. медленно растворяется с выделением водорода и образованием соответственно хлорида CoCl 2и сульфата CoSO 4. Разбавленная азотная кислота растворяет К. с выделением окислов азота и образованием нитрата Co (NO 3) 2. Концентрированная HNO 3пассивирует К. (см. Пассивирование металлов ) .Названные соли Со (II) хорошо растворимы в воде [при 25 °С 100 г воды растворяют 52,4 г CoCl 2, 39,3 г CoSO 4, 136,4 г.Со (NO 3) 2]. Едкие щёлочи осаждают из растворов солей Со 2+синюю гидроокись Со (ОН) 2, которая постепенно буреет вследствие окисления кислородом воздуха до Со (ОН) 3. Нагревание в кислороде при 400-500 °С переводит CoO в чёрную закись-окись Co 3O 4, или CoO·Co 2O 3- соединение типа шпинели.Соединение того же типа CoAl 2O 4или CoAl 2O 3синего цвета (тенарова синь, открытая в 1804 Л. Ж. Тенаром) получается при прокаливании смеси CoO и Al 2O 3при температуре около 1000 °С. Из простых соединений Со (III) известны лишь немногие. При действии фтора на порошок Со или CoCl 2при 300-400 °С образуется коричневый фторид CoF 3. Комплексные соединения Со (III) весьма устойчивы и получаются легко. Например, KNO 2осаждает из растворов солей Со (II), содержащих CH 3COOH, жёлтый труднорастворимый гексанитрокобальтат (III) калия K 3[Co (NO 2) 6]. Весьма многочисленны кобальтаммины (прежнее название кобальтиаки) - комплексные соединения Со (III), содержащие аммиак или некоторые органические амины. Получение и применение. Минералы К. редки и не образуют значительных рудных скоплений. Главным источником промышленного получения К. служат руды никеля,содержащие К. как примесь. Переработка этих руд весьма сложна, и её способ зависит от состава руды. В конечном итоге получают раствор хлоридов К. и никеля, содержащий примеси Cu 2+, Pb 2+, Bi 3+. Действием H 2S осаждают сульфиды Cu, Pb, Bi, после чего пропусканием хлора переводят Fe (II) в Fe (lll) и добавлением СаСО 3осаждают Fe (OH) 3и CaHAsO 4. От никеля К. отделяют по реакции: 2CoCl 2+NaCIO+4NaOH+H 2O = 2Co (OH) 3Ї+5NaCI. Почти весь никель остаётся в растворе. Чёрный осадок Со (ОН) 3прокаливают для удаления воды; полученный окисел Co 3O 4восстанавливают водородом или углеродом. Металлический К., содержащий до 2-3% примесей (Ni, Fе, Cu и др.), может быть очищен электролизом. К. применяется главным образом в виде сплавов; таковы кобальтовые сплавы,а также сплавы на основе др. металлов, где К. служит легирующим элементом. Сплавы К. используют в качестве жаропрочных и жаростойких материалов, при изготовлении постоянных магнитов, режущего инструмента и др. Порошкообразный К., а также Co 3O 4служат катализаторами. Фторид CoF 3применяется как сильный фторирующий агент, тенарова синь и особенно силикат К. и калия (см. Смальта ) -как краски в керамической и стекольной промышленности. Соли К. применяют в сельском хозяйстве как микроудобрения,а также для подкормки животных. С. А. Погодин. Из искусственно радиоактивных изотопов К. наибольшее значение имеет 60Со с периодом полураспада T 1/ 2= 5,27 года, широко используемый как гамма-излучатель. В технике его применяют для гамма-дефектоскопии. В медицине - главным образом при лучевой терапии опухолей (см. Гамма-установка ) и для стерилизации медикаментов. Он служит также для уничтожения насекомых в зерне и овощах и для консервирования пищевых продуктов. Др. радиоактивные изотопы - 56Co (T 1/ 2= 77 сут), 57Со (270 сут) и 58Со (72 сут) как менее опасные (небольшой период полураспада) используют в качестве изотопных индикаторов при исследовании обмена веществ, в частности для изучения распределения К. в организме животных (с помощью радиоактивного К. исследовали проницаемость плаценты и т.п.). К. в организме. Постоянно присутствуя в тканях животных и растений, К. участвует в обменных процессах. В животном организме содержание К. зависит от его уровня в кормовых растениях и почвах. Концентрация К. в растениях пастбищ и лугов в среднем составляет 2,2·10 -5-4,5·10 -5% на сухое вещество. Способность к накоплению К. у бобовых выше, чем у злаковых и овощных растений. В связи с высокой способностью к концентрации К. морские водоросли по его содержанию мало отличаются от наземных растений, хотя в морской воде К. значительно меньше, чем в почвах. Суточная потребность человека в К. равна примерно 7-15 мкги удовлетворяется за счёт его поступления с пищей. Потребность животных в К. зависит от их вида, возраста и продуктивности. Наиболее нуждаются в К. жвачные, которым он необходим для развития симбиотической микрофлоры в желудке (главным образом в рубце). Суточная потребность в К. у дойных коров составляет 7-20 мг,у овец - около 1 мг.При недостатке К. в рационе снижается продуктивность животных, нарушаются обмен веществ и кроветворение, у жвачных возникают эндемичные заболевания - акобальтозы. Биологическая активность К. определяется его участием в построении молекулы витамина B 12и его коферментных форм, фермента транскарбоксилазы. К. необходим для проявления активности ряда ферментов. Он влияет на обмен белка и синтез нуклеиновых кислот, на обмен углеводов и жиров, окислительно-восстановительные реакции в животном организме. К. - мощный активатор кроветворения и синтеза эритропоэтинов . К. участвует в ферментных системах клубеньковых бактерий, осуществляющих фиксацию атмосферного азота; стимулирует рост, развитие и продуктивность бобовых и растений ряда др. семейств. Ю. И. Раецкая.
Лит.:Перельман Ф. М., Кобальт, в кн.: Краткая химическая энциклопедия, т. 2, М., 1963; Некрасов Б. В., Основы общей химии, т. 3, М., 1970; Гудима Н. В., Металлургия кобальта, в кн.: Справочник металлурга по цветным металлам, т. 2, М., 1947; Ястребов А. П., Действие кобальта на образование эритроцитов, в кн.: Патофизиология эритропоэза (Тр. 7 конференции Уральского Межобластного общества патофизиологов), Свердловск, 1965; Ягодин Б. А., Кобальт в жизни растений, М., 1970; Trace element metabolism in animals. Proceedings of International symposium Aberdeen, Scotland, July 1969, Edin. - L., 1970; Northrop D. B., Transcarboxylase, «Journal of Biological Chemistry», 1969, v. 244, № 21, p. 5808-27. Кобальтин Кобальти'н,кобальтовый блеск, минерал, сульфоарсенид кобальта CoAsS, относящийся к сложным сульфоарсенидам. Содержит Со 35,41%, As 45,26% и S 19,33%. Частично Со может замещаться Fe и Ni (разновидности феррокобальтин и никелькобальтин). Кристаллизуется в кубической системе. Встречается в виде кристаллов кубического облика, а также в более сложных комбинационных формах (пентагондодекаэдр, октаэдр и др.). Наиболее обычны зернистые агрегаты. Цвет желтовато-белый с розоватым оттенком. Непрозрачен, блеск металлический. Твёрдость по минералогической шкале 5,5; плотность 6100-6400 кг/ м 3. Обычно встречается в контактово-метасоматических месторождениях вместе с пирротином, пиритом, арсенопиритом, халькопиритом и др. сульфидами; в гидротермальных золотокварцевых жилах; в жилах Co-Ni-Ag-Bi-U формации. К. - один из главных рудных минералов для получения кобальта, его сплавов и соединений. Г. П. Барсанов. Кобальтовая пушка Ко'бальтовая пу'шка,аппарат для проведения гамма-терапии; то же, что гамма-установка . Кобальтовые руды Ко'бальтовые ру'ды,природные минеральные образования, содержащие кобальт в количествах, при которых экономически целесообразно его извлечение. В природе известно более 100 кобальтсодержащих минералов, в том числе около 30 собственно кобальтовых, но только 4 распространены широко: кобальтин CoAsS, скуттерудит CoAs 3, шмальтин-хлоантит (Co, Ni, Fe) As 3 - 2, саффлорит (Со, Fe) As 2. Характерной особенностью кобальта является его способность образовывать промышленные концентрации в месторождениях других металлов (никеля, меди и железа), где он представлен не только собственно кобальтовыми минералами, а в основном кобальтсодержащими рудными минералами (пирит, пентландит, асболаны). По минеральному и химическому составу различаются 3 типа К. р.: мышьяковые, сернистые и окисленные. Главные минералы мышьяковых К. р. - соединения Со, Ni и Fe с мышьяком (арсениды) или с мышьяком и серой (сульфоарсениды). Среди арсенидов различаются группы скуттерудита (до 20% Со), сложных смесей шмальтин-хлоантита (от 20 до 5-1% Со) и саффлорита-леллингита (от следов до 23- 28% Со). Примесь Со в никелевых арсенидах (раммельсбергит, никелин и др.) обычно не превышает нескольких %. К сульфоарсенидам относятся ряды: кобальтина-герсдорфита и глаукодота-арсенопирита (содержание Со от весьма незначительного в никелевых и железистых разностях до 33-34% в собственно кобальтовых). Среднее содержание Со в промышленных рудах обычно 1-2%. В составе руд могут присутствовать минералы меди, золота, серебра, висмута, урана. Бедные руды перед металлургическим переделом, как правило, подвергаются обогащению; более богатые могут использоваться непосредственно (в частности, с применением современных методов гидрометаллургии); при благоприятных условиях попутно извлекаются золото, серебро и др. ценные металлы. Среди месторождений мышьяковых К. р. важное промышленное значение имеют: в СССР Хову-Аксинское месторождение (в Тувинской АССР); за рубежом - месторождения района Бу-Аззер (Марокко). Сернистые К. р. относятся к типу комплексных руд никеля, меди и железа. Среди них выделяются магматические медно-никелевые в ультраосновных и основных породах, медно-колчеданные и скарново-магнетитовые. В первом типе главным кобальтсодержащим минералом является пентландит, в двух остальных - пирит с сильно колеблющимися примесями Со (до 2,5%-3%). Собственно кобальтовые сульфиды - кобальт-пентландит (Со, Fe, Ni) 9S 8, линнеит CO 3S 4, карролит CuCo 2S 4, каттиерит CoS 2и др. - сравнительно редки. Несмотря на невысокие средние содержания Со (от тысячных и сотых до десятых долей %), крупные размеры месторождений при комплексном использовании руд позволяют вести экономически выгодную добычу Со в значительных масштабах. В СССР кобальтсодержащие медно-никелевые руды известны в Красноярском крае (Норильск) и на Кольском полуострове; за рубежом - в сульфидных медно-никелевых месторождениях Канады. Окисленные К. р. принадлежат также к комплексным. Они образуются при выветривании на поверхности кобальт- и никельсодержащих ультраосновных пород или сернистых руд. Как в первом широко распространённом типе так называемых силикатно-никелевых руд (около 0,1% Со), так и во втором редком типе окисленных сернистых руд (1-4% Co), Co концентрируется преимущественно в непостоянных по составу гидроокислах марганца (асболанах), к которым в зоне окисления сульфидных руд присоединяются гидроокислы и карбонаты Со. Силикатно-никелевые руды известны: в СССР на Урале и в Казахстане; за рубежом на островах Куба и Н. Каледония, сернистые руды - в медных месторождениях Заира (Африка). Лит.:Крутов Г. А., Месторождения кобальта, М., 1959; Требования промышленности к качеству минерального сырья, в. 55 - Глазковский А. А., Кобальт, 2 изд., М., 1961. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 299, 300, 301, 302, 303, 304, 305, 306, 307, 308, 309, 310, 311, 312, 313, 314 |
 , с = 4,614
, с = 4,614
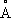 ), выше этой температуры решётка К. кубическая гранецентрированная (а = 3,5370
), выше этой температуры решётка К. кубическая гранецентрированная (а = 3,5370
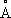 ). Атомный радиус 1,25
). Атомный радиус 1,25
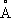 , ионные радиусы Co
2+0,78
, ионные радиусы Co
2+0,78
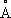 и Co
3+0,64
и Co
3+0,64
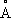 . Плотность 8,9 г/см
3(при 20°С):
t
nл1493° С
о,
t
к
ип3100°С. Теплоёмкость 0,44
кдж/(
кг·К)
,или 0,1056 кал/(
г·°С); теплопроводность 69,08
вт/(
м·К)
,или 165
кал/(
см·сек·°
С)
при 0-100 °С. Удельное электросопротивление 5,68·10
-8
ом·м,или 5,68·10
-6
ом·см(при 0°С). К. ферромагнитен, причём сохраняет ферромагнетизм от низких температур до точки Кюри, Q= 1121 °С (см.
Ферромагнетизм
)
.Механические свойства К. зависят от способа механической и термической обработки. Предел прочности при растяжении 500
Мн/м
2(или 50
кгс/мм
2)
для кованого и отожжённого К.; 242- 260
Мн/м
2для литого; 700
Мн/м
2для проволоки. Твёрдость по Бринеллю 2,8
Гн/м
2(или 280
кгс/мм
2) для наклёпанного металла, 3,0
Гн/м
2для осажденного электролизом; 1,2-1,3
Гн/м
2для отожжённого.
. Плотность 8,9 г/см
3(при 20°С):
t
nл1493° С
о,
t
к
ип3100°С. Теплоёмкость 0,44
кдж/(
кг·К)
,или 0,1056 кал/(
г·°С); теплопроводность 69,08
вт/(
м·К)
,или 165
кал/(
см·сек·°
С)
при 0-100 °С. Удельное электросопротивление 5,68·10
-8
ом·м,или 5,68·10
-6
ом·см(при 0°С). К. ферромагнитен, причём сохраняет ферромагнетизм от низких температур до точки Кюри, Q= 1121 °С (см.
Ферромагнетизм
)
.Механические свойства К. зависят от способа механической и термической обработки. Предел прочности при растяжении 500
Мн/м
2(или 50
кгс/мм
2)
для кованого и отожжённого К.; 242- 260
Мн/м
2для литого; 700
Мн/м
2для проволоки. Твёрдость по Бринеллю 2,8
Гн/м
2(или 280
кгс/мм
2) для наклёпанного металла, 3,0
Гн/м
2для осажденного электролизом; 1,2-1,3
Гн/м
2для отожжённого.