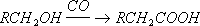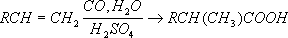|
|
���������� ������:: ��� :: ������ ������ ����� :: �������� ������� :: ������ ������� :: ���� ����� ����� :: ������ ������� �������� :: ������� ��� ���������� :: ����� ���� :: ������ ����� :: �������� ����� ���������� �����:: ���������� �� ������� Windows XP :: ������ ���� :: ���������� c���� :: ��������� ����� � �����-���������� :: ������, ������, ���� :: ������ � �������� :: ����������� ������ � ������ ������������ :: ���������� ������ :: �� ���� ����� �� �����... :: ������ ����������� |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 164)
С тех пор получены карбонилы многих металлов и некоторых неметаллов. В зависимости от числа атомов металла в молекуле К. м. могут быть «одноядерными» и «многоядерными»; известны также смешанные К. м., например [Co(CO)
4]
2Zn. О строении К. м. см.
Комплексные соединения,
Валентность.
Карбонилы никеля, железа, осмия, рутения - жидкости; большинство других К. м. - кристаллические вещества. К. м. диамагнитны, весьма летучи, чрезвычайно токсичны. Для меди, серебра, золота известны лишь карбонилгалогениды, Me(CO)X, устойчивые только в атмосфере окиси углерода. При нагревании выше определённой температуры К. м. разлагаются с выделением окиси углерода и металла в мелкодисперсном состоянии. Физические свойства важнейших К. м. приведены в таблице. Указанные в таблице К. м. хорошо растворимы в органических растворителях. Физические свойства некоторых карбонилов металлов
Общий способ получения К. м. заключается во взаимодействии окиси углерода с металлами или их солями при повышенных температурах и давлении. Наибольшее техническое значение имеют карбонилы никеля Ni(CO) 4, кобальта Со(СО) 4и железа Fe(CO) 3. Карбонилы применяют для получения чистых металлов, образующихся при их термическом разложении. Термическое разложение карбонилов кобальта, никеля и хрома используется для нанесения металлических покрытий, особенно на поверхности сложной формы. Карбопилы кобальта и никеля применяются в качестве катализаторов важных химических процессов. Их используют при синтезе карбоновых кислот и их производных из олефинов, акриловой кислоты из ацетилена, при гидроформилировании:
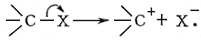
К. м. - хорошие антидетонаторы моторного топлива, однако при их сгорании образуются трудноудаляемые окислы. Некоторые карбонилы используются для получения совершенно чистой окиси углерода. Лит.:Белозерский Н. А., Карбонилы металлов, М., 1958; Химия координационных соединений, ред. Дж. Бейлар, Д. Буш, пер. с англ., М., 1960, Химия металлоорганических соединении, под ред. Г. Цейсса, пер. с англ., М., 1964, с. 538-604. Н. А. Несмеянов. Карбония ионы Карбо'ния ио'ны,карбкатионы, молекулярные частицы, содержащие трёхковалентный положительно заряженный атом углерода. К. и. обладают высокой реакционной способностью и поэтому малоустойчивы (ср. Карбанионы ) .К. и. образуются: При гетеролитическом разрыве связи С - Х (электронная пара, осуществляющая эту связь, уходит вместе с группой X):
Например, действие сильных кислот на трифенилкарбинол даёт соль трифенилметилкатиона: (C 6H 5) 3C-OH + H 2SO 4Ы (С 6Н 5) 3С ++ НSО 4 -+ H 2O. Этот К. и. устойчив вследствие распределения положительного заряда между несколькими атомами углерода. При действии апротонных кислот на галогенпроизводные, например: CCl 4+ AICI 3Ы CCI 3 ++ AICl 4 -. При присоединении протона или другого катиона по кратной связи: (CH 3) 2C=CH 2+ H +Ы (CH 3) 3C + и др. способами. К. и. легко реагируют с анионами, с молекулами, имеющими неподелённую электронную пару или кратную связь, и с др. соединениями, атакуя места с повышенной электронной плотностью. К. и. - промежуточные частицы в большом числе теоретически и практически важных органических реакций (например, алкилирование и ацилирование по Фриделю - Крафтсу, реакции электрофильного присоединения к олефинам, изомеризация и катионная полимеризация олефинов, пинаколиновая и ретропинаколиновая, Демьянова и Вагнера - Меервейна перегруппировки). Лит.:Бреслоу Р., Механизмы органических реакций, пер. с англ., М., 1968; Робертс Дж., Касерио М., Основы органической химии, пер. с англ., ч. 1-2, М., 1968. Б. Л. Дяткин. Карбоновые кислоты
Карбо'новые кисло'ты,класс органических соединений, содержащих карбоксильную группу (карбоксил)
Большинство К. к. имеет тривиальные названия, многие из которых связаны с их нахождением в природе, например муравьиная, яблочная, валериановая, лимонная кислоты. По Женевской номенклатуре наименования К. к. производят от названий углеводородов с тем же числом атомов углерода, прибавляя окончание «овая» и слово «кислота», например метановая кислота (муравьиная), этановая кислота (уксусная) и т.д. Нередко К. к. рассматривают как производные углеводородов; например, кислоту строения HC є С - COOH называют ацетиленкарбоновой кислотой. Кислотные свойства обусловлены способностью К. к. к диссоциации в водном растворе: RCOOH Ы RCOO -+ H +. Как правило, К. к. слабее минеральных. Константы диссоциации одноосновных насыщенных кислот жирного ряда при 25°С изменяются от 1,7Ч10 -4 (муравьиная кислота) до 1,3 . 10 -5(высшие гомологи). Сила К. к. существенно зависит также от электрофильности радикала, связанного с карбоксилом. Введение электроотрицательных заместителей (например, NO 2, CN, Cl) в положение, соседнее с карбоксильной группой, резко повышает кислотность, например циануксусная кислота CNCH 2COOH примерно в 200 раз сильнее уксусной кислоты CH 3COOH. По мере удаления от карбоксила влияние заместителей ослабевает. Дикарбоновые кислоты сильнее монокарбоновых, причём влияние одного карбоксила на другой тем больше, чем они ближе расположены друг к другу. Так, в ряду кислот щавелевая кислота HOOC-COOH сильнее малоновой кислоты HOOCCH 2COOH, которая, в свою очередь, сильнее янтарной HOOC (CH 2) 2COOH, и т.д. Кислотность непредельных кислот выше, чем предельных; влияние двойной связи тем сильнее, чем она ближе расположена к карбоксилу. Так, акриловая кислота CH 2=CH-СООН в 4 раза сильнее пропионовой CH 3-CH 2-COOH. Ароматические кислоты сильнее предельных алифатических (например, константа диссоциации бензойной кислоты 6,5 . 10 -5). К. к. - жидкие (например, низшие жирные кислоты) или твёрдые (например, высшие жирные и ароматические кислоты) вещества (см. табл. ). Низшие члены насыщенных К. к. жирного ряда хорошо растворимы в воде, средние члены (C 4- C 10), а также ароматические кислоты - ограниченно, высшие жирные кислоты в воде не растворимы; как и ароматические кислоты, они хорошо растворяются в спирте, эфире, бензоле. Наиболее важные химические свойства К. к. - способность превращаться в производные. При взаимодействии с основаниями К. к. дают соли: RCOOH + NaOH ® RCOONa + H 2O. При действии на К. к. спиртов в присутствии минеральных кислот легко образуются эфиры сложные: RCOOH + R'OH ® RCOOR' + H 2O; при действии галогенангидридов минеральных кислот (например, PCl 3, POCl 3, SOCl 2)- галогенангидриды К. к. RCOX (X - атом галогена). При нагревании кислот с водоотнимающими средствами получаются ангидриды К. к. (RCO) 2O. Галогенангидриды и ангидриды К. к. применяют как ацилирующие агенты. Отщепление воды от аммониевых солей К. к. (1) и реакция галогенангидридов с аммиаком (2) приводят к амидам кислот: 1) RCOONH 4® RCONH 2+ H 2O 2) RCOCI + 2NH 3® RCONH 2+ NH 4CI. Методы получения К. к. весьма многочисленны. Окислением первичных спиртов и альдегидов получают К. к. с тем же числом атомов углерода. Окисление кетонов сопровождается разрывом связи С-С; из циклических кетонов образуются дикарбоновые кислоты, например адипиновая кислота из циклогексанона:
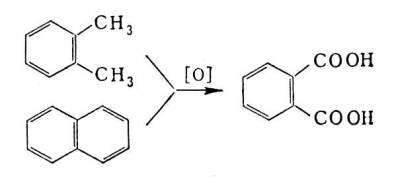
Насыщенные углеводороды могут быть подвергнуты деструктивному окислению с образованием смеси продуктов, в том числе и карбоновых кислот. Этим методом из 1 mпарафина обычно получают около 350 кгК. к. Окисление боковой цепи жирно-ароматических углеводородов либо многоядерных ароматических углеводородов приводит к ароматическим К. к.; например, фталевая кислота получается окислением о-ксилола или нафталина:
Ненасыщенные углеводороды окисляются по месту двойной связи:
Важный метод синтеза К. к. - гидролиз их нитрилов, легко получаемых взаимодействием галогенопроизводных углеводородов с цианистым натрием: RCI + NaCN ® RCN ® RCOOH. В настоящее время промышленное значение приобрёл метод синтеза К. к. карбонилированием, т. е. введением группы CO в органические соединения:
Некоторые К. к. получают из природных продуктов. Так, щелочным гидролизом (омылением) жиров получают соли высших жирных кислот (мыла) и глицерин.Лимонную кислоту получают из ботвы хлопчатника и из стеблей махорки (после выделения из них никотина). Многие К. к. получают сбраживанием углеводов в присутствии бактерий определённого вида (маслянокислое, молочнокислое, лимоннокислое и др. виды брожения). К. к. широко распространены в природе в свободном состоянии и в виде производных (главным образом сложных эфиров). Так, в летучем масле герани содержится пеларгоновая кислота, в лимонах - лимонная. В состав животных и растительных жиров и масел входят глицериды высших нормальных К. к. жирного ряда, из которых преобладают пальмитиновая кислота, стеариновая кислотаи олеиновая кислота. К. к., их производные, а также многочисленные соединения, содержащие наряду с карбоксильной иные функциональные группы (например, аминокислоты, оксикислотыи др.), имеют большое биологическое значение и находят разнообразное практическое применение. Муравьиную и уксусную кислоты, например, применяют при крашении и печатании тканей; уксусную кислоту и уксусный ангидрид - в производстве ацетилцеллюлозы.Аминокислоты входят в состав белков. В медицине используют салициловую кислоту, n-аминосалициловую кислоту (ПАСК) и др. Высшие жирные К. к. широко применяют как сырьё для производства мыла, лакови красок,поверхностно-активных веществ, как эмульгаторы в производстве каучуков, как пластификаторы в производстве резин и др. Адипиновая кислота - один из исходных продуктов в производстве полиамидного волокна (найлона), терефталевая - в производстве полиэфирного волокна (лавсана, терилена), полимерный нитрил акриловой кислоты (орлон) применяют как синтетическое волокно, близкое по свойствам к натуральной шерсти. Полимеры и сополимеры эфиров метакриловой кислоты используют как органическое стекло. Некоторые представители карбоновых кислот и их свойства
*В скобках указана температура (в °С). ** 1 мм рт. ст.= 133,322 н/м 2. Лит.:Неницеску К. Д., Органическая химия, пер. с рум., т. 1-2, М., 1962-1963; Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М., 1969-70. Карбораны Карбора'ны,химические соединения, состоящие из атомов бора, углерода и водорода, общей формулы B nC mH n+m .В К. атомы В и С расположены по вершинам более или менее правильного многогранника, причём каждый атом В или С связан с одним атомом Н. В К. один из атомов В или С может быть замещен на атом другого элемента, например фосфора, мышьяка, олова, алюминия и т.д. Агрегатное состояние К. по мере увеличения nменяется от газообразного до твёрдого. К. и их производные отличаются высокой термической и химической стабильностью. По свойствам они во многом аналогичны ароматическим углеводородам и способны к разнообразным превращениям, которые связаны с замещением атомов Н, стоящих у атома С или В. К. получают в основном взаимодействием производных ацетилена с соответствующими бороводородами. Карборан B 10C 2H 12применяют для получения различного типа полимеров, используемых в твёрдых ракетных топливах и в качестве термостойких покрытий. Лит.:Михайлов Б. М., Химия бороводородов, М., 1967; Жигач А. Ф., Стасиневич Д. С., Химия гидридов, Л., 1969. Н. И. Бекасова. Карборунд Карбору'нд,SiC, соединение кремния с углеродом; то же, что кремния карбид. Карботермия Карботерми'я(от карбо... и греч. therme - теплота, жар), металлургические процессы, основанные на восстановлении металлов из их соединений углеродом и углеродсодержащими материалами при повышенных температурах. Наиболее распространённый углеродсодержащий материал - металлургический кокс. Различают прямое восстановление (твёрдым углеродом) и косвенное (окисью углерода). Карботермическое восстановление лежит в основе металлургии железа (см. Доменное производство ) .В цветной металлургии с помощью К. получают свинец, олово, значительную часть цинка и некоторые др. металлы. Лит.:Есин О. А. и Гельд П. В., Физическая химия металлургических процессов, ч. 1, Свердловск, 1962. Карботион Карботио'н,карбатион, N-метилдитиокарбамат натрия, химическое средство борьбы с почвенными возбудителями болезней растений и сорняками (см. Стерилизаторы почвы ) . Карбофос Карбофо'с,О, О-диметил-S-1,2-дикарбоэтоксиэтилдитиофосфат, химическое средство борьбы с вредными насекомыми. См. Инсектициды. Карбоцепные полимеры Карбоцепны'е полиме'ры, полимеры,основная цепь макромолекул которых построена только из атомов углерода. Карбоциклические соединения Карбоцикли'ческие соедине'ния(от карбо...и греч. kykios - круг, кольцо), изоциклические соединения, органические соединения, содержащие в молекулах кольца (циклы) из атомов углерода. К. с. отличаются от гетероциклических соединений,циклы которых содержат, кроме атомов углерода, атомы др. элементов, чаще всего О, N или S, а также от ациклических соединений,не содержащих циклов. К. с. - один из основных классов органических соединений, который подразделяют на алициклические соединения и ароматические соединения (бензоидного и небензоидного характера). К. с. чрезвычайно распространены; многие из них имеют большое практическое значение. Так, к ним относится значительная часть углеводородов нефти, терпенов, ряд антибиотиков, многие красители, лекарственные вещества, инсектициды и др.; их применяют для получения синтетических смол, пластических масс и т.д. Карбромал Карброма'л,адалин, лекарственный препарат из группы снотворных средств. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241 |
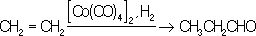
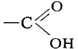 . В зависимости от природы радикала, связанного с группой - COOH, К. к. могут принадлежать к алифатическому (жирному), алициклическому, ароматическому или гетероциклическому ряду. По числу карбоксильных групп в молекуле различают одно-, двух- и многоосновные (соответственно моно-, ди- и поликарбоновые) кислоты. Кроме того, К. к. могут быть насыщенными (предельными) и ненасыщенными (непредельными), содержащими в молекулах двойные или тройные связи.
. В зависимости от природы радикала, связанного с группой - COOH, К. к. могут принадлежать к алифатическому (жирному), алициклическому, ароматическому или гетероциклическому ряду. По числу карбоксильных групп в молекуле различают одно-, двух- и многоосновные (соответственно моно-, ди- и поликарбоновые) кислоты. Кроме того, К. к. могут быть насыщенными (предельными) и ненасыщенными (непредельными), содержащими в молекулах двойные или тройные связи.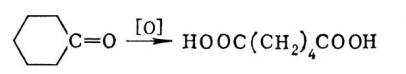
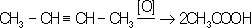 .
.