 |
|
Популярные авторы:: Чехов Антон Павлович :: Горький Максим :: БСЭ :: Толстой Лев Николаевич :: Борхес Хорхе Луис :: Раззаков Федор :: Азимов Айзек :: Лондон Джек :: Сименон Жорж :: Желязны Роджер Популярные книги:: Справочник по реестру Windows XP :: Долгое завтра :: Вольга и Микула Селянинович :: Почтовый феномен :: Николай Черкасов :: Андоррский блудоград, или Der Irrgarten von Andorra :: Всего один концерт :: Так держать, «Секретная семерка»! (Тайна украденных псов) :: Шабаш ведьм :: На страже |
Большая Советская Энциклопедия (МО)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (МО) - Чтение (стр. 25)
где u i= 0, 1, 2, ... - соответствующие колебательные квантовые числа. Набор частот нормальных колебаний в основном электронном состоянии является очень важной характеристикой молекулы, зависящей от её химического строения. В определённом нормальном колебании участвуют все атомы молекулы или часть их; атомы при этом совершают гармонические колебания с одной частотой v i, но с различными амплитудами, определяющими форму колебания. Нормальные колебания разделяют по их форме на валентные (при которых изменяются длины линий связи) и деформационные (при которых изменяются углы между химическими связями - валентные углы). Число различных частот колебаний для молекул низкой симметрии (не имеющих осей симметрии порядка выше 2) равно 2, и все колебания являются невырожденными, а для более симметричных молекул имеются дважды и трижды вырожденные колебания (пары и тройки совпадающих по частоте колебаний). Например, у нелинейной трёхатомной молекулы H 2O ( рис. 2 , а) f= 3 и возможны три невырожденных колебания (два валентных и одно деформационное). Более симметричная линейная трёхатомная молекула CO 2( рис. 2 , б) имеет f= 4 - два невырожденных колебания (валентных) и одно дважды вырожденное (деформационное). Для плоской высокосимметричной молекулы C 6H 6( рис. 2 , в) получается f= 30 - десять невырожденных и 10 дважды вырожденных колебаний; из них 14 колебаний происходят в плоскости молекулы (8 валентных и 6 деформационных) и 6 неплоских деформационных колебаний - перпендикулярно этой плоскости. Ещё более симметричная тетраэдрическая молекула CH 4( рис. 2 , г) имеет f =9 - одно невырожденное колебание (валентное), одно дважды вырожденное (деформационное) и два трижды вырожденных (одно валентное и одно деформационное). Вращательные уровни энергии можно найти квантованием вращательного движения молекулы, рассматривая её как твёрдое тело с определёнными моментами инерции.В простейшем случае двухатомной или линейной многоатомной молекулы её энергия вращения
где I- момент инерции молекулы относительно оси, перпендикулярной оси молекулы, а М- вращательный момент количества движения. Согласно правилам квантования,
где вращательное квантовое число J= 0, 1, 2, ..., и, следовательно, для E вращполучили:
где вращательная постоянная
Различные типы М. с. возникают при различных типах переходов между уровнями энергии молекул. Согласно (1) и (2) D E= E‘ - E‘’ = D E эл+ D E кол+ D E вращ, (8) где изменения D E эл, D E коли D E вращэлектронной, колебательной и вращательной энергий удовлетворяют условию: D E эл>> D E кол>> D E вращ (9) [расстояния между уровнями того же порядка, что и сами энергии E эл, E оли E вращ, удовлетворяющие условию (4)]. При D E эл¹ 0 получаются электронные М. с., наблюдаемые в видимой и в ультрафиолетовой (УФ) областях. Обычно при D E эл¹ 0 одновременно D E кол¹ 0 и D E вращ¹ 0; различным D E колпри заданном D E элсоответствуют различные колебательные полосы ( рис. 3 ), а различным D E вращпри заданных D E эли D E кол- отдельные вращательные линии, на которые распадается данная полоса; получается характерная полосатая структура ( рис. 4 ). Совокупность полос с заданным D E эл(соответствующим чисто электронному переходу с частотой v эл= D E эл/ h) называемая системой полос; отдельные полосы обладают различной интенсивностью в зависимости от относительных вероятностей переходов (см. Квантовые переходы ) ,которые могут быть приближённо рассчитаны квантовомеханическими методами. Для сложных молекул полосы одной системы, соответствующие данному электронному переходу, обычно сливаются в одну широкую сплошную полосу, могут накладываться друг на друга и несколько таких широких полос. Характерные дискретные электронные спектры наблюдаются в замороженных растворах органических соединений (см. Шпольского эффект ) .Электронные (точнее, электронно-колебательно-вращательные) спектры изучаются экспериментально при помощи спектрографов и спектрометров со стеклянной (для видимой области) и кварцевой (для УФ-области) оптикой, в которых для разложения света в спектр применяются призмы или дифракционные решётки (см. Спектральные приборы ) . При D E эл= 0, а D E кол¹ 0 получаются колебательные М. с., наблюдаемые в близкой (до нескольких мкм) и в средней (до нескольких десятков мкм) инфракрасной (ИК) области, обычно в поглощении, а также в комбинационном рассеянии света. Как правило, одновременно D E вращ¹ 0 и при заданном E колполучается колебательная полоса, распадающаяся на отдельные вращательные линии. Наиболее интенсивны в колебательных М. с. полосы, соответствующие D u = u’ - u’’ = 1 (для многоатомных молекул - D u i= u i’ - u i’’= 1 при D u k= u k’ - u k’’ = 0, где k¹ i). Для чисто гармонических колебаний эти отбора правила,запрещающие др. переходы, выполняются строго; для ангармонических колебаний появляются полосы, для которых D u> 1 (обертоны); их интенсивность обычно мала и убывает с увеличением D u. Колебательные (точнее, колебательно-вращательные) спектры изучаются экспериментально в ИК-области в поглощении при помощи ИК-спектрометров с призмами, прозрачными для ИК-излучения, или с дифракционными решётками, а также Фурье-спектрометров и в комбинационном рассеянии при помощи светосильных спектрографов (для видимой области) с применением лазерного возбуждения. При D E эл= 0 и D E кол= 0 получаются чисто вращательные М. с., состоящие из отдельных линий. Они наблюдаются в поглощении в далёкой (сотни мкм) ИК-области и особенно в микроволновой области, а также в спектрах комбинационного рассеяния. Для двухатомных и линейных многоатомных молекул (а также для достаточно симметричных нелинейных многоатомных молекул) эти линии равно отстоят (в шкале частот) друг от друга с интервалами Dn = 2 Bв спектрах поглощения и Dn = 4 Bв спектрах комбинационного рассеяния. Чисто вращательные спектры изучают в поглощении в далёкой ИК-области при помощи ИК-спектрометров со специальными дифракционными решётками (эшелеттами) и Фурье-спектрометров, в микроволновой области при помощи микроволновых (СВЧ) спектрометров (см. Микроволновая спектроскопия ) ,а также в комбинационном рассеянии при помощи светосильных спектрографов. Методы молекулярной спектроскопии, основанные на изучении М. с., позволяют решать разнообразные задачи химии, биологии и др. наук (например, определять состав нефтепродуктов, полимерных веществ и т. п.). В химии по М. с. изучают структуру молекул. Электронные М. с. дают возможность получать информацию об электронных оболочках молекул, определять возбуждённые уровни и их характеристики, находить энергии диссоциации молекул (по схождению колебательных уровней молекулы к границам диссоциации). Исследование колебательных М. с. позволяет находить характеристические частоты колебаний, соответствующие определённым типам химических связей в молекуле (например, простых двойных и тройных связей С-С, связей С-Н, N-Н, О-Н для органических молекул), различных групп атомов (например, CH 2, CH 3, NH 2), определять пространственную структуру молекул, различать цис- и транс-изомеры. Для этого применяют как инфракрасные спектры поглощения (ИКС), так и спектры комбинационного рассеяния (СКР). Особенно широкое распространение получил метод ИКС как один из самых эффективных оптических методов изучения строения молекул. Наиболее полную информацию он даёт в сочетании с методом СКР. Исследование вращательных М. с., а также вращательной структуры электронных и колебательных спектров позволяет по найденным из опыта значениям моментов инерции молекул [которые получаются из значений вращательных постоянных, см. (7)] находить с большой точностью (для более простых молекул, например H 2O) параметры равновесной конфигурации молекулы - длины связей и валентные углы. Для увеличения числа определяемых параметров исследуют спектры изотопических молекул (в частности, в которых водород заменен дейтерием), имеющих одинаковые параметры равновесных конфигураций, но различные моменты инерции. В качестве примера применения М. с. для определения химического строения молекул рассмотрим молекулу бензола C
6H
6. Изучение её М. с. подтверждает правильность модели, согласно которой молекула плоская, а все 6 связей С-С в бензольном кольце равноценные и образуют правильный шестиугольник (
рис. 2
, б), имеющий ось симметрии шестого порядка, проходящую через центр симметрии молекулы перпендикулярно её плоскости. Электронный М. с. поглощения C
6H
6состоит из нескольких систем полос, соответствующих переходам из основного чётного синглетного уровня на возбуждённые нечётные уровни, из которых первый является триплетным, а более высокие - синглетными (
рис. 5
). Наиболее интенсивна система полос в области 1840
Подобным же образом можно при помощи М. с. определять структуру разнообразных классов органических и неорганических молекул, вплоть до весьма сложных, например молекул полимеров. Лит.:Кондратьев В. Н., Структура атомов и молекул, 2 изд., М., 1959; Ельяшевич М. А., Атомная и молекулярная спектроскопия, М., 1962; Герцберг Г., Спектры и строение двухатомных молекул, пер. с англ., М., 1949; его же, Колебательные и вращательные спектры многоатомных молекул, пер. с англ., М., 1949; его же, Электронные спектры и строение многоатомных молекул, пер. с англ., М., 1969; Применение спектроскопии в химии, под ред. В. Веста, пер. с англ., М., 1959. М. А. Ельяшевич. 
Рис. 4. Вращательное расщепление электронно-колебательной полосы 3805
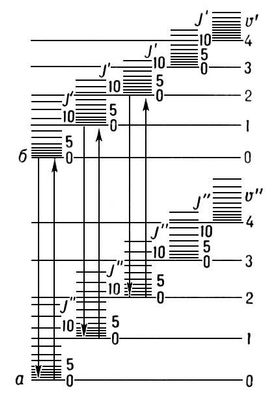
Рис. 1. Схема уровней энергии двухатомной молекулы: а и б - электронные уровни; v' и v'' - квантовые числа колебательных уровней. J' и J'' - квантовые числа вращательных уровней. 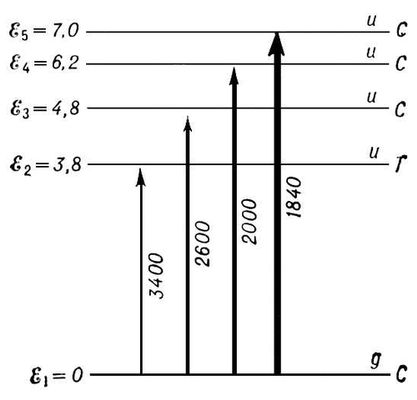
Рис. 5. Схема электронных уровней и переходов для молекулы бензола. Энергия уровней дана в
эв. С - синглетные уровни; Т - триплетный уровень. Чётность уровня указана буквами g и u. Для систем полос поглощения указаны примерные области длин волн в
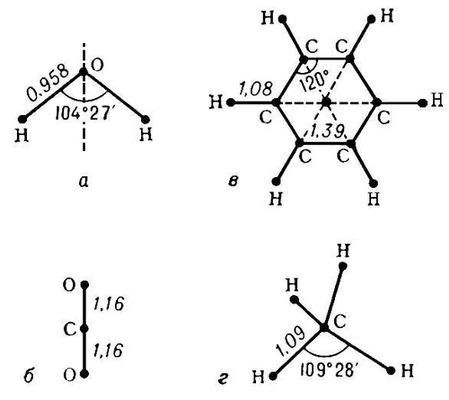
Рис. 2. Равновесные конфигурации молекул: а - H
2O; б - CO
2; в - C
6H
6; г - CH
4. Числами указаны длины связей (в

Рис. 3. Электронно-колебательный спектр молекулы N 2в близкой ультрафиолетовой области; группы полос соответствуют различным значениям D v= v' - v''. Молекулярный вес Молекуля'рный вес,то же, что молекулярная масса. Молекулярный генератор Молекуля'рный генера'тор,устройство, в котором когерентные электромагнитные колебания генерируются за счёт вынужденных квантовых переходов молекул из исходного энергетического состояния в состояние с меньшей внутренней энергией (см. Когерентность, Квантовая электроника) .М. г. - первый квантовый генератор, созданный в 1954 Н. Г. Басовым и А. М. Прохоровым (СССР) и независимо от них Ч. Таунсом,Дж. Гордоном и Х. Цейгером (США). Оба варианта этого М. г. работали на молекулах аммиака NH 3и генерировали электромагнитные колебания с частотой 24840 Мгц(длина волны l = 1,24 см) . Для возбуждения генерации когерентных колебаний необходимо выполнение двух основных условий: в рабочем объёме прибора количество частиц в исходном состоянии должно быть больше, чем в состоянии с меньшей внутренней энергией ( инверсия населённостей ) ,должна быть обеспечена связь между частицами, излучающими в различные моменты времени (положительная обратная связь ) .В М. г. первое условие осуществляется электростатической сортировкой пучка молекул, а обратная связь при помощи объёмного резонатора,настроенного на частоту, равную частоте излучения, сопровождающего переход молекулы из исходного энергетического состояния в конечное. Пучок молекул формируется при вылете молекул из источника в вакуум через узкие отверстия или капилляры (см. Молекулярные и атомные пучки ) . Электростатическая сортировка молекул по энергетическим состояниям в М. г. основана на том, что молекулы, обладающие электрическим дипольным моментом (например, молекулы NH 3), пролетая через неоднородное электрическое поле, отклоняются этим полем от прямолинейного пути по-разному в зависимости от энергии (см. Штарка эффект ) .В первом М. г. сортирующая система представляла собой квадрупольный конденсатор, состоящий из 4 параллельных стержней специальной формы, соединённых попарно с высоковольтным выпрямителем ( рис. ). Электрическое поле такого конденсатора весьма неоднородно, что вызывает искривление траекторий молекул NH 3, летящих вдоль его оси. Свойства молекул NH 3таковы, что те из них, которые находятся в верхнем из используемой пары энергетических состояний, отклоняются к оси конденсатора и попадают внутрь объёмного резонатора. Молекулы, находящиеся в нижнем состоянии, отбрасываются в стороны и не попадают в резонатор. Отсортированный т. о. пучок содержит молекулы, находящиеся в верхнем энергетическом состоянии. Попадая внутрь резонатора, такие молекулы излучают под воздействием электромагнитного поля резонатора (вынужденное излучение). Излученные фотоны остаются внутри резонатора, усиливая его поле и увеличивая вероятность вынужденного излучения для молекул, пролетающих позже. Если интенсивность пучка активных молекул такова, что вероятность вынужденного излучения фотона больше, чем вероятности поглощения фотона в стенках резонатора, то возникает процесс самовозбуждения - быстро возрастает интенсивность электромагнитного поля резонатора на частоте перехода за счёт внутренней энергии молекул пучка. Это возрастание прекращается, когда поле в резонаторе достигает величины, при которой вероятность вынужденного испускания становится столь большой, что за время пролёта резонатора успевает испустить фотон как раз половина молекул пучка. При этом для пучка в целом вероятность поглощения становится равной вероятности вынужденного испускания (см. Насыщения эффект ) .Мощность, генерируемая М. г. на пучке молекул NH 3, составляет 10 -8 вт,стабильность частоты генерации в пределах 10 -7-10 -11. В дальнейшем были созданы М. г. на ряде других дипольных молекул, работающие в диапазоне сантиметровых и миллиметровых волн, и квантовые генераторы на пучке атомов водорода, работающие на длине волны 21 см.Эти приборы, как и квантовые усилители радиодиапазона, иногда называют мазерами.Существует несколько конструктивных вариантов М. г., отличающихся устройством сортирующих систем, количеством резонаторов и т. п. К М. г. относят также квантовые генераторы, в которых инверсия населённости уровней молекул достигается не сортировкой, а другими способами, например воздействием вспомогательного электромагнитного поля (накачки), электрическим разрядом и др. В этом смысле к М. г. можно отнести и квантовые генераторы оптического диапазона ( лазеры ) ,рабочим веществом которых служат молекулярные газы (см. Газовый лазер ) .
Лит.:Ораевский А. Н., Молекулярные генераторы, М., 1964; Григорьянц В. В., Жаботинский М. Е., Золин В. Ф., Квантовые стандарты частоты, М., 1968; Зингер Дж., Мазеры, М., 1961; Сигмен А., Мазеры, пер. с англ., М., 1966. М. Е. Жаботинский. 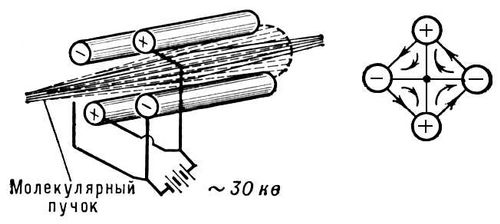
Сортировка молекул по энергетическим состояниям с помощью квадрупольного конденсатора. Молекулярных орбиталей метод Молекуля'рных орбита'лей ме'тод,важнейший метод квантовой химии.В основе метода лежит представление о том, что каждый электрон молекулы описывается своей волновой функцией - молекулярной орбиталью (МО). Вследствие невозможности точно решить Шрёдингера уравнение для систем с двумя и более электронами, способ получения выражения для МО неоднозначен. На практике чаще всего каждую МО y i представляют как ЛКАО - линейную комбинацию атомных орбиталей (AO) c р (приближение МО ЛКАО) вида y i= S pc ipc p , где i- номер МО, р- номер АО, c ip- алгебраические коэффициенты, являющиеся мерой вкладов индивидуальных АО в МО. Это приближение основано на предположении, что в окрестности любого атомного ядра МО y i должна напоминать составляющие её АО c р этого атома. Поскольку при соединении атомов в молекулу изменения состояния электронов по сравнению с исходным можно считать не слишком радикальными, то в рассматриваемом приближении по-прежнему пользуются атомными волновыми функциями (хотя и не обязательно с параметрами свободных атомов). Вместе с тем описание электрона с помощью ЛКАО отображает те качественные изменения, которые произошли в состоянии электрона при образовании молекулы: о любом из электронов молекулы нельзя более утверждать, что он находится у определённого атома. Подобно тому, как в атоме водорода электрон можно с различной вероятностью обнаружить в разных точках околоядерного пространства, так и в молекуле электрон «размазан» по всей молекуле в целом. В общем случае метод МО рассматривает образование химических связей как результат движения всех электронов в суммарном поле, созданном всеми электронами и всеми ядрами исходных атомов. Однако поскольку основной вклад в образование связей дают электроны наружных (валентных) оболочек, обычно ограничиваются рассмотрением только этих электронов. Полная волновая функция Y молекулы конструируется из одноэлектронных МО y i с учётом требования антисимметрии волновой функции Y (вытекающего из принципа Паули). Функции Y, y i и c p находят при решении уравнения Шрёдингера вариационным методом, обычно по схеме самосогласованного поля (ССП) Хартри - Фока. Количественные расчёты многоэлектронных молекул сопряжены с серьёзными математическими и техническими трудностями. Полные неэмпирические расчёты по методу МО с достижением хартри-фоковского предела точности (который к тому же иногда недостаточен для количественного сравнения с экспериментом) осуществлены для молекул с числом электронов порядка 50. Поэтому большинство проводимых расчётов носит полуэмпирический характер и в них используются дополнительные приближения. Существуют многочисленные варианты метода ССП МО ЛКАО (различающиеся полнотой учёта межэлектронного взаимодействия и процедуры самосогласования), эффективность применения которых зависит от изучаемых объектов и их свойств. Существенно, что метод МО в его любой форме, даже в самых упрощённых вариантах, органически связан с пространственной симметрией молекул. Это позволяет получать вполне однозначную качественную информацию о многих свойствах молекул (степени вырождения энергетических уровней, величине магнитного момента, интенсивности спектральных линий и т. д.) вне зависимости от характера выбранного приближения. Начиная с 1965 всё большее развитие получает новый вариант М. о. м., не использующий приближения МО ЛКАО. В этом варианте объединены статистическая модель атома и некоторые модели теории твёрдого тела. В результате удаётся построить специальные МО, которые удобно определять путём численного (не аналитического) решения уравнения Шрёдингера также по схеме ССП. Расчёты по этому новому методу, почти не уступая по точности неэмпирическим расчётам ССП МО ЛКАО, обычно требуют для своего проведения в 100-1000 раз меньше машинного времени (минуты вместо десятков часов). Указанный метод особенно перспективен для количественных расчётов больших молекул. В химии метод МО (особенно в форме МО ЛКАО) важен тем, что позволяет получать данные о строении и свойствах молекул, исходя из соответствующих характеристик атомов. Поэтому почти все современные концепции химической связи и химической реакционной способности базируются на представлениях метода МО. Лит.:Слэтер Дж., Электронная структура молекул, пер. с англ., М., 1965; Коулсон Ч., Валентность, пер. с англ., М., 1965; Дьюар М., Теория молекулярных орбиталей в органической химии, пер. с англ., М., 1972; Шусторович Е. М., Химическая связь, М., 1973. Е. М. Шусторович. «Моление Даниила Заточника» «Моле'ние Дании'ла Зато'чника»,памятник древнерусской литературы 13 в. Написан в форме послания к переяславско-суздальскому князю Ярославу Всеволодовичу. Автор, попавший в нужду, просит князя о помощи, изображает его как защитника подданных. Некоторые исследователи считают «Моление...» первым опытом древнерусской дворянской публицистики. Для стиля «Моления...» характерны сочетание цитат из библейских книг, летописи и других литературных сочинений с образами живой речи, элементы сатиры, направленной против бояр и духовенства. По-видимому, «Моление...» написано на основе «Слова Даниила Заточника» (12 в.), однако вопросы хронологического и литературного соотношения обоих текстов, как и вопрос об их авторстве, не решены наукой. Лит.:Слово Даниила Заточника по редакциям XII и XIII вв. и их переделкам, Л., 1932; Рыбаков Б. А., Даниил Заточник и Владимирское летописание конца XII в., в сборнике: Археографический ежегодник за 1970 год, М., 1971 (библ.). А. Н. Робинсон. Молескин Молески'н(англ. moleskin, от mole - крот и skin - кожа), плотная, прочная хлопчато-бумажная ткань, вырабатываемая усиленным сатиновым переплетением (см. Переплетение нитей ) .М. имеет на лицевой стороне плотный гладкий уточный застил, который создаётся своеобразным переплетением, а также большей плотностью нитей по утку, чем по основе. М. выпускается обычно гладкокрашеным в тёмные тона. Некоторые сорта М. подвергаются ворсованию и называются М.-сукно. М. употребляется для изготовления рабочей, спортивной и специальной форменной одежды, верха обуви, переплётов и пр. Наиболее плотные сорта М. иногда называют чёртовой кожей. Молетай Моле'тай,город (до 1956 - село), центр Молетского района Литовской ССР. Расположен на р. Сесартис (бассейн Нямунаса), в 33 кмот ж.-д. станции Утена (на линии Шяуляй - Швенчёнеляй) и в 70 кмк С. от Вильнюса. Маслозавод. В окрестностях - много озёр (Молетская группа озёр). Молешотт Якоб Мо'лешотт(Moleschott) Якоб (9.8.1822, Хертогенбос, Нидерланды, - 20.5. 1893, Рим), немецкий физиолог и философ, представитель вульгарного материализма.Изучал медицину и физиологию в Гейдельбергском университете, в котором с 1847 читал лекции. В начале 50-х гг. подвергся преследованиям за пропаганду материализма и атеизма и переехал в Швейцарию; с 1860-х гг. жил в Италии. Профессор в Цюрихе (с 1856), Турине (с 1861) и Риме (с 1879). М. фактически отождествлял философию с естествознанием, а в мышлении видел лишь физиологический механизм. По М., все психологические и духовные процессы имеют вещественно-физиологическую природу и зависят, в частности, от характера пищи, её состава и т. п. Взгляды М. оказали некоторое влияние на итальянских учёных, в том числе на Ч. Ломброзо;к ним сочувственно относился Д. И. Писарев.Вульгарный материализм М. был подвергнут критике Л. Фейербахом, К. Марксом и Ф. Энгельсом. Биохимические исследования М. сыграли значительную роль в развитии физиологической химии. Соч.: Fьr meine Freunde. Lebens-Erinnerungen, Giessen, 1894; в рус. пер. - Естествознание и медицина, СПБ, 1865; Физиологические эскизы, М., 1863; Вращение жизни в природе, СПБ - М., 1867; Причины и действия в учении о жизни, М., 1868; Учение о пище, 2 изд., СПБ, 1868. Лит.:Жане П., Современный материализм, пер. с франц., М., 1867; Таганский Г., Вульгарный материализм третьей четверти XIX в. и современные механисты, в сборнике: Из истории философии XIX в., [М.], 1933; Юшманов Н., Общественно-политические взгляды вульгарных материалистов, там же. А. П. Огурцов. Моли Мо'линастоящие (Tineidae), семейство бабочек. Крылья в размахе от 6 (Meessia) до 60 мм(Scardia). 2000 видов; распространены очень широко. В СССР около 200 видов. Гусеницы в шёлковых ходах или чехликах; питаются растительными или животными остатками, грибами и лишайниками. Около 40 видов - вредители; одни портят продовольственные запасы (особенно зерновая М. - Nemapogon granellus), другие - шерсть, мех, перо (платяная М. - Tineola biselliella и мебельная М. - Т. furciferella). М. называют также представителей др. семейств: выемчатокрылые М., горностаевые М., моли-минеры и др. Лит.:Загуляев А. К., Настоящие моли (Tineidae), в. 2-4, М. - Л., 1960-73 (Фауна СССР. Насекомые чешуекрылые, т. 4, в. 3); его же, Моли и огневки - вредители зерна и продовольственных запасов, М. - Л., 1965. 
Зерновая моль (самец). Молибдаты Молибда'ты,соли молибденовых кислот. Известны нормальные М. - соли молибденовой кислоты Н 2МоО 4и полимолибдаты - соли изополимолибденовых кислот. Все нормальные М., за исключением М. щелочных металлов и магния, малорастворимы в воде. Среди растворимых М. наибольшее практическое значение имеет Na 2MoO 4, используемый в производстве лаков и красок. Растворимые М. применяют как микроудобрения. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94 |
|||||||
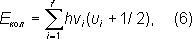
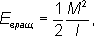
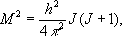
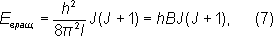
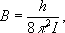 определяет масштаб расстояний между уровнями энергии, уменьшающийся с увеличением масс ядер и межъядерных расстояний. На
рис. 1
показаны вращательные уровни для каждого электронно-колебательного состояния.
определяет масштаб расстояний между уровнями энергии, уменьшающийся с увеличением масс ядер и межъядерных расстояний. На
рис. 1
показаны вращательные уровни для каждого электронно-колебательного состояния. (
E
5-
E
1= 7,0
эв), наиболее слаба система полос в области 3400
(
E
5-
E
1= 7,0
эв), наиболее слаба система полос в области 3400
 (
E
2-
E
1= 3,8
эв)
,соответствующая синглетно-триплетному переходу, запрещенному приближёнными правилами отбора для полного спина. Переходы соответствуют возбуждению т. н. p-электронов, делокализованных по всему бензольному кольцу (см.
Молекула
)
;полученная из электронных молекулярных спектров схема уровней
рис. 5
находится в согласии с приближёнными квантовомеханическими расчётами. Колебательные М. с. C
6H
6соответствуют наличию в молекуле центра симметрии - частоты колебаний, проявляющиеся (активные) в ИКС, отсутствуют (неактивные) в СКР и наоборот (т. н. альтернативный запрет). Из 20 нормальных колебаний C
6H
64 активны в ИКС и 7 активны в СКР, остальные 11 неактивны как в ИКС, так и в СКР. Значения измеренных частот (в
см
-1)
:673, 1038, 1486, 3080 (в ИКС) и 607, 850, 992, 1178, 1596, 3047, 3062 (в СКР). Частоты 673 и 850 соответствуют неплоским колебаниям, все остальные частоты - плоским колебаниям. Особо характерны для плоских колебаний частота 992 (соответствующая валентному колебанию связей С-С, состоящему в периодическом сжатии и растяжении бензольного кольца), частоты 3062 и 3080 (соответствующие валентным колебаниям связей С-Н) и частота 607 (соответствующая деформационному колебанию бензольного кольца). Наблюдаемые колебательные спектры C
6H
6(и аналогичные им колебательные спектры C
6D
6) находятся в очень хорошем согласии с теоретическими расчётами, позволившими дать полную интерпретацию этих спектров и найти формы всех нормальных колебаний.
(
E
2-
E
1= 3,8
эв)
,соответствующая синглетно-триплетному переходу, запрещенному приближёнными правилами отбора для полного спина. Переходы соответствуют возбуждению т. н. p-электронов, делокализованных по всему бензольному кольцу (см.
Молекула
)
;полученная из электронных молекулярных спектров схема уровней
рис. 5
находится в согласии с приближёнными квантовомеханическими расчётами. Колебательные М. с. C
6H
6соответствуют наличию в молекуле центра симметрии - частоты колебаний, проявляющиеся (активные) в ИКС, отсутствуют (неактивные) в СКР и наоборот (т. н. альтернативный запрет). Из 20 нормальных колебаний C
6H
64 активны в ИКС и 7 активны в СКР, остальные 11 неактивны как в ИКС, так и в СКР. Значения измеренных частот (в
см
-1)
:673, 1038, 1486, 3080 (в ИКС) и 607, 850, 992, 1178, 1596, 3047, 3062 (в СКР). Частоты 673 и 850 соответствуют неплоским колебаниям, все остальные частоты - плоским колебаниям. Особо характерны для плоских колебаний частота 992 (соответствующая валентному колебанию связей С-С, состоящему в периодическом сжатии и растяжении бензольного кольца), частоты 3062 и 3080 (соответствующие валентным колебаниям связей С-Н) и частота 607 (соответствующая деформационному колебанию бензольного кольца). Наблюдаемые колебательные спектры C
6H
6(и аналогичные им колебательные спектры C
6D
6) находятся в очень хорошем согласии с теоретическими расчётами, позволившими дать полную интерпретацию этих спектров и найти формы всех нормальных колебаний.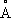 молекулы N
2.
молекулы N
2.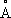 , более интенсивные системы полос обозначены более жирными стрелками.
, более интенсивные системы полос обозначены более жирными стрелками.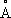 ) и величины валентных углов.
) и величины валентных углов.