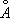|
|
���������� ������:: �������� ��� ������ :: ������ ������ ����� :: ���� ����� ����� :: ����� ����� ������ :: �������� ������� :: ������� ������ :: ����� ������ :: ���� ���������� ��������� :: ���������� ���������� ���������� :: ������ ����� ���������� �����:: ���������� �� ������� Windows XP :: �������� ���� :: ������ ����� �������� :: ������ ���� :: �������� �� :: ��������� �� ������� :: �� ������� �������, � 4(52) 2006 �. :: ��������� ���!� :: ������� ������ :: ������ � ������� |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 9)
Лит.:Маркс К., Критика Готской программы, Маркс К. и Энгельс Ф., Соч., 2 изд., т. 19; его же, Капитал, т. 1, там же, т. 23, с. 5-11, 157-87, 545-75; Ленин В. И., Государство и революция, Полн. собр. соч., 5 изд., т. 33; Меринг Ф., О «железном законе заработной платы», в сборнике: Памяти Лассаля, [К.], 1925; Афанасьева. С., Критика современных буржуазных теорий заработной платы, в сборнике: Критика буржуазных экономических теорий, М., 1960, разд. 3; Цkonomisches Lexikon, Bd 1, В., 1967, S. 513. В. С. Афанасьев. Железный колчедан Желе'зный колчеда'н,то же, что пирит . Железный купорос Желе'зный купоро'с,FeSO 4х 7H 2O, см. Железа сульфаты . Железный шпат Желе'зный шпат,то же, что сидерит . Железняк Максим Железня'к(Зализняк) Максим (р. начало 40-х гг. 18 в., с. Медведовка, около г. Чигирина, - г. и место смерти неизвестны). Запорожский казак, один из предводителей Крестьянской войны 1768 на Правобережной Украине против польской шляхты. Родился в бедной крестьянской семье. Мальчиком ушёл в Запорожскую Сечь, работал по найму. Когда в мае 1768 в районе Черкасс вспыхнуло восстание, Ж. возглавил отряд повстанцев (см. «Колиивщина» ). Ж. и др. предводители восстания были схвачены царскими офицерами. Ж. был подвергнут наказанию батогами, клеймению и сослан в Сибирь. Дальнейшая его судьба неизвестна. Лит.:Голобуцкий В. А., М. Железняк, М., 1960. Железняков Анатолий Григорьевич Железняко'вАнатолий Григорьевич [20.4(2.5).1895, с. Федоскино, ныне Московской области, - 26.7.1919, ныне г. Верховцево Днепропетровской области], герой Гражданской войны 1918-20. Родился в семье крестьянина, был рабочим, кочегаром на торговых судах. С 1915 на Балтийском флоте. В 1917 принадлежал к группе анархистов, поддерживавших большевиков. Участвовал в Октябрьском вооруженном восстании и штурме Зимнего дворца, был делегатом 2-го Всероссийского съезда Советов. В январе 1918, будучи начальником караула Таврического дворца, предложил контрреволюционным депутатам Учредительного собрания покинуть дворец. Участвовал в Гражданской войне на Украине: в январе 1918 в должности комиссара Дунайской флотилии против войск Центральной рады и румынских интервентов, в марте 1918 против австро-германских оккупантов как начальник Бирзульского укрепленного района. Затем командовал полком 16-й стрелковой дивизии, был на подпольной работе в Одессе. С мая 1919 командовал бронепоездом в боях против григорьевцев, а позже в боях против деникинцев в составе 14-й армии. Был смертельно ранен в бою у станции Верховцево. Похоронен в Москве на Ваганьковском кладбище. 
А. Г. Железняков. Железо Желе'зо(латинское Ferrum), Fe, химический элемент VIII группы периодической системы Менделеева; атомный номер 26, атомная масса 55,847; блестящий серебристо-белый металл. Элемент в природе состоит из четырёх стабильных изотопов: 54Fe (5,84%), 56Fe (91,68%), 57Fe (2,17%) и 58Fe (0,31%). Историческая справка. Ж. было известно ещё в доисторические времена, однако широкое применение нашло значительно позже, т. к. в свободном состоянии встречается в природе крайне редко, а получение его из руд стало возможным лишь на определённом уровне развития техники. Вероятно, впервые человек познакомился с метеоритным Ж., о чём свидетельствуют его названия на языках древних народов: древнеегипетское «бени-пет» означает «небесное железо»; древнегреческое sideros связывают с латинским sidus (родительный падеж sideris) - звезда, небесное тело. В хеттских текстах 14 в. до н. э. упоминается о Ж. как о металле, упавшем с неба. В романских языках сохранился корень названия, данного римлянами (например, французское fer, итальянское ferro). Способ получения Ж. из руд был изобретён в западной части Азии во 2-м тысячелетии до н. э.; вслед за тем применение Ж. распространилось в Вавилоне, Египте, Греции; на смену бронзовому веку пришёл железный век.Гомер (в 23-й песне «Илиады») рассказывает, что Ахилл наградил диском из железной крицы победителя в соревновании по метанию диска. В Европе и Древней Руси в течение многих веков Ж. получали по сыродутному процессу.Железную руду восстанавливали древесным углём в горне (см. Восстановление металлов ), устроенном в яме; в горн мехами нагнетали воздух, продукт восстановления - крицу ударами молота отделяли от шлака и из неё выковывали различные изделия. По мере усовершенствования способов дутья и увеличения высоты горна температура процесса повышалась и часть Ж. науглероживалась, т. е. получался чугун ; этот сравнительно хрупкий продукт считали отходом производства. Отсюда название чугуна «чушка», «свинское железо» - английское pig iron. Позже было замечено, что при загрузке в горн не железной руды, а чугуна также получается низкоуглеродистая железная крица, причём такой двухстадийный процесс (см. Кричный передел ) оказался более выгодным, чем сыродутный. В 12-13 вв. кричный способ был уже широко распространён. В 14 в. чугун начали выплавлять не только как полупродукт для дальнейшего передела, но и как материал для отливки различных изделий. К тому же времени относится и реконструкция горна в шахтную печь («домницу»), а затем и в доменную печь. В середине 18 в. в Европе начал применяться тигельный процесс получения стали , который был известен на территории Сирии ещё в ранний период средневековья, но в дальнейшем оказался забытым. При этом способе сталь получали расплавлением металлические шихты в небольших сосудах (тиглях) из высокоогнеупорной массы. В последней четверти 18 в. стал развиваться пудлинговый процесс передела чугуна в Ж. на поду пламенной отражательной печи (см. Пудлингование ). Промышленный переворот 18 - начала 19 вв., изобретение паровой машины, строительство железных дорог, крупных мостов и парового флота вызвали громадную потребность в Ж. и его сплавах. Однако все существовавшие способы производства Ж. не могли удовлетворить потребности рынка. Массовое производство стали началось лишь в середине 19 в., когда были разработаны бессемеровский, томасовский и мартеновский процессы. В 20 в. возник и получил широкое распространение электросталеплавильный процесс, дающий сталь высокого качества. Распространённость в природе. По содержанию в литосфере (4,65% по массе) Ж. занимает второе место среди металлов (на первом алюминий). Оно энергично мигрирует в земной коре, образуя около 300 минералов (окислы, сульфиды, силикаты, карбонаты, титанаты, фосфаты и т. д.). Ж. принимает активное участие в магматических, гидротермальных и гипергенных процессах, с которыми связано образование различных типов его месторождений (см. Железные руды ). Ж. - металл земных глубин, оно накапливается на ранних этапах кристаллизации магмы, в ультраосновных (9,85%) и основных (8,56%) породах (в гранитах его всего 2,7%). В биосфере Ж. накапливается во многих морских и континентальных осадках, образуя осадочные руды. Важную роль в геохимии Ж. играют окислительно-восстановительные реакции - переход 2-валентного Ж. в 3-валентное и обратно. В биосфере при наличии органических веществ Fe 3+восстанавливается до Fe 2+и легко мигрирует, а при встрече с кислородом воздуха Fe 2+окисляется, образуя скопления гидроокисей 3-валентного Ж. Широко распространённые соединения 3-валентного Ж. имеют красный, жёлтый, бурый цвета. Этим определяется окраска многих осадочных горных пород и их наименование - «красно-цветная формация» (красные и бурые суглинки и глины, жёлтые пески и т. д.). Физические и химические свойства. Значение Ж. в современной технике определяется не только его широким распространением в природе, но и сочетанием весьма ценных свойств. Оно пластично, легко куется как в холодном, так и нагретом состоянии, поддаётся прокатке, штамповке и волочению. Способность растворять углерод и др. элементы служит основой для получения разнообразных железных сплавов. Ж. может существовать в виде двух кристаллических решёток: a- и g- объёмноцентрированной кубической (ОЦК) и гранецентрированной кубической (ГЦК). Ниже 910 °С устойчиво a - Fe с ОЦК-решёткой (а = 2,86645
Полиморфные превращения Ж. и стали при нагревании и охлаждении открыл в 1868 Д. К.
Чернов
. Углерод образует с Ж.
твёрдые растворы
внедрения, в которых атомы С, имеющие небольшой атомный радиус (0,77
Физические свойства Ж. зависят от его чистоты. В промышленных железных материалах Ж., как правило, сопутствуют примеси углерода, азота, кислорода, водорода, серы, фосфора. Даже при очень малых концентрациях эти примеси сильно изменяют свойства металла. Так, сера вызывает т. н. красноломкость , фосфор (даже 10 -20% Р) - хладноломкость ; углерод и азот уменьшают пластичность , а водород увеличивает хрупкость Ж. (т. н. водородная хрупкость). Снижение содержания примесей до 10 -7 -10 -9% приводит к существенным изменениям свойств металла, в частности к повышению пластичности. Ниже приводятся физические свойства Ж., относящиеся в основном к металлу с общим содержанием примесей менее 0,01% по массе: Атомный радиус 1,26
Ионные радиусы Fe
2+O,80
Плотность (20 oC) 7,874 г/см 3 t пл1539°С t kипоколо 3200 оС Температурный коэффициент линейного расширения (20°С) 11,7·10 -6 Теплопроводность (25°С) 74,04 вт/( м·К) [0,177 ( кал/см·сек·град)] Теплоёмкость Ж. зависит от его структуры и сложным образом изменяется с температурой; средняя удельная теплоёмкость (0-1000 oC) 640,57 дж/( кг·К) [0,153 кал/( г·град)]. Удельное электрическое сопротивление (20°С) 9,7·10 -8 ом·м[9,7·10 -6 ом·см] Температурный коэффициент электрического сопротивления (0-100°С) 6,51·10 -3 Модуль Юнга 190-210·10 3 Мн/м. 2 (19-21·10 3 кгс/мм 2) Температурный коэффициент модуля Юнга 4·10 -6 Модуль сдвига 84,0·10 3 Мн/м 2[8,4·10 3 кгс/мм 2] Кратковременная прочность на разрыв 170-210 Мн/м 2[17-21 кгс/мм 2] Относительное удлинение 45-55% Твёрдость по Бринеллю 350-450 Мн/м 2 [35-45 кгс/мм 2] Предел текучести 100 Мн/м 2[10 кгс/мм 2] Ударная вязкость 300 Мн/м 2[30 кгс/мм 2] Конфигурация внешней электронной оболочки атома Fe 3 d 6 4s 2 .Ж. проявляет переменную валентность (наиболее устойчивы соединения 2- и 3-валентного Ж.). С кислородом Ж. образует закись FeO, окись Fe 2O 3и закись-окись Fe 3O 4(соединение FeO с Fe 2O 3, имеющее структуру шпинели ) .Во влажном воздухе при обычной температуре Ж. покрывается рыхлой ржавчиной (Fe 2O 3· nH 2O). Вследствие своей пористости ржавчина не препятствует доступу кислорода и влаги к металлу и поэтому не предохраняет его от дальнейшего окисления. В результате различных видов коррозии ежегодно теряются миллионы тонн Ж. (см. Коррозия металлов). При нагревании Ж. в сухом воздухе выше 200°С оно покрывается тончайшей окисной плёнкой, которая защищает металл от коррозии при обычных температурах; это лежит в основе технического метода защиты Ж. - воронения.При нагревании в водяном паре Ж. окисляется с образованием Fe 3O 4(ниже 570°С) или FeO (выше 570°С) и выделением водорода. Гидроокись Fe (OH) 2образуется в виде белого осадка при действии едких щелочей или аммиака на водные растворы солей Fe 2+в атмосфере водорода или азота. При соприкосновении с воздухом Fe (OH) 2сперва зеленеет, затем чернеет и наконец быстро переходит в красно-бурую гидроокись Fe (OH) 3. Закись FeO проявляет основные свойства. Окись Fe 2O 3амфотерна и обладает слабо выраженной кислотной функцией; реагируя с более основными окислами (например, с MgO), она образует ферриты - соединения типа Fe 2O 3· nMeO, имеющие ферромагнитные свойства и широко применяющиеся в радиоэлектронике. Кислотные свойства выражены и у 6-валентного Ж., существующего в виде ферратов, например K 2FeO 4, солей не выделенной в свободном состоянии железной кислоты. Ж. легко реагирует с галогенами и галогеноводородами, давая соли, например хлориды FeCl 2и FeCl 3. При нагревании Ж. с серой образуются сульфиды FeS и FeS 2. Карбиды Ж. - Fe 3C ( цементит ) и Fe 2C (e-карбид) - выпадают из твёрдых растворов углерода в Ж. при охлаждении. Fe 3C выделяется также из растворов углерода в жидком Ж. при высоких концентрациях С. Азот, подобно углероду, даёт с Ж. твёрдые растворы внедрения; из них выделяются нитриды Fe 4N и Fe 2N. С водородом Ж. даёт лишь малоустойчивые гидриды, состав которых точно не установлен. При нагревании Ж. энергично реагирует с кремнием и фосфором, образуя силициды (например, Fe 3Si) и фосфиды (например, Fe 3P). Соединения Ж. с многими элементами (О, S и др.), образующие кристаллическую структуру, имеют переменный состав (так, содержание серы в моносульфиде может колебаться от 50 до 53,3 ат.%). Это обусловлено дефектами кристаллической структуры. Например, в закиси Ж. часть ионов Fe 2+в узлах решётки замещена ионами Fe 3+; для сохранения электронейтральности некоторые узлы решётки, принадлежавшие ионам Fe 2+, остаются пустыми и фаза (вюстит) в обычных условиях имеет формулу Fe 0,947O. Нормальный электродный потенциал Ж. в водных растворах его солей для реакции 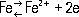
составляет - 0,44 в,а для реакции 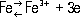
равен - 0,036 в.Т. о., в ряду активностей Ж. стоит левее водорода. Оно легко растворяется в разбавленных кислотах с выделением H 2и образованием ионов Fe 2+. Своеобразно взаимодействие Ж. с азотной кислотой.Концентрированная HNO 3(плотность 1,45 г/см 3) пассивирует Ж. вследствие возникновения на его поверхности защитной окисной плёнки; более разбавленная HNO 3растворяет Ж. с образованием ионов Fe 2+или Fe 3+, восстанавливаясь до MH 3или N 2O и N 2. Растворы солей 2-валентного Ж. на воздухе неустойчивы - Fe 2+постепенно окисляется до Fe 3+. Водные растворы солей Ж. вследствие гидролиза имеют кислую реакцию. Добавление к растворам солей Fe 3+тиоцианат-ионов SCN -даёт яркую кроваво-красную окраску вследствие возникновения Fe (SCN) 3, что позволяет открывать присутствие 1 части Fe 3+примерно в 10 6частях воды. Для Ж. характерно образование комплексных соединений. Получение и применение. Чистое Ж. получают в относительно небольших количествах электролизом водных растворов его солей или восстановлением водородом его окислов. Разрабатывается способ непосредственного получения Ж. из руд электролизом расплавов. Постепенно увеличивается производство достаточно чистого Ж. путём его прямого восстановления из рудных концентратов водородом, природным газом или углём при относительно низких температурах. Ж. - важнейший металл современной техники. В чистом виде Ж. из-за его низкой прочности практически не используется, хотя в быту «железными» часто называют стальные или чугунные изделия. Основная масса Ж. применяется в виде весьма различных по составу и свойствам сплавов. На долю сплавов Ж. приходится примерно 95% всей металлической продукции. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28 |
|||||||
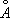 при 20°С). Между 910°С и 1400°С устойчива g-модификация с ГЦК-решёткой (а = 3,64
при 20°С). Между 910°С и 1400°С устойчива g-модификация с ГЦК-решёткой (а = 3,64
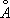 ). Выше 1400°С вновь образуется ОЦК-решётка d-Fe (а = 2,94
). Выше 1400°С вновь образуется ОЦК-решётка d-Fe (а = 2,94
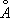 ), устойчивая до температуры плавления (1539°С). a - Fe ферромагнитно вплоть до 769°С (точка Кюри). Модификация g-Fe и d-Fe парамагнитны.
), устойчивая до температуры плавления (1539°С). a - Fe ферромагнитно вплоть до 769°С (точка Кюри). Модификация g-Fe и d-Fe парамагнитны.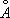 ), размещаются в междоузлиях кристаллической решётки металла, состоящей из более крупных атомов (атомный радиус Fe 1,26
), размещаются в междоузлиях кристаллической решётки металла, состоящей из более крупных атомов (атомный радиус Fe 1,26
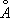 ). Твёрдый раствор углерода в g-Fe наз.
аустенитом
, а в (a-Fe-
ферритом
.
Насыщенный твёрдый раствор углерода в g
-Fe содержит 2,0% С по массе при 1130°С; a-Fe растворяет всего 0,02- 0,04%С при 723°С, и менее 0,01% при комнатной температуре. Поэтому при
закалке
аустенита образуется
мартенсит-пересыщенный твёрдый раствор углерода в a- Fe, очень твёрдый и хрупкий. Сочетание закалки с
отпуском
(нагревом до относительно низких температур для уменьшения внутренних напряжений) позволяет придать стали требуемое сочетание твёрдости и пластичности (см.
Железо - углеродистые сплавы
.
Термическая обработка металлов
).
). Твёрдый раствор углерода в g-Fe наз.
аустенитом
, а в (a-Fe-
ферритом
.
Насыщенный твёрдый раствор углерода в g
-Fe содержит 2,0% С по массе при 1130°С; a-Fe растворяет всего 0,02- 0,04%С при 723°С, и менее 0,01% при комнатной температуре. Поэтому при
закалке
аустенита образуется
мартенсит-пересыщенный твёрдый раствор углерода в a- Fe, очень твёрдый и хрупкий. Сочетание закалки с
отпуском
(нагревом до относительно низких температур для уменьшения внутренних напряжений) позволяет придать стали требуемое сочетание твёрдости и пластичности (см.
Железо - углеродистые сплавы
.
Термическая обработка металлов
).
 , Fe
3+O,67
, Fe
3+O,67