 |
|
���������� ������:: ��� :: ������� ��� ���������� :: ������ ����� :: �������� ����� :: ����� ����� �������� :: ���� ��������� :: ������� ������ :: ������ ����� ���� :: ������� ���� :: ������� ������ ���������� ���������� �����:: �������� ������ :: ����� ���� (��� 1) :: ������ � ������ ��� ����� (��������� ��. ����������� � �������� ������ ������) :: �������� ���� :: ������ ��� :: � ����� ������ �. �������� :: ���� (����� 2) :: ������� ����� :: ������ � �� ����� :: ��� �� ������ �� ������� ������ |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 39)
Лит.:Дэна Дж., Дэна Э. С., Фрондель К., Минералы кремнезёма, пер. с англ., М., 1966 (Система минералогии, т. 3); Минералы, т. 2, в. 2, М., 1965; Костов И., Минералогия, пер. с англ., М., 1971. Г. П. Барсанов. 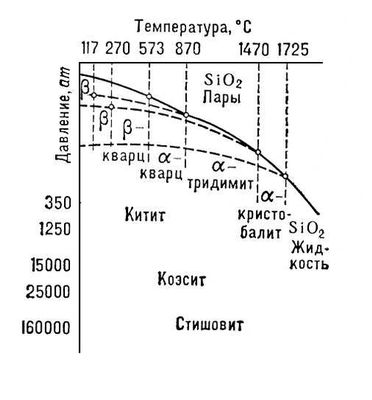
Рис. к ст. Кремнезёма минералы. Кремнероговые губки Кремнероговы'е гу'бки(Cornacuspongida), самый большой отряд губок. Скелет состоит из одноосных кремнёвых игл ( рис. ) и органического вещества - спонгина, или только из спонгиновых волокон. Канальная система - лейконоидного типа .К. г. большей частью образуют колонии в виде корковых или подушковидных обрастаний или трубчатых, воронковидных, кустистых и др. образований. Высота колоний до 0,5 ми более. Встречаются от приливо-отливной зоны до ультраабиссали. В СССР в морских и пресных водоёмах обитает около 220 видов; обычны представители родов Halichondria, Haliclona, Hymeniacidon, Mycale, Myxilla, Tedania и др. 
Иглы кремнероговых губок: одноосные иглы разной формы (слева); хелы, якорьки (справа, вверху), шпильки, сигмы, дужки (справа, внизу). Кремнефториды Кремнефтори'ды,фторсиликаты, соли кремнефтористоводородной кислоты H 2SiF 6. При нагревании распадаются, например CaSiF 6= CaF 2+ SiF 4. Соли Na, К, Rb, Cs и Ba трудно растворимы в воде и образуют характерные кристаллы, что используется в количественном и микрохимическом анализе. Наибольшее практическое значение имеет кремнефторид натрия Na 2SiF 6(в частности, в производстве кислотоупорных цементов, эмалей и т. д.). Значительную долю Na 2SiF 6перерабатывают на NaF. Получают Na 2SiF 6из содержащих SiF 4отходов суперфосфатных заводов. Хорошо растворимые в воде кремнефториды Mg, Zn и Al (техническое название флюаты) применяют для придания водонепроницаемости строительному камню. Все К. (а также H 2SiF 6) ядовиты. Кремнефтористоводородная кислота Кремнефтористоводоро'дная кислота',H 2SiF 6, сильная неорганическая кислота. Существует лишь в водном растворе; в свободном виде распадается на тетрафторид кремния SiF 4и фтористый водород HF. Применяется как сильно дезинфицирующее средство, но главным образом - для получения солей К. к. - кремнефторидов. Кремниевые кислоты Кре'мниевые кисло'ты,производные кремниевого ангидрида SiO 2; очень слабые кислоты, мало растворимые в воде. В чистом виде были получены метакремниевая кислота H 2SiO 3(точнее её полимерная форма H 8Si 4O 12) и H 2Si 2O 5. Аморфная двуокись кремния (аморфный кремнезём) в водном растворе (растворимость около 100 мгв 1 л) образует преимущественно ортокремниевую кислоту H 4SiO 4. В полученных разными способами пересыщенных растворах К. к. изменяются с формированием коллоидных частиц (молярная масса до 1500), на поверхности которых находятся группы OH. Образованный т. о. золь в зависимости от водородного показателя pH может быть устойчивым (pH около 2) или может агрегировать, переходя в гель (pH 5-6). Устойчивые высококонцентрированные золи К. к., содержащие специальные вещества - стабилизаторы, применяют при производстве бумаги, в текстильной промышленности, для очистки воды. Лит.:Айлер Р., Коллоидная химия кремнезёма и силикатов, пер. с англ., М., 1959. Кремниевый ангидрид Кре'мниевый ангидри'д,то же, что кремния двуокись SiO 2. Кремний Кре'мний(лат. Silicium), Si, химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28,086. В природе элемент представлен тремя стабильными изотопами: 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%). Историческая справка. Соединения К., широко распространённые на земле, были известны человеку с каменного века. Использование каменных орудий для труда и охоты продолжалось несколько тысячелетий. Применение соединений К., связанное с их переработкой, - изготовление стекла-началось около 3000 лет до н. э. (в Древнем Египте). Раньше других известное соединение К. - двуокись SiO 2(кремнезём). В 18 в. кремнезём считали простым телом и относили к «землям» (что и отражено в его названии). Сложность состава кремнезёма установил И. Я. Берцелиус.Он же впервые, в 1825, получил элементарный К. из фтористого кремния SiF 4, восстанавливая последний металлическим калием. Новому элементу было дано название «силиций» (от лат. silex - кремень). Русское название ввёл Г. И. Гесс в 1834. Распространённость в природе. По распространённости в земной коре К. - второй (после кислорода) элемент, его среднее содержание в литосфере 29,5% (по массе). В земной коре К. играет такую же первостепенную роль, как углерод в животном и растительном мире. Для геохимии К. важна исключительно прочная связь его с кислородом. Около 12% литосферы составляет кремнезём SiO 2в форме минерала кварца и его разновидностей. 75% литосферы слагают различные силикаты и алюмосиликаты (полевые шпаты, слюды, амфиболы и т. д.). Общее число минералов, содержащих кремнезём, превышает 400 (см. Кремнезёма минералы ) . При магматических процессах происходит слабая дифференциация К.: он накапливается как в гранитоидах (32,3%), так и в ультраосновных породах (19%). При высоких температурах и большом давлении растворимость SiO 2повышается. Возможна его миграция и с водяным паром, поэтому для пегматитов гидротермальных жил характерны значительные концентрации кварца, с которым нередко связаны и рудные элементы (золото-кварцевые, кварцево-касситеритовые и др. жилы). Физические и химические свойства. К. образует тёмно-серые с металлическим блеском кристаллы, имеющие кубическую гранецентрированную решётку типа алмаза с периодом а= 5,431Е, плотностью 2,33 г/см 3.При очень высоких давлениях получена новая (по-видимому, гексагональная) модификация с плотностью 2,55 г/см 3.К. плавится при 1417°С, кипит при 2600°С. Удельная теплоёмкость (при 20-100°С) 800 дж/( кгЧ К), или 0,191 кал/( гЧ град) ;теплопроводность даже для самых чистых образцов не постоянна и находится в пределах (25°С) 84-126 вт/( мЧ К), или 0,20-0,30 кал/( смЧ секЧ град) .Температурный коэффициент линейного расширения 2,33Ч10 -6К -1; ниже 120K становится отрицательным. К. прозрачен для длинноволновых ИК-лучей; показатель преломления (для l =6 мкм) 3,42; диэлектрическая проницаемость 11,7. К. диамагнитен, атомная магнитная восприимчивость -0,13Ч10 -6. Твёрдость К. по Моосу 7,0, по Бринеллю 2,4 Гн/м 2(240 кгс/мм 2) ,модуль упругости 109 Гн/м 2(10890 кгс/мм 2) ,коэффициент сжимаемости 0,325Ч10 -6см 2/кг. К. хрупкий материал; заметная пластическая деформация начинается при температуре выше 800°С. К. - полупроводник, находящий всё большее применение. Электрические свойства К. очень сильно зависят от примесей. Собственное удельное объёмное электросопротивление К. при комнатной температуре принимается равным 2,3Ч10 3 омЧ м(2,3Ч10 5 омЧ см) . Полупроводниковый К. с проводимостью р-типа (добавки В, Al, In или Ga) и n-типа (добавки Р, Bi, As или Sb) имеет значительно меньшее сопротивление. Ширина запрещенной зоны по электрическим измерениям составляет 1,21 эвпри 0 Ки снижается до 1,119 эвпри 300 К. В соответствии с положением К. в периодической системе Менделеева 14 электронов атома К. распределены по трём оболочкам: в первой (от ядра) 2 электрона, во второй 8, в третьей (валентной) 4; конфигурация электронной оболочки 1s 22s 22p 63s 23p 2(см. Атом ) .Последовательные потенциалы ионизации ( эв): 8,149; 16,34; 33,46 и 45,13. Атомный радиус 1,33Е, ковалентный радиус 1,17Е, ионные радиусы Si 4+0,39Е, Si 4-1,98Е. В соединениях К. (аналогично углероду) 4-валентен. Однако, в отличие от углерода, К. наряду с координационым числом 4 проявляет координационное число 6, что объясняется большим объёмом его атома (примером таких соединений являются кремнефториды, содержащие группу [SiF 6] 2-). Химическая связь атома К. с другими атомами осуществляется обычно за счёт гибридных sp 3-орбиталей, но возможно также вовлечение двух из его пяти (вакантных) 3 d-орбиталей, особенно когда К. является шестикоординационным. Обладая малой величиной электроотрицательности, равной 1,8 (против 2,5 у углерода; 3,0 у азота и т. д.), К. в соединениях с неметаллами электроположителен, и эти соединения носят полярный характер. Большая энергия связи с кислородом Si-O, равная 464 кдж/моль(111 ккал/моль) ,обусловливает стойкость его кислородных соединений (SiO 2и силикатов). Энергия связи Si-Si мала, 176 кдж/моль(42 ккал/моль) ;в отличие от углерода, для К. не характерно образование длинных цепей и двойной связи между атомами Si. На воздухе К. благодаря образованию защитной окисной плёнки устойчив даже при повышенных температурах. В кислороде окисляется начиная с 400°С, образуя кремния двуокись SiO 2. Известна также моноокись SiO, устойчивая при высоких температурах в виде газа; в результате резкого охлаждения может быть получен твёрдый продукт, легко разлагающийся на тонкую смесь Si и SiO 2. К. устойчив к кислотам и растворяется только в смеси азотной и фтористоводородной кислот; легко растворяется в горячих растворах щелочей с выделением водорода. К. реагирует с фтором при комнатной температуре, с остальными галогенами - при нагревании с образованием соединений общей формулы SiX 4(см. Кремния галогениды ) .Водород непосредственно не реагирует с К., и кремневодороды (силаны) получают разложением силицидов (см. ниже). Известны кремневодороды от SiH 4до Si 8H 18(по составу аналогичны предельным углеводородам). К. образует 2 группы кислородсодержащих силанов - силоксаны и силоксены. С азотом К. реагирует при температуре выше 1000°С. Важное практическое значение имеет нитрид Si 3N 4, не окисляющийся на воздухе даже при 1200°С, стойкий по отношению к кислотам (кроме азотной) и щелочам, а также к расплавленным металлам и шлакам, что делает его ценным материалом для химической промышленности, для производства огнеупоров и др. Высокой твёрдостью, а также термической и химической стойкостью отличаются соединения К. с углеродом ( кремния карбид SiC) и с бором (SiB 3, SiB 6, SiB 12). При нагревании К. реагирует (в присутствии металлических катализаторов, например меди) с хлорорганическими соединениями (например, с CH 3Cl) с образованием органогалосиланов [например, Si (CH 3) 3CI], служащих для синтеза многочисленных кремнийорганических соединений. К. образует соединения почти со всеми металлами - силициды (не обнаружены соединения только с Bi, Tl, Pb, Hg). Получено более 250 силицидов, состав которых (MeSi, MeSi 2, Me 5Si 3, Me 3Si, Me 2Si и др.) обычно не отвечает классическим валентностям. Силициды отличаются тугоплавкостью и твёрдостью; наибольшее практическое значение имеют ферросилиций (восстановитель при выплавке специальных сплавов, см. Ферросплавы ) и силицид молибдена MoSi 2(нагреватели электропечей, лопатки газовых турбин и т. д.). Получение и применение. К. технической чистоты (95-98%) получают в электрической дуге восстановлением кремнезёма SiO 2между графитовыми электродами. В связи с развитием полупроводниковой техники разработаны методы получения чистого и особо чистого К. Это требует предварительного синтеза чистейших исходных соединений К., из которых К. извлекают путём восстановления или термического разложения. Чистый полупроводниковый К. получают в двух видах: поликристаллический (восстановлением SiCI 4или SiHCl 3цинком или водородом, термическим разложением Sil 4и SiH 4) и монокристаллический (бестигельной зонной плавкой и «вытягиванием» монокристалла из расплавленного К. - метод Чохральского). Специально легированный К. широко применяется как материал для изготовления полупроводниковых приборов (транзисторы, термисторы, силовые выпрямители тока, управляемые диоды - тиристоры; солнечные фотоэлементы, используемые в космических кораблях, и т. д.). Поскольку К. прозрачен для лучей с длиной волны от 1 до 9 мкм,его применяют в инфракрасной оптике (см. также Кварц ) . К. имеет разнообразные и всё расширяющиеся области применения. В металлургии К. используется для удаления растворённого в расплавленных металлах кислорода (раскисления). К. является составной частью большого числа сплавов железа и цветных металлов. Обычно К. придаёт сплавам повышенную устойчивость к коррозии, улучшает их литейные свойства и повышает механическую прочность; однако при большем его содержании К. может вызвать хрупкость. Наибольшее значение имеют железные, медные и алюминиевые сплавы, содержащие К. Всё большее количество К. идёт на синтез кремнийорганических соединений и силицидов. Кремнезём и многие силикаты (глины, полевые шпаты, слюды, тальки и т. д.) перерабатываются стекольной, цементной, керамической, электротехнической и др. отраслями промышленности. В. П. Барзаковский. Кремний в организме находится в виде различных соединений, участвующих главным образом в образовании твёрдых скелетных частей и тканей. Особенно много К. могут накапливать некоторые морские растения (например, диатомовые водоросли) и животные (например, кремнероговые губки, радиолярии), образующие при отмирании на дне океана мощные отложения двуокиси кремния. В холодных морях и озёрах преобладают биогенные илы, обогащенные К., в тропических морях - известковые илы с низким содержанием К. Среди наземных растений много К. накапливают злаки, осоки, пальмы, хвощи. У позвоночных животных содержание двуокиси кремния в зольных веществах 0,1-0,5%. В наибольших количествах К. обнаружен в плотной соединительной ткани, почках, поджелудочной железе. В суточном рационе человека содержится до 1 гК. При высоком содержании в воздухе пыли двуокиси кремния она попадает в лёгкие человека и вызывает заболевание - силикоз. В. В. Ковальский.
Лит.:Бережной А. С., Кремний и его бинарные системы. К., 1958; Красюк Б. А., Грибов А. И., Полупроводники - германий и кремний, М., 1961; Реньян В. Р., Технология полупроводникового кремния, пер. с англ., М., 1969; Салли И. В., Фалькевич Э. С., Производство полупроводникового кремния, М., 1970; Кремний и германий. Сб. ст., под ред. Э. С. Фалькевича, Д. И. Левинзона, в. 1-2, М., 1969-70; Гладышевский Е. И., Кристаллохимия силицидов и германидов, М., 1971; Wolf Н. F., Silicon semiconductor data, Oxf. - N. Y., 1965. Кремнийорганические жидкости Кремнийоргани'ческие жи'дкости,силиконовые масла, органосилоксановые олигомеры или полимеры невысокой молярной массы, способные сохранять текучесть в широком интервале температур. Наибольшее распространение получили К. ж. с макромолекулами линейной (I) и разветвленной (II) структуры и блокированными концами, чаще всего - полидиметилсилоксановые (R = R' = CH 3), полидиэтилсилоксановые (R = R' = C 2H 5) и полиметилфенилсилоксановые (R = CH 3, R' =C 6H 5) с молярными массами от нескольких сот до 30 000 (см. также Кремнийорганические полимеры ) . R
3SiO-[-
RSi [-O (-
К. ж. по внешнему виду напоминают масла нефтяные.К. ж. обладают очень ценными свойствами: гидрофобностью, высокой сжимаемостью, физической и химической инертностью, относительно малым изменением вязкости при изменении температуры, стойкостью при высокой температуре даже в окислительной среде и т. д. Коэффициент адиабатической сжимаемости 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112 |
|||||||
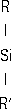 -O-]
n-SiR
3(I)
-O-]
n-SiR
3(I)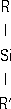 -)
nSiR
3]
3. (II)
-)
nSiR
3]
3. (II)