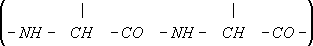|
|
Популярные авторы:: Чехов Антон Павлович :: Горький Максим :: БСЭ :: Толстой Лев Николаевич :: Борхес Хорхе Луис :: Раззаков Федор :: Азимов Айзек :: Лондон Джек :: Сименон Жорж :: Желязны Роджер Популярные книги:: Справочник по реестру Windows XP :: Долгое завтра :: Вольга и Микула Селянинович :: Почтовый феномен :: Николай Черкасов :: Андоррский блудоград, или Der Irrgarten von Andorra :: Всего один концерт :: Так держать, «Секретная семерка»! (Тайна украденных псов) :: Шабаш ведьм :: На страже |
Большая Советская Энциклопедия (БЕ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (БЕ) - Чтение (стр. 13)
Белич Александр Бе'лич(БелиЋ) Александр (2.8.1876, Белград, - 26.11.1960, там же), сербский языковед, президент Сербской АН (1937), иностранный член АН СССР (1910). Профессор Белградского университета (1905), почётный профессор Московского (1947), Пражского, Глазговского и других университетов. В изучении диалектологии, истории, грамматики современного сербского языка труды Б. играют основополагающую роль: «Диалекты Восточной и Южной Сербии» (1905), «Диалектологическая карта сербского языка» (1905), «Современный сербскохорватский язык» (т. 1-2, 1948-49), «История сербскохорватского языка» (т. 1-2, 1950-51). Значителен вклад Б. и в сравнительную грамматику славянских языков: «Акцентологические исследования» (1914), «О двойственном числе в славянских языках» (1932), «Происхождение праславянской глагольной системы» (1935). В своих взглядах на общее языкознание Б. сначала примыкал к младограмматизму , а затем, отойдя от него, создал т. н. белградскую школу. Основные общелингвистические воззрения Б. изложены в труде «О природе языка и языковом развитии» (т. 1-2, 1941-59). Б. - основатель (1913) и редактор журнала «Jyжнословенски филолог». Соч.: Правопис српскохрватског књижевног jeзика, Београд, 1950; Око нашег књижевног jeзика, Београд, 1951. Лит.:Поспелов Н. С., Толстой Н. И., А. И. Белич. [Некролог], «Изв. АН СССР, Отделение литературы и языка», 1960, т. 19, в. 3, с. 269-70. Т. В. Вентцель. Беличан Белича'н,посёлок городского типа в Сусуманском районе Магаданской области РСФСР, на р. Берелёх (бассейн Колымы), в 15 кмот г. Сусуман. 1,2 тыс. жителей (1968). Добыча золота. Беличьи Бе'личьи(Sciuridae), семейство млекопитающих отряда грызунов. К Б. относятся разнообразные по внешнему виду и образу жизни животные, объединяемые единством происхождения и сходством анатомического строения. Семейство включает 47 родов, объединяемых в 2 подсемейства: белки и летяги . Хвост густо покрыт длинными волосами. У летяг по бокам тела имеется кожная перепонка. Зубов 20-22. Распространены очень широко, отсутствуют лишь в Австралии, на Новой Гвинее, в Тасмании, на Мадагаскаре, в северо-западной Африке и в южной части Южной Америки. Белки (грызуны) Бе'лки(Sciurus), род млекопитающих семейства беличьих отряда грызунов. Распространены в лесах Европы, Азии и Америки. Около 50 видов. Приспособлены к древесному образу жизни. Длина тела до 28 см.Мех обычно густой, у некоторых пушистый. Окраска варьирует от ярко-рыжей до серой и чёрной, многие виды окрашены пёстро. В СССР 2 вида: обыкновенная Б. и персидская Б. Обыкновенная Б. (S. vulgaris) распространена в лесной и лесостепной зоне на С. до лесотундры. Наиболее многочисленна в темнохвойной и лиственной тайге и в смешанных лесах. Питается семенами хвойных пород, желудями, орехами, ягодами, иногда насекомыми и яйцами птиц. На зиму делает запасы. Ведёт дневной образ жизни. Строит на деревьях из лишайников, мха, луба и веточек гнёзда (гайна) или поселяется в дуплах. Обычно 2 (иногда 3) выводка в год (по 5-10 бельчат). Численность зависит от урожая семян хвойных пород; в голодные годы предпринимают массовые перекочёвки. Один из основных объектов пушного промысла в СССР (таёжная зона Европейской части, Урала и Сибири). Персидская Б. (S. anomalus) встречается в лесных районах Закавказья; вследствие малочисленности и редкого грубого меха промыслового значения не имеет. Лит.:Огнев С. И., Звери СССР и прилежащих стран, т. 4 - Грызуны, М.-Л., 1940; Наумов С. П. и Лавров Н. П., Биология промысловых зверей и птиц СССР, М., 1948; Млекопитающие фауны СССР. М.-Л., 1963. 
Обыкновенная белка. Белки (название горных вершин в Сибири) Белки',название горных хребтов и вершин в Сибири, главным образом на Алтае (например, Катунские Б.) и в Восточных Саянах (например, Агульские Б.) поднимающихся выше границы леса и покрытых снегом в течение всего или большей части года. Иногда подобного вида вершины и хребты носят название белогорий (например, Манское белогорье в Восточных Саянах). Белки (протеины) Белки',протеины, высокомолекулярные природные органические вещества, построенные из аминокислот и играющие фундаментальную роль в структуре и жизнедеятельности организмов. Именно Б. (ферменты и др.) осуществляют обмен веществ и энергетические превращения, неразрывно связанные с активными биологическими функциями. Б. входят в состав сложных клеточных структур - органелл. И хотя органеллы содержат также другие вещества ( липиды , углеводы , нуклеиновые кислоты , неорганические компоненты), Б. особенно важны; они - основные структурообразователи и играют ведущую роль в выполнении физиологических функций. Например, благодаря соответствующей организации различного рода Б. биологические мембраны , покрывающие клетки, активно (с затратой энергии) переносят в клетку или из клетки определённые молекулы и ионы. В частности, транспорт катионов создаёт электрическую поляризацию, необходимую для процессов возбуждения . В двигательных аппаратах - мышечных волокнах и других - комплексы специфических Б. осуществляют сокращение, превращая химическую энергию в механическую работу. Деятельность Б. во многом связана с разными небелковыми веществами, из которых наибольшее биологическое значение имеют нуклеиновые кислоты. Однако решающим фактором молекулярных механизмов всех активных проявлений жизнедеятельности являются Б. В этом смысле подтверждено и детализировано известное положение Ф. Энгельса о Б. как основе биологической формы движения материи (см. «Анти-Дюринг», 1966, с. 78). Молекулы Б. в структурном отношении бесконечно разнообразны - жёсткость и точность уникальной организации сочетаются в них с гибкостью и пластичностью (см. ниже Структура Б.). Всё это создаёт необозримые функциональные потенции; поэтому Б. и явились тем исключительным материалом, который послужил основой возникновения жизни на Земле. Б. - один из основных продуктов питания человека и животных (см. Белковые корма ), они служат источником восстановления и обновления цитоплазмы клеток, образования ферментов, гормонов и др. (см. Белковый обмен ). Физико-химические свойства Б.Молекулы Б. имеют массу от десятков тыс. до 1 млн. и выше. Так, фермент рибонуклеаза имеет молекулярную массу 12 700, дыхательный пигмент улитки гемоцианин - 6 600 000. Элементарный состав большинства Б.: 50,6-54,5% углерода, 6,5-7,3% водорода, 21,5-23,5% кислорода, 15-17,6% азота, 0,3-2,5% серы; в состав ряда Б. входит и фосфор. Сведения о молекулярной массе и ряде свойств молекул Б. можно получить, исследуя их осаждение (седиментацию) в ультрацентрифуге, диффузию, вязкость, растворимость и светорассеяние. Все Б. с очень большой молекулярной массой построены из более мелких частиц - субъединиц. Растворимые Б. - гидрофильные коллоиды , активно связывающие воду; их растворы обладают значительной вязкостью, низким осмотическим давлением. Молекулы Б. не проходят через полупроницаемые мембраны, обладают слабой способностью к диффузии. Б. - амфотерные электролиты , т.к. имеют свободные карбоксильные (кислотные) и аминные (основные) группы. Изоэлектрическая точка различных Б. неодинакова: для альбумина плазмы крови она равна 4,7, для зеина кукурузы 6,2. Б. имеют электрический заряд, изменяющийся в зависимости от структуры Б. и реакции среды. В электрическом поле растворённые Б. движутся ( электрофорез ), причём направление и скорость движения неодинаковы для различных Б. Растворимость Б. варьирует не меньше, чем другие их свойства. Одни Б. легко растворяются в воде, другие требуют для растворения небольших концентраций солей, третьи переходят в раствор только под воздействием сильных щелочей и т.п. Из растворов Б. неодинаково осаждаются органическими веществами (например, спиртами) или высокими концентрациями солей (высаливаются). Существенные различия в растворимости и других свойствах используются при выделении индивидуальных Б. из тех сложных систем, в которых они встречаются в природе. После очистки многие Б. способны кристаллизоваться. Структура Б.Белок всех организмов состоит из 20 видов аминокислот. Каждый Б. характеризуется определённым ассортиментом и количественным соотношением аминокислот. В молекулах Б. аминокислоты соединены между собой пептидными связями (-СО-NH-) в линейной последовательности ( рис. 1 ), составляющей так называемую первичную структуру Б.
Аминокислотные (полипептидные) цепи, содержащие аминокислоту цистин, в местах его расположения скреплены дисульфидными связями (-S-S-). Между аминокислотами в Б., как правило, не существует иных химических связей, кроме пептидных и дисульфидных. Для каждого Б. не только состав, но и последовательность аминокислот в полипептидной цепи - первичная структура - строго индивидуальны; любое звено цепи - вполне определённая аминокислота. Все многочисленные виды Б., существующие в природе, различаются по первичной структуре; потенциально возможное их число практически неограниченно. Индивидуальная первичная структура каждого Б. сохраняется в поколениях благодаря точной передаче соответствующей наследственной информации (см. ниже Биосинтез Б.). Для анализа первичной структуры Б. разработаны специальные методы. При переваривании определёнными ферментами, например трипсином, каждый Б. даёт свой набор фрагментов (пептидов). При соответствующем их разделении на листе бумаги получается «пептидная карта», которая, подобно отпечатку пальца, характерна для данного Б. Разделение на пептиды и определение строения каждого из них в отдельности - основной путь расшифровки первичной структуры Б. Кроме пептидных и дисульфидных связей, в молекуле Б. есть многочисленные связи с меньшей энергией взаимодействия, имеющие большое значение для внутренней организации и функции Б. Среди этих связей наиболее существенны так называемые гидрофобные связи, создаваемые неполярными боковыми группами аминокислот. Эти группы, лишённые сродства к воде, имеют тенденцию контактировать между собой внутри молекулы Б. Кроме того, в молекуле Б. имеются водородные связи, образуемые полярными группами, например -СО-NH-, а также электростатические взаимодействия между группами, несущими электрические заряды. Пространственная конфигурация (конформация) полипептидной цепи Б. определяется его первичной структурой и условиями среды. При обычных условиях (температура не выше 40°С, нормальное давление и т.д.) Б. характеризуются внутримолекулярной упорядоченностью. «Хребет» полипептидной цепи
местами может закручиваться спиралью или образовывать полностью вытянутые отрезки (вторичная структура). В обоих случаях возникает система водородных связей. Но в значительной части «хребта» геометрическая регулярность может отсутствовать. Полипептидная цепь в целом «упаковывается» и жестко фиксируется с помощью взаимодействий боковых групп аминокислот (третичная структура). В зависимости от укладки полипептидных цепей форма молекул Б. варьирует от фибриллярной (вытянутой, нитеобразной) до глобулярной (округлой). Детальная конфигурация глобулярных молекул сложна и своеобразна для каждого Б. В молекуле превалирует совершенная упорядоченность, распространяющаяся на положение отдельных атомов. Однако некоторые периферические участки могут быть закреплены менее жестко, а погруженные в растворитель гидрофильные боковые группы остаются вполне гибкими. Конформация некоторых Б., например лизоцима ( рис. 2 ), раскрыта рентгеноструктурными исследованиями. Создание упорядоченной прочной конформации Б. определяется целыми системами взаимодействий, находящихся во взаимной зависимости. Смены конформации Б., вызываемые изменениями среды или реакциями, в которые Б. вступают, связаны с изменением ряда взаимодействий. Конформационные переходы охватывают молекулу Б. целиком или ограничиваются определёнными районами. При нагревании, резком подкислении среды и других сильных воздействиях происходит «плавление» молекулы Б. - переход в состояние беспорядочного клубка. Это, как правило, влечёт за собой ряд других превращений, общий результат которых обозначают как денатурацию Б. (см. Биополимеры ) .При этом понижается растворимость Б., усиливается вязкость их растворов, теряются ферментативные и другие биологические свойства. Каждый из бесчисленного множества существующих Б. имеет особую наследственно детерминированную первичную структуру, присущую только ему. Это обусловливает строго индивидуальную систему внутримолекулярных связей, т. е. уникальную конформацию Б. Поэтому каждый Б. характеризуется собственной «химической топографией» и своеобразными сочетаниями пространственно сближенных химических групп. Часть таких сочетаний служит функциональными центрами молекул Б. Благодаря структурному соответствию, напоминающему отношение ключа к замку (комплементарности), функциональные центры «узнают» и избирательно присоединяют вещества, на которые соответствующие Б. «установлены». Функциональные - активные центры Б.-ферментов специфически присоединяют субстраты и активируют их, ускоряя и направляя химические превращения. При помощи особых центров взаимного связывания («контактных площадок») определённые Б. соединяются по нескольку вместе (структура 4-го порядка) или создают значительно более сложные системы (самосборка крупных белковых структур). Процессы самосборки существенны для морфогенеза. Изучение структуры Б. даёт возможность переходить к их синтезу. В 1955 была выяснена структура инсулина,молекула которого состоит из двух сравнительно коротких полипептидных цепей (21 и 30 аминокислотных остатков). Вслед за этим была раскрыта первичная структура гемоглобина,рибонуклеазы, трипсина и ряда других Б. ( рис. 3 ). Путём химического синтеза сначала были получены сложные пептиды со свойствами гормонов,затем удалось синтезировать гормон инсулин, наконец - фермент рибонуклеазу. Правильность химической формулы инсулина и рибонуклеазы подтвердилась тем, что синтетические Б. не отличались от Б., продуцируемых организмом, ни по физико-химическим свойствам, ни по биологической активности. Установлена полностью или частично первичная структура свыше 200 Б. Классификация Б.До сих пор нет единого принципа классификации Б. При делении всех известных Б. на группы учитывают и их состав (строение), физико-химические свойства (растворимость, щёлочность), происхождение и роль в организме. Б. делят на простые - протеины, состоящие только из аминокислот, и сложные - протеиды, в состав молекулы которых входят, кроме аминокислот, и другие соединения. К простым Б. относятся альбумины , глобулины , гистоны , глутелины , проламины , протамины и протеиноиды . К сложным Б. относятся гликопротеиды (содержащие, кроме аминокислот, углеводы), липопротеиды (содержащие липиды), нуклеопротеиды (в их состав входят и нуклеиновые кислоты), фосфопротеиды (содержащие фосфорные кислоты) и хромопротеиды (имеющие пигментные металлосодержащие группы). В. А. Белицер. Биосинтез Б.- процесс образования Б. из аминокислот в клетках живых организмов. Выяснение механизма этого процесса, имеющего огромное биологическое значение, можно отнести к важнейшим достижениям науки 20 в. Биосинтез Б. идёт при помощи особых сложных механизмов, обеспечивающих упорядоченное воспроизведение специфических Б. уникальной структуры. Механизмы эти едины или весьма сходны для самых разнообразных клеток и организмов, в них принимают участие нуклеиновые кислоты , в особенности рибонуклеиновые кислоты (РНК). Этот процесс идёт с использованием энергии, накопленной в виде аденозинтрифосфорной кислоты (АТФ) (см. Биоэнергетика ). Биосинтез Б. происходит на особых рибонуклеопротеидных частицах - рибосомах , состоящих из почти равных количеств рибосомной РНК ( р-РНК) и белков. Первичная структура (последовательность аминокислот) синтезирующихся полипептидных цепочек обеспечивается соединением с рибосомами особой матричной, или информационной, рибонуклеиновой кислоты (и-РНК, или м-РНК), которая содержит информацию о специфическом строении Б., «закодированную» в виде последовательного расположения нуклеотидов, составляющих и-РНК. Эту информацию и-РНК получает от дезоксирибонуклеиновой кислоты (ДНК), хранящей и передающей её по наследству. Аминокислоты, прежде чем попасть в рибосомы, активируются, получая энергию от АТФ и образуя соединение с адениловой кислотой. (Активированные аминокислоты представляют собой смешанный ангидрид аминокислоты и адениловой кислоты - аминоациладенилат.) Далее, остаток данной аминокислоты переносится на соответствующую транспортную рибонуклеиновую кислоту (т-РНК). Оба эти процесса катализируются одним и тем же ферментом (аминоациладенилатсинтетазой, или аминоацилт-РНК-синтетазой), специфическим для каждой аминокислоты. Определённой аминокислоте соответствуют одна или несколько специфичных для неё т-РНК. Все т-РНК сравнительно низкополимерны, содержат около 80 нуклеотидных остатков. Они построены по общему плану: в начале цепи находится 5-гуаниловая кислота, а в конце - часто обменивающаяся группировка из двух остатков цитидиловой кислоты и аденозина, к которому и присоединяется остаток аминокислоты. Остаток аминокислоты, соединённый с т-РНК, далее переносится на рибосомы, где и происходит образование полипептидной цепочки Б. ( рис. 4 ). Т. о., рибосомная стадия - центральный этап биосинтеза Б. В процессе биосинтеза Б. рибосомы соединяются в цепочки при помощи и-РНК, образуя активные белоксинтезирующие структуры -полирибосомы, или полисомы. и-РНК синтезируется на матрице ДНК. В уникальной последовательности нуклеотидов ДНК линейно «записана» генетическая информация о последовательности аминокислотных остатков в полипептидных цепочках Б. В новообразованной и-РНК получается нуклеотидная последовательность, соответствующая матричной ДНК, - комплементарная последовательность, которая определяет первичную структуру синтезирующейся полипептидной цепочки. Включение каждой аминокислоты обусловливается (кодируется) определёнными группами из трёх нуклеотидных остатков (триплетами). Каждой аминокислоте соответствует несколько триплетов, или кодонов, для которых теперь установлены состав и последовательность нуклеотидов (см. Генетический код ). В полисомах т-РНК, нагруженная аминокислотой, присоединяется к соответствующим кодонам и-РНК. Это присоединение совершается внутри рибосомы в силу взаимодействия комплементарных оснований: аденина с урацилом или тимином и гуанина с цитозином. При этом т-РНК присоединяется к кодону содержащимся в ней комплементарным триплетом, называемым антикодоном. По мере продвижения рибосомы по нуклеотидной цепочке и-РНК к соседним кодонам присоединяются новые молекулы т-РНК, нагруженные аминокислотами. Предыдущая т-РНК при этом освобождается, присоединяя свою аминокислоту карбоксильным концом к аминогруппе новой аминокислоты с образованием пептидной связи. Т. о., полипептидная цепочка растет по мере продвижения рибосомы по и-РНК и освобождается по завершении своего синтеза, пройдя соответствующий участок и-РНК, комплементарный данному структурному гену ( цистрону ) ДНК. Процесс биосинтеза Б. не исчерпывается образованием полипептидных цепочек, т. е. созданием первичной структуры Б. Далее происходит свёртывание цепочек в спирали, их «укладка» и взаимодействие, и образование вторичной, третичной и, иногда, четвертичной структуры. Однако возможно, что приведённая схема не исчерпывает всех путей биосинтеза Б. Весьма важна проблема регуляции биосинтеза Б., определяющей включение или выключение синтеза тех или иных Б. под влиянием внутренних (в том числе дифференцировки клеток и тканей) или внешних импульсов и создающей условия для синтеза Б. в данной дифференцированной клетке. Теоретическая и экспериментальная разработка проблемы биосинтеза Б. имеет не только важнейшее теоретическое, но и практическое значение, поскольку, открывая подходы к воздействию на этот процесс, она намечает пути лечения ряда заболеваний, а также влияния на продуктивность многих сельскохозяйственных растений и животных. В связи с важным значением Б. разрабатываются новые методы получения Б. и аминокислот путём промышленного микробиологического синтеза, т. е. выращиванием микробов (например, дрожжей и др.) на дешёвом сырье (например, нефти, газе и др.). И. Б. Збарский. Лит.:Волькенштейн М. В., Молекулы и жизнь, М., 1965, гл. 3-5; Гауровиц Ф., Химия и функции белков, пер. с англ., [2 изд.], М., 1965; Биосинтез белка и нуклеиновых кислот, под ред. А. С. Спирина, М., 1965; Сисакян Н. М. и Гладилин К. Л., Биохимические аспекты синтеза белка, в кн.: Успехи биологической химии, т. 7, М., 1965, с. 3; Молекулы и клетки. [Сб. ст.], пер. с англ., М., 1966, с. 7-27, 94-106; Шамин А. Н., Развитие химии белка, М., 1966; Введение в молекулярную биологию, пер. с англ., М., 1967. 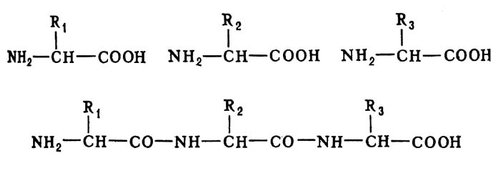
Рис. 1. Соединение аминокислот. Верхняя строка - свободные аминокислоты с боковыми группами R1, R2, R3; нижняя строка - аминокислоты соединены пептидными связями. 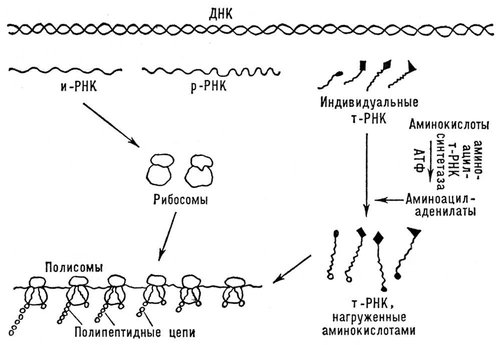
Рис. 4. Общая схема биосинтеза белков. 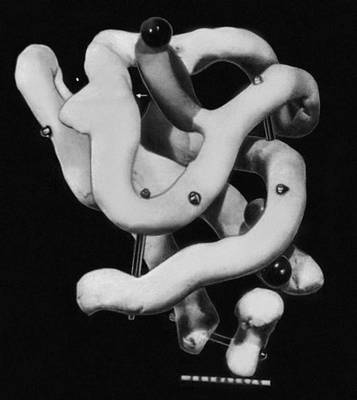
Рис. 3. Модель молекулы миоглобина (пространственная конфигурация молекулы). 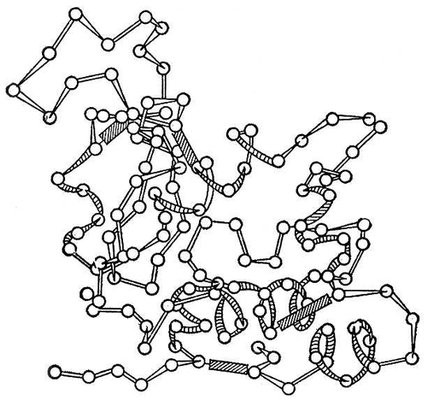
Рис. 2. Схема трёхмерной структуры фермента лизоцима. Кружки - аминокислоты; тяжи - пептидные связи; заштрихованные прямоугольники - дисульфидные связи. Видны спирализованные и вытянутые участки полипептидной цепи. Белковомолочность Белковомоло'чность,один из важных качественных показателей молочной продуктивности животных. Выражается процентным или весовым содержанием белка в молоке. В молоке различных видов сельскохозяйственных животных содержится общего белка в среднем (%): у коров 3,3-3,4, у буйволиц 4,0, у зебу 4,3, у ячих 5,0, у кобыл 2,1, у ослиц 2,2, у верблюдиц 3,5, у овец 6,0, у коз 4,0, у свиней 7,2. Содержание белка в молоке зависит также от породы, периода лактации, кормления и содержания, здоровья, физиологического состояния животного и других факторов. Например, содержание белка в молоке коров ярославской породы 3,5%, холмогорской 3,3%. У одной и той же породы наибольшее содержание белка в молозиве от 14 до 22%; к 10-му дню после отёла в молоке - среднее для породы, ко 2-3-му меслактации - наименьшее, к концу лактации опять увеличивается. В период половой охоты, линьки, при истощении количество белка в молоке снижается. Повышенное содержание протеина в рационе, как правило, сопровождается увеличением белка в молоке, но при организации кормления следует учитывать, что белковый перекорм физиологически вреден и экономически невыгоден. Возраст животных и техника доения существенного влияния на Б. не оказывают. Б. - качество наследственное, поэтому в племенном животноводстве необходимо вести отбор и подбор по этому качеству. Большое значение имеет проверка и оценка производителей по Б. их дочерей. Лит.:Маркова К. В., Альтман А. Д., Какие факторы влияют на состав молока, М., 1963; Соловьев А. А., Веселова И. А., Содержание белковых веществ в молоке и пути их повышения, «Труды Вологодского молочного института», 1963, в. 46; Методы определения белка в молоке, пер. с голл., М., 1965. А. А. Соловьёв. Белковые железы Белко'вые же'лезы,все железы, в секрете которых содержится белок. У позвоночных к Б. ж. относятся поджелудочная, слёзные, из слюнных - околоушная (у человека), подчелюстная (у грызунов) и др. К Б. ж. относятся и железы, выделяющие белок яйца . У беспозвоночных, например у слизняков, - это выросты половых путей, у позвоночных - отдельные клетки в стенках яйцеводов . Белковые искусственные волокна Белко'вые иску'сственные воло'кна,волокна, получаемые путём химической переработки белков животного или растительного происхождения. В качестве сырья для Б. и. в. применяют в основном белок молока ( казеин ), а также белки, содержащиеся в кукурузных зёрнах, земляных орехах и соевых бобах. Б. и. в. формуют из щелочных (NaOH) растворов белков по так называемому мокрому методу (о методах формования волокон см. Волокна химические ). Волокна окрашивают кислотными, протравными и другими красителями, применяемыми для крашения шерсти. Б. и. в. обладают хорошими теплозащитными свойствами, эластичны, мягки на ощупь, не вызывают раздражения кожи, устойчивы к действию слабых растворов минеральных кислот; неустойчивы в растворах едких щелочей. Обычные органические растворители не повреждают Б. и. в., поэтому изделия из них можно подвергать сухой химической чистке. Прочность Б. и. в. по сравнению с другими искусственными волокнами невелика - разрывная длина от 7 до 10 км,потеря прочности при испытании в мокром состоянии составляет 50-70%. В связи с этим Б. и. в. обычно выпускают в виде штапельного волокна и перерабатывают в изделия в смеси с шерстью или хлопком. Б. и. в. применяют для изготовления костюмных, сорочечных и пижамных тканей; фетровых, вязаных и чулочно-носочных изделий; спортивной одежды и одеял. Белковые корма Белко'вые корма',корма растительного и животного происхождения с высоким содержанием протеина . Среди зелёных кормов больше всего протеина высокого качества в молодой траве бобовых - от 132 г(у клевера) до 218 г(у бобов кормовых) переваримого протеина на 1 кормовую единицу (корм. ед.). Из зерновых кормов богаты протеином также бобовые: в 1 корм. ед. зерна гороха содержится до 158 гпереваримого протеина, бобов 211 г, сои 223 г.Много протеина в муке и отрубях бобовых, пшенице, просе, жмыхах, шротах, пивных, пекарских и кормовых дрожжах. Корма животного происхождения отличаются не только богатством, но и высокой биологической ценностью протеина. В мясной муке 480 гпереваримого протеина на 1 корм. ед., в лучших сортах рыбной муки свыше 600 г,в сухой крови до 554 г. Белковые пластики Белко'вые пла'стики,пластмассы на основе белков животного или растительного происхождения. Сырьём для Б. п. служит в основном белок молока ( казеин ), а также белки, содержащиеся в кукурузных зёрнах, земляных орехах и соевых бобах. В состав Б. п., кроме белков, входят пластификаторы, красители, а также наполнители (для получения непрозрачных изделий). Наиболее распространённый Б. п. - галалит. Для его получения казеин измельчают на вальцах, замешивают с красителями (0,6-1,5% от массы казеина) и пластификаторами (1,3% диметиланилина и 1,4% дифениламина), а затем смесь формуют в червячном прессе при 50-100°С и давлении 10-20 Мн/м 2(100-200 кгс/см 2) .Полученный в виде стержней, лент, труб или ронделей (пуговичных заготовок) продукт отверждают (дубят) в 3-5%-ном водном растворе формальдегида, а затем сушат горячим (50°С) воздухом. Отверждение придаёт Б. п. стойкость в агрессивных средах, повышает их механическую прочность и снижает гигроскопичность. В зависимости от состава композиции получают Б. с широким диапазоном свойств [например, прочность при растяжении от 70 до 105 Мн/м 2(от 700 до 1050 кгс/см 2) ,при изгибе от 50 до 120 Мн/м 2(от 500 до 1200 кгс/см 2) ;водопоглощение от 7 до 14%]. Б. п. устойчивы к действию органических растворителей и растворов слабых кислот, разрушаются при действии сильных кислот и растворов щелочей, хорошо поддаются механической обработке. Применяют Б. п. в основном для изготовления пуговиц и пряжек (галалит), а также получения износостойких и блестящих плёнок для упаковки пищевых продуктов. Производство Б. п. за рубежом и в СССР сокращается в связи с получением новых синтетических материалов на основе непищевых продуктов. Белковый минимум Белко'вый ми'нимум,наименьшее количество белка в пище, необходимое для сохранения азотистого равновесия в организме. Уменьшение белка в пище ниже Б. м. приводит к распаду собственных белков организма. Б. м. зависит от индивидуальных особенностей организма, возраста, упитанности, а также от качества и количества других небелковых компонентов пищи (углеводов, жиров, витаминов и пр.). Количество белка, необходимое для человека или животного, меняется в связи с биологической ценностью пищевых белков, которая определяется содержанием в них различных аминокислот . Многие белки и белковые смеси неполноценны вследствие отсутствия в них определённых аминокислот, которые не могут быть синтезированы в организме человека и животных. Для составления пищевых рационов ориентируются на белковый оптимум, т. е. на количество белка, необходимое для полного обеспечения потребностей организма; для взрослого человека оно равно, в среднем, 80-100 гбелка, при тяжёлом физическом труде - 150 г.См. Белки, Белковый обмен, Обмен веществ. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67 |
|||||||