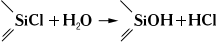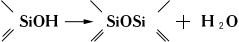|
|
���������� ������:: ��� :: ������� ��� ���������� :: ������ ����� :: �������� ����� :: ����� ����� �������� :: ���� ��������� :: ������� ������ :: ������ ����� ���� :: ������� ���� :: ������� ������ ���������� ���������� �����:: �������� ������ :: ����� ���� (��� 1) :: ������ � ������ ��� ����� (��������� ��. ����������� � �������� ������ ������) :: �������� ���� :: ������ ��� :: � ����� ������ �. �������� :: ���� (����� 2) :: ������� ����� :: ������ � �� ����� :: ��� �� ������ �� ������� ������ |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 41)
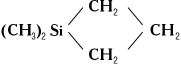
Практическое значение имеют: 1) полиборорганосилоксаны, которые применяют для изготовления клеев и самосклеивающихся резин; 2) полиалюмоорганосилоксаны - теплостойкие материалы в прецизионном литье металлов, катализаторы полимеризации при получении полиорганосилоксанов, а также плёнкообразующие для приготовления лаков, дающих термостойкие покрытия; 3) полититанорганосилоксаны - термостойкие материалы и герметики. Полиорганосилазаны.Линейные полимеры - вязкие продукты, хорошо растворимые в органических растворителях, полимеры полициклической структуры - твёрдые бесцветные хрупкие вещества, имеющие температуру плавления от 150 до 320°С. Полиорганосилазаны устойчивы к действию воды в нейтральной и слабощелочной средах, но в кислой среде разлагаются; при нагревании со спиртом подвергаются алкоголизу. Полимеры низкой молярной массы получают аммонолизом алкилхлорсиланов аммиаком или первичными аминами, например: n (CH 3) 2SiCl 2+(2n-1) NH 3®H 2N-Si (CH 3) 2[-NH-Si (CH 3) 2-] n-1NH 2+2NH 4CI. Эта реакция сопровождается образованием циклических соединений. Полимеры с молярной массой до 5000 получают ионной полимеризацией органоциклосилазанов. Полиорганосилазаны находят практическое применение как гидрофобизаторы для различных строительных материалов и тканей, а также в качестве отвердителей кремнийорганических полимеров, эпоксидных смол и компаундов полимерных. Полиорганоалкиленсиланы.Эти полимеры обладают довольно высокой термостойкостью. Т. к. полимерная цепь полиорганоалкиленсиланов содержит только связи Si-C и С-С, они отличаются высокой гидролитической устойчивостью и стойкостью к действию щелочей и кислот. Высокомолекулярные полимеры этого класса получают полимеризацией силациклоалканов в присутствии металлоорганических катализаторов или взаимодействием гидросиланов с дивинилсиланами в присутствии H 2PtCl 6 ,органических перекисей или третичных аминов. Полиорганоалкиленсиланы пока не нашли практического применения из-за относительно высокой стоимости соответствующих мономеров. Прочие полимеры.Полиорганосиланы отличаются невысокой химической и термоокислительной стойкостью, т. к. связь Si-Si при действии щелочей или окислителей легко разрывается с образованием силанольной группировки Si-ОН. Поэтому практическое значение полиорганосиланов является проблематичным. К. п. с органическими главными цепями макромолекул имеют меньшее практическое значение, чем, например, полиорганосилоксаны, т. к. они не обладают высокой теплостойкостью, присущей последним. Лит.:Андрианов К. А., Полимеры с неорганическими главными цепями молекул, М., 1962; Бажант В., Хваловски В., Ратоуски И., Силиконы, [пер. с чеш.], М., 1960; Миле Р. Н., Льюис Ф. М., Силиконы, пер. с англ., М.,1964; Андрианов К. А., Теплостойкие кремнийорганические диэлектрики, М.- Л., 1964; Борисов С. Н., Воронков М. Г., Лукевиц Э. Я., Кремнеэлементоорга-нические соединения, [Л.], 1966; Андрианов К. А., Кремний, М., 1968 (Методы элементоорганической химии). К. А. Андрианов. Кремнийорганические соединения Кремнийоргани'ческие соедине'ния,класс химических соединений, содержащих в молекулах связь кремний - углерод. К. с. подразделяют на следующие группы. 1) Органогалогенсиланы [алкил (арил)-галогенсиланы] R nSiX 4-n; органогидридгалогенсиланы R nSiH mX 4-(n+m)(где Х - чаще Cl); органоалкоксисиланы R nSi (OR') 4-n; органоацилоксисиланы R nSi (OCOR') 4-n; органоаминосиланы RnSi (NH 2) 4-n. 2) Органосиланы (замещенные силаны) R nSiH 4-n. 3) Органосилоксаны, включающие дисилоксаны R 3SiOSiR 3, трисилоксаны R 3SiOSi (R 2) OSiR 3и т. д.; циклосилоксаны (R2SiO) n, где n =3-10 (чаще 3-4) 4) Гетероциклические соединения, например диметилсилациклобутан
К соединениям первых двух групп примыкают близкие им по химическим свойствам соответствующие неорганические аналоги, такие, как галогенсиланы SiH mX 4-m(см. Кремния галогениды ) ,силаны Si xH y(см. Кремневодороды ) ,а также алкоксисиланы Si (OR) 4. Получение. В промышленности наиболее важные К. с. получают главным образом непосредственным взаимодействием хлористых алкилов (арилов) с кремнием в присутствии меди; наряду с главным продуктом реакции 2RCI+Si®R 2SiCl 2образуется смесь различных соединений (RSiCI 3, R 3SiCl, RHSiCl 2и др.), которые также находят применение в промышленности, например для синтеза К. с. более сложной структуры или полимеров. К. с. получают также реакциями с металлоорганическими соединениями: CH 3SiCl 3+C 6H 5MgCl®CH 3(C 6H 5) SiCl 2+MgCI 2; термической конденсацией: CH 3SiHCl 2+CH 2=CHCl®CH 3(CH 2=CH) SiCl 2+HCI; жидкофазной дегидроконденсацией: CH 3SiHCl 2+C 6H 6®CH 3(C 6H 5) SiCl 2+H2; присоединением органогидридхлорсиланов к ненасыщенным соединениям: CH 3SiHCl 2+RCH=СН 2®CH 3(RCH 2CH 2) SiCl 2. Алкокси- и ацилоксисиланы получают чаще всего взаимодействием органохлорсиланов со спиртами, кислотами и др. Свойства некоторых кремнийорганических соединений
Свойства и применение. Почти все К. с. - бесцветные жидкости (см. табл.); лишь некоторые из них, например циклосилоксаны (R 2SiO) 3, - твёрдые кристаллические вещества. Обычно К. с. термически устойчивы (~600°С), перегоняются при атмосферном давлении и в вакууме; хорошо растворяются в углеводородах, хлорированных углеводородах, эфирах и др. органических растворителях; с водой не смешиваются. К. с. легко гидролизуются, особенно органохлорсиланы (дымят на воздухе):
Образующиеся при гидролизе органогидроксисиланы вступают в межмолекулярную конденсацию с образованием органосилоксанов:
Под влиянием выделяющейся (или вводимой) кислоты происходит поликонденсация с образованием кремнийорганических полимеров.В соответствии с числом способных к гидролитическому отщеплению групп (обычно хлор, иногда алкокси-, ацилокси- или аминогруппы) различают моно-, ди-, три- и тетрафункциональные К. с., образующие при гидролизе соответственно дисилоксаны, смесь линейных полимеров HO (R 2SiO) nH и низкомолекулярных циклических диорганосилоксанов (R^SiO) n(в основном n=4), полимеры циклолинейной и сшитой структур (RSiO 1,5) nи (SiO 2) n. Циклические диорганосилоксаны (главным образом тримеры и тетрамеры), образующиеся также при термокаталитической деструкции (щелочь, 150-400°С) полимеров, содержащих концевые гидроксильные группы, используют для производства кремнииоиганических каучуков и кремнийорганических жидкостей.Смесь тетраэтоксисилана с продуктами его частичного гидролиза под техническим названием «этилсиликат» используют при приготовлении форм для точного литья по выплавляемым моделям. С. А. Голубцов. Кремнистые породы Кремни'стые поро'ды,силициты, группа осадочных пород, состоящих полностью или более чем на 50% из свободного или водного кремнезёма. Породообразующими минералами являются опал, халцедон и кварц. Соответственно различают опаловые, халцедоновые, кварцевые и смешанные К. п. Строение микрозернистое и скрытокристаллическое. По условиям залегания К. п. могут быть пластовыми и желваковыми (см. Кремень ) .По происхождению различают хемогенные (джеспилиты, кремнистые туфы) и органогенные (диатомит, радиолярит, спонголит) К. п. Кроме того, выделяются криптогенные К. п. (опоки, трепел и др.). В образовании многих К. п. весьма существенное значение имеет вулканогенно-осадочный процесс (яшмы, гейзериты, некоторые джеспилиты и др.). Халцедоновые и кварцевые К. п. возникают в результате раскристаллизаций опаловых. Генезис многих К. п. является предметом дискуссии. К. п. молодых отложений (начиная с меловой системы) сложены преимущественно опалом, в юрских и триасовых - халцедоном и кварцем; в палеозойских и более древних - кварцем. В древних породах опал встречается лишь в виде вторичных выделений. Распространение К. п. по стратиграфической колонке и в пространстве отражает эволюцию кремнистого осадконакопления. В докембрии (в геосинклинальных и платформенных условиях) отлагались железисто-кремнистые толщи джеспилитов за счёт веществ, поступавших с материков и из вулканических источников. В отложениях моложе кембрия джеспилиты не встречаются. В палеозое существенную роль в образовании К. п. приобретают организмы (радиолярии и губки). Основными зонами накопления К. п. стали геосинклинали с характерным для них вулканогенно-осадочным процессом. Вулканогенный SiO 2выпадал в осадок химическим и биохимическим путями. Начиная с мелового времени органогенное образование К. п. стало господствующим в связи с появлением в конце юры диатомей. К. п. получили широкое распространение в осадках мирового океана и на материковых платформах, преимущественно в высоких широтах Северного и Южного полушарий; они сохранили также значительное развитие в геосинклиналях. В современную эпоху морские воды недонасыщены кремнезёмом и хемогенное осаждение К. п. не происходит; накапливаются только органогенные К. п. Лит.:Швецов М. С., Петрография осадочных пород, 3 изд., М., 1958; Теодорович Г. И., Учение об осадочных породах, Л., 1958; Геохимия кремнезема, Сб. ст., М., 1966. Г. А. Каледа. Кремнистый туф Кремни'стый туф,натёчные кремнёвые, в основном опаловые, породы, являющиеся отложениями минеральных источников, преимущественно горячих. Характерен для отложений гейзеров и др. источников вулканических областей (гейзерит). Окраска (бурая, зеленоватая, красная, жёлтая и др.) зависит от различных минеральных примесей (главным образом водных окислов железа, а также от присутствия органических веществ). Отложения К. т. обычно пористые, иногда в виде натёков, занимают небольшие участки вблизи источника, из воды которого выпадает кремнёвое вещество. Кремницкие горы Кремни'цкие го'ры(Kremnickй pohoYн), горы в южной части Западных Карпат, в Чехословакии. Высоты до 1318 м(г. Флохова). Сложены главным образом андезитами и вулканическими туфами. Дубовые, буковые и смешанные (ель, пихта и бук) леса. В восточных предгорьях К. г. - г. Банска-Бистрица. Кремния галогениды Кре'мния галогени'ды,соединения кремния с галогенами. Известны К. г. следующих типов (Х-галоген): SiX 4, SiH nX 4-n(галогенсиланы), Si nX 2n+2и смешанные галогениды, например SiClBr 3. При обычных условиях SiF 4- газ, SiCl 4и SiBr 4- жидкости ( t пл-68,8 и 5°С), SiI 4- твёрдое тело ( t nл124°С). Соединения SiX 4легко подвергаются гидролизу: SiX 4+2H 2O=SiO 2+4HX; на воздухе дымят вследствие образования очень мелких частиц SiO 2; тетрафторид кремния реагирует иначе: 3SiF 4+2H 2O=SiO 2+2H 2SiF 6. Хлорсиланы (SiH nX 4-n), например SiHCl 3(получается действием газообразного HCl на Si), при действии воды образуют полимерные соединения с прочной силоксановой цепью (см. Силоксаны ) Si-O-Si. Отличаясь большой реакционной способностью, хлорсиланы служат исходными веществами для получения кремнийорганических соединений.Соединения типа Si nX 2n+2, содержащие цепи атомов Si, при Х - хлор, дают ряд, включая Si 6Cl 14( t nл320°С); остальные галогены образуют только Si 2X 6. Получены соединения типов (SiX 2) nи (SiX) n. Молекулы SiX 2и SiX существуют при высокой температуре в виде газа и при резком охлаждении (жидким азотом) образуют твёрдые полимерные вещества, нерастворимые в обычных органических растворителях. Тетрахлорид кремния SiCl 4используется при производстве смазочных масел, электроизоляций, теплоносителей, гидрофобизирующих жидкостей и т. д. Лит.:Лапидус И. И. и Нисельсон Л. А., Тетрахлорсилан и трихлорсилан, М., 1970. В. П. Барзаковский. Кремния двуокись Кре'мния двуо'кись,кремнезём, SiO 2, соединение кремния с кислородом. Кремнезём в форме минерала кварца и др. разновидностей составляет около 12% массы земной коры (см. Кремнезёма минералы ) .К. д. широко применяется в силикатной промышленности - в производстве стекла ( кварцевое стекло и др.), керамики, абразивов, бетонных изделий, силикатного кирпича и др. Важная область применения кристаллов кварца - радиотехника и ультразвуковые установки (подробнее см. Кварц ) . Кремния карбид Кре'мния карби'д,карборунд, SiC, соединение кремния с углеродом; один из важнейших карбидов,применяемых в технике. В чистом виде К. к. - бесцветный кристалл с алмазным блеском; технический продукт зелёного или сине-чёрного цвета. К. к. существует в двух основных кристаллических модификациях - гексагональной (a-SiC) и кубической (b-SiC), причём гексагональная является «гигантской молекулой», построенной по принципу своеобразной структурно-направленной полимеризации простых молекул. Слои из атомов углерода и кремния в a-SiC размещены относительно друг друга по-разному, образуя много структурных типов. Переход b-SiC в a-SiC происходит при температуре 2100-2300°С (обратный переход обычно не наблюдается). К. к. тугоплавок (плавится с разложением при 2830°С), имеет исключительно высокую твёрдость (микротвёрдость 33400 Мн/м 2или 3,34 тс/мм 2) ,уступая только алмазу и бора карбидуB 4C;хрупок; плотность 3,2 г/см 3.К. к. устойчив в различных химических средах, в том числе при высоких температурах. К. к. получают в электропечах при 2000-2200°С из смеси кварцевого песка (51-55%), кокса (35-40%) с добавкой NaCI (I-5%) и древесных опилок (5-10%). Благодаря высокой твёрдости, химической устойчивости и износостойкости К. к. широко применяется как абразивный материал (при шлифовании), для резания твёрдых материалов, точки инструментов, а также для изготовления различных деталей химической и металлургической аппаратуры, работающей в сложных условиях высоких температур. К. к., легированный различными примесями, используется в технике полупроводников, особенно при повышенных температурах. Интересно использование К. к. в электротехнике - для изготовления нагревателей высокотемпературных электропечей сопротивления (силитовые стержни), грозоразрядников для линий передачи электрического тока, нелинейных сопротивлений, в составе электроизолирующих устройств и т. д. Г. В. Самсонов. Кремона (город в Италии) Кремо'на(Cremona), город в Северной Италии, в Ломбардии, на левом берегу р. По. Административный центр провинции Кремона. 82 тыс. жителей (1970). Речной порт, ж.-д. узел. Пищевая, швейная, машиностроительная, деревообрабатывающая, нефтеперерабатывающая, химическая, керамическая промышленность. Традиционное производство музыкальных инструментов (фортепиано и смычковые). В 16-18 вв. в К. работали скрипичные мастера Амати, Гварнери, Страдивари. Архитектурные памятники 12- 14 вв. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112 |
||||||||||||||||||||||||||||||||||||||||||||||