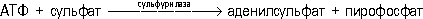|
|
Популярные авторы:: Картленд Барбара :: Чехов Антон Павлович :: Громов Дмитрий :: Андреев Леонид Николаевич :: Горький Максим :: Толстой Лев Николаевич :: Твен Марк :: Коллектив Рубоард :: Говард Роберт Ирвин :: БСЭ Популярные книги:: Справочник по реестру Windows XP :: Пичугин мост :: Бурый волк :: Мясоеды :: Марсианский прибой :: Игры оборотней :: Пять рассказов о знаменитых актерах (Дуэты, сотворчество, содружество) :: В тумане :: Похититель талантов :: Митрофан и Захарка |
Большая Советская Энциклопедия (СЕ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (СЕ) - Чтение (стр. 54)
В обогащении полезных ископаемых почти все операции разделения (включая грохочение и классификацию) можно отнести к С. Например, воздушная, или пневматическая, С., С. в тяжёлых средах, магнитная, пенная (флотация крупных частиц), электрическая С., трибоадгезионная, радиометрическая С., сепарация по трению, С. по упругости и др. В сельском хозяйстве при переработке зерна операции разделения также называется С.; при этом используют различия в размерах зерна, форме, плотности, коэффициент трения, упругости, магнитной восприимчивости и др. Свойства, которыми должны отличаться продукты С., не всегда совпадают с признаками, по которым можно разделить смесь компонентов. Например, при С. угля и породы продукты одинаковой плотности могут иметь разное содержание золы, определяющее качество угля. Для выбора способа С. изучают состав разделяемой смеси, свойства компонентов и степень соответствия желаемых признаков возможным свойствам разделения. С. обычно происходит не по одному главному свойству, отличающему компоненты смеси, а по ряду свойств. Поэтому процесс С. зависит от условий проведения и аппарата ( сепаратора ), в котором происходит разделение. Например, при воздушной С. по крупности мелкие частицы должны выноситься потоком воздуха и результаты разделения определяются не только размерами частиц, но также плотностью и формой. В С. участвует множество отдельных частиц (зёрен), среди которых имеются частицы с промежуточными свойствами по отношению к главному признаку. В результате промышленной С. из исходной смеси не получаются чистые фракции разделяемых веществ, а только продукты с преобладающим их содержанием. Лит.:Барский Л. А., Плаксин И. Н., Критерии оптимизации разделительных процессов, М., 1967; Справочник по обогащению руд, т. 1-3, М., 1972-74; Гортинский В. В., Демский А. Б., Борискин М. А., Процессы сепарирования на зерноперерабатывающих предприятиях, М., 1973; Справочник по обогащению углей, М., 1974. В. А. Перов. Сепарация пара Сепара'ция па'ра,отделение воды от насыщенного пара , вырабатываемого в парогенераторах. С. п. предотвращает осаждение минеральных примесей, содержащихся в воде, на внутренних поверхностях труб пароперегревателей и на лопатках паровых турбин (примеси ухудшают условия охлаждения труб и снижают кпд паровых турбин). В процессе сепарации поступающий в барабан парогенератора пар направляется на отбойные щитки, в циклоны и другие приспособления. Различают объёмную С. п., в результате которой происходят гашение динамического напора струй пароводяной смеси , отделение больших количеств воды, выравнивание пароводяных нагрузок, и механической С. п. - улавливание остатков влаги из пара, выходящего из барабана парогенератора. При высоких давлениях для очистки пара от растворённых в нём веществ применяют также промывку пара конденсатом или питательной водой. При высоком содержании солей в питательной воде используют метод ступенчатого испарения , предложенный советским учёным Э. И. Роммом в 1937. Сепежский целлюлозно-бумажный комбинат Сепе'жский целлюло'зно-бума'жный комбина'т,предприятие по производству сульфатной целлюлозы, бумаги, бумажных мешков, изделий лесохимии, этилового спирта, кормовых дрожжей, углекислоты. Основан в 1936 в г. Сегежа Карельской АССР, на берегу Выгозера. В 1939 выработка комбината составляла 113 тыс. тв год (в расчёте на целлюлозу). После Великой Отечественной войны 1941-45 (уже к середине 1945) производственная мощность С. ц.-б. к. полностью восстановлена. С 1960 осуществляются модернизация действующего оборудования и новое строительство, техническое перевооружение. Комбинат занимает ведущее место в СССР и в Европе по комплексной переработке древесины и изготовлению бумажных мешков. С 1960 перерабатывается только низкосортная древесина (лесопильные отходы, дрова и т. п.), что экономит балансовую древесину, способствует охране окружающей среды. С вводом современного оборудования общий объём производства С. ц.-б. к. в 1974 составил 109,3 млн. руб. в денежном выражении, выработка целлюлозы - 414,5 тыс. т,бумаги - 373,8 тыс. т,мешков - 689 млн. шт. Награжден орденом Ленина (1948). А. Б. Герасимова, В. Г. Звягин. Сепиолит Сепиоли'т(от сепия и греч. lнthos - камень: назван из-за сходства с пористым известковым скелетом каракатицы - сепии), гуннбьярнит, глинистый минерал из класса силикатов со сложной, цепочечно-слоистой структурой. Химический состав Mg 4[Si 6O 15](OH) 2·6H 2O. Mg замещается Fe 2+и Fe 3+, Ni, Al, Сu (разновидности: феррисепиолит, алюмосепиолит, никельсепиолит и др.). Кристаллизуется в ромбической (?) системе, образуя волокнистые субмикроскопические кристаллики. По свойствам аналогичен палыгорскиту . С. встречается также в виде плотных или губчатых и очень лёгких агрегатов («морская пена»). Образуется в почвах в условиях аридного и полуаридного климата, в морских и солоно-водных бассейнах, среди осадочных глинисто-карбонатных пород, а также при выветривании серпентинитов. Богатые никелем разновидности С. входят в состав силикатных никелевых руд . Сепир Эдуард Се'пир(Sapir) Эдуард (26.1.1884, Лауэнбург, Германия, - 4.2.1939, Нью-Хейвен, Коннектикут, США), американский языковед и этнолог. Член Американской академии искусств и наук. Окончил Колумбийский университет (1904). Профессор Чикагского (1927-31), Йельского (с 1931) университетов. Президент Лингвистического (1933) и Антропологического (1938) обществ США. Основные труды посвящены проблемам общего языкознания, языкам американских индейцев. В книге «Язык» (1921, рус. пер. 1934) изложена лингвистическая концепция С. (язык - строго организованная система), оказавшая значительное влияние на развитие современного американского структурализма (см. Структурная лингвистика ), а также дана оригинальная типологическая классификация языков. Для С. характерно понимание социальной сущности языка и отрицание расовых теорий в антропологии и лингвистике. Его гипотеза о воздействии языка на формирование системы представлений человека об окружающем мире (т. н. гипотеза Сепира - Уорфа) лежит в основе этнолингвистики. Соч.: The Takelma language of Southwestern Oregon, Wash., 1912; Sound patterns in language, «Language», 1925, V. I, №1. Лит.:Гухман М. М., Э. Сепир и «этнографическая лингвистика», «Вопросы языкознания», 1954, № 1; Swadesh М., Edward Sapir, «Language», 1939, v. 15, № 2; Voegelin С. F., Edward Sapir, в кн.: Portraits of linguists, ed. by T. Sebeok, v. 2, Bloomington - L., 1966. В. А. Виноградов. Сепия (красящее вещ-во) Се'пия(лат. sepia, от греч. sepнa - каракатица), светло-коричневое красящее вещество. Натуральная С. изготовлялась из т. н. чернильного мешка морского моллюска - сепии. В 20 в. С., многообразная по цветовым оттенкам краска акварельного типа, приготовляется искусственным путём. С. называется также вид графической техники, получившей распространение в Европе с середины 18 в. (О. Фрагонар во Франции и др.). Сепия (род моллюсков) Се'пия,род головоногих моллюсков; см. Каракатица . Сепп Евгений Константинович СеппЕвгений Константинович [5(17).9.1878, Землянск, ныне Воронежской области, - 10.11.1957, Москва], советский невропатолог, академик АМН СССР (1944). Член КПСС с 1939. В 1904 окончил медицинский факультет Московского университета; ученик В. К. Рота . Профессор (1913). С 1919 ректор Высшей медицинской школы, с 1929 заведующий кафедрой нервных болезней 1-го МГУ (с 1930 - 1-й Московский медицинский институт). Работы по проблемам эпилепсии, истерии, травматических поражений нервной системы, мозгового кровообращения, патогистологии, эволюции нервной системы. Описал (1937) четверохолмный рефлекс и его изменения у человека. Разработал метод окраски нервной ткани, выявляющий одновременно нервные клетки и волокна. Награжден орденом Ленина, 2 др. орденами, а также медалями. Соч.: Нервные болезни, 5 изд., М., 1954 (соавтор); История развития нервной системы позвоночных, [2 изд.], М., 1959. Лит.:Шмидт Е. В., Е. К. Сепп, «Вестник АМН СССР», 1958, № 2. Сепсис Се'псис(от греч. sepsis - гниение), тяжёлое инфекционное заболевание человека и животных, вызываемое попаданием в кровь и ткани гноеродных микроорганизмов и продуктов их жизнедеятельности - токсинов. Возбудители С.: чаще стрептококки и стафилококки, реже - пневмококки, кишечная палочка и др. Обычно С. - осложнение раневого или воспалительного процесса. В его развитии у человека важную роль играет снижение защитных сил организма вследствие тяжёлого заболевания, операции, большой кровопотери, недостаточного питания. Источником общей инфекции могут быть нагноение в ране или осложнённое течение местных гнойных заболеваний (фурункул, карбункул, флегмона) - т. н. хирургический С.; осложнения после родов или аборта, когда «входными воротами» инфекции является слизистая оболочка матки, - акушерско-гинекологический С.; гнойные процессы или повреждения органов мочеполовой системы, застой и инфицирование мочи - уросепсис; острые или хронические гнойные заболевания органов полости рта - ротовой С. и т. д. С. проявляется местными признаками - в первичном очаге заболевания (например, очищение раны и рост в ней грануляций останавливаются, они выглядят бледными, сухими, с грязно-мутным налётом) и главным образом общими симптомами - головная боль (в тяжёлых случаях - спутанность сознания), повышение температуры тела до 39-40° с большими суточными колебаниями, прогрессирующее похудание, учащение пульса, снижение артериального давления, тромбозы, отёки, пролежни. Клиническое течение С. может быть молниеносным (бурное развитие проявлений в течение 1-2 сут), острым (до 5-7 сут), подострым и хроническим. Нередко наблюдаются атипичность или «стертость» его симптомов (так, и в разгар болезни может не быть высокой температуры), что связано со значительным изменением болезнетворных свойств возбудителей в результате массового применения антибиотиков. С. может протекать с образованием местных гнойников в различных органах и тканях (занос инфекции из первичного очага) - т. н. септикопиемия, при которой течение С. зависит от расположения гнойников (например, гнойник в мозге с соответствующими неврологическими расстройствами), и без метастатических гнойников - т. н. септицемия, нередко с более бурным течением, резко выраженными общими симптомами. При развитии С. у новорождённых (источник - гнойный процесс в тканях и сосудах пуповины - т. н. пупочный С.) характерны рвота, понос, полный отказ ребёнка от груди, быстрое похудание, обезвоживание; кожные покровы теряют эластичность, становятся сухими, иногда землистого цвета; нередко определяются местное нагноение в области пупка, глубокие флегмоны и абсцессы различной локализации. Проявления С. у животных в основном схожи с его симптомами у человека. Лечение С. направлено на борьбу с инфекцией (большие дозы антибиотиков с учётом чувствительности возбудителя и сульфаниламидные препараты) и повышение сопротивляемости организма (усиленное и витаминизированное высококалорийное питание, переливания крови и белковых препаратов, применение специфических сывороток, аутовакцины и гаммаглобулина). Местное лечение при наличии ран: своевременное удаление омертвевших тканей и вскрытие гнойных затёков, создание постоянного оттока гнойного отделяемого, обработка ран антибиотиками и антисептиками. Лит.:Шлапоберский В. Я., Хирургический сепсис. (Клиника и лечение), М., 1952; Скворцов М. А., Пупочный сепсис, в кн.: Многотомное руководство по патологической анатомии, т. 3, М., 1960; Бубличенко Л. И., Хаскин С. Г., Послеродовые инфекционные заболевания, в кн.: Многотомное руководство по акушерству и гинекологии, т. 3, кн. 2, М., 1964. В. Ф. Пожариский. Септаккорд Септакко'рд(музыкальный), аккорд из четырёх звуков, которые расположены или могут быть расположены по терциям. Основной вид С. - с основным тоном в басу. Если в басу помещаются другие звуки, возникают т. н. обращения С. Первое обращение с терцией в басу называется квинтсекстаккордом, второе с квинтой в басу - терцквартаккордом, третье с секундой в басу - секундаккордом. По звуковому составу различают большие С. (при расположении звуков по терциям между крайними звуками образуется большая септима) и малые (между крайними звуками - малая септима). С., состоящий из трёх малых терций, называется уменьшенным С. Наиболее распространены С. доминантовой и субдоминантовой функций - доминантсептаккорд (на V ступени) и его обращения, вводные С. (малый - на VII ступени натурального мажора, уменьшенный - на VII ступени гармонического мажора и минора), а также представляющий субдоминантовую функцию септаккорд II ступени и в особенности его первое обращение - квинтсекстаккорд, имеющий в басу основной звук субдоминанты. Септет Септе'т(нем. Septett, от лат. septem - семь), музыкальный ансамбль из семи исполнителей, а также музыкальное произведение для этого ансамбля. Септик Се'птик(англ. septic, от греч. septikуs - гнилостный, гнойный), сооружение для очистки небольших количеств (до 25 м 3, реже до 50 м 3в сутки) бытовых сточных вод . С. представляет собой подземный отстойник горизонтального типа, состоящий из 1-3 камер, через которые последовательно протекает сточная жидкость. Предварительно обработанные (осветлённые) в С. сточные воды подвергаются затем биологической очистке на полях подземной фильтрации или в песчано-гравийных фильтрах. В С. задерживается до 90% взвешенных веществ. Септима Се'птима(от лат. septima - седьмая) в музыке, один из интервалов , а также одна из ступеней . Септимий Север Луций Септи'мий Севе'рЛуций (Lucius Septimius Severus) (146-211), римский император в 193-211, основатель династии Северов . Был квестором, народным трибуном, управлял многими провинциями, был консулом, сенатором. С 190 командовал войсками в Германии. Императором провозглашен паннонскими легионами. Опирался на солдат, которым дал ряд привилегий (уравнение легионеров с преторианской гвардией и др.). Проводил последовательную антисенаторскую политику. Управлял с помощью императорского совета, включавшего видных юристов, и возросшего при нём бюрократического аппарата, комплектовавшегося зачастую из военных. При С. С. была введена цензуальная система налогообложения и принудительных повинностей (трудовых, военных и др.). С. С. укрепил дунайскую, рейнскую, британскую и восточную границы империи. Септоль Септо'ль(от лат. septimus - седьмой) в музыке, ритмическая фигура; см. Ритмическое деление . Септориозы Септорио'зы,болезни растений, вызываемые грибами рода Septoria и характеризующиеся образованием, главным образом на листьях, небольших, преимущественно округлых (на злаках вытянутых) пятен, более тёмных на периферии и светлых, иногда почти белых в центре. С. называются также белой пятнистостью. Наиболее распространены и вредоносны С. злаков (возбудители Septoria graminum, S. nodorum и др.), томата (возбудитель S. lycopersici), смородины и крыжовника (возбудитель S. ribis). С. поражаются также просо (возбудитель S. panicimiliacei), конопля (S. cannabis), соя (S. glycincs), виноград (возбудитель S. ampelina) и многие другие растения. Сохраняется большинство возбудителей С. на растительных остатках. Распространение спор и заражение растений происходит во влажную погоду при набухании пикнид. При сильном поражении больные листья и побеги засыхают, стебли буреют, сморщиваются и часто перегибаются, наблюдается преждевременное опадание листьев, отмирание колосковых плёнок и недоразвитие зерна (у злаков). Меры борьбы: уничтожение растительных остатков; применение севооборотов (при возделывании однолетних культур); опрыскивание растений фунгицидами ; выращивание устойчивых или менее поражаемых сортов; внесение полного минерального удобрения. Лит.:Пересыпкин В. Ф., Сельскохозяйственная фитопатология, М., 1969. М. И. Дементьева. Сера Се'ра(лат. Sulfur) S, химический элемент VI группы периодической системы Менделеева; атомный номер 16, атомная масса 32,06. Природная С. состоит из четырёх стабильных изотопов: 32S (95,02%), 33S (0,75%), 34S (4,21%), 36S (0,02%). Получены также искусственные радиоактивные изотопы 31S ( T 1/2= 2,4 сек), 35S ( T 1/2= 87,1 cym), 37S ( T 1/2= 5,04 мин). Историческая справка. С. в самородном состоянии, а также в виде сернистых соединений известна с древнейших времён. Она упоминается в Библии, поэмах Гомера и др. С. входила в состав «священных» курений при религиозных обрядах; считалось, что запах горящей С. отгоняет злых духов. С. давно стала необходимым компонентом зажигательных смесей для военных целей, например «греческого огня» (10 в. н. э.). Около 8 в. в Китае стали использовать С. в пиротехнических целях. Издавна С. и её соединениями лечили кожные заболевания. В период арабской алхимии возникла гипотеза, согласно которой С. (начало горючести) и ртуть (начало металличности) считали составными частями всех металлов. Элементарную природу С. установил А. Л. Лавуазье и включил её в список неметаллических простых тел (1789). В 1822 Э. Мичерлих обнаружил аллотропию С. Распространение в природе. С. относится к весьма распространённым химическим элементам (кларк 4,7·10 -2); встречается в свободном состоянии ( сера самородная ) и в виде соединений - сульфидов, полисульфидов, сульфатов (см. Сульфиды природные , Сульфаты природные , Сульфидные руды ). Вода морей и океанов содержит сульфаты натрия, магния, кальция. Известно более 200 минералов С., образующихся при эндогенных процессах. В биосфере образуется свыше 150 минералов С. (преимущественно сульфатов); широко распространены процессы окисления сульфидов до сульфатов, которые в свою очередь восстанавливаются до вторичного H 2S и сульфидов. Эти реакции происходят при участии микроорганизмов. Многие процессы биосферы приводят к концентрации С. - она накапливается в гумусе почв, углях, нефти, морях и океанах (8,9·10 -2%), подземных водах, в озёрах и солончаках. В глинах и сланцах С. в 6 раз больше, чем в земной коре в целом, в гипсе - в 200 раз, в подземных сульфатных водах - в десятки раз. В биосфере происходит круговорот С.: она приносится на материки с атмосферными осадками и возвращается в океан со стоком. Источником С. в геологическом прошлом Земли служили главным образом продукты извержения вулканов, содержащие SO 2и H 2S. Хозяйственная деятельность человека ускорила миграцию С.; интенсифицировалось окисление сульфидов. Физические и химические свойства. С. - твёрдое кристаллическое вещество, устойчивое в виде двух аллотропических модификаций. Ромбическая a-S лимонно-жёлтого цвета, плотность 2,07 г/см 3, t пл112,8 °С, устойчива ниже 95,6°С; моноклинная b-S медово-жёлтого цвета, плотность 1,96 г/см 3, t пл119,3 °С, устойчива между 95,6 °С и температурой плавления. Обе эти формы образованы восьмичленными циклическими молекулами S 8с энергией связи S - S 225,7 кдж/моль. При плавлении С. превращается в подвижную жёлтую жидкость, которая выше 160 °С буреет, а около 190 °С становится вязкой тёмно-коричневой массой. Выше 190°С вязкость уменьшается, а при 300 °С С. вновь становится жидкотекучей. Это обусловлено изменением строения молекул: при 160 °С кольца S 8начинают разрываться, переходя в открытые цепи; дальнейшее нагревание выше 190 °С уменьшает среднюю длину таких цепей. Если расплавленную С., нагретую до 250-300 °С, влить тонкой струей в холодную воду, то получается коричнево-жёлтая упругая масса (пластическая С.). Она лишь частично растворяется в сероуглероде, в осадке остаётся рыхлый порошок. Растворимая в CS 2модификация называется l-S, а нерастворимая - m-S. При комнатной температуре обе эти модификации превращаются в устойчивую хрупкую a-S. t kипС. 444,6 °С (одна из стандартных точек международной температурной шкалы). В парах при температуре кипения, кроме молекул S 8, существуют также S 6, S 4и S 2. При дальнейшем нагревании крупные молекулы распадаются, и при 900°С остаются лишь S 2, которые приблизительно при 1500°С заметно диссоциируют на атомы. При замораживании жидким азотом сильно нагретых паров С. получается устойчивая ниже - 80°С пурпурная модификация, образованная молекулами S 2. С. - плохой проводник тепла и электричества. В воде она практически нерастворима, хорошо растворяется в безводном аммиаке, сероуглероде и в ряде органических растворителей (фенол, бензол, дихлорэтан и др.). Конфигурация внешних электронов атома S 3 s 23 p 4. В соединениях С. проявляет степени окисления -2, +4, +6. С. химически активна и особенно легко при нагревании соединяется почти со всеми элементами, за исключением N 2, I 2, Au, Pt и инертных газов. СO 2на воздухе выше 300 °С образует окислы: SO 2- сернистый ангидрид и SO 3- серный ангидрид , из которых получают соответственно сернистую кислоту и серную кислоту , а также их соли сульфиты и сульфаты (см. также Тиокислоты и Тиосульфаты ). Уже на холоду S энергично соединяется с F 2, при нагревании реагирует с Cl 2(см. Серы фториды , Серы хлориды ); с бромом С. образует только S 2Br 2, иодиды серы неустойчивы. При нагревании (150 - 200 °С) наступает обратимая реакция с H 2с получением сернистого водорода . С. образует также многосернистые водороды общей формулы H 2S x, т. н. сульфаны. Известны многочисленные сераорганические соединения . При нагревании С. взаимодействует с металлами, образуя соответствующие сернистые соединения (сульфиды) и многосернистые металлы (полисульфиды). При температуре 800-900 °С пары С. реагируют с углеродом, образуя сероуглерод CS 2. Соединения С. с азотом (N 4S 4и N 2S 5) могут быть получены только косвенным путём. Получение. Элементарную С. получают из серы самородной, а также окислением сернистого водорода и восстановлением сернистого ангидрида. О способах добычи С. см. Серные руды . Источник сернистого водорода для производства С. - коксовые, природные газы, газы крекинга нефти. Разработаны многочисленные методы переработки H 2S; наибольшее значение имеют следующие: 1) H 2S извлекают из газов раствором моногидротиоарсената натрия: Na 2HAsS 2+ H 2S = Na 2HAsS 3O + H 2O. Затем продувкой воздуха через раствор осаждают С. в свободном виде: NaHAsS 3O + 1/2 O 2= Na 2HAsS 2O 2+ S. 2) H 2S выделяют из газов в концентрированном виде. Затем его основная масса окисляется кислородом воздуха до С. и частично до SO 2. После охлаждения H 2S и образовавшиеся газы (SO 2, N 2, CO 2) поступают в два последовательных конвертора, где в присутствии катализатора (активированный боксит или специально изготовляемый алюмогель) происходит реакция: 2H 2S + SO 2= 3S + 2H 2O. В основе получения С. из SO 2лежит реакция восстановления его углём или природными углеводородными газами. Иногда это производство сочетается с переработкой пиритных руд. В 1972 элементарной С. в мире (без социалистических стран) произведено 32,0 млн. т; основная масса её добывалась из природных самородных руд. В 70-е гг. 20 в. первостепенное значение (в связи с открытием крупных месторождений сероводородсодержащих топливных газов) приобретают методы получения С. из H 2S. Сорта С. Выплавленная непосредственно из серных руд С. называется природной комовой; полученная из H 2S и SO 2- газовой комовой. Природная комовая С., очищенная перегонкой, называется рафинированной. Сконденсированная из паров при температуре выше точки плавления в жидком состоянии и затем разлитая в формы - черенковой С. При конденсации С. ниже точки плавления на стенках конденсационных камер образуется мелкий порошок С. - серный цвет. Особо высокодисперсная С. носит название коллоидной. Применение. С. применяется в первую очередь для получения серной кислоты: в бумажной промышленности (для получения сульфитцеллюлозы); в сельском хозяйстве (для борьбы с болезнями растений, главным образом винограда и хлопчатника); в резиновой промышленности (вулканизующий агент); в производстве красителей и светящихся составов; для получения чёрного (охотничьего) пороха; в производстве спичек. И. К. Малина. В медицинской практике применение С. основано на её способности при взаимодействии с органическими веществами организма образовывать сульфиды и пентатионовую кислоту, от присутствия которых зависят кератолитические (растворяющие - от греч. kйras - рог и lytikуs - растворяющий), противомикробные и противопаразитарные эффекты. С. входит в состав Вилькинсона мази и других препаратов, применяемых для лечения чесотки. Очищенную и осажденную С. употребляют в мазях и присыпках для лечения некоторых кожных заболеваний (себорея, псориаз и др.); в порошке - при глистных инвазиях (энтеробиоз); в растворах - для пиротерапии прогрессивного паралича и др. Сера в организме. В виде органических и неорганических соединений С. постоянно присутствует во всех живых организмах и является важным биогенным элементом . Её среднее содержание в расчёте на сухое вещество составляет: в морских растениях около 1,2%, наземных - 0,3%, в морских животных 0,5-2%, наземных - 0,5%. Биологическая роль С. определяется тем, что она входит в состав широко распространённых в живой природе соединений: аминокислот ( метионин , цистеин ), и следовательно белков и пептидов; коферментов ( кофермент А, липоевая кислота ), витаминов ( биотин , тиамин ), глутатиона и другие Сульфгидрильные группы (- SH) остатков цистеина играют важную роль в структуре и каталитическая активности многих ферментов. Образуя дисульфидные связи (- S - S -) внутри отдельных полипептидных цепей и между ними, эти группы участвуют в поддержании пространственной структуры молекул белков. У животных С. обнаружена также в виде органических сульфатов и сульфокислот - хондроитинсерной кислоты (в хрящах и костях), таурохолиевой кислоты (в жёлчи), гепарина , таурина . В некоторых железосодержащих белках (например, ферродоксинах) С. обнаружена в форме кислотолабильного сульфида. С. способна к образованию богатых энергией связей в макроэргических соединениях . Неорганические соединения С. в организмах высших животных обнаружены в небольших количествах, главным образом в виде сульфатов (в крови, моче), а также роданидов (в слюне, желудочном соке, молоке, моче). Морские организмы богаче неорганическими соединениями С., чем пресноводные и наземные. Для растений и многих микроорганизмов сульфат (SO 4 2-) наряду с фосфатом и нитратом служит важнейшим источником минерального питания. Перед включением в органические соединения С. претерпевает изменения в валентности и превращается затем в органическую форму в своём наименее окисленном состоянии; т. о. С. широко участвует в окислительно-восстановительных реакциях в клетках. В клетках сульфаты, взаимодействуя с аденозинтрифосфатом (АТФ), превращаются в активную форму - аденилилсульфат:
Катализирующий эту реакцию фермент - сульфурилаза (АТФ: сульфат - адснилилтрансфераза) широко распространён в природе. В такой активированной форме сульфонильная группа подвергается дальнейшим превращениям - переносится на др. акцептор или восстанавливается. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72 |
|||||||