|
|
Популярные авторы:: Эллисон Харлан :: Желязны Роджер :: Говард Роберт Ирвин :: Ломер Кит :: Лавкрафт Говард Филлипс :: Шукшин Василий Макарович :: Родари Джанни :: Ламур Луис :: Дойл Артур Конан :: Силверберг Роберт Популярные книги:: Справочник по реестру Windows XP :: Бурый волк :: Снежная страна :: Лопатка :: Последний коммунист :: Дунайский лоцман :: Птичка певчая :: Вирусы мозга :: Шотландский лев :: Иди и смотри |
Большая Советская Энциклопедия (ХЛ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ХЛ) - Чтение (стр. 6)
в. окисляется до хлора: 4HCl + O
2= 2Н
2О + 2Cl2. Со щелочными металлами, алюминием и магнием реагирует с выделением водорода, особенно легко при нагревании, например: 2Al + 6HCl = 2AlCl
3+ 3Н
2. С аммиаком взаимодействует с образованием дыма - твёрдых частиц хлорида аммония NH
4Cl. В присутствии катализаторов присоединяется к ненасыщенным органическим соединениям, например: C
2H
4+ HCl ® C
2H
5Cl.
Получают Х. в. прямым синтезом из элементов или действием серной кислоты на хлорид натрия. Большие количества Х. в. получаются как побочный продукт при органических соединений: RH + Cl 2= RCl + HCl (где R - радикал), а также при гидролизе хлорида магния: MgCl 2+ H 2O = MgO + 2HCl. Мировое производство Х. в. составляет около 10 млн. т(1975). Х. в. используют для получения соляной кислоты, синтеза органических соединений, например .
Лит.:Якименко Л. М., Производство хлора, каустической соды и неорганических хлорпродуктов, М., 1974; Якименко Л. М., Пасманик М. И., Справочник по производству хлора, каустической соды и основных хлорпродуктов, 2 изд., М., 1976. Л. М. Якименко. Хлористый калий Хло'ристый ка'лий,концентрированное .Белое кристаллическое вещество, гигроскопично, слёживается при хранении, хорошо растворяется в воде. Содержит и примеси; калия в пересчёте на K 2O - 52-60%. Применяют Х. к. на всех почвах как основное удобрение - осенью под зяблевую вспашку и в пару. При систематическом внесении подкисляет почву (физиологически кислое удобрение). Особенно эффективно при использовании под корнеплоды, картофель, подсолнечник, плодовые и др. калиелюбивые культуры. Хлористый циан Хло'ристый циа'н,CICN, при обычных условиях бесцветный газ; t пл-6°С, t kип13°C. Х. ц. в присутствии галогенводородных кислот тримеризуется, образуя . Получают Х. ц. действием хлора на водный раствор Na 2(Zn (CN) 4]; может быть получен также взаимодействием хлора с водным раствором HCN. Используется для получения цианамида (сырья в производстве дициандиамида и ) и некоторых красителей. Токсичен (незначительные количества его в воздухе рабочих помещений вызывают слезотечение). Лит.см. при ст. . Хлоритизация Хлоритиза'ция,метасоматический процесс, при котором темноцветные минералы горных пород, а иногда и основная масса породы замещаются .Различают: региональную постмагматическую Х. основных эффузивов и их туфов (см. ) ,Х. основных лав, сопряжённую с альбитизацией (см. ) ,а также темноцветных минералов кислых и средних изверженных пород (например, биотита и роговой обманки в гранитоидах); гидротермальную Х. разнообразных пород как распространённый тип околорудных изменений (см. ) .Развитие линейных зон Х. является поисковым признаком гидротермальных рудных месторождений. Хлоритоид Хлорито'ид[от (минералы) и греч. йidos - вид], минерал класса островных силикатов, химический состав (Fe, Mg) 2(AI, Fe 3+) AI 3[SiO 4] 2O 2(OH) 4. Содержит до 16,6% MnO в оттрелите. Кристаллизуется в моноклинной и триклинной системе; обе модификации одинаково распространены и часто образуют тесные срастания. Обычно наблюдается в виде плохообразованных таблитчатых кристаллов и их сростков (порфиробласты Х. в метаморфических сланцах), а также чешуйчатых агрегатов. Цвет темно-синий, тёмно-зелёный (до чёрного). Твердость по минералогической шкале 6,5; плотность около 3600 кг/м 3.Хрупок. Характерна совершенная спайность параллельно уплощению кристаллов. Породообразующий минерал некоторых метаморфических сланцев и контактных роговиков; встречается также в месторождениях ,в гидротермальных кварцевых жилах и околожильных породах. Хлориты (минералы) Хлори'ты(от греч. chlorуs - зелёный), группа широко распространённых минералов - водных метаалюмосиликатов Mg и Fe со слоистой слюдоподобной кристаллической структурой. Химический состав (Mg, Fe 2+)Ч[AISi 3O 10(OH) 2]Ч3(Mg, Fe)(OH) 2характерны изоморфные замещения Si на Al в пределах Si 7AI - Si 4Al 4, Mg на Al в пределах Mg 11Al - Mg 4Al 4; Mg 2+может полностью замещаться на Fe 2+и Fe 3+ ,частично также на Mn 2+ ,Cr, Ni, Ti, Li и др. Различают триоктаэдрические и диоктаэдрические Х., а также Х. с частично или полностью неупорядоченными структурами. Слоистая кристаллическая структура Х. определяет широкое распространение полиморфных модификаций (политипов). Часто возникают смешанно-слойные образования типа хлорит-монтмориллонит, хлорит-вермикулит (корренсит) и др. По соотношению Fe 2+/Fe 3+выделяются ортохлориты (неокисленные, с содержанием Fe 2O 3не более 4%) и лептохлориты (окисленные, богатые Fe 2O 3). Ортохлориты - большая группа минералов, различающихся по общей железистости, т. е. величине отношения Fe/(Fe+Mg) в октаэдрических слоях и по соотношению Si/Al в тетраэдрах. Среди ортохлоритов выделяются: магнезиальные (по возрастающему количеству Si) - корундофиллит, шериданит, клинохлор, ,тальк-хлорит; магнезиально-железистые - рипидолит, пикнохлорит диабантин; железистые - псевдотюрингит, дафнит, брунсвигит. К лептохлоритам относятся , ,делессит. Известны также Х. марганцовистые - пеннантит и гоньерит, хромовые - кеммерерит и кочубеит, литиевые - кукеит и др. Точная диагностика Х. возможна с помощью рентгеноструктурного, электронографического и термического анализов. Х. кристаллизуются в моноклинной или триклинной системах, характеризуются слюдоподобным пластинчатым псевдогексагональным габитусом кристаллов, совершенной спайностью, низкой твёрдостью (1,5-2,5); пластинки Х. гибки но не упруги; плотность 2600-3300 кг/м 3.(Образуют пластинчатые, чешуйчатые, сферолитовые, скрытокристаллические оолитовые агрегаты. Цвет обычно зелёный (от светло- до тёмно-зелёного), но встречаются белые, жёлтые (маложелезистые), розовые, красно-фиолетовые (содержащие Cr и Mn), чёрные (Fe-хлорит) разности. Ортохлориты - важные породообразующие минералы зелёных сланцев - пород начальных стадий регионального метаморфизма; характерны для около рудноизменённых пород гидротермальных месторождений и преобразованных лав вулканических областей. Процессы хлоритизации широко развиты в природе и протекают при сравнительно невысоких температурах (см. также , ) .Х. часто возникают как продукты изменения более высокотемпературных Mg-Fe-силикатов ( , и др.), а также замещают , , , , и многие др. минералы с образованием по ним .В больших количествах Х. (совместно с и серпентином) появляются при гидротермальном преобразовании ультраосновных горных пород, вулканических туфов, глинистых сланцев, иногда даже доломитов. Часто присутствуют в рудных кварцевых жилах и околожильных ореолах. Литиевые Х. встречаются в редкометальных ,хромовые - в месторождениях хромитов, никелевые - образуются при изменении некоторых основных изверженных пород. Лептохлориты (тюрингит и шамозит) имеют преимущественно осадочное происхождение, иногда они образуют крупные залежи промышленного значения (например, железные руды на Урале, в Тюрингии, Лотарингии). Лит.:Сердюченко Д. П., Хлориты, их химическая конституция и классификация, М.. 1953 (Тр. института геологич. наук АН СССР, в. 140); Кепежинскас К. Б., Статистический анализ хлоритов и их парагенетические типы, М., 1965; Дир У. А., Хауи Р. А., Зусман Дж., Породообразующие минералы, т. 3 - Листовые силикаты, пер. с англ., М., 1966; Костов И., Минералогия. пер. с англ., М., 1971; Годовиков А. А., Минералогия, М., 1975. А. М. Портнов, Л. Г. Фельдман. Хлориты (химич.) Хлори'ты,соли с HClO 2. Образуются при взаимодействии с двуокиси хлора с растворами щелочей в присутствии H 2O 2или восстановителей, например: 2ClO 2+ 2NaOH + H 2O 2= 2NaClO 2+ 2H 2O + O 2. Х. в кислой среде - хорошие окислители, в твёрдом состоянии легко взрываются от удара, а также при нагревании или в присутствии легкоокисляющихся примесей. Из Х. применение находит Х. натрия. Это бесцветные кристаллы. Растворимость в воде (в %): 31,1 (0°С); 50,7 (37,4°C); 56,3 (70°C); ниже 37,4°C образует кристаллогидрат NaClO 2Ч3H 2O. Выше 100°C Х. натрия начинает разлагаться с образованием натрия хлората и .При взаимодействии с хлором Х. натрия образует ClO 2и NaCI. Используется в виде водных растворов для мягкой отбелки тканей (главным образом льняных) и бумаги, для обеззараживания воды, в небольших количествах - для получения ClO 2. Лит.см. при ст. . Хлор-ИФК Хлор-ИФК,3-ClC6H4NHCOOC3H7-изо, химический препарат преимущественно для борьбы с однолетними злаковыми сорняками хлопчатника, лука, моркови, подсолнечника, сои, гороха ( ) . Хлорная вода Хло'рная вода',раствор хлора в воде. Получают в пропусканием хлора в воду до насыщения (1 объём воды растворяет при 20°C около 2,2 объёма газообразного хлора). При охлаждении Х. в. из неё выпадает гидрат хлора - соединение переменного состава Cl 2Ч nH 2O(где n= 6ё8) - жёлтые кристаллы, плавящиеся с разложением при 9,6°С. При обычной температуре до 50% растворённого в Х. в. хлора подвергается гидролизу: Cl 2+ H 2O Ы HClO + HCl; образующаяся HClO разлагается на свету на O 2и HCl. Х. в. - сильный окислитель, применяется для обеззараживания вод и отбелки тканей. Лит.см. при ст. . Хлорная известь Хло'рная и'звесть,белильная известь, сложный комплекс гипохлорита Ca (ClO) 2, хлорида CaCI 2, гашёной извести Ca (OH) 2и кристаллизационной воды. Белый гигроскопичный порошок с запахом хлора. Насыпная масса около 500 кг/м 3.Товарная Х. и. близка к составу 1,5Са (ClO) 2Ч1,5CaCl 2Ч3Ca (OH) 2ЧnH 2O и содержит от 28 до 38% активного хлора (т. е. хлора, выделяющегося при реакции извести с соляной кислотой) и около 10% воды. Получается при взаимодействии газообразного хлора с гашёной известью Ca (OH) 2. Х. и. при хранении медленно разлагается, теряя в год около 10% активного хлора; на воздухе при поглощении влаги и углекислого газа разложение ускоряется. В присутствии органических примесей или каталитически действующих солей некоторых металлов (Fe, Ni, Co), а также при нагревании Х. и. разлагается бурно. Сильный окислитель. Выпускается также стабильная Х. и., содержащая 2% воды (потеря активного хлора 7-9% за 8 лет); её получают хлорированием гашёной извести в кипящем слое при повышенной температуре. Х. и. - сильный окислитель. Применяется в медицине в качестве ,для дезинфекции помещений, посуды, а также для ,обеззараживания отбросов. В ограниченном количестве Х. и. используется для отбеливания целлюлозы и тканей, хлорирования. Лит.см. при ст. . Хлорная кислота Хло'рная кислота',HClO 4, одноосновная кислота, в которой хлор имеет степень окисления +7. Безводная Х. к. - бесцветная подвижная жидкость, дымящая на воздухе, плотность при 20°C 1,761 г/см 3; t пл-102°С, t kип110 °С. Х. к. - одна из самых сильных неорганических кислот; соответствующие ей соли - .Безводная Х. к. очень реакционноспособна и неустойчива. С водой образует ряд гидратов HClO 4Ч nH 2O (где n= 0,25ё4). Водные растворы Х. к. устойчивы, имеют низкую окислительную способность. Х. к. с водой образует азеотропную смесь, кипящую при 203 °С и содержащую 72% HClO 4. Водные растворы Х. к. получают электрохимическим окислением соляной кислоты или хлора, растворённых в крепкой Х. к., а также обменным разложением перхлоратов натрия или калия сильными неорганическими кислотами. Концентрированные водные растворы Х. к. широко используются в аналитической химии, а также для получения перхлоратов. Безводная Х. к. получается при взаимодействии перхлоратов натрия или калия с крепкой серной кислотой, а также водных растворов Х. к. с .Безводную Х. к. нельзя длительно хранить и перевозить, т.к. при хранении в обычных условиях она медленно разлагается, окрашивается окислами хлора, образующимися при её разложении, и может самопроизвольно взрываться. Х. к. применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора. Лит.:Росоловский В. Я., Химия безводной хлорной кислоты, М., 1966; Якименко Л. М., Производство хлора, каустической соды и неорганических хлорпродуктов, М., 1974; Якименко Л. М., Пасманик М. И., Справочник по производству хлора, каустической соды и основных хлорпродуктов, 2 изд., М., 1976. Л. М. Якименко. Хлорноватая кислота Хлорнова'тая кислота',HClO 3, сильная одноосновная кислота, в которой хлор имеет степень окисления +5. В свободном виде не получена; в водных растворах при концентрации ниже 30% на холоду довольно устойчива; в более концентрированных растворах распадается: 8HClO 3= 4HClO 4+ 3O 2+ 2Cl 2+ 2H 2O. Х. к. - сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры. В 40%-ной Х. к. воспламеняется, например, фильтровальная бумага. Х. к. образуется при разложении ,при электролизе растворов хлоридов; в лабораторных условиях получают при взаимодействии хлората бария с разбавленной серной кислотой: Ba (ClO 3) 2+ H 2S 4= BaSO 4+ 2HClO 3. Х. к. соответствуют соли - ; из них наибольшее значение имеют хлораты натрия, калия, кальция и магния. Лит.см. при ст. . Хлорноватистая кислота Хлорнова'тистая кислота',HClO, очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Неустойчива, постепенно разлагается даже в разбавленных водных растворах. Х. к. и её соли - гипохлориты - сильные окислители. Кристаллогидрат LiClOЧH 2O выдерживает длительное хранение; NaClOЧH 2O при 70 °С разлагается со взрывом, а KClO известен только в виде водных растворов. Ca (ClO) 2в сухом виде вполне устойчив, но в присутствии H 2O и CO 2разлагается. Более стоек Mg (ClO) 2. Х. к. и гипохлориты легко разлагаются с выделением кислорода и поэтому широко используются для отбелки целлюлозы и тканей, а также для санитарных целей. Х. к. получается при гидролизе хлора или при растворении окиси хлора Cl 2O в воде. В промышленном масштабе производятся гипохлориты кальция, натрия, калия, лития хлорированием известкового молока и соответствующих щелочей. Лит.см. при ст. . Хлоробактерии Хлоробакте'рии,то же, что . Хлорогеновая кислота Хлороге'новая кислота',Cl 16H 18O 9, сложный эфир кофейной (3,4-диоксикоричной) кислоты с одним из стереоизомеров .Бесцветные кристаллы с t пл206-210 °С, хорошо растворимы в воде. Щелочные растворы Х. к. на воздухе зеленеют (отсюда название). Широко распространена среди высших растений, часто в смеси с изомерной ей изохлорогеновой кислотой. В больших количествах содержится в прорастающих семенах подсолнечника и необжаренных зёрнах кофе. Вероятно, Х. к. принимает участие в регулировании созревания плодов, воздействуя на дыхание плодов как ингибитор .Х. к. токсична для некоторых патогенных микроорганизмов, вызывающих болезни растений (паршу картофеля, вилт и т.п.). У ряда растений (например, у риса) биосинтез Х. к. увеличивается в ответ на микробную инфекцию. Хлороз Хлоро'з(от греч. chlorуs - бледно-зелёный, зеленовато-жёлтый), устаревшее название железодефицитной анемии, преимущественно у лиц юношеского возраста. Хлороз растений Хлоро'з расте'ний,болезнь растений, при которой нарушается образование хлорофилла в листьях и снижается активность фотосинтеза. Характерные признаки: преждевременное пожелтение и опадение листьев, мелколистность, усыхание верхушек побегов, отмирание активных корней и т.п. Из культурных растений чаще болеют плодово-ягодные и декоративные культуры. Причины Х. р. различны. Инфекционный Х. р. вызывается вирусами (например, верхушечный хлороз табака и махорки, хлороз малины), грибами и др. микроорганизмами. Переносчиками его возбудителей часто являются вредители (трипсы, тли). Неинфекционный, или функциональный, Х. р. возникает при неблагоприятных почвенных и климатических условиях и нарушениях технологии возделывания с.-х. культур. В большинстве случаев это железный или известковый Х. р., которым болеют плодово-ягодные культуры, особенно виноград, на карбонатных почвах. Встречается также цинковый, магниевый Х. р. и др. При заболевании происходит своеобразное пожелтение листьев: появляются пятна, сначала желтеют нижние или верхние листья или только межжилковые участки (см. ). Наследственный Х. р. (пестролистность, золотолистность) возникает как мутация и передаётся по наследству. Используется в селекции декоративных растений для выведения пестролистных форм. Меры борьбы: для предупреждения Х. р. применяют органические и минеральные удобрения, проводят кислование карбонатных почв, мульчирование и задернение междурядий садов, уничтожают вредителей - переносчиков инфекции. При лечении неинфекционного Х. р. в почву вносят недостающие элементы питания вблизи активной зоны корневой системы, используют некорневые подкормки и инъекции растворами микроудобрений в штамбы, ветки и корни плодовых деревьев; растения, заболевшие инфекционным хлорозом, удаляют. Лит.:Дементьева М. И., Болезни плодовых культур, М., 1962; Шпота Л. А., Хлороз растений в Чуйской долине и борьба с ним, Фр., 1968; Накаидзе И. А., Почвенные условия и хлороз виноградной лозы в Грузии, Тб., 1969. Л. А. Шпота. Хлорокись меди Хлоро'кись ме'ди,3Cu (OH) 2ЧCuClЧH 2O, химический препарат для борьбы с возбудителями болезней (церкоспороз сахарной свёклы, фитофтороз картофеля, септориоз, фитофтороз томата, парша и монилиоз яблони и груши, милдью винограда и др.) растений ( ) . Хлорококковые водоросли Хлороко'кковые во'доросли,класс (или порядок) . Хлорокруорины Хлорокруори'ны(от греч. chlorуs - бледно-зелёный и лат. cruor - кровь), зелёные дыхательные пигменты, заменяющие гемоглобины у некоторых представителей многощетинковых червей (семейства Sabellidae, Serpulidae, Chlorhaemidae, Ampharetidae). В крови некоторых из этих червей встречаются одновременно Х. и гемоглобины. У молодых особей рода Serpula преобладают гемоглобины, у взрослых - Х. Выделенная из сосудов кровь, содержащая Х., красного цвета, разбавленная - зелёного. По химическому строению Х. отличаются от гемоглобинов в белковой и небелковой частях молекулы. Х. содержат ,в котором винильная группа (CH = CH) протопорфирина (см. ) в положении 2 замещена формильной группой (CHO). В плазме крови Х. находятся в растворённом состоянии и, подобно ,имеют высокую молекулярную массу (2 800 000). У Х. и гемоглобинов одинаковое сродство к кислороду. Лит.:Гауровиц Ф., Химия и функции белков, пер. с англ., М., 1965; Сравнительная физиология животных, т. 2, пер. с англ., М., 1977, гл. 8. Е. П. Феденко. Хлоропласты Хлоропла'сты(от греч. chlorуs - зелёный и plastуs - вылепленный, образованный), внутриклеточные органеллы растительной клетки - ,в которых осуществляется фотосинтез. Окрашены в зелёный цвет благодаря присутствию в них основного пигмента фотосинтеза - .Основная функция Х., состоящая в улавливании и преобразовании световой энергии, нашла отражение и в особенностях их строения. У высших растений Х. - тельца линзообразной формы диаметром 3-10 мкми толщиной 2-5 мкм,представляют собой систему белково-липидных мембран, погруженных в основное вещество - матрикс, или строму, и отграничены от цитоплазмы наружной мембраной (оболочкой). Внутренние мембраны образуют единую (непрерывную) пластинчатую, или ламеллярную, систему, состоящую из замкнутых уплощённых мешочков (цистерн) - т. н. тилакоидов, которые группируются по 10-30 (стопками) в граны (до 150 в Х.), соединяющиеся между собой крупными тилакоидами. При таком строении значительно увеличивается фотоактивная поверхность Х. и обеспечивается максимальное использование световой энергии. В мембране тилакоидов, состоящей из двух слоев белка, разделённых слоем липидов, осуществляется первичная световая стадия фотосинтеза, ведущая к образованию двух необходимых для ассимиляции CO 2соединений - восстановленного (НАДФЧН) и богатого энергией соединения аденозинтрифосфата (АТФ). Источником энергии для образования молекул АТФ является разность потенциалов, которая образуется на мембране в результате векторного (направленного) переноса заряда. Разделение заряда по обеим сторонам мембраны обеспечивается особым расположением компонентов электронно-транспортной цепи в мембране, перешнуровывающих её толщу. Благодаря мембранам, играющим роль «перегородок», осуществляется пространственное разобщение продуктов фотосинтеза, например O 2и восстановителей, без которых эти продукты взаимодействовали бы друг с другом. Наружная поверхность тилакоида покрыта частицами диаметром 14-15 нм,которые представляют собой «факторы сопряжения», участвуют в синтезе АТФ. В строме же сосредоточены ферменты фиксации CO 2; (темновая стадия фотосинтеза). У растений, способных к «кооперативному» фотосинтезу, существует 2 типа Х., различающихся по строению и функциям. Одни из них, находящиеся в клетках мезофилла, мелкие с гранами, другие, более крупные, содержатся в клетках обкладки проводящих сосудистых пучков, граны в них лишь зачаточные или совсем отсутствуют. В Х. второго типа функционирует фотосистема 1, которая образует АТФ в ходе циклического фосфорилирования, а НАДФЧН - за счёт реакции декарбоксилирования яблочной кислоты. Х. клеток обкладки фиксируют CO 2на рибулозодифосфате, т. е. с помощью цикла Калвина, а Х. клеток мезофилла - на фосфоенолпирувате (путь Хетча - Слэка); т. о. взаимодействие Х. обоих типов обеспечивает высокую эффективность фотосинтеза у растений. В строму Х., наряду с ферментами фиксации CO 2, включены нити ДНК, рибосомы, крахмальные зёрна, осмиофильные гранулы. Наличие в Х. собственного генетического аппарата и специфической белоксинтезирующей системы обусловливает определённую, хотя и относительную, автономию Х. в клетке. При развитии и размножении растения в новых генерациях клеток Х. возникают только путём деления. Происхождение Х. связывают с ,полагая, что современные Х. - потомки сине-зелёных водорослей, вступившие в симбиоз с древними ядерными гетеротрофными клетками бесцветных водорослей или простейших. Х. занимают 20-30% объёма растительной клетки. У водорослей, например хламидомонады, имеется один Х., в клетке высших растений содержится от 10 до 70 Х. Развиваются Х. из т. н. инициальных частиц, или пропластид, - небольших пузырьков, отделяющихся от ядра. В конце вегетации растения Х. в результате разрушения хлорофилла утрачивают зелёную окраску и превращаются в .См. также .
Лит.:Хлоропласты и митохондрии. Вопросы мембранной биологии, Сб., М., 1969; Лёви А., Сикевиц Ф., Структура и функция клетки, пер. с англ., М., 1971; Хит О., Фотосинтез, пер. с англ., М., 1972; Баславская С. С., Фотосинтез, М., 1974; Насыров Ю. С., Фотосинтез и генетика хлоропластов, М., 1975; Structure and function orchloroplasts, ed. М. Gibbs, B., 1971. Р. М. Бекина. 
Микрофотография хлоропласта. 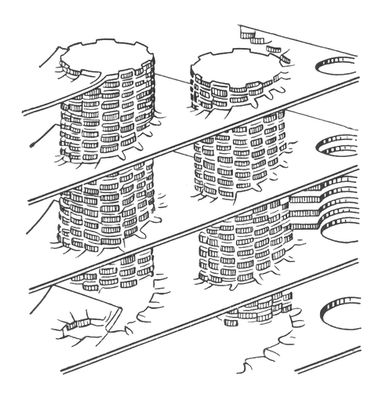
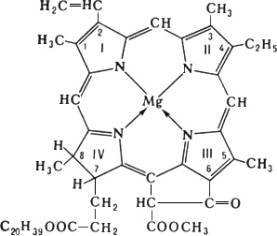
Модель пластинчатой (ламелярной) системы хлоропластов. Столбики - граны, образованные тилакоидами. Хлоропрен Хлоропре'н,2-хлорбутадиен-1,3, CH 2=CH-CCl=CH 2, бесцветная жидкость с резким запахом; t kип59,4 °С, плотность 0,9585 г/см 3(20 °С). Нерастворим в воде, смешивается с большинством органических растворителей. Х. присоединяет по двойным связям (обычно в положение 1,4) галогены, галогеноводороды, вступает в реакции ,чрезвычайно легко полимеризуется (поэтому его стабилизируют добавками или ) .Получают Х. гидрохлорированием при 0-20 °С в присутствии хлорида меди Cu 2Cl 2и хлорида аммония; применяется для производства хлоропреновых каучуков. Токсичен; предельно допустимая концентрация в воздухе 0,002 мг/л. Хлоропреновые каучуки Хлоропре'новые каучу'ки',синтетические каучуки, полимеры хлоропрена общей формулы [-CH 2-CCl=CH-CH 2-] n ; продукты светло-жёлтого цвета. Плотность Х. к. 1,20-1,24 г/см 3, молекулярная масса (100-200)Ч10 3, температура стеклования -40° С, удельное объёмное электрическое сопротивление 4,4Ч10 6 ом( м,электрическая прочность 23 Мв/м,диэлектрическая проницаемость 6,4-6,7. Для Х. к. характерен комплекс специфических свойств, обусловленных присутствием в их макромолекулах атомов хлора: масло-, бензо-, озоно- и теплостойкость, негорючесть, а также способность к вулканизации окислами металлов (в промышленности для этой цели применяют смеси ZnO и MgO). Х. к. кристаллизуются при растяжении, благодаря чему ненаполненные резины на их основе имеют высокую прочность. При наполнении Х, к. этот показатель резин в некоторых случаях снижается (см. ) ,однако др. их ценные свойства, например сопротивление раздиру, бензостойкость, как правило, улучшаются. Промышленный метод синтеза Х. к. - полимеризация в водной эмульсии. Основные области их применения - производство резино-технических. изделий, главным образом конвейерных лент, ремней, рукавов. Из Х. к. изготовляют также оболочки проводов и кабелей, защитные покрытия. Важное промышленное значение имеют из Х. к. и хлоропреновые .Мировое производство Х. к. ~ 400 тыс. тв год. Наиболее распространённые торговое название - наирит (СССР), неопрен (США). Лит.:Энциклопедия полимеров, т. 3, М., 1977; см, также лит. при ст. . Хлорофилл Хлорофи'лл(от греч. chlorуs - зелёный и phэllon - лист), зелёный пигмент растений, с помощью которого они улавливают энергию солнечного света и осуществляют .Локализован в особых клеточных структурах - хлоропластах или и связан с белками и липидами мембран. Основу структуры молекулы Х, составляет магниевый комплекс порфиринового цикла; в IV пиррольном кольце к остатку пропионовой кислоты присоединён высокомолекулярный спирт ,который придаёт Х. способность встраиваться в липидный слой мембран хлоропластов.
Высшие растения и зелёные водоросли содержат Х. аи в, бурые и диатомовые водоросли - аи с, красные водоросли - Х. аи d.В фотосинтезирующих бактериях присутствуют близкие аналоги Х. - .По своему строению Х. близок к др. природным комплексам порфиринов (с железом) - дыхательным пигментам - ,красящему веществу крови - ,а также простетическим группам некоторых ферментов - пероксидазы, каталазы. 1, 2, 3, 4, 5, 6, 7 |
|||||||