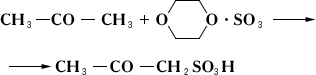|
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Раззаков Федор :: Азимов Айзек :: Чехов Антон Павлович :: Грин Александр :: Борхес Хорхе Луис :: Горький Максим :: Андреев Леонид Николаевич :: Сименон Жорж Популярные книги:: Ожерелье Иомалы :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: О «Двух душах» М. Горького :: Магия луны (Том 1) :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер :: Вторая книга Царств |
Большая Советская Энциклопедия (СУ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (СУ) - Чтение (стр. 16)
Сульфадимезин Сульфадимези'н, антибактериальное средство из группы .Применяют в порошках и таблетках при различных инфекционных заболеваниях. Сульфаниламидные препараты Сульфанилами'дные препара'ты,сульфаниламиды, группа антимикробных лекарственных средств - производных сульфаниловой кислоты. Их антибактериальные свойства обнаружены немецким учёным Г. Домагком в 1934-35. С. п. близки по химической структуре парааминобензойной кислоте (ПАБК) - необходимому фактору роста микроорганизмов, при отсутствии которого они не могут размножаться. Основной механизм действия С. п. - конкуренция с ПАБК за связывание с определёнными ферментами в микробной клетке. В результате соединения С. п. с ферментами бактерии теряют способность синтезировать необходимый им витамин - и осуществлять др. превращения веществ, которые в норме протекают с участием ПАБК. Поскольку эти ферменты обладают более высоким сродством с ПАБК, чем с С. п., терапевтический эффект достигается при достаточно больших дозах препаратов. Приём С. п. в недостаточных дозах или досрочное прекращение лечения могут привести к появлению устойчивых штаммов возбудителей, не поддающихся в дальнейшем действию С. п. Бактериостатический эффект С. п. распространяется на многие микроорганизмы: стрептококки, пневмококки, стафилококки, гонококки, менингококки, некоторые крупные вирусы и др. По времени нахождения в организме С. п. делят на средства короткого (например, стрептоцид, этазол, сульфадимезин) и длительного (сульфапиридазин, сульфадиметоксин) действия. Большинство С. п. хорошо всасывается из желудочно-кишечного тракта и быстро накапливается в крови и органах в бактериостатических концентрациях. Их применяют при лечении ангины, рожистого воспаления, циститов и т. д. Фталазол, сульгин и некоторые др. С. п. плохо всасываются из желудочно-кишечного тракта, относительно долго находятся в кишечнике в высоких концентрациях и применяются при кишечных инфекциях (дизентерия и др.). С. п. воздействуют не только на микроорганизмы, но и на организм человека. Некоторые из них (например, бутамид) способны снижать уровень сахара в крови, в связи с чем нашли применение при лечении .С. п. могут вызывать побочные явления: аллергические реакции, тошноту, рвоту, снижение содержания лейкоцитов в крови, невриты, нарушения функции почек и др. Применяются только по назначению врача. Лит.:Закусов В. В., Фармакология, 2 изд., М., 1966; Машковский М. Д., Лекарственные средства, 7 изд., ч. 2, М., 1972. В. В. Чурюканов. Сульфаниловая кислота Сульфани'ловая кислота', n-аминобензолсульфокислота, бесцветные кристаллы, разлагающиеся при 280-300 °С; ограниченно растворимы в воде (1 гв 100 гпри 20 °С).
С. к. - внутренняя соль, в которой аминогруппа нейтрализована остатком сульфокислоты, поэтому С. к. не образует солей с минеральными кислотами, но её сульфогруппа может быть нейтрализована щелочами (например, с образованием натриевой соли H
2N-C
6H
4SO
3Na). Получают С. к. нагреванием анилинсульфата C
6H
5NH
2Ч
Сульфатазы Сульфата'зы, сульфогидролазы, ферменты класса ;катализируют расщепление эфиров серной кислоты с выделением свободного сульфата. Широко представлены у животных, растений и микроорганизмов. Известны С., действующие на различные субстраты: арил-С. (гидролизуют ароматические эфиры серной кислоты); глико-С. (гидролизуют серные эфиры моно- и дисахаридов); хондро-С. (расщепляет ) ;стерол-С. (гидролизует серные эфиры ) ;целлюлозо-поли-С. (отщепляет сульфогруппы от полисульфатов целлюлозы). Наиболее изучены арилсульфатазы. Сульфатная целлюлоза Сульфа'тная целлюло'за, целлюлоза, получаемая по так называемому сульфатному способу варки. См. . Сульфатостойкий цемент Сульфатосто'йкий цеме'нт,сульфатостойкий портландцемент, разновидность .По сравнению с обычным портландцементом С. ц. обладает повышенной стойкостью к действию минерализованных вод, содержащих , меньшим тепловыделением, замедленной интенсивностью твердения и высокой морозостойкостью. С. ц. получают тонким измельчением нормированного минералогического состава. Предназначается для изготовления бетонных и железобетонных конструкций гидротехнических и др. сооружений, испытывающих воздействие агрессивной сульфатной среды (например, морской воды), особенно в условиях переменного увлажнения, чередующихся замерзания и оттаивания. См. также . Сульфаты Сульфа'ты(от лат. sulphur, sulfur - сера), сернокислые соли, соли серной кислоты H 2SO 4. Имеются два ряда С.- средние (нормальные) общей формулы Mg 2SO 4и кислые ( ) -MHSO 4, где М - одновалентный металл. С. - кристаллические вещества, бесцветные (если катион бесцветен), в большинстве случаев хорошо растворимые в воде. Малорастворимые С. встречаются в виде минералов: гипса CaSO 4Ч2H 2O, целестина SrSO 4, англезита PbSO 4и др. (см. ) .Практически нерастворимы барит BaSO 4и RaSO 4. Кислые С. выделены в твёрдом состоянии лишь для наиболее активных металлов - Na, К и др. Они хорошо растворимы в воде, легко плавятся. Нормальные С. можно получить растворением металлов в H 2SO 4, действием H 2SO 4на окиси, гидроокиси, карбонаты металлов и др. Гидросульфаты получают нагреванием нормальных С. с концентрированной H 2SO 4: K 2SO 4+ H 2SO 4= 2KHSO 4. Кристаллогидраты С. некоторых тяжёлых металлов называются . Широкое применение во многих отраслях промышленности находят сульфаты природные. Подробнее о С. и их применении см. , , , , , , . И. К. Малина. Сульфаты природные Сульфа'ты приро'дные, класс минералов, представляющих собой природные соли серной кислоты. Содержит около 150 минеральных видов; однако число устойчивых и широко распространённых С. п. в земной коре сравнительно невелико ( , , , , , ,квасцы и др.). Химически С. п. представляют собой или простые безводные соли, либо большей частью простые или двойные соли с кристаллизационной водой или с добавочными анионами. Обобщённые формулы для последних имеют вид: A m[SO 4] pZ q Ч xH 2O и A mB n[SO 4] pZ qx x H 20, где А и В - катионы, а Z - добавочные анионы ([ОН] -, Cl -, [СОз] 2 -и др.). Важнейшие видообразующие катионы в С. п.: Fe (особенно Fe 3 +), Na +, К +, Cu 2+, Mg 2+, Al 3+, Ca 2+, Pb 2+, Ва 2 +. Основная кристаллохимическая структурная единица С. п. - тетраэдр [SO 4], в котором сера находится в центре. Анионы [SO 4] 2 -всегда отделены др. катионами и анионами, поэтому среди С. п. резко доминируют островные структуры. Возникновение цепных или слоистых структур обусловлено либо наличием водородных или гидроксильных связей, либо сочетанием их с прочными комплексами (UO 6и др.). Большинство С. н. обладает низкой симметрией (ромбические, моноклинные, реже триклинные). Кристаллы С. п., как правило, имеют изометрический габитус. Цвет С. п. обусловлен ионами-хромофорами, минеральными включениями и наличием дефектов. Плотность С. п. от 1490 до 6920 кг/м 3 .Для С. п. характерны низкая твёрдость (2-3,5 по минералогической шкале), повышенная растворимость в воде (особенно С. п. с одновалентными катионами). Почти все С. п. образуются в зоне гипергенеза и при седиментогенезе в крупных водных бассейнах. В гидротермальных месторождениях С. п. представлены баритом, реже встречаются другие безводные сульфаты - ангидрит, целестин и .Многие С. п. (например, гипс, брошантит, ярозит, купоросы и др.) образуются в зоне окисления сульфидных месторождений, при сольфатарной деятельности вулканов (например, алунит); некоторые редкие С. п. (например, халькокианит) возникают в результате фумарольной деятельности. С. п. находят широкое применение как сырьё для извлечения металлов (Ва, Sr, Pb, Al) в химической промышленности; при бурении - как утяжелитель глинистых растворов (барит); в резиновой, бумажной, лакокрасочной, сахарной промышленности; в стекольном и керамическом производстве; в строительном деле для изготовления цементов (гипс и ангидрит), а также в фармацевтической, кожевенной, текстильной и др. отраслях промышленности. Некоторые С. п. используют для получения калийных удобрений. Лит.:Костов И., Минералогия, пер. с англ., М., 1971. Сульфгидрильные группы Сульфгидри'льные гру'ппы,тиоловые группы, SH-группы органических соединений. С. г. обладают высокой и разнообразной реакционной способностью: легко окисляются с образованием дисульфидов, сульфеновых, сульфиновых или сульфокислот; легко вступают в реакции алкилирования, ацилирования, тиол-дисульфидного обмена, образуют меркаптиды (при реакции с ионами тяжёлых металлов), меркаптали, меркаптолы (при реакции с альдегидами и кетонами). С. г. играют важную роль в биохимических процессах. С. г. , и 4 1-фосфопантетеина участвуют в ферментативных реакциях образования и переноса ацильных остатков, связанных с метаболизмом липидов и углеводов; С. г. -в обезвреживании чужеродных органических соединений, восстановлении перекисей и в осуществлении его коферментных функций. В белках С. г. принадлежат остаткам аминокислоты .В составе активных центров ряда ферментов С. г. участвуют в их каталитическом действии, в связывании субстратов, коферментов и ионов металлов. Каталитическая роль С. г. ферментов заключается в образовании промежуточных соединений с субстратами (или их остатками) или в переносе электронов и протонов от субстратов к акцепторам (в некоторых окислительных ферментах). Блокирование С. г. при помощи специфичных реагентов вызывает частичное или полное торможение активности многих ферментов. Важную роль в стабилизации структуры белков, в том числе ферментов, антител и некоторых гормонов, играют дисульфидные связи (-S-S-), которые образуются при окислении С. г. в процессе биосинтеза белков. Расщепление дисульфидных связей приводит к нарушению нативной структуры белков и утрате ими биологической активности. Лит.:Торчинский Ю. М., Сульфгидрильные и дисульфндные группы белков, М., 1971; Jocelyn P. С., Biochemistry of the SH group, L.- N. Y., 1972; Friedman M., The chemistry and biochemistry of the sulfhydryl group in amino acids, peptides and proteins, Oxf.- N. Y., 1973. Ю. М. Торчинский. Сульфидирование Сульфиди'рование,технологический приём в цветной металлургии, заключающийся в переводе окислов или металлов в сульфидную форму для облегчения их последующего извлечения. Наибольшее распространение С. получило в производстве никеля, где при шахтной плавке окисленных никелевых руд незначительного количества никеля и кобальта (содержание Ni в руде ~1%, Со ~0,025%) отделяются от пустой породы путём перевода их в относительно богатые (до 22% Ni) .Расход сульфидизаторов, в качестве которых используются гипс (CaSO 4Ч 2H 2O) и пирит (FeS 2), составляет 5-7% от массы шихты. С. применяется также для очистки чернового свинца от меди (сульфидизатором при этом служит элементарная сера), а также при обогащении руд - для подготовки окисленных минералов перед флотацией (сульфидизатор - сульфид натрия Na 2S). В. Я. Зайцев. Сульфидные руды Сульфи'дные ру'ды, природные минеральные образования, состоящие из сернистых соединений металлов (сульфидов); к ним относятся также селенистые, теллуристые, мышьяковистые и сурьмянистые соединения металлов. С. р. - важный источник для получения Ni, Со, Cu, Zn, Pb, Мо, Bi, Sb и Hg. В состав С. р., кроме сульфидов, входят др. минералы, в том числе и не содержащие металлы (кварц, кальцит, иногда барит, слюдистые минералы и др.). В зависимости от соотношения сульфидов и др. минералов выделяют С. р. сплошные, или массивные, с преобладанием сульфидов, и прожилковые, или вкрапленные, с преобладанием несульфидных минералов. С. р. бывают простые, или монометаллические, и комплексные, или полиметаллические. Особенно распространены полиметаллические С. р., в состав которых входят сульфиды меди, цинка и свинца (см. ) ,а также комплексные , , , и .Во многих С. р. в качестве примесей присутствуют Pt, Au, Ag, Cd, In, Se, Те. Большинство месторождений С. р. относится к эндогенным месторождениям с преобладанием среди них .Рудные тела чаще всего представлены жилами, а также пластами, линзами, штоками и трубообразными залежами. Такие тела протягиваются в длину и на глубину на сотни м -несколько км.Запасы С. р. в них достигают сотен млн. и даже млрд. т,а запасы металлов - десятков, сотен тысяч и даже нескольких млн. т,при содержании металлов в руде от десятых долей до нескольких десятков процента. См. также .
Лит.:Смирнов В. И., Геология полезных ископаемых, 2 изд., М., 1969. В. И. Смирнов. Сульфиды Сульфи'ды(от лат. sulphur, sulfur - сера), соединения серы с более электроположительными элементами; могут рассматриваться как соли H 2S. Имеется два ряда С.: средние (нормальные) общей формулы M 2S и кислые (гидросульфиды) общей формулы MHS, где М - одновалентный металл. С. щелочных металлов бесцветны, хорошо растворимы в воде. Их водные растворы сильно гидролизованы и имеют щелочную реакцию. При действии разбавленных кислот выделяют H 2S. С. щёлочноземельных металлов бесцветны, в воде малорастворимы. Во влажном воздухе выделяют H 2S. По остальным свойствам подобны С. щелочных металлов. И те и другие С. легко окисляются до сульфатов. С. тяжёлых металлов практически нерастворимы в воде. Почти все они чёрного или черно-бурого цвета (за исключением белого ZnS, розоватого MnS, жёлтого CdS, оранжево-красного Sb 2S 3, жёлтого SnS 2). Неодинаковое отношение С. к кислотам и С. аммония используется в химическом анализе. Многие элементы образуют общей формулы M 2S x. Они при нагревании разлагаются с образованием нормальных С. Особенно склонны к образованию полисульфидов Na, К, NH 4 +, Са, Sr, Ва. С. получают: 1) непосредственным соединением элементов; 2) взаимодействием водных растворов солей с H 2S или (NH 4) 2S; 3) взаимодействием гидроокисей с H 2S; 4) восстановлением сульфатов углём при прокаливании. Многие С. имеют большое практическое значение: Na 2S, CaS, BaS - в кожевенном производстве для дубления кож; полисульфиды кальция и бария - в сельском хозяйстве для борьбы с вредителями растений; PbS, CdS, ZnS и др. - полупроводниковые материалы, а кристаллы этих и некоторых др. С. - полупроводниковые лазерные материалы; С. щёлочноземельных металлов, а также ZnS и CdS - основа люминофоров; MoS 2- твёрдая смазка; (NH 4) 2S - важный реактив в качественном химическом анализе; FeS 2- сырьё для производства . И. К. Малина. Сульфиды органические
Сульфи'ды органи'ческие,
общей формулы R-S
n-R' (R и R' - одинаковые или разные углеводородные остатки алифатического или ароматического ряда;
n
Моносульфиды кипят выше соответствующих ROR', сернистыми аналогами которых они являются [так, диметилсульфид (CH 3) 2S кипит при 38,0 °С, (СН з) 2О - при –23,6 °С]; окисляются, например, перекисью водорода до ,концентрированной азотной кислотой - до ,присоединяют галогены, алкилгалогениды, алкилсульфаты. С. о. широко распространены в природе. Некоторые нефти содержат до 4-5% серы, большая часть которой связана в виде сульфидов; к С. о. принадлежат биологически важные природные продукты , и др.; диаллилдисульфид найден в чесноке. С. о. применяют как антиокислители и стабилизаторы моторных топлив и смазочных масел, как лекарственные препараты, красители (см. ) ,растворители. Некоторые синтетические ди- и полисульфиды имеют большое промышленное значение, например (тиоколы), тетраметилтиурамдисульфид, применяемый для вулканизации каучуков. Галогенированные С. о. токсичны (см., например, ) . Сульфиды природные Сульфи'ды приро'дные, класс минералов - сернистых соединений металлов. С. п. составляют около 0,15% (по массе) земной коры, насчитывают свыше 200 минеральных видов. К С. п. близки , , ,а также антимониды, висмутиды. В качестве главных видообразующих элементов в С. п. находятся Pb, Cu, Sb, As, Ag, Bi, Fe, Co, Ni, входящие в состав многих десятков минеральных видов. Менее разнообразные соединения дают Zn, Cd, Mn, Ge, Sn, Tl, Mo, Hg (по 3-5), но среди них находятся такие распространённые и промышленно важные минералы, как (ZnS), (MoS 2), (HgS). К элементам, встречающимся в виде изоморфных примесей в С. п., относятся Au, Ag, Ga, Ge, In, Tl, Re и др. Помимо простых С. п., производных H 2S (например, Ag 2S, PbS), выделяются персульфиды, производные H 2S 2(например, FeS2); сложные сульфиды (например, Pb 5Sb 4S 11) и сульфосоли с анионами [AsS] 3–, [SbS3] 3–и др. (например, Ag 3SbS 3); двойные сульфиды (например, халькопирит CuFeS 2). В современной классификации С. п., основанной на кристаллохимических данных, внутри главных химических типов различают подклассы с выделением среди них групп, соответствующих структурным типам. К важнейшим группам С. п. относятся: в подклассе координационных С. п. - группы галенита PbS, сфалерита ZnS, пирротина Fe 1–XS, пентландита (Fe, Ni) 9S 8, кубанита CuFe 2S 3, халькопирита, борнита Cu 5FeS 4и др.; в подклассе каркасных С. п. - группы Ag 2S, ;в подклассе кольцевых С. п. - группа AsS; в подклассе островных С. п. - группы FeS 2, CoAsS - FeAsS и др.; в подклассе цепных С. п. - группы Sb 2S 3, NiS, киновари HgS и др.; в подклассе слоистых С. п. - группы молибденита MoS 2, As 2S 3, CuS и др. По типу химической связи С. п. - преимущественно ковалентные соединения. Большинство С. п. - полупроводники (С. п. со структурами пирита, марказита, арсенопирита), но распространены и соединения с металлической проводимостью, а также изоляторы и сверхпроводники (некоторые дисульфиды). Ряд С. п. - сегнетоэлектрики (например, антимонит). По магнитным свойствам выделяются диамагнитные, парамагнитные, ферромагнитные, антиферромагнитные С. п. По оптическим свойствам большинство С. п. непрозрачны в видимой области, часто имеют высокую отражательную способность. Твёрдость по минералогической шкале обычно 2-4, у слоистых С. п. до 1-2 (молибденит, ковеллин и др.), у персульфидов до 5-7 (пирит и др.). Плотность свыше 4000 кг/м 3 .Преобладающая масса С. п. входит в состав гидротермального происхождения; некоторые сульфиды Fe, Ni, Си, Pt связаны с магматогенными процессами в ультраосновных породах. С. п. могут иметь осадочное или экзогенное происхождение, отлагаясь из поверхностных растворов при действии H 2S (например, в угленосных толщах, в зонах окисления сульфидных месторождений). При окислении на поверхности Земли С. п. легко переходят в сульфаты, а затем в гидроокислы, карбонаты и др. соли кислородных кислот, реже - в самородные элементы (например, Cu, Ag). Многие С. п. являются важными рудными минералами. Лит.:Рамдор П., Рудные минералы и их срастания, пер. с нем., М., 1962; Минералы. Справочник, т. 1, М., 1960; Марфунин А. С., Введение в физику минералов, М., 1974. А. С. Марфунин. Сульфирование Сульфи'рование,замещение в органических соединениях водорода у атома углерода на сульфогруппу (-SO 3H) при действии серной кислоты или олеума. С. подвергаются главным образом ароматические соединения, например: C 6H 6+ H 2SO4 ® C 6H 5SO зН + H 2O. В алифатические соединения сульфогруппу вводят обычно косвенным способом, например обменом галогена в галогенопроизводных (1) или действием на углеводороды сернистого ангидрида и хлора при облучении ультрафиолетовым светом (сульфохлорирование) с последующим гидролизом (2): CH 2= CH-CH 2CI + NaHSO 3® CH 2= CH-CH 2SO зН + NaCI (1)
(R - углеводородный радикал, например, алкил). С. соединений, неустойчивых к действию кислот, осуществляют комплексно связанным серным ангидридом, например диоксансульфотриоксидом:
С. и сульфохлорирование - важные промышленные процессы, широко используемые в производстве , и др. (см. также ) . Б. Л. Дяткин. Сульфитация Сульфита'цияв пищевой промышленности, плодов и овощей с помощью сернистого ангидрида SO 2, сернистой кислоты H 2SO 3, а также гидросульфита (бисульфита) натрия NaHSO 3. Сульфиты в концентрациях 0,1-0,2% (по массе) в кислой среде уничтожают плесневые грибки и дрожжи, вызывающие порчу плодов и овощей. Обработка выполняется сухим способом (окуривание сернистым газом в деревянных или каменных камерах) или мокрым (плоды или ягоды заливают в бочках слабым раствором кислоты или гидросульфита). Сульфитируют летом и осенью, главным образом фруктовые полуфабрикаты (пюре, соки, дроблёные и целые плоды и ягоды), предназначающиеся для переработки в зимние месяцы. В СССР не допускается выработка из сульфитированных полуфабрикатов продуктов для детского и диетического питания. С. заменяется др. методами консервирования - охлаждением, замораживанием, , ,а также применением безвредных химических консервантов, например сорбиновой кислоты. Лит.:Наместников А. Ф., Качество консервов, М., 1967: Фан-Юнг А. Ф., Фл ауменбаум Б. Л., Изотов А, К., Технология консервирования плодов и овощей, 3 изд., М., 1969. А. Ф. Наместников. Сульфитная целлюлоза Сульфи'тная целлюло'за,целлюлоза, получаемая по так называемому сульфитному способу варки. См. . Сульфитный щёлок Сульфи'тный щёлок,отход производства целлюлозы сульфитным способом (так называемая отработанная варочная кислота). На 1 тцеллюлозы приходится 8-10 тщёлока. Содержит переведённые в растворённое состояние нецеллюлозные компоненты древесины, главным образом гемицеллюлозы, и продукт сульфирования лигнина (лигносульфоновую кислоту). Из С. щ. получают этиловый спирт и кормовые дрожжи. См. . Сульфиты Сульфи'ты, соли H 2SO 3. Существует два ряда С.: средние (нормальные) общей формулы M 2SO 3и кислые ( ) общей формулы MHSO 3(М - одновалентный металл). Средние, за исключением С. щелочных металлов и аммония, малорастворимы в воде, растворяются в присутствии SO 2. Из кислых в свободном состоянии выделены лишь гидросульфиты щелочных металлов. Для С. в водном растворе характерны окисление до и восстановление до гипосульфитов M 2S 2O 3. Получают взаимодействием SO 2с гидроокисями или карбонатами соответствующих металлов в водной среде. Применяются главным образом гидросульфиты - в текстильной промышленности при крашении и печатании (KHSO 3, NaHSO 3), в бумажной промышленности при получении целлюлозы из древесины [Ca (HSO 3) 2], в фотографии, в органическом синтезе. Сульфо..., сульф... Сульфо..., сульф...(от лат. sulphur, sulfur - сера), в химических, медицинских и других терминах составная часть, означающая отношение к ;см., например, , . Сульфокислоты Сульфокисло'ты, сульфоновые кислоты, RSO 3H (R - углеводородный радикал алифатического или ароматического ряда), обычно кристаллические гигроскопичные вещества, хорошо растворимые в воде. По кислотности С. близки к минеральным кислотам. Ароматические С. получают сульфированием ароматических углеводородов и их производных, алифатические С. - обменом галогена на сульфогруппу - SO 3H или сульфохлорированием углеводородов (см. ) . С. под действием PCI 5превращаются в сульфохлориды RSO 2CI; восстановление С. приводит к сульфиновым кислотам RSO 2H и RSH. В ароматическом ядре SO 3H-rpynna легко обменивается под действием нуклеофильных реагентов на Н, OH, OR, H 2N, R 2N и др. Ароматические С. - важные полупродукты основного органического синтеза (например, в производстве фенолов); применяются для получения ,лекарственных веществ ( ) , ,гальванических добавок и др. Щелочные и четвертичные аммониевые соли алифатических С. (сульфонаты) - поверхностно-активные вещества, используемые как компоненты .См. также . В неорганической химии термин «С.» иногда употребляется вместо термина - . Б. Л. Дяткин. Сульфоксиды
Сульфокси'ды, сульфоокиси,
,содержащие группу
связанную с двумя органическими радикалами. С. - бесцветные вязкие жидкости или кристаллические вещества, например для диметилсульфоксида (CH 3) 2SO t пл 18,4 °С, t kип189 °С; растворимы в спирте, эфире (низшие члены гомологического ряда растворяются также в воде). С сильными кислотами С. образуют солеобразные аддукты (продукты присоединения), например R 2SO ЧHCl. Получают С. обычно окислением органических сульфидов (тиоэфиров). Диметилсульфоксид применяют как растворитель. Открыты А. М. Зайцевым (1886).Ч 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 |
|||||||
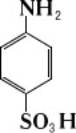
 H
2SO
4при 180-200 °С. Диазотированием С. к. получают диазобензолсульфокислоту N
+
2
-C
6H
4-SO
-
3, широко используемую в производстве
.Применение в медицине нашли амид С. к. H
2N-C
6H
4-SO
2NH
2(сульфаниламид), называемый белым стрептоцидом, и некоторые его производные (например, альбуцид,
,сульфидин,
,сульфазол; см.
)
.В лаборатории С. к. используют для определения нитритов и обнаружения некоторых металлов (осмия, рутения и др.).
H
2SO
4при 180-200 °С. Диазотированием С. к. получают диазобензолсульфокислоту N
+
2
-C
6H
4-SO
-
3, широко используемую в производстве
.Применение в медицине нашли амид С. к. H
2N-C
6H
4-SO
2NH
2(сульфаниламид), называемый белым стрептоцидом, и некоторые его производные (например, альбуцид,
,сульфидин,
,сульфазол; см.
)
.В лаборатории С. к. используют для определения нитритов и обнаружения некоторых металлов (осмия, рутения и др.).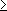 1)
.С
.о., у которых
n= 1, называются моносульфидами, или тиоэфирами, с
n= 2 и
n > 2 -дисульфидами, трисульфидами и т. д.
1)
.С
.о., у которых
n= 1, называются моносульфидами, или тиоэфирами, с
n= 2 и
n > 2 -дисульфидами, трисульфидами и т. д.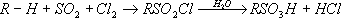 (2)
(2)