 |
|
���������� ������:: ��� :: ������� ��� ���������� :: �������� ����� :: ������ ����� :: ����� ����� �������� :: ���� ��������� :: ������ ����� ���� :: ������� ������ :: ������� ������ ���������� :: ������� ���� ���������� �����:: �������� ������ :: ������ � ������ ��� ����� (��������� ��. ����������� � �������� ������ ������) :: �������� ���� :: � ����� ������ �. �������� :: ����� ���� (��� 1) :: ���� (����� 2) :: ������� ����� :: ������ � �� ����� :: ��� �� ������ �� ������� ������ :: ������ ����� ������ |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 81)
-6(0-300 °C); теплопроводность при 20 °C 125,6
Вт/(мЧК) или 0,3
кал/(
смЧ
сек°С); удельная теплоёмкость (0-100 °С) 623,9
дж/(кгЧ
К) или 0,149
кал/(
гЧ°C); удельное электросопротивление при 20°C 4,6Ч10
-8
омЧ
мили 4,6Ч10
-6
омЧ
см; температурный коэффициент электросопротивления 4,57Ч10
-3(20 °C). Модуль упругости 26
Гн/м
2(2600
кгс/мм
2); предел прочности при растяжении 60
Мн/м
2(6
кгс/мм
2); предел упругости 4
Мн/м
2(0,4
кгс/мм
2), предел текучести 38
Мн/м
2(3,8
кгс/мм
2); относительное удлинение 50%; твердость по Бринеллю 200-300
Мн/м
2(20-30
кгс/мм
2). К. достаточно высокой чистоты пластичен, хорошо прессуется, прокатывается и поддается обработке резанием.
Конфигурация внешней электронной оболочки атома Ca 4s 2, в соответствии с чем Ca в соединениях 2-валентен. Химически Ca очень активен. При обычной температуре Ca легко взаимодействует с кислородом и влагой воздуха, поэтому его хранят в герметически закрытых сосудах или под минеральным маслом. При нагревании на воздухе или в кислороде воспламеняется, давая основной окисел CaO (см. Кальция окись ). Известны также перекиси Ca - CaO 2и СаО 4. С холодной водой Ca взаимодействует сначала быстро, затем реакция замедляется вследствие образования пленки Ca (OH) 2(см. Кальция гидроокись ). Ca энергично взаимодействует с горячей водой и кислотами, выделяя H 2(кроме концентрированной HNO 3). С фтором реагирует на холоду, а с хлором и бромом - выше 400 °С, давая соответственно CaF 2, CaCl 2и CaBr 2(см. Кальция фторид , Кальция хлорид , Кальция бромид ). Эти галогениды в расплавленном состоянии образуют с Ca так называемого субсоединения - CaF, CaCI, в которых Ca формально одновалентен. При нагревании Ca c серой получается кальция сульфид CaS, последний присоединяет серу, образуя полисульфиды (CaS 2, CaS 4и др.). Взаимодействуя с сухим водородом при 300-400 °C Ca образует гидрид CaH 2- ионное соединение, в котором водород является анионом. При 500 °C Ca и азот дают нитрид Ca 3N 2; взаимодействие Ca с аммиаком на холоду приводит к комплексному аммиакату Ca [NH 3] 6. При нагревании без доступа воздуха с графитом, кремнием или фосфором Ca дает соответственно карбид кальция CaC 2, силициды CaSi 2и фосфид Ca 3P 2. Ca образует интерметаллические соединения с Al, Ag, Au, Cu, Li, Mg, Pb, Sn и др. Получение и применение. В промышленности Ca получают двумя способами: 1) нагреванием брикетированной смеси CaO и порошка Al при 1200 °С в вакууме 0,01-0,02 мм рт. ст.; выделяющиеся по реакции: 6CaO +2Al = 3 СаОЧl 2O 3+ 3Са пары Ca конденсируются на холодной поверхности; 2) электролизом расплава CaCl 2и KCl с жидким медно-кальциевым катодом приготовляют сплав Cu - Ca (65% Ca), из которого Ca отгоняют при температуре 950-1000 °С в вакууме 0,1-0,001 мм рт. ст. В виде чистого металла Ca применяют как восстановитель U, Th, Cr, V, Zr, Cs, Rb и некоторых редкоземельных металлов из их соединений. Его используют также для раскисления сталей, бронз и др. сплавов, для удаления серы из нефтепродуктов, для обезвоживания органических жидкостей, для очистки аргона от примеси азота и в качестве поглотителя газов в электровакуумных приборах. Большое применение в технике получили антифрикционные материалы системы Pb-Na-Ca, а также сплавы Pb-Ca, служащие для изготовления оболочки электрических кабелей. Сплав Ca-Si-Ca (силикокальций) применяется как раскислитель и дегазатор в производстве качественных сталей. О применении соединений К. см. в соответствующих статьях. А. Я. Фишер, А. И. Перельман. Кальций в организме. Ca - один из биогенных элементов , необходимых для нормального протекания жизненных процессов. Он присутствует во всех тканях и жидкостях животных и растений. Лишь редкие организмы могут развиваться в среде, лишённой Ca у некоторых организмов содержание Ca достигает 38%; у человека - 1,4-2%. Клетки растительных и животных организмов нуждаются в строго определённых соотношениях ионов Ca 2+, Na +и К +во внеклеточных средах. Растения получают Ca из почвы. По их отношению к Ca растения делят на кальцефилов и кальцефобов . Животные получают Ca с пищей и водой. Ca необходим для образования ряда клеточных структур, поддержания нормальной проницаемости наружных клеточных мембран, для оплодотворения яйцеклеток рыб и др. животных, активации ряда ферментов. Ионы Ca 2+передают возбуждение на мышечное волокно, вызывая его сокращение, увеличивают силу сердечных сокращений повышают фагоцитарную функцию лейкоцитов, активируют систему защитных белков крови, участвуют в её свертывании. В клетках почти весь Ca находится в виде соединений с белками, нуклеиновыми кислотами, фосфолипидами, в комплексах с неорганическими фосфатами и органическими кислотами. В плазме крови человека и высших животных только 20-40% Ca может быть связано с белками. У животных, обладающих скелетом, до 97-99% всего Ca используется в качестве строительного материала: у беспозвоночных в основном в виде CaCO 3(раковины моллюсков, кораллы), у позвоночных - в виде фосфатов. Многие беспозвоночные запасают Ca перед линькой для построения нового скелета или для обеспечения жизненных функции в неблагоприятных условиях. Содержание Ca в крови человека и высших животных регулируется гормонами паращитовидных и щитовидной желёз. Важнейшую роль в этих процессах играет витамин D. Всасывание Ca происходит в переднем отделе тонкого кишечника. Усвоение Ca ухудшается при снижении кислотности в кишечнике и зависит от соотношения Ca, Р и жира в пище. Оптимальные соотношения Ca/P в коровьем молоке около 1,3 (в картофеле 0,15, в бобах 0,13, в мясе 0,016). При избытке в пище Р или щавелевой кислоты всасывание Ca ухудшается, Желчные кислоты ускоряют его всасывание. Оптимальные соотношения Са/жир в пище человека 0,04-0,08 гCa на 1 гжира. Выделение Ca происходит главным образом через кишечник. Млекопитающие в период лактации теряют много Ca с молоком. При нарушениях фосфорно-кальциевого обмена у молодых животных и детей развивается рахит , у взрослых животных - изменение состава и строения скелета ( остеомаляция ). И. А. Скульский. В медицине применение препаратов Ca устраняет нарушения, связанные с недостатком ионов Ca 2+в организме (при тетании, спазмофилии, рахите). Препараты Ca снижают повышенную чувствительность к аллергенам и используются для лечения аллергических заболеваний (сывороточная болезнь, крапивница, ангионевротический отёк, сенная лихорадкаи др.). Препараты Ca уменьшают повышенную проницаемость сосудов и оказывают противовоспалительное действие. Их применяют при геморрагическом васкулите, лучевой болезни, воспалительных и экссудативных процессах (пневмония, плеврит, эндометрит и др.) и некоторых кожных заболеваниях. Назначают как кровоостанавливающие средства, для улучшения деятельности сердечной мышцы и усиления действия препаратов наперстянки; как слабые мочегонные и как противоядия при отравлении солями магния. Вместе с др. средствами препараты Ca применяют для стимулирования родовой деятельности. Хлористый кальций вводят через рот и внутривенно. Оссокальцинол (15%-ная стерильная суспензия особым образом приготовленного костного порошка в персиковом масле) предложен для тканевой терапии. К препаратам Ca относится также гипс (CaSO 4), применяемый в хирургии для гипсовых повязок, и мел (СаСО 3), назначаемый внутрь при повышенной кислотности желудочного сока и для приготовления зубного порошка. Лит.:Краткая химическая энциклопедия, т. 2, М., 1963, с. 370-75; Родякин В. В., Кальций, его соединения и сплавы, М., 1967; Капланский С. Я., Минеральный обмен, М. - Л.,1938; Вишняков С. И., Обмен макроэлементов у сельскохозяйственных животных, М., 1967. Кальцинирование соломы Кальцини'рование соломы,способ обработки соломы известью с целью повышения ее переваримости и питательности. Жёсткость соломы, снижающая её поедаемость и затрудняющая ее переваримость, обусловлена тем, что в растении, по мере роста и развития, клетчатка пропитывается лигнином - веществом, придающим соломе прочность и свойства древесины В основу К. с. положено свойство щелочей нарушать связи лигнина с клетчаткой. Солому, обработанную известковым раствором, скармливают крупному рогатому скоту и овцам в сочетании с силосом и концентратами. Лит.:Кормщиков П. А., Кальцинирование грубых кормов, М., 1958. Кальцинированная сода Кальцини'рованная со'да,то же, что натрия карбонат Na 2CO 3; см. также Сода . Кальциноз Кальцино'з,обызвествление, отложение солей кальция в тех тканях и органах, которые их в норме в нерастворённом состоянии не содержат. У старых людей известь откладывается в хрящах рёбер и гортани; как физиологическое явление песчинки извести находятся в шишковидной железе и в сосудистом сплетении мозга (так называемый мозговой песок). В патологических условиях соли кальция откладываются в клетках и внеклеточно. Иногда они имеют вид песчинок и зёрен, иногда образуют более крупные глыбки; такое отложение извести называется петрификацией, а обызвествлённый участок - петрификатом. Причиной выпадения солей кальция из раствора и отложения их в тканях является непостоянное состояние белковых коллоидов, изменения водородного показателя (pH) в сторону большей щёлочности и повышение концентрации кальция в крови. По механизму развития различают несколько форм К. Дистрофическое обызвествление - местный процесс в участках тканей с резко ослабленным обменом, в результате чего снижаются окислительные процессы, ткань становится более щелочной, и известь выпадает из раствора. Встречается при дистрофических процессах (см. Дистрофия ) и некрозе тканей. Известковые метастазы являются проявлением общего нарушения известкового обмена, при котором концентрация кальция в крови повышается. Остеомиелит, миелома и др. болезни вызывают процессы, разрушающие костную ткань и освобождающие из неё известь. Причиной накопления извести в крови могут быть болезни толстой кишки и почек, гиповитаминоз D и др. В отличие от дистрофического обызвествления, осаждение извести происходит в здоровых неизмененных тканях и органах, но только в тех, где имеется щелочная среда (лёгкие, желудок, почки, артерии). Интерстициальный К. (известковая подагра) отличается тем, что при нём нет обеднения известью костей и нет избыточной концентрации её в крови. Происходит отложение извести в коже и подкожной клетчатке или же её отложение распространяется на мышцы и др. ткани. Причина К. пока не выяснена. Выявляется К. в основном при рентгенологическом исследовании. Лечение симптоматическое, а также направленное на устранение основной причины, вызвавшей К. Кальцит Кальци'т,известковый шпат, минерал, химического состава CaCO 3; содержит 56% CaO и 44% CO 2, нередко примеси Mg, Fe, Mn (до 8%), а также Zn, Со, Sr, Ba. Кристаллизуется в тригональной системе. Встречается в виде кристаллов разнообразного облика - ромбоэдрического, скаленоэдрического, призматического или таблитчатого ( рис. ), а также в виде плотных, зернистых и землистых масс (мел), в натёчных формах (сталактитах) и др. В структуре К. атомы Ca и С расположены по узлам ромбоэдрических решёток, как бы вдвинутых одна в другую. Атомы О группируются по три вокруг С. располагаясь в одной с ними плоскости. К. хрупок, обладает весьма совершенной спайностью по ромбоэдру [1011]. Характерны двойники (см. Двойникование ). Кристаллы К. обладают весьма высоким двойным лучепреломлением. Многие К. сильно флюоресцируют. Твёрдость по минералогической шкале 3; плотность 2720-2800 кг/м 3. При нагревании разлагается при 825 °С; легко растворяется в кислотах. К. - один из наиболее распространённых минералов в земной коре, особенно среди гидротермальных образований в контактово-метасоматических месторождениях, в миндалинах и жеодах вулканических пород. Иногда К. формируется в магматогенных условиях, образуя так называемые карбонатиты . Выпадает из известковых горячих источников в виде туфа (травертина). Огромные массы К. образуются в виде осадка в морских бассейнах, частично биогенным путём. К. является главной составной частью известняков , мраморов и др. осадочных и метаморфических пород, широко используемых в качестве строительных и облицовочных материалов. Чистые и прозрачные разновидности К. - исландский шпат - находят применение в оптической промышленности. Лит.:Оптические материалы для инфракрасной техники, М., 1965; Кальцит, в кн.: Физический энциклопедический словарь, т. 2, М., 1962; К остов И., Минералогия, [пер. с англ.], М., 1971. М. Д. Дорфман, М. О. Клия. 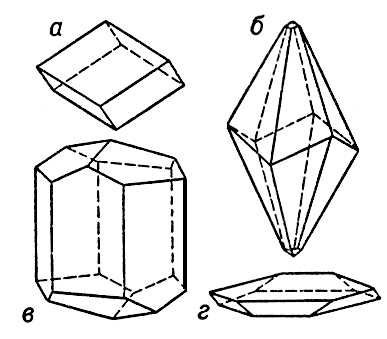
Кристаллы кальцита: а - ромбоэдрический; б - скаленоэдрический; в - призматический; г - таблитчатый. Кальциферолы Кальциферо'лы,витамины группы D; по химическому строению близки к стеринам . К. встречаются в виде эргокальциферола (витамина D 2) и холекальциферола (витамина D 3), образующихся соответственно из эргостерина и дегидрохолестерина в результате облучения последних ультрафиолетовыми лучами. Эргокальциферол обнаружен в очень малых количествах в растительных продуктах. Холекальциферол содержится главным образом в продуктах животного происхождения (сыр жирный, сливочное масло, яичный желток, говяжья печень, печень трески и палтуса, сельдь, лосось, тунец). К. регулируют обмен кальция и фосфора в организме. См. также Витамины . Кальцифир Кальцифи'р,метаморфическая горная порода, состоящая из кальцита или доломита; в подчинённом количестве присутствуют гранат, пироксен, форстерит, шпинель, полевой шпат и др. минералы. К. противопоставляется мрамору , содержащему немного примесей. Кальция бромид Ка'льция броми'д,бромистый кальций, CaBr 2, соль; бесцветные кристаллы, плотность 3,35 г/см 3, t пл760 °С. Легко растворим в воде (594 гна 100 гH 2O при 0 °С). Известен кристаллогидрат CaBr 2Ч6H 2O, t пл38,2 °С. Получают К. б. взаимодействием брома с известковым молоком в присутствии аммиака и др. способами. Применяют для получения светочувствительных фотоматериалов. Кальция гидроокись Ка'льция гидроо'кись,гашёная известь, пушонка, Ca (OH) 2, сильное основание; бесцветные кристаллы, плотность 2,24 г/см 3. Технический продукт - белый пушистый порошок. При нагревании отщепляет воду, превращаясь в CaO. Растворимость в воде очень мала ( гна 100 гH 2O): 0,165 (20 °С), 0,077 (100 °С); в присутствии солей растворимость сильно повышается. Водный раствор К. г. называют известковой водой, а суспензия К. г. в воде - известковым молоком. К. г. легко поглощает углекислый газ из воздуха: Ca (OH) 2+ CO 2= CaCO 3+ H 2O. Применяют К. г. как дешёвую щелочь , а также в строительстве и др. областях. См. также Известь . Кальция карбид Ка'льция карби'д,соединение кальция с углеродом, CaC 2; см. Карбид кальция . Кальция карбонат Ка'льция карбона'т,углекислый кальций, CaCO 3, соль. В природе образует два минерала, различающиеся кристаллической структурой: широко распространённый кальцит и арагонит . При нагревании выше 900 °С К. к. разлагается: CaCO 3= CaO + CO 2 (способ получения извести ). Трудно растворим в воде (14 мгкальцита в 1 лпри 18 °С), легко - в кислотах. Природный К. к. (известняк, мрамор) применяют как строительный материал; мел (молотый К. к.) - наполнитель для резиновых смесей, бумаги, линолеума. Более мягкий и тонкий продукт - так называемый осажденный К. к., полученный взаимодействием CaCl 2и Na 2CO 3- в производстве зубного порошка, косметических средств и т.д. Кальция нитрат Ка'льция нитра'т,то же, что кальциевая селитра . Кальция окись Ка'льция о'кись,негашёная известь, кипелка, CaO, соединение кальция с кислородом; бесцветные кристаллы, плотность 3,4 г/см 3 ,t пл2585 °С. Технический продукт - белое пористое вещество. К. о. жадно реагирует с водой с выделением большого количества тепла и образованием кальция гидроокиси : CaO + H 2O = Ca (OH) 2 (процесс гашения). К. о. получают обжигом известняка или мела. Широко применяют в строительстве, в химической промышленности, металлургии, сельском хозяйстве, водоочистке и т.д. См. также Известь . 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241 |