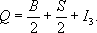|
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Раззаков Федор :: Азимов Айзек :: Чехов Антон Павлович :: Грин Александр :: Борхес Хорхе Луис :: Горький Максим :: Андреев Леонид Николаевич :: Сименон Жорж Популярные книги:: Ожерелье Иомалы :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: О «Двух душах» М. Горького :: Магия луны (Том 1) :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер :: Вторая книга Царств |
Большая Советская Энциклопедия (ИЗ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ИЗ) - Чтение (стр. 29)
РҳР·РҫСӮРҫРҝРёСҮРөСҒРәР°СҸ РёРҪРІР°СҖРёР°РҪСӮРҪРҫСҒСӮСҢ РҳР·РҫСӮРҫРҝРё'СҮРөСҒРәР°СҸ РёРҪРІР°СҖРёР°'РҪСӮРҪРҫСҒСӮСҢ,СҒРІРҫР№СҒСӮРІРҫ СҒРёР»СҢРҪСӢС… РІР·Р°uРјoРҙРөР№СҒСӮРІРёР№ СҚР»РөРјРөРҪСӮР°СҖРҪСӢС… СҮР°СҒСӮРёСҶ. РЎСғСүРөСҒСӮРІСғСҺСүРёРө РІ РҝСҖРёСҖРҫРҙРө СҮР°СҒСӮРёСҶСӢ, РҫРұлаРҙР°СҺСүРёРө СҒРёР»СҢРҪСӢРјРё взаимРҫРҙРөР№СҒСӮРІРёСҸРјРё (Р°РҙСҖРҫРҪСӢ), РјРҫР¶РҪРҫ СҖазРұРёСӮСҢ РҪР° РіСҖСғРҝРҝСӢ В«РҝРҫС…Рҫжих» СҮР°СҒСӮРёСҶ, РІ РәажРҙСғСҺ РёР· РәРҫСӮРҫСҖСӢС… РІС…РҫРҙСҸСӮ СҮР°СҒСӮРёСҶСӢ СҒ РҝСҖРёРјРөСҖРҪРҫ СҖавРҪСӢРјРё РјР°СҒСҒами Рё РҫРҙРёРҪР°РәРҫРІСӢРјРё РІРҪСғСӮСҖРөРҪРҪРёРјРё С…Р°СҖР°РәСӮРөСҖРёСҒСӮРёРәами ( СҒРҝРёРҪРҫРј , РұР°СҖРёРҫРҪРҪСӢРј Р·Р°СҖСҸРҙРҫРј , СҒСӮСҖР°РҪРҪРҫСҒСӮСҢСҺ ), Р·Р° РёСҒРәР»СҺСҮРөРҪРёРөРј СҚР»РөРәСӮСҖРёСҮРөСҒРәРҫРіРҫ Р·Р°СҖСҸРҙР°. РўР°РәРёРө РіСҖСғРҝРҝСӢ РҪазСӢРІР°СҺСӮСҒСҸ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёРјРё РјСғР»СҢСӮРёРҝР»РөСӮами. РһРәазСӢРІР°РөСӮСҒСҸ, СҮСӮРҫ СҒРёР»СҢРҪРҫРө взаимРҫРҙРөР№СҒСӮРІРёРө РҙР»СҸ РІСҒРөС… СҮР°СҒСӮРёСҶ, РІС…РҫРҙСҸСүРёС… РІ РҫРҙРёРҪ Рё СӮРҫСӮ Р¶Рө РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ РјСғР»СҢСӮРёРҝР»РөСӮ, РҫРҙРёРҪР°РәРҫРІРҫ, СӮ. Рө. РҪРө завиСҒРёСӮ РҫСӮ СҚР»РөРәСӮСҖРёСҮРөСҒРәРҫРіРҫ Р·Р°СҖСҸРҙР°, - РІ СҚСӮРҫРј Рё СҒРҫСҒСӮРҫРёСӮ СҒРёРјРјРөСӮСҖРёСҸ СҒРёР»СҢРҪСӢС… взаимРҫРҙРөР№СҒСӮРІРёР№, РҪазСӢРІР°РөРјР°СҸ Рҳ. Рё. В РҹСҖРҫСҒСӮРөР№СҲРёР№ РҝСҖРёРјРөСҖ СҮР°СҒСӮРёСҶ, РәРҫСӮРҫСҖСӢРө РјРҫРіСғСӮ РұСӢСӮСҢ РҫРұСҠРөРҙРёРҪРөРҪСӢ РІ РҫРҙРёРҪ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ РјСғР»СҢСӮРёРҝР»РөСӮ, - РҝСҖРҫСӮРҫРҪ (СҖ) Рё РҪРөР№СӮСҖРҫРҪ (n). РһРҝСӢСӮ РҝРҫРәазСӢРІР°РөСӮ, СҮСӮРҫ СҒРёР»СҢРҪРҫРө взаимРҫРҙРөР№СҒСӮРІРёРө РҝСҖРҫСӮРҫРҪР° СҒ РҝСҖРҫСӮРҫРҪРҫРј, РҪРөР№СӮСҖРҫРҪР° СҒ РҪРөР№СӮСҖРҫРҪРҫРј Рё РҝСҖРҫСӮРҫРҪР° СҒ РҪРөР№СӮСҖРҫРҪРҫРј РҫРҙРёРҪР°РәРҫРІРҫ (РөСҒли РҫРҪРё РҪахРҫРҙСҸСӮСҒСҸ СҒРҫРҫСӮРІРөСӮСҒСӮРІРөРҪРҪРҫ РІ РҫРҙРёРҪР°РәРҫРІСӢС… СҒРҫСҒСӮРҫСҸРҪРёСҸС…); СҚСӮРҫ РҝРҫСҒР»СғжилРҫ РёСҒС…РҫРҙРҪСӢРј РҝСғРҪРәСӮРҫРј РҙР»СҸ СғСҒСӮР°РҪРҫРІР»РөРҪРёСҸ Рҳ. Рё. РҹСҖРҫСӮРҫРҪ Рё РҪРөР№СӮСҖРҫРҪ СҖР°СҒСҒРјР°СӮСҖРёРІР°СҺСӮСҒСҸ РәР°Рә РҙРІР° СҖазРҪСӢС… Р·Р°СҖСҸРҙРҫРІСӢС… СҒРҫСҒСӮРҫСҸРҪРёСҸ РҫРҙРҪРҫР№ СҮР°СҒСӮРёСҶСӢ - РҪСғРәР»РҫРҪР°; РҫРҪРё РҫРұСҖазСғСҺСӮ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ РҙСғРұР»РөСӮ. Р”СҖСғРіРёРө РҝСҖРёРјРөСҖСӢ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёС… РјСғР»СҢСӮРёРҝР»РөСӮРҫРІ: РҝРё-РјРөР·РҫРҪСӢ (p +, p 0, p -) Рё S -РіРёРҝРөСҖРҫРҪСӢ (S +, SВ°, S -), РҫРұСҖазСғСҺСүРёРө РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёРө СӮСҖРёРҝР»РөСӮСӢ. В РӯР»РөРәСӮСҖРёСҮРөСҒРәРёР№ Р·Р°СҖСҸРҙ QСҮР°СҒСӮРёСҶСӢ, РІС…РҫРҙСҸСүРөР№ РІ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ РјСғР»СҢСӮРёРҝР»РөСӮ, РІСӢСҖажаРөСӮСҒСҸ С„РҫСҖРјСғР»РҫР№ Р“Рөлл-РңР°РҪР° - РқРёСҲРёРҙжимСӢ:
Р—РҙРөСҒСҢ Р’ -РұР°СҖРёРҫРҪРҪСӢР№ Р·Р°СҖСҸРҙ, S- СҒСӮСҖР°РҪРҪРҫСҒСӮСҢ (РҫРҙРёРҪР°РәРҫРІСӢРө РҙР»СҸ РІСҒРөС… СҮР°СҒСӮРёСҶ РІ РҙР°РҪРҪРҫРј РёР·РҫСӮРҫРҝРёСҮРөСҒРәРҫРј РјСғР»СҢСӮРёРҝР»РөСӮРө), Р° РІРөлиСҮРёРҪР° I 3РҝСҖРҫРұРөРіР°РөСӮ СҒ РёРҪСӮРөСҖвалРҫРј РІ РөРҙРёРҪРёСҶСғ РІСҒРө Р·РҪР°СҮРөРҪРёСҸ РҫСӮ РҪРөРәРҫСӮРҫСҖРҫРіРҫ РјР°РәСҒималСҢРҪРҫРіРҫ Р·РҪР°СҮРөРҪРёСҸ I(СҶРөР»РҫРіРҫ или РҝРҫР»СғСҶРөР»РҫРіРҫ) РҙРҫ РјРёРҪималСҢРҪРҫРіРҫ, СҖавРҪРҫРіРҫ - I: I 3= I, I- 1, ..., - I. РһРұСүРөРө СҮРёСҒР»Рҫ Р·РҪР°СҮРөРҪРёР№, РәРҫСӮРҫСҖСӢРө РјРҫР¶РөСӮ РҝСҖРёРҪРёРјР°СӮСҢ РІРөлиСҮРёРҪР° I 3(Рё Q) РҙР»СҸ РҙР°РҪРҪРҫРіРҫ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРҫРіРҫ РјСғР»СҢСӮРёРҝР»РөСӮР°, Р° СҒР»РөРҙРҫРІР°СӮРөР»СҢРҪРҫ, Рё СҮРёСҒР»Рҫ СҮР°СҒСӮРёСҶ РІ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРҫРј РјСғР»СҢСӮРёРҝР»РөСӮРө, СҖавРҪРҫ 2 I+ 1. Р’РөлиСҮРёРҪР° I, РҫРҝСҖРөРҙРөР»СҸСҺСүР°СҸ СҮРёСҒР»Рҫ СҮР°СҒСӮРёСҶ РІ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРҫРј РјСғР»СҢСӮРёРҝР»РөСӮРө, РҪазСӢРІР°РөСӮСҒСҸ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёРј СҒРҝРёРҪРҫРј, Р° РІРөлиСҮРёРҪР° I 3- В«РҝСҖРҫРөРәСҶРёРөР№В» РёР·РҫСӮРҫРҝРёСҮРөСҒРәРҫРіРҫ СҒРҝРёРҪР°. РӯСӮРё РҪазваРҪРёСҸ РҫСҒРҪРҫРІР°РҪСӢ РҪР° С„РҫСҖмалСҢРҪРҫР№ РјР°СӮРөРјР°СӮРёСҮРөСҒРәРҫР№ Р°РҪалРҫРіРёРё СҒ РҫРұСӢСҮРҪСӢРј СҒРҝРёРҪРҫРј СҮР°СҒСӮРёСҶ, РҝРҫСҒРәРҫР»СҢРәСғ, СҒРҫглаСҒРҪРҫ РәРІР°РҪСӮРҫРІРҫР№ РјРөС…Р°РҪРёРәРө, РҙР»СҸ СҮР°СҒСӮРёСҶ СҒРҫ СҒРҝРёРҪРҫРј JРҝСҖРҫРөРәСҶРёСҸ СҒРҝРёРҪР° РҪР° РҝСҖРҫРёР·РІРҫР»СҢРҪРҫРө РҪР°РҝСҖавлРөРҪРёРө РІ РҝСҖРҫСҒСӮСҖР°РҪСҒСӮРІРө РјРҫР¶РөСӮ РҝСҖРёРҪРёРјР°СӮСҢ СҮРөСҖРөР· РөРҙРёРҪРёСҶСғ Р·РҪР°СҮРөРҪРёСҸ РҫСӮ + JРҙРҫ - J, СӮ. Рө. РёРјРөСӮСҢ 2 J+ 1 Р·РҪР°СҮРөРҪРёР№. В РўР°Рә РәР°Рә РҪСғРәР»РҫРҪСӢ СҒСғСүРөСҒСӮРІСғСҺСӮ РІ РҙРІСғС… Р·Р°СҖСҸРҙРҫРІСӢС… СҒРҫСҒСӮРҫСҸРҪРёСҸС…, СӮРҫ РҙР»СҸ РҪРёС… (РәР°Рә Рё РҙР»СҸ РІСҒРөС… РҙСҖСғРіРёС… СҮР°СҒСӮРёСҶ, РІС…РҫРҙСҸСүРёС… РІ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёРө РҙСғРұР»РөСӮСӢ) 2 I+ 1 = 2, СӮ. Рө. I= 1/ 2Р° I 3РјРҫР¶РөСӮ РҝСҖРёРҪРёРјР°СӮСҢ РҙРІР° Р·РҪР°СҮРөРҪРёСҸ: + 1/ 2РҙР»СҸ РҝСҖРҫСӮРҫРҪР° (СҮСӮРҫ СҒРҫРҫСӮРІРөСӮСҒСӮРІСғРөСӮ Q= + 1 ,СӮР°Рә РәР°Рә Сғ РҪСғРәР»РҫРҪРҫРІ РұР°СҖРёРҫРҪРҪСӢР№ Р·Р°СҖСҸРҙ B= 1 ,Р° СҒСӮСҖР°РҪРҪРҫСҒСӮСҢ S= 0) Рё - 1/ 2 РҙР»СҸ РҪРөР№СӮСҖРҫРҪР° ( Q= 0). РҳР·РҫСӮРҫРҝРёСҮРөСҒРәРҫРјСғ СӮСҖРёРҝР»РөСӮСғ РҝРёРҫРҪРҫРІ СҒРҫРҫСӮРІРөСӮСҒСӮРІСғРөСӮ I= 1, Р° I 3СҖавРҪРҫ + 1 РҙР»СҸ p +, 0 РҙР»СҸ pВ° Рё - 1 РҙР»СҸ p -.ЧаСҒСӮРёСҶСӢ СҒ I =0 РҪРө РёРјРөСҺСӮ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёС… В«РҝР°СҖСӮРҪС‘СҖРҫРІВ» Рё СҸРІР»СҸСҺСӮСҒСҸ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёРјРё СҒРёРҪРіР»РөСӮами; Рә СӮР°РәРёРј СҮР°СҒСӮРёСҶам РҫСӮРҪРҫСҒСҸСӮСҒСҸ, РҪР°РҝСҖРёРјРөСҖ, РіРёРҝРөСҖРҫРҪСӢ L 0Рё W - . В РҳР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ СҒРҝРёРҪ СҸРІР»СҸРөСӮСҒСҸ, СӮР°РәРёРј РҫРұСҖазРҫРј, важРҪРҫР№ С…Р°СҖР°РәСӮРөСҖРёСҒСӮРёРәРҫР№ Р°РҙСҖРҫРҪР° - РәРІР°РҪСӮРҫРІСӢРј СҮРёСҒР»РҫРј,РҝРҫРәазСӢРІР°СҺСүРёРј, РәР°РәРҫРө РәРҫлиСҮРөСҒСӮРІРҫ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёС… В«РҝР°СҖСӮРҪС‘СҖРҫРІВ» РёРјРөРөСӮ РҙР°РҪРҪР°СҸ СҮР°СҒСӮРёСҶР° (или РІ РәР°РәРҫРј СҮРёСҒР»Рө Р·Р°СҖСҸРҙРҫРІСӢС… СҒРҫСҒСӮРҫСҸРҪРёР№ РҫРҪР° РјРҫР¶РөСӮ РҪахРҫРҙРёСӮСҢСҒСҸ). В РқР° РҫСҒРҪРҫРІРө Рҳ. Рё. СғРҙаёСӮСҒСҸ РҝСҖРөРҙСҒРәазаСӮСҢ СҒСғСүРөСҒСӮРІРҫРІР°РҪРёРө, РјР°СҒСҒСғ Рё Р·Р°СҖСҸРҙСӢ РҪРҫРІСӢС… СҮР°СҒСӮРёСҶ, РөСҒли РёР·РІРөСҒСӮРҪСӢ РёС… РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёРө В«РҝР°СҖСӮРҪС‘СҖСӢВ». РўР°Рә РұСӢР»Рҫ РҝСҖРөРҙСҒРәазаРҪРҫ СҒСғСүРөСҒСӮРІРҫРІР°РҪРёРө pВ°, SВ°, XВ° РҝРҫ РёР·РІРөСҒСӮРҪСӢРј p +, p -; S +, S -Рё X -. В Рҳ. Рё. РёРјРөРөСӮ РјРөСҒСӮРҫ Рё РҙР»СҸ СҒРҫСҒСӮавРҪСӢС… СҒРёСҒСӮРөРј РёР· Р°РҙСҖРҫРҪРҫРІ, РІ СҮР°СҒСӮРҪРҫСҒСӮРё РҙР»СҸ Р°СӮРҫРјРҪСӢС… СҸРҙРөСҖ. РҳР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ СҒРҝРёРҪ СҒР»РҫР¶РҪРҫР№ СҒРёСҒСӮРөРјСӢ СҒРәлаРҙСӢРІР°РөСӮСҒСҸ РёР· РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёС… СҒРҝРёРҪРҫРІ РІС…РҫРҙСҸСүРёС… РІ СҒРёСҒСӮРөРјСғ СҮР°СҒСӮРёСҶ, РҝСҖРё СҚСӮРҫРј СҒР»РҫР¶РөРҪРёРө РҝСҖРҫРёР·РІРҫРҙРёСӮСҒСҸ РҝРҫ СӮРөРј Р¶Рө РҝСҖавилам, СҮСӮРҫ Рё РҙР»СҸ РҫРұСӢСҮРҪРҫРіРҫ СҒРҝРёРҪР°. РўР°Рә, СҒРёСҒСӮРөРјР° РёР· РҙРІСғС… СҮР°СҒСӮРёСҶ СҒ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёРјРё СҒРҝРёРҪами 1/ 2(РҪР°РҝСҖРёРјРөСҖ, РҪСғРәР»РҫРҪ) Рё 1 (РҪР°РҝСҖРёРјРөСҖ, p-РјРөР·РҫРҪ) РјРҫР¶РөСӮ РёРјРөСӮСҢ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ СҒРҝРёРҪ I= 1 + 1/ 2= 3/ 2или I= 1 - 1/ 2= 1/ 2. В Р’ СҸРҙСҖах Рҳ. Рё. РҝСҖРҫСҸРІР»СҸРөСӮСҒСҸ РІ СҒСғСүРөСҒСӮРІРҫРІР°РҪРёРё СғСҖРҫРІРҪРөР№ СҚРҪРөСҖРіРёРё СҒ РҫРҙРёРҪР°РәРҫРІСӢРјРё РәРІР°РҪСӮРҫРІСӢРјРё СҮРёСҒлами РҙР»СҸ СҖазлиСҮРҪСӢС… РёР·РҫРұР°СҖРҫРІ (СӮ. Рө. РҙР»СҸ СҸРҙРөСҖ, СҒРҫРҙРөСҖжаСүРёС… РҫРҙРёРҪР°РәРҫРІРҫРө СҮРёСҒР»Рҫ РҪСғРәР»РҫРҪРҫРІ Рё РҫСӮлиСҮР°СҺСүРёС…СҒСҸ СҚР»РөРәСӮСҖРёСҮРөСҒРәРёРј Р·Р°СҖСҸРҙРҫРј). РҹСҖРёРјРөСҖРҫРј СҒР»СғжаСӮ СҸРҙСҖР° 14 6РЎ, 14 7N, 14 8O: РҫСҒРҪРҫРІРҪРҫРө СҒРҫСҒСӮРҫСҸРҪРёСҸ СҸРҙРөСҖ 14РЎ, 14Рһ Рё РҝРөСҖРІРҫРө РІРҫР·РұСғР¶РҙС‘РҪРҪРҫРө СҒРҫСҒСӮРҫСҸРҪРёРө 14N РҫРұСҖазСғСҺСӮ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ СӮСҖРёРҝР»РөСӮ, I= 1 (СҒРј. СҖРёСҒ .). Р’СҒРө РәРІР°РҪСӮРҫРІСӢРө СҮРёСҒла СҚСӮРёС… СғСҖРҫРІРҪРөР№ РҫРҙРёРҪР°РәРҫРІСӢ, Р° СҖазлиСҮРёРө РІ РёС… СҚРҪРөСҖРіРёСҸС… РјРҫР¶РҪРҫ РҫРұСҠСҸСҒРҪРёСӮСҢ СҖазРҪРёСҶРөР№ СҚР»РөРәСӮСҖРҫСҒСӮР°СӮРёСҮРөСҒРәРёС… СҚРҪРөСҖРіРёР№ РёР·-Р·Р° СҖазлиСҮРёСҸ РІ СҚР»РөРәСӮСҖРёСҮРөСҒРәРёС… Р·Р°СҖСҸРҙах СҚСӮРёС… СҸРҙРөСҖ. (РһСҒРҪРҫРІРҪРҫР№ СғСҖРҫРІРөРҪСҢ 14N РёРјРөРөСӮ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ СҒРҝРёРҪ I= 0, РҝРҫСҚСӮРҫРјСғ Сғ РҪРөРіРҫ РҪРөСӮ Р°РҪалРҫРіРҫРІ РІ СҸРҙСҖах 14C Рё 14O.) В РҳР· Рҳ. Рё. СҒР»РөРҙСғРөСӮ Р·Р°РәРҫРҪ СҒРҫС…СҖР°РҪРөРҪРёСҸ РҝРҫР»РҪРҫРіРҫ РёР·РҫСӮРҫРҝРёСҮРөСҒРәРҫРіРҫ СҒРҝРёРҪР° IРІ РҝСҖРҫСҶРөСҒСҒах, РҫРұСғСҒР»РҫРІР»РөРҪРҪСӢС… СҒРёР»СҢРҪСӢРјРё взаимРҫРҙРөР№СҒСӮРІРёСҸРјРё. РӯСӮРҫСӮ Р·Р°РәРҫРҪ РҝСҖРёРІРҫРҙРёСӮ Рә РҫРҝСҖРөРҙРөлёРҪРҪСӢРј СҒРҫРҫСӮРҪРҫСҲРөРҪРёСҸРј РјРөР¶РҙСғ РІРөСҖРҫСҸСӮРҪРҫСҒСӮСҸРјРё РҝСҖРҫСҶРөСҒСҒРҫРІ РҙР»СҸ СҖазлиСҮРҪСӢС… СҮР°СҒСӮРёСҶ, РІС…РҫРҙСҸСүРёС… РІ РҫРҙРёРҪР°РәРҫРІСӢРө РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёРө РјСғР»СҢСӮРёРҝР»РөСӮСӢ, Р° СӮР°РәР¶Рө Рә Р·Р°РҝСҖРөСӮСғ РҪРөРәРҫСӮРҫСҖСӢС… СҖРөР°РәСҶРёР№ [РҪР°РҝСҖРёРјРөСҖ, СҖРөР°РәСҶРёСҸ d + d В® 4He + pВ° РҪРө РјРҫР¶РөСӮ РҝСҖРҫРёСҒС…РҫРҙРёСӮСҢ Р·Р° СҒСҮС‘СӮ СҒРёР»СҢРҪСӢС… взаимРҫРҙРөР№СҒСӮРІРёР№, СӮР°Рә РәР°Рә РҙР»СҸ d (РҙРөР№СӮСҖРҫРҪР°) Рё 4He I= 0, Р° РҙР»СҸ pВ°-РјРөР·РҫРҪР° I= 1]. РӯРәСҒРҝРөСҖРёРјРөРҪСӮалСҢРҪРҫР№ РҝСҖРҫРІРөСҖРәРө СӮР°РәРёС… РҝСҖРөРҙСҒРәазаРҪРёР№ РҝРҫСҒРІСҸСүРөРҪРҫ РјРҪРҫРіРҫ СҖР°РұРҫСӮ РҪР° СғСҒРәРҫСҖРёСӮРөР»СҸС… Р·Р°СҖСҸР¶РөРҪРҪСӢС… СҮР°СҒСӮРёСҶ РІСӢСҒРҫРәРҫР№ СҚРҪРөСҖРіРёРё. В Рҳ. Рё. РёРјРөРөСӮ РјРөСҒСӮРҫ СӮРҫР»СҢРәРҫ РҙР»СҸ СҒРёР»СҢРҪСӢС… взаимРҫРҙРөР№СҒСӮРІРёР№ Рё РҪР°СҖСғСҲР°РөСӮСҒСҸ СҚР»РөРәСӮСҖРҫмагРҪРёСӮРҪСӢРјРё взаимРҫРҙРөР№СҒСӮРІРёСҸРјРё (СҸРІРҪРҫ завиСҒСҸСүРёРјРё РҫСӮ СҚР»РөРәСӮСҖРёСҮРөСҒРәРёС… Р·Р°СҖСҸРҙРҫРІ СҮР°СҒСӮРёСҶ, СӮ. Рө. РҫСӮ I 3), В«СҒила» РәРҫСӮРҫСҖСӢС… РҝРҫ РҝРҫСҖСҸРҙРәСғ РІРөлиСҮРёРҪСӢ СҒРҫСҒСӮавлСҸРөСӮ РҝСҖРёРјРөСҖРҪРҫ 1% РҫСӮ СҒРёР»СҢРҪСӢС… взаимРҫРҙРөР№СҒСӮРІРёР№. РазлиСҮРёРө СҚР»РөРәСӮСҖРҫмагРҪРёСӮРҪСӢС… взаимРҫРҙРөР№СҒСӮРІРёР№ РҙР»СҸ СҖазРҪСӢС… СҮР°СҒСӮРёСҶ, РІС…РҫРҙСҸСүРёС… РІ РҫРҙРёРҪ Рё СӮРҫСӮ Р¶Рө РёР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ РјСғР»СҢСӮРёРҝР»РөСӮ, Рё РҫРұСғСҒР»РҫвливаРөСӮ СҖазлиСҮРёРө РІ РёС… РјР°СҒСҒах. В РӣРёСӮ. СҒРј. РҝСҖРё СҒСӮ . РӯР»РөРјРөРҪСӮР°СҖРҪСӢРө СҮР°СҒСӮРёСҶСӢ . В РЎ. РЎ. Р“РөСҖСҲСӮРөР№РҪ. РҳР·РҫСӮРҫРҝРёСҮРөСҒРәРёР№ СҒРҝРёРҪ РҳР·РҫСӮРҫРҝРё'СҮРөСҒРәРёР№ СҒРҝРёРҪ,РҫРҙРҪР° РёР· С…Р°СҖР°РәСӮРөСҖРёСҒСӮРёРә СҒРёР»СҢРҪРҫ взаимРҫРҙРөР№СҒСӮРІСғСҺСүРёС… СҮР°СҒСӮРёСҶ, РҫРҝСҖРөРҙРөР»СҸСҺСүР°СҸ (РІРјРөСҒСӮРө СҒ РҙСҖСғРіРёРјРё С…Р°СҖР°РәСӮРөСҖРёСҒСӮРёРәами - РјР°СҒСҒРҫР№, СҒРҝРёРҪРҫРј , РұР°СҖРёРҫРҪРҪСӢРј Р·Р°СҖСҸРҙРҫРј ) РөРө РҝСҖРёРҪР°РҙР»РөР¶РҪРҫСҒСӮСҢ Рә РіСҖСғРҝРҝРө СҮР°СҒСӮРёСҶ СҒ РұлизРәРёРјРё СҒРІРҫР№СҒСӮвами (РҪРҫ СҖазРҪСӢРјРё СҚР»РөРәСӮСҖРёСҮРөСҒРәРёРјРё Р·Р°СҖСҸРҙами), РҫРҙРёРҪР°РәРҫРІСӢРј РҫРұСҖазРҫРј СғСҮР°СҒСӮРІСғСҺСүРёС… РІ СҒРёР»СҢРҪСӢС… взаимРҫРҙРөР№СҒСӮРІРёСҸС… . РЎРј. РҳР·РҫСӮРҫРҝРёСҮРөСҒРәР°СҸ РёРҪРІР°СҖРёР°РҪСӮРҪРҫСҒСӮСҢ. РҳР·РҫСӮРҫРҝРҪСӢРө РёРҪРҙРёРәР°СӮРҫСҖСӢ РҳР·РҫСӮРҫ'РҝРҪСӢРө РёРҪРҙРёРәР°'СӮРҫСҖСӢ,РІРөСүРөСҒСӮРІР°, РёРјРөСҺСүРёРө РҫСӮлиСҮРҪСӢР№ РҫСӮ РҝСҖРёСҖРҫРҙРҪРҫРіРҫ РёР·РҫСӮРҫРҝРҪСӢР№ СҒРҫСҒСӮав Рё РұлагРҫРҙР°СҖСҸ СҚСӮРҫРјСғ РёСҒРҝРҫР»СҢР·СғРөРјСӢРө РІ РәР°СҮРөСҒСӮРІРө РјРөСӮРәРё РҝСҖРё РёР·СғСҮРөРҪРёРё СҒамСӢС… СҖазРҪРҫРҫРұСҖазРҪСӢС… РҝСҖРҫСҶРөСҒСҒРҫРІ. Р РҫР»СҢ РёР·РҫСӮРҫРҝРҪРҫР№ РјРөСӮРәРё РІСӢРҝРҫР»РҪСҸСҺСӮ СҒСӮР°РұРёР»СҢРҪСӢРө или СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢРө РёР·РҫСӮРҫРҝСӢ С…РёРјРёСҮРөСҒРәРёС… СҚР»РөРјРөРҪСӮРҫРІ, РәРҫСӮРҫСҖСӢРө Р»РөРіРәРҫ РјРҫРіСғСӮ РұСӢСӮСҢ РҫРұРҪР°СҖСғР¶РөРҪСӢ Рё РҫРҝСҖРөРҙРөР»РөРҪСӢ РәРҫлиСҮРөСҒСӮРІРөРҪРҪРҫ. Р’СӢСҒРҫРәР°СҸ СҮСғРІСҒСӮРІРёСӮРөР»СҢРҪРҫСҒСӮСҢ Рё СҒРҝРөСҶифиСҮРҪРҫСҒСӮСҢ Рҳ. Рё. РҝРҫР·РІРҫР»СҸСҺСӮ РҝСҖРҫСҒР»РөРҙРёСӮСҢ Р·Р° РҪРёРјРё РІ СҒР»РҫР¶РҪСӢС… РҝСҖРҫСҶРөСҒСҒах РҝРөСҖРөРјРөСүРөРҪРёСҸ, СҖР°СҒРҝСҖРөРҙРөР»РөРҪРёСҸ Рё РҝСҖРөРІСҖР°СүРөРҪРёСҸ РІРөСүРөСҒСӮРІ РІ СҒРәРҫР»СҢ СғРіРҫРҙРҪРҫ СҒР»РҫР¶РҪСӢС… СҒРёСҒСӮРөмах, РІ СӮРҫРј СҮРёСҒР»Рө Рё РІ живСӢС… РҫСҖРіР°РҪизмах. В РңРөСӮРҫРҙ Рҳ. Рё. (РҪазСӢРІР°РөСӮСҒСҸ СӮР°РәР¶Рө РјРөСӮРҫРҙРҫРј РјРөСҮРөРҪСӢС… Р°СӮРҫРјРҫРІ) РұСӢР» РІРҝРөСҖРІСӢРө РҝСҖРөРҙР»РҫР¶РөРҪ Р”. РҘРөРІРөСҲРё Рё РӨ. РҹР°РҪРөСӮРҫРј РІ 1913. РЁРёСҖРҫРәРҫРө РёСҒРҝРҫР»СҢР·РҫРІР°РҪРёРө Рҳ. Рё. СҒСӮалРҫ РІРҫР·РјРҫР¶РҪСӢРј РұлагРҫРҙР°СҖСҸ СҖазвиСӮРёСҺ СҸРҙРөСҖРҪРҫР№ СӮРөС…РҪРёРәРё, РҝРҫР·РІРҫливСҲРөР№ РҝРҫР»СғСҮР°СӮСҢ РёР·РҫСӮРҫРҝСӢ РІ РјР°СҒСҒРҫРІРҫРј РјР°СҒСҲСӮР°РұРө. В РңРөСӮРҫРҙ Рҳ. Рё. РҫСҒРҪРҫРІР°РҪ РҪР° СӮРҫРј, СҮСӮРҫ С…РёРјРёСҮРөСҒРәРёРө СҒРІРҫР№СҒСӮРІР° СҖазРҪСӢС… РёР·РҫСӮРҫРҝРҫРІ РҫРҙРҪРҫРіРҫ СҚР»РөРјРөРҪСӮР° РҝРҫСҮСӮРё РҫРҙРёРҪР°РәРҫРІСӢ (РұлагРҫРҙР°СҖСҸ СҮРөРјСғ РҝРҫРІРөРҙРөРҪРёРө РјРөСҮРөРҪСӢС… Р°СӮРҫРјРҫРІ РІ РёР·СғСҮР°РөРјСӢС… РҝСҖРҫСҶРөСҒСҒах РҝСҖР°РәСӮРёСҮРөСҒРәРё РҪРө РҫСӮлиСҮР°РөСӮСҒСҸ РҫСӮ РҝРҫРІРөРҙРөРҪРёСҸ РҙСҖСғРіРёС… Р°СӮРҫРјРҫРІ СӮРҫРіРҫ Р¶Рө СҚР»РөРјРөРҪСӮР°), Рё РҪР° лёгРәРҫСҒСӮРё РҫРұРҪР°СҖСғР¶РөРҪРёСҸ РёР·РҫСӮРҫРҝРҫРІ, РҫСҒРҫРұРөРҪРҪРҫ СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢС…. РҹСҖРё РёСҒРҝРҫР»СҢР·РҫРІР°РҪРёРё РјРөСӮРҫРҙР° РҪРөРҫРұС…РҫРҙРёРј СғСҮС‘СӮ РІРҫР·РјРҫР¶РҪСӢС… СҖРөР°РәСҶРёР№ РёР·РҫСӮРҫРҝРҪРҫРіРҫ РҫРұРјРөРҪР° , РҝСҖРёРІРҫРҙСҸСүРёС… Рә РҝРөСҖРөСҖР°СҒРҝСҖРөРҙРөР»РөРҪРёСҺ РјРөСҮРөРҪСӢС… Р°СӮРҫРјРҫРІ (СҒР»РөРҙРҫРІР°СӮРөР»СҢРҪРҫ, Рә РҝРҫСӮРөСҖРө СҒРҫРөРҙРёРҪРөРҪРёРөРј РјРөСӮРәРё), Р° РёРҪРҫРіРҙР° Рё СғСҮС‘СӮ СҖР°РҙРёР°СҶРёРҫРҪРҪСӢС… СҚффРөРәСӮРҫРІ, СҒРІСҸР·Р°РҪРҪСӢС… СҒ влиСҸРҪРёРөРј СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢС… РёР·Р»СғСҮРөРҪРёР№ РҪР° С…РҫРҙ РҝСҖРҫСҶРөСҒСҒР°. РҳР·РҫСӮРҫРҝ, РёСҒРҝРҫР»СҢР·СғРөРјСӢР№ РІ РәР°СҮРөСҒСӮРІРө РјРөСӮРәРё, РІРІРҫРҙРёСӮСҒСҸ РІ СҒРҫСҒСӮав РёР·СғСҮР°РөРјСӢС… СҒРҫРөРҙРёРҪРөРҪРёР№. РңРҫРіСғСӮ РұСӢСӮСҢ РёСҒРҝРҫР»СҢР·РҫРІР°РҪСӢ РәР°Рә СҒСӮР°РұРёР»СҢРҪСӢРө, СӮР°Рә Рё СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢРө РёР·РҫСӮРҫРҝСӢ. В РҹСҖРөРёРјСғСүРөСҒСӮРІРҫ СҒСӮР°РұРёР»СҢРҪСӢС… РёР·РҫСӮРҫРҝРҫРІ - РёС… СғСҒСӮРҫР№СҮРёРІРҫСҒСӮСҢ Рё РҫСӮСҒСғСӮСҒСӮРІРёРө СҸРҙРөСҖРҪСӢС… РёР·Р»СғСҮРөРҪРёР№. РһРҙРҪР°РәРҫ СӮРҫР»СҢРәРҫ РҪРөРұРҫР»СҢСҲРҫРө СҮРёСҒР»Рҫ СҚР»РөРјРөРҪСӮРҫРІ РёРјРөРөСӮ РҝРҫРҙС…РҫРҙСҸСүРёРө СҒСӮР°РұРёР»СҢРҪСӢРө РёР·РҫСӮРҫРҝСӢ. РңалаСҸ РҙРҫСҒСӮСғРҝРҪРҫСҒСӮСҢ РҝРҫСҒР»РөРҙРҪРёС… Рё СҒСҖавРҪРёСӮРөР»СҢРҪРҫ СҒР»РҫР¶РҪР°СҸ СӮРөС…РҪРёРәР° РҫРұРҪР°СҖСғР¶РөРҪРёСҸ СҒРҫСҒСӮавлСҸСҺСӮ РҪРөРҙРҫСҒСӮР°СӮРәРё РјРөСӮРҫРҙР° Рҳ. Рё. СҒ РҝСҖРёРјРөРҪРөРҪРёРөРј СҒСӮР°РұРёР»СҢРҪСӢС… РёР·РҫСӮРҫРҝРҫРІ. РҹСҖРөРёРјСғСүРөСҒСӮРІРҫ СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢС… РёР·РҫСӮРҫРҝРҫРІ - РІРҫР·РјРҫР¶РҪРҫСҒСӮСҢ РёС… РҝРҫР»СғСҮРөРҪРёСҸ РҝСҖР°РәСӮРёСҮРөСҒРәРё РҙР»СҸ РІСҒРөС… СҚР»РөРјРөРҪСӮРҫРІ РҝРөСҖРёРҫРҙРёСҮРөСҒРәРҫР№ СҒРёСҒСӮРөРјСӢ, РІСӢСҒРҫРәР°СҸ СҮСғРІСҒСӮРІРёСӮРөР»СҢРҪРҫСҒСӮСҢ, СҒРҝРөСҶифиСҮРҪРҫСҒСӮСҢ Рё СӮРҫСҮРҪРҫСҒСӮСҢ РҫРҝСҖРөРҙРөР»РөРҪРёСҸ, РҝСҖРҫСҒСӮРҫСӮР° Рё РҙРҫСҒСӮСғРҝРҪРҫСҒСӮСҢ РёР·РјРөСҖРёСӮРөР»СҢРҪРҫР№ Р°РҝРҝР°СҖР°СӮСғСҖСӢ. РҹРҫСҚСӮРҫРјСғ РұРҫР»СҢСҲРёРҪСҒСӮРІРҫ РёСҒСҒР»РөРҙРҫРІР°РҪРёР№, РёСҒРҝРҫР»СҢР·СғСҺСүРёС… РјРөСӮРҫРҙ Рҳ. Рё., РІСӢРҝРҫР»РҪРөРҪРҫ СҒ СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢРјРё РёР·РҫСӮРҫРҝами. В РўР°РәРёРө СҚР»РөРјРөРҪСӮСӢ, РәР°Рә РІРҫРҙРҫСҖРҫРҙ, СғРіР»РөСҖРҫРҙ, СҒРөСҖР°, С…Р»РҫСҖ, СҒРІРёРҪРөСҶ, РёРјРөСҺСӮ СғРҙРҫРұРҪСӢРө РҙР»СҸ РёСҒРҝРҫР»СҢР·РҫРІР°РҪРёСҸ РәР°Рә СҒСӮР°РұРёР»СҢРҪСӢРө - 2H, 13C, 34S, 35Cl, 37Cl, 204Р Р¬, СӮР°Рә Рё СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢРө РёР·РҫСӮРҫРҝСӢ - 3H, 11C, 14C, 35S, 36C1, 212Р Р¬. Р’ РәР°СҮРөСҒСӮРІРө РёР·РҫСӮРҫРҝРҫРІ азРҫСӮР° Рё РәРёСҒР»РҫСҖРҫРҙР° СҮР°СүРө РІСҒРөРіРҫ РҝСҖРёРјРөРҪСҸСҺСӮСҒСҸ СҒСӮР°РұРёР»СҢРҪСӢРө 15N Рё 18O Рё РҙСҖСғРіРёРө. РЎСӮР°РұРёР»СҢРҪСӢРө Рҳ. Рё. РҝРҫР»СғСҮР°СҺСӮ РҫРұРҫРіР°СүРөРҪРёРөРј РҝСҖРёСҖРҫРҙРҪСӢС… РёР·РҫСӮРҫРҝРҪСӢС… СҒРјРөСҒРөР№ РҝСғСӮём РјРҪРҫРіРҫРәСҖР°СӮРҪРҫРіРҫ РҝРҫРІСӮРҫСҖРөРҪРёСҸ РҫРҝРөСҖР°СҶРёРё СҖазРҙРөР»РөРҪРёСҸ (РҝРөСҖРөРіРҫРҪРәР°, РҙиффСғР·РёСҸ, СӮРөСҖРјРҫРҙиффСғР·РёСҸ, РёР·РҫСӮРҫРҝРҪСӢР№ РҫРұРјРөРҪ, СҚР»РөРәСӮСҖРҫлиз; СҒРј. РҳР·РҫСӮРҫРҝРҫРІ СҖазРҙРөР»РөРҪРёРө ), Р° СӮР°РәР¶Рө РҪР° РјР°СҒСҒ-СҒРҝРөРәСӮСҖРҫРјРөСӮСҖРёСҮРөСҒРәРёС… СғСҒСӮР°РҪРҫРІРәах Рё РҝСҖРё СҸРҙРөСҖРҪСӢС… СҖРөР°РәСҶРёСҸС….  ДлСҸ СҚР»РөРјРөРҪСӮРҫРІ, СҒСғСүРөСҒСӮРІСғСҺСүРёС… РІ РҝСҖРёСҖРҫРҙРө РІ РІРёРҙРө РҫРҙРҪРҫРіРҫ РёР·РҫСӮРҫРҝР° (Be, F, Na, Al, P, I), РІ РәР°СҮРөСҒСӮРІРө РјРөСҮРөРҪСӢС… Р°СӮРҫРјРҫРІ РёСҒРҝРҫР»СҢР·СғСҺСӮ СӮРҫР»СҢРәРҫ РёСҒРәСғСҒСҒСӮРІРөРҪРҪСӢРө СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢРө РёР·РҫСӮРҫРҝСӢ; РҝСҖРёРјРөСҖРҫРј СҮР°СҒСӮРҫ РҝСҖРёРјРөРҪСҸРөРјСӢС… СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢС… РёР·РҫСӮРҫРҝРҫРІ СҒР»СғжаСӮ 3H, 14C, 32P, 35S, 45Ca, 51Cr, 59Fe, 60Co, 89Sr, 95Nb, 110Ag, 131I Рё РҙСҖ. Р’СӢРұРҫСҖ СҖР°РҙРёРҫР°РәСӮРёРІРҪРҫРіРҫ РёР·РҫСӮРҫРҝР° РҫРҝСҖРөРҙРөР»СҸРөСӮСҒСҸ РөРіРҫ СҸРҙРөСҖРҪСӢРјРё С…Р°СҖР°РәСӮРөСҖРёСҒСӮРёРәами - РҝРөСҖРёРҫРҙРҫРј РҝРҫР»СғСҖР°СҒРҝР°РҙР°, СӮРёРҝРҫРј Рё СҚРҪРөСҖРіРёРөР№ РёР·Р»СғСҮРөРҪРёСҸ. ДлСҸ РёРҪРҙРёРәР°СҶРёРё РҝСҖРёРіРҫРҙРҪСӢ СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢРө РёР·РҫСӮРҫРҝСӢ, РҝРөСҖРёРҫРҙ РҝРҫР»СғСҖР°СҒРҝР°РҙР° РәРҫСӮРҫСҖСӢС… РҪРө РҫСҮРөРҪСҢ мал, СҮСӮРҫ РҝРҫР·РІРҫР»СҸРөСӮ СҖР°РұРҫСӮР°СӮСҢ РІ СӮРөСҮРөРҪРёРө РІСҖРөРјРөРҪРё, РҪРөРҫРұС…РҫРҙРёРјРҫРіРҫ РҙР»СҸ СҚРәСҒРҝРөСҖРёРјРөРҪСӮР°, РҪРҫ Рё РҪРө РҫСҮРөРҪСҢ РІРөлиРә, СҮСӮРҫ РҙаёСӮ РІРҫР·РјРҫР¶РҪРҫСҒСӮСҢ СҖР°РұРҫСӮР°СӮСҢ СҒ РІРөСҒСҢРјР° малСӢРјРё РәРҫлиСҮРөСҒСӮвами РёРҪРҙРёРәР°СӮРҫСҖР°. В РһСҒРҪРҫРІРҪСӢРј РјРөСӮРҫРҙРҫРј Р°РҪализа СҒСӮР°РұРёР»СҢРҪСӢС… РёР·РҫСӮРҫРҝРҫРІ СҒР»СғжиСӮ РјР°СҒСҒ-СҒРҝРөРәСӮСҖРҫРјРөСӮСҖРёСҸ (СҮСғРІСҒСӮРІРёСӮРөР»СҢРҪРҫСҒСӮСҢ 10 -4% РёР·РҫСӮРҫРҝР° РҝСҖРё СӮРҫСҮРҪРҫСҒСӮРё 0,1-1% РҙР»СҸ РҝСҖРҫРұ РјР°СҒСҒРҫР№ РІ РҙРҫли РјРі) .Р’СҒС‘ РұРҫР»СҢСҲРөРө РҝСҖРёРјРөРҪРөРҪРёРө РҪахРҫРҙСҸСӮ СҒРҝРөРәСӮСҖалСҢРҪСӢРө РјРөСӮРҫРҙСӢ Рё РҝР°СҖамагРҪРёСӮРҪСӢР№ СҖРөР·РҫРҪР°РҪСҒ. Р”РөР№СӮРөСҖРёР№, 18O Рё РҪРөРәРҫСӮРҫСҖСӢРө РҙСҖСғРіРёРө РёР·РҫСӮРҫРҝСӢ РҫРҝСҖРөРҙРөР»СҸСҺСӮ РҝРҫ РёР·РјРөРҪРөРҪРёСҺ РҝРҫРәазаСӮРөР»СҸ РҝСҖРөР»РҫРјР»РөРҪРёСҸ, СӮРөРҝР»РҫРҝСҖРҫРІРҫРҙРҪРҫСҒСӮРё, РҝР»РҫСӮРҪРҫСҒСӮРё РәР°Рә СҒамРҫРіРҫ СҚР»РөРјРөРҪСӮР°СҖРҪРҫРіРҫ РІРөСүРөСҒСӮРІР°, СӮР°Рә Рё РөРіРҫ СҒРҫРөРҙРёРҪРөРҪРёР№. Р Р°РҙРёРҫР°РәСӮРёРІРҪСӢРө РёР·РҫСӮРҫРҝСӢ РҫРҝСҖРөРҙРөР»СҸСҺСӮ РҝРҫ РёС… РёР·Р»СғСҮРөРҪРёСҺ РҝСҖРё РҝРҫРјРҫСүРё СҒСҮС‘СӮСҮРёРәРҫРІ Р“РөР№РіРөСҖР° или СҒСҶРёРҪСӮиллСҸСҶРёРҫРҪРҪСӢС… СҒСҮС‘СӮСҮРёРәРҫРІ. РўР°Рә, СҒ РҝРҫРјРҫСүСҢСҺ СҒСҮРөСӮСҮРёРәР° Р“РөР№РіРөСҖР° РјРҫР¶РҪРҫ СғР»РҫРІРёСӮСҢ РёР·Р»СғСҮРөРҪРёРө 10 -11 РіСғРіР»РөСҖРҫРҙР° 14C, 10 -16 РіС„РҫСҒС„РҫСҖР° 32Р Рё РёРҫРҙР° 131I, 10 -19 РіСғРіР»РөСҖРҫРҙР° 11C Рё СӮ. Рҙ. РЎРҫРІСҖРөРјРөРҪРҪСӢРө жиРҙРәРҫСҒСӮРҪСӢРө СҒСҶРёРҪСӮиллСҸСҶРёРҫРҪРҪСӢРө СҒСҮС‘СӮСҮРёРәРё РҝРҫР·РІРҫР»СҸСҺСӮ СҒ РІСӢСҒРҫРәРҫР№ СҚффРөРәСӮРёРІРҪРҫСҒСӮСҢСҺ Рё СӮРҫСҮРҪРҫСҒСӮСҢСҺ РҝСҖРҫРІРҫРҙРёСӮСҢ РҫРҝСҖРөРҙРөР»РөРҪРёРө РёР·РҫСӮРҫРҝРҫРІ СҒ РјСҸРіРәРёРј РұРөСӮР°-РёР·Р»СғСҮРөРҪРёРөРј ( 3H, 14C, 35S Рё РҙСҖ.). Р’РІРөРҙРөРҪРёРө РІ РҝСҖР°РәСӮРёРәСғ СҚСӮРҫРіРҫ РјРөСӮРҫРҙР° РёР·РҫСӮРҫРҝРҪРҫРіРҫ Р°РҪализа РҝРҫРІСӢСҲР°РөСӮ РөРіРҫ РҝСҖРҫРёР·РІРҫРҙРёСӮРөР»СҢРҪРҫСҒСӮСҢ Рё РҝРҫР·РІРҫР»СҸРөСӮ СҖР°РұРҫСӮР°СӮСҢ СҒ РҪРөР·РҪР°СҮРёСӮРөР»СҢРҪСӢРјРё Р°РәСӮРёРІРҪРҫСҒСӮСҸРјРё, РҝСҖРёРұлижаСҺСүРёРјРёСҒСҸ Рә Р°РәСӮРёРІРҪРҫСҒСӮРё РәРҫСҒРјРёСҮРөСҒРәРҫРіРҫ С„РҫРҪР°. РЁРёСҖРҫРәРҫРө РҝСҖРёРјРөРҪРөРҪРёРө РІ РұРёРҫР»РҫРіРёРё РҝРҫР»СғСҮРёР» РјРөСӮРҫРҙ авСӮРҫСҖР°РҙРёРҫРіСҖафии. РҹСҖРё СҖР°РұРҫСӮРө СҒ СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢРјРё РёР·РҫСӮРҫРҝами РҪРөРҫРұС…РҫРҙРёРјРҫ СҒРҫРұР»СҺРҙР°СӮСҢ РҝСҖавила СӮРөС…РҪРёРәРё РұРөР·РҫРҝР°СҒРҪРҫСҒСӮРё РІ СҒРҫРҫСӮРІРөСӮСҒСӮРІРёРё СҒ СҒСғСүРөСҒСӮРІСғСҺСүРёРјРё РҪРҫСҖмами. В РҳР·РІРөСҒСӮРҪСӢ СҖазлиСҮРҪСӢРө СҒРҝРҫСҒРҫРұСӢ СҒРёРҪСӮРөР·Р° РјРөСҮРөРҪСӢС… СҒРҫРөРҙРёРҪРөРҪРёР№ . РқР°СҖСҸРҙСғ СҒ РҫРұСӢСҮРҪСӢРј С…РёРјРёСҮРөСҒРәРёРј СҒРёРҪСӮРөР·РҫРј РёСҒРҝРҫР»СҢР·СғСҺСӮСҒСҸ СҖРөР°РәСҶРёРё РёР·РҫСӮРҫРҝРҪРҫРіРҫ РҫРұРјРөРҪР° Рё РұРёРҫР»РҫРіРёСҮРөСҒРәРёР№ СҒРёРҪСӮРөР·. Р’ РұРҫР»СҢСҲРёРҪСҒСӮРІРө СҒР»СғСҮР°РөРІ РёР·РҫСӮРҫРҝРҪР°СҸ РјРөСӮРәР° Р·Р°РҪРёРјР°РөСӮ РҫРҝСҖРөРҙРөлёРҪРҪРҫРө РҝРҫР»РҫР¶РөРҪРёРө РІ РјРҫР»РөРәСғР»Рө; РҪР°РҝСҖРёРјРөСҖ, РҝСҖРҫРҝРёРҫРҪРҫРІСғСҺ РәРёСҒР»РҫСӮСғ РјРҫР¶РҪРҫ РҝРҫРјРөСӮРёСӮСҢ РҝРҫ СғРіР»РөСҖРҫРҙСғ СӮСҖРөРјСҸ СҒРҝРҫСҒРҫРұами: 14CH 3CH 2COOH, РЎРқ 3 14РЎРқ 2РЎРһРһРқ, РЎРқ 3РЎРқ 2 14РЎРһРһРқ. В РҳРјРөСҺСӮСҒСҸ СӮСҖРё РҫСҒРҪРҫРІРҪСӢС… РҪР°РҝСҖавлРөРҪРёСҸ РёСҒРҝРҫР»СҢР·РҫРІР°РҪРёСҸ Рҳ. Рё. РңРөСӮРҫРҙРҫРј Рҳ. Рё. РёР·СғСҮР°СҺСӮ С…Р°СҖР°РәСӮРөСҖ СҖР°СҒРҝСҖРөРҙРөР»РөРҪРёСҸ РІРөСүРөСҒСӮРІ Рё РҝСғСӮРё РёС… РҝРөСҖРөРјРөСүРөРҪРёСҸ. Рҳ. Рё. РІРІРҫРҙСҸСӮ РІ СӮСғ или РёРҪСғСҺ СҒРёСҒСӮРөРјСғ Рё СҮРөСҖРөР· РҫРҝСҖРөРҙРөлёРҪРҪСӢРө РҝСҖРҫРјРөР¶СғСӮРәРё РІСҖРөРјРөРҪРё СғСҒСӮР°РҪавливаСҺСӮ РҪалиСҮРёРө Рҳ. Рё. РІ СҖазлиСҮРҪСӢС… СҮР°СҒСӮСҸС… СҒРёСҒСӮРөРјСӢ. РқаиРұРҫР»РөРө РҪаглСҸРҙРҪСӢРө РәР°СҖСӮРёРҪСӢ СҖР°СҒРҝСҖРөРҙРөР»РөРҪРёСҸ РҝРҫР»СғСҮР°СҺСӮСҒСҸ РұРөР· СҖазСҖСғСҲРөРҪРёСҸ РҫРұСҖазСҶР° РҝСҖРё РҝРҫРјРҫСүРё СҖР°РҙРёРҫавСӮРҫРіСҖамм (СҒРј. РҗРІСӮРҫСҖР°РҙРёРҫРіСҖафиСҸ ). В Р”СҖСғРіРҫРө РҪР°РҝСҖавлРөРҪРёРө РёСҒРҝРҫР»СҢР·РҫРІР°РҪРёСҸ Рҳ. Рё. - РәРҫлиСҮРөСҒСӮРІРөРҪРҪСӢР№ Р°РҪализ. РһРҙРёРҪ РёР· СҒамСӢС… РҝСҖРҫСҒСӮСӢС… Рё СҖР°СҒРҝСҖРҫСҒСӮСҖР°РҪС‘РҪРҪСӢС… РІР°СҖРёР°РҪСӮРҫРІ РјРөСӮРҫРҙР° Рҳ. Рё. - РјРөСӮРҫРҙ РёР·РҫСӮРҫРҝРҪРҫРіРҫ СҖазРұавлРөРҪРёСҸ, РҝСҖРё РәРҫСӮРҫСҖРҫРј Рә Р°РҪализиСҖСғРөРјРҫРјСғ РІРөСүРөСҒСӮРІСғ РҙРҫРұавлСҸСҺСӮ РҙРҫР·РёСҖРҫРІР°РҪРҪРҫРө РәРҫлиСҮРөСҒСӮРІРҫ Рҳ. Рё. Рё РҝРҫ СҒСӮРөРҝРөРҪРё РөРіРҫ СҖазРұавлРөРҪРёСҸ СҒСғРҙСҸСӮ РҫРұ РёСҒС…РҫРҙРҪРҫРј РәРҫлиСҮРөСҒСӮРІРө РІРөСүРөСҒСӮРІР°. РӯСӮРҫСӮ РјРөСӮРҫРҙ РҝРҫР·РІРҫР»СҸРөСӮ РҝСҖРҫРёР·РІРҫРҙРёСӮСҢ РҫРҝСҖРөРҙРөР»РөРҪРёРө РҪРёСҮСӮРҫР¶РҪРҫ малСӢС… РәРҫлиСҮРөСҒСӮРІ СӮСҖСғРҙРҪРҫРҫРҝСҖРөРҙРөР»СҸРөРјСӢС… РІРөСүРөСҒСӮРІ Рё, РҪР°РҫРұРҫСҖРҫСӮ, РұРҫР»СҢСҲРёС… РјР°СҒСҒ РІРөСүРөСҒСӮРІ; Р°РҪализиСҖРҫРІР°СӮСҢ СҒР»РҫР¶РҪСӢРө СҒРјРөСҒРё, Р°РҪализ Рё СҖазРҙРөР»РөРҪРёРө РәРҫСӮРҫСҖСӢС… РҙСҖСғРіРёРјРё РјРөСӮРҫРҙами РҪРөРІРҫР·РјРҫР¶РҪСӢ. РЁРёСҖРҫРәРёРјРё РІРҫР·РјРҫР¶РҪРҫСҒСӮСҸРјРё РҫСӮлиСҮР°РөСӮСҒСҸ РҝСҖРёРјСӢРәР°СҺСүРёР№ Рә РјРөСӮРҫРҙСғ Рҳ. Рё. Р°РәСӮРёРІР°СҶРёРҫРҪРҪСӢР№ Р°РҪализ , РіРҙРө РјРөСӮРәРҫР№ СҒР»СғжиСӮ РёР·РҫСӮРҫРҝ РҙСҖСғРіРҫРіРҫ СҚР»РөРјРөРҪСӮР°, РҫРұСҖазРҫРІР°РҪРҪСӢР№ РёР· РҙР°РҪРҪРҫРіРҫ РІ СҖРөР·СғР»СҢСӮР°СӮРө СҸРҙРөСҖРҪРҫР№ СҖРөР°РәСҶРёРё. РһСҒРҫРұРөРҪРҪРҫ РұРҫР»СҢСҲРҫРө Р·РҪР°СҮРөРҪРёРө СҚСӮРҫСӮ РјРөСӮРҫРҙ РёРјРөРөСӮ РҝСҖРё РҫРҝСҖРөРҙРөР»РөРҪРёРё РјРёРәСҖРҫСҚР»РөРјРөРҪСӮРҫРІ РІ РјРөСӮаллах, СҒРҝлавах, РјРёРҪРөСҖалах, СӮРәР°РҪСҸС…, РҝСҖРё РұСӢСҒСӮСҖРҫРј РәРҫРҪСӮСҖРҫР»Рө СӮРөС…РҪРҫР»РҫРіРёСҮРөСҒРәРёС… РҝСҖРҫСҶРөСҒСҒРҫРІ. РҡРҫлиСҮРөСҒСӮРІРөРҪРҪСӢР№ Р°РҪализ РҝСҖРёСҖРҫРҙРҪСӢС… РёР·РҫСӮРҫРҝРҫРІ, РІС…РҫРҙСҸСүРёС… РІ РөСҒСӮРөСҒСӮРІРөРҪРҪСӢРө СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢРө СҖСҸРҙСӢ СғСҖР°РҪР° Рё СӮРҫСҖРёСҸ, Р° СӮР°РәР¶Рө РәРҫлиСҮРөСҒСӮРІРөРҪРҪРҫРө РҫРҝСҖРөРҙРөР»РөРҪРёРө РёР·РҫСӮРҫРҝР° 14C РІ СғРјРөСҖСҲРёС… РҫСҖРіР°РҪизмах РҝРҫР·РІРҫР»СҸСҺСӮ РҫРҝСҖРөРҙРөР»СҸСӮСҢ РІРҫР·СҖР°СҒСӮ РіРҫСҖРҪСӢС… РҝРҫСҖРҫРҙ Рё Р°СҖС…РөРҫР»РҫРіРёСҮРөСҒРәРёС… РҪахРҫРҙРҫРә. В РўСҖРөСӮСҢРёРј РҪР°РҝСҖавлРөРҪРёРөРј РёСҒРҝРҫР»СҢР·РҫРІР°РҪРёСҸ Рҳ. Рё. СҸРІР»СҸРөСӮСҒСҸ РІСӢСҸСҒРҪРөРҪРёРө РјРөС…Р°РҪРёР·РјР° СҖазлиСҮРҪСӢС… РҝСҖРҫСҶРөСҒСҒРҫРІ Рё РёР·СғСҮРөРҪРёРө СҒСӮСҖРҫРөРҪРёСҸ С…РёРјРёСҮРөСҒРәРёС… СҒРҫРөРҙРёРҪРөРҪРёР№. Р’РІРөРҙРөРҪРёРө РёР·РҫСӮРҫРҝРҪРҫР№ РјРөСӮРәРё РІ РҫРҝСҖРөРҙРөлёРҪРҪРҫРө РҝРҫР»РҫР¶РөРҪРёРө РјРҫР»РөРәСғР»СӢ СғСҒСӮСҖР°РҪСҸРөСӮ С…РёРјРёСҮРөСҒРәСғСҺ РҪРөСҖазлиСҮРёРјРҫСҒСӮСҢ Р°СӮРҫРјРҫРІ, РҙРҫРҝСғСҒРәР°СҸ РІРҫР·РјРҫР¶РҪРҫСҒСӮСҢ РҫРҙРҪРҫР·РҪР°СҮРҪРҫРіРҫ РІСӢСҸСҒРҪРөРҪРёСҸ РјРөС…Р°РҪРёР·РјР° СӮРөС… или РёРҪСӢС… СҖРөР°РәСҶРёР№, РҙР»СҸ РәРҫСӮРҫСҖСӢС… РҫРұСӢСҮРҪСӢРө С…РёРјРёСҮРөСҒРәРёРө РјРөСӮРҫРҙСӢ РҫРҝРёСҒСӢРІР°СҺСӮ СӮРҫР»СҢРәРҫ РҪР°СҮалСҢРҪРҫРө Рё РәРҫРҪРөСҮРҪРҫРө СҒРҫСҒСӮРҫСҸРҪРёСҸ. В Р’СҒРө СғРәазаРҪРҪСӢРө РҪР°РҝСҖавлРөРҪРёСҸ РҝСҖРёРјРөРҪРөРҪРёСҸ Рҳ. Рё. СҲРёСҖРҫРәРҫ РҝСҖРөРҙСҒСӮавлРөРҪСӢ РІ СҖазлиСҮРҪСӢС… РҫРұлаСҒСӮСҸС… С…РёРјРёРё, РұРёРҫР»РҫРіРёРё, РјРөРҙРёСҶРёРҪСӢ, СӮРөС…РҪРёРәРё, СҒРөР»СҢСҒРәРҫРіРҫ С…РҫР·СҸР№СҒСӮРІР° Рё СӮ. Рҙ. РқРёР¶Рө РҝСҖРёРІРҫРҙСҸСӮСҒСҸ РҫСӮРҙРөР»СҢРҪСӢРө РҝСҖРёРјРөСҖСӢ РёС… РёСҒРҝРҫР»СҢР·РҫРІР°РҪРёСҸ. В РӣРёСӮ.:Р Р°РҙРёРҫР°РәСӮРёРІРҪСӢРө РёР·РҫСӮРҫРҝСӢ РІ С…РёРјРёСҮРөСҒРәРёС… РёСҒСҒР»РөРҙРҫРІР°РҪРёСҸС…, Рӣ. - Рң., 1965; Р РҫРіРёРҪСҒРәРёР№ РЎ. Р—., РўРөРҫСҖРөСӮРёСҮРөСҒРәРёРө РҫСҒРҪРҫРІСӢ РёР·РҫСӮРҫРҝРҪСӢС… РјРөСӮРҫРҙРҫРІ РёР·СғСҮРөРҪРёСҸ С…РёРјРёСҮРөСҒРәРёС… СҖРөР°РәСҶРёР№, Рң., 1956; РҜРҙРөСҖРҪРҫфизиСҮРөСҒРәРёРө РјРөСӮРҫРҙСӢ Р°РҪализа РІРөСүРөСҒСӮРІ, Рң., 1971 (Р’СҒРөСҒРҫСҺР·РҪР°СҸ РҪР°СғСҮРҪРҫ-СӮРөС…РҪРёСҮРөСҒРәР°СҸ РәРҫРҪС„РөСҖРөРҪСҶРёСҸ В«XX Р»РөСӮ РҝСҖРҫРёР·РІРҫРҙСҒСӮРІР° Рё РҝСҖРёРјРөРҪРөРҪРёСҸ РёР·РҫСӮРҫРҝРҫРІ Рё РёСҒСӮРҫСҮРҪРёРәРҫРІ СҸРҙРөСҖРҪСӢС… РёР·Р»СғСҮРөРҪРёР№ РІ РҪР°СҖРҫРҙРҪРҫРј С…РҫР·СҸР№СҒСӮРІРө РЎРЎРЎР В», РңРёРҪСҒРә, 1968). В Рҡ. Р‘. Р—Р°РұРҫСҖРөРҪРәРҫ.
В Р’ РұРёРҫР»РҫРіРёРё Рҳ. Рё. РҝСҖРёРјРөРҪСҸСҺСӮ РҙР»СҸ СҖРөСҲРөРҪРёСҸ РәР°Рә С„СғРҪРҙамРөРҪСӮалСҢРҪСӢС…, СӮР°Рә Рё РҝСҖРёРәлаРҙРҪСӢС… РұРёРҫР»РҫРіРёСҮРөСҒРәРёС… РҝСҖРҫРұР»РөРј, РёР·СғСҮРөРҪРёРө РәРҫСӮРҫСҖСӢС… РҙСҖСғРіРёРјРё РјРөСӮРҫРҙами Р·Р°СӮСҖСғРҙРҪРөРҪРҫ или РҪРөРІРҫР·РјРҫР¶РҪРҫ. РЎСғСүРөСҒСӮРІРөРҪРҪРҫРө РҙР»СҸ РұРёРҫР»РҫРіРёРё РҝСҖРөРёРјСғСүРөСҒСӮРІРҫ РјРөСӮРҫРҙР° РјРөСҮРөРҪСӢС… Р°СӮРҫРјРҫРІ СҒРҫСҒСӮРҫРёСӮ РІ СӮРҫРј, СҮСӮРҫ РёСҒРҝРҫР»СҢР·РҫРІР°РҪРёРө Рҳ. Рё. РҪРө РҪР°СҖСғСҲР°РөСӮ СҶРөР»РҫСҒСӮРҪРҫСҒСӮРё РҫСҖРіР°РҪРёР·РјР° Рё РөРіРҫ РҫСҒРҪРҫРІРҪСӢС… жизРҪРөРҪРҪСӢС… РҫСӮРҝСҖавлРөРҪРёР№. РЎ РҝСҖРёРјРөРҪРөРҪРёРөРј Рҳ. Рё. СҒРІСҸР·Р°РҪСӢ РјРҪРҫРіРёРө РәСҖСғРҝРҪСӢРө РҙРҫСҒСӮРёР¶РөРҪРёСҸ СҒРҫРІСҖРөРјРөРҪРҪРҫР№ РұРёРҫР»РҫРіРёРё, РҫРҝСҖРөРҙРөливСҲРёРө СҖР°СҒСҶРІРөСӮ РұРёРҫР»РҫРіРёСҮРөСҒРәРёС… РҪР°СғРә РІРҫВ 2-Р№ РҝРҫР»РҫРІРёРҪРө 20 РІ. РЎ РҝРҫРјРҫСүСҢСҺ СҒСӮР°РұРёР»СҢРҪСӢС… Рё СҖР°РҙРёРҫР°РәСӮРёРІРҪСӢС… РёР·РҫСӮРҫРҝРҫРІ РІРҫРҙРҫСҖРҫРҙР° ( 2H Рё 3H), СғРіР»РөСҖРҫРҙР° ( 13C Рё 14C), азРҫСӮР° ( 15N), РәРёСҒР»РҫСҖРҫРҙР° ( 18O), С„РҫСҒС„РҫСҖР° ( 32P), СҒРөСҖСӢ ( 35S), Р¶РөР»РөР·Р° ( 59Fe), Р№РҫРҙР° ( 131I) Рё РҙСҖ. РұСӢли РІСӢСҸСҒРҪРөРҪСӢ Рё РҙРөСӮалСҢРҪРҫ РёР·СғСҮРөРҪСӢ СҒР»РҫР¶РҪСӢРө Рё взаимРҫСҒРІСҸР·Р°РҪРҪСӢРө РҝСҖРҫСҶРөСҒСҒСӢ РұРёРҫСҒРёРҪСӮРөР·Р° Рё СҖР°СҒРҝР°РҙР° РұРөР»РәРҫРІ, РҪСғРәР»РөРёРҪРҫРІСӢС… РәРёСҒР»РҫСӮ, СғРіР»РөРІРҫРҙРҫРІ, жиСҖРҫРІ Рё РҙСҖ. РұРёРҫР»РҫРіРёСҮРөСҒРәРё Р°РәСӮРёРІРҪСӢС… СҒРҫРөРҙРёРҪРөРҪРёР№, Р° СӮР°РәР¶Рө С…РёРјРёСҮРөСҒРәРёРө РјРөС…Р°РҪРёР·РјСӢ РёС… РҝСҖРөРІСҖР°СүРөРҪРёР№ РІ живРҫР№ РәР»РөСӮРәРө ( СҖРёСҒ. 1 - 3).РҹСҖРёРјРөРҪРөРҪРёРө Рҳ. Рё. РҝСҖРёРІРөР»Рҫ Рә РҝРөСҖРөСҒРјРҫСӮСҖСғ РҝСҖРөР¶РҪРёС… РҝСҖРөРҙСҒСӮавлРөРҪРёР№ Рҫ РҝСҖРёСҖРҫРҙРө С„РҫСӮРҫСҒРёРҪСӮРөР·Р° , Р° СӮР°РәР¶Рө Рҫ РјРөС…Р°РҪизмах, РҫРұРөСҒРҝРөСҮРёРІР°СҺСүРёС… СғСҒРІРҫРөРҪРёРө СҖР°СҒСӮРөРҪРёСҸРјРё РҪРөРҫСҖРіР°РҪРёСҮРөСҒРәРёС… РІРөСүРөСҒСӮРІ - РәР°СҖРұРҫРҪР°СӮРҫРІ, РҪРёСӮСҖР°СӮРҫРІ, С„РҫСҒфаСӮРҫРІ Рё РҙСҖ. В РЎ РҝРҫРјРҫСүСҢСҺ Рҳ. Рё. РІСӢРҝРҫР»РҪРөРҪРҫ РҫРіСҖРҫРјРҪРҫРө СҮРёСҒР»Рҫ РёСҒСҒР»РөРҙРҫРІР°РҪРёР№ РІ СҒамСӢС… СҖазРҪРҫРҫРұСҖазРҪСӢС… РҪР°РҝСҖавлРөРҪРёСҸС… РұРёРҫР»РҫРіРёРё Рё РұРёРҫС…РёРјРёРё. РһРҙРҪРҫ РёР· РҪР°РҝСҖавлРөРҪРёР№ РІРәР»СҺСҮР°РөСӮ СҖР°РұРҫСӮСӢ РҝРҫ РёР·СғСҮРөРҪРёСҺ РҙРёРҪамиРәРё Рё РҝСғСӮРөР№ РҝРөСҖРөРјРөСүРөРҪРёСҸ РҝРҫРҝСғР»СҸСҶРёР№ РІ РұРёРҫСҒС„РөСҖРө Рё РҫСӮРҙРөР»СҢРҪСӢС… РҫСҒРҫРұРөР№ РІРҪСғСӮСҖРё РҙР°РҪРҪРҫР№ РҝРҫРҝСғР»СҸСҶРёРё, РјРёРіСҖР°СҶРёРё РјРёРәСҖРҫРұРҫРІ, Р° СӮР°РәР¶Рө РҫСӮРҙРөР»СҢРҪСӢС… СҒРҫРөРҙРёРҪРөРҪРёР№ РІРҪСғСӮСҖРё РҫСҖРіР°РҪРёР·РјР°. Р’РІРҫРҙСҸ РІ РҫСҖРіР°РҪРёР·РјСӢ СҒ РҝРёСүРөР№ или РҝСғСӮём РёРҪСҠРөРәСҶРёР№ РјРөСӮРәСғ, СғРҙалРҫСҒСҢ РёР·СғСҮРёСӮСҢ СҒРәРҫСҖРҫСҒСӮСҢ Рё РҝСғСӮРё РјРёРіСҖР°СҶРёРё РјРҪРҫРіРёС… РҪР°СҒРөРәРҫРјСӢС… (РјРҫСҒРәРёСӮРҫРІ, РјСғС…, СҒР°СҖР°РҪСҮРё), РҝСӮРёСҶ, РіСҖСӢР·СғРҪРҫРІ Рё РҙСҖ. РјРөР»РәРёС… живРҫСӮРҪСӢС… Рё РҝРҫР»СғСҮРёСӮСҢ РҙР°РҪРҪСӢРө Рҫ СҮРёСҒР»РөРҪРҪРҫСҒСӮРё РёС… РҝРҫРҝСғР»СҸСҶРёР№. Р’ РҫРұлаСҒСӮРё физиРҫР»РҫРіРёРё Рё РұРёРҫС…РёРјРёРё СҖР°СҒСӮРөРҪРёР№ СҒ РҝРҫРјРҫСүСҢСҺ Рҳ. Рё. СҖРөСҲРөРҪ СҖСҸРҙ СӮРөРҫСҖРөСӮРёСҮРөСҒРәРёС… Рё РҝСҖРёРәлаРҙРҪСӢС… РҝСҖРҫРұР»РөРј: РІСӢСҸСҒРҪРөРҪСӢ РҝСғСӮРё РҝРҫСҒСӮСғРҝР»РөРҪРёСҸ РјРёРҪРөСҖалСҢРҪСӢС… РІРөСүРөСҒСӮРІ, жиРҙРәРҫСҒСӮРөР№ Рё газРҫРІ РІ СҖР°СҒСӮРөРҪРёСҸ, Р° СӮР°РәР¶Рө СҖРҫР»СҢ СҖазлиСҮРҪСӢС… С…РёРјРёСҮРөСҒРәРёС… СҚР»РөРјРөРҪСӮРҫРІ, РІ СӮРҫРј СҮРёСҒР»Рө РјРёРәСҖРҫСҚР»РөРјРөРҪСӮРҫРІ , РІ жизРҪРё СҖР°СҒСӮРөРҪРёР№ ( СҖРёСҒ. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38 |
|||||||