 |
|
���������� ������:: ��� :: ������� ��� ���������� :: ������ ����� :: �������� ����� :: ����� ����� �������� :: ���� ��������� :: ������� ������ :: ������ ����� ���� :: ������� ���� :: ������� ������ ���������� ���������� �����:: �������� ������ :: ����� ���� (��� 1) :: ������ � ������ ��� ����� (��������� ��. ����������� � �������� ������ ������) :: �������� ���� :: ������ ��� :: � ����� ������ �. �������� :: ���� (����� 2) :: ������� ����� :: ������ � �� ����� :: ��� �� ������ �� ������� ������ |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 7)
В промышленности в больших масштабах производятся сплавы Х. - и . Применение. Использование Х. основано на его жаропрочности, твёрдости и устойчивости против коррозии. Больше всего Х. применяют для выплавки хромистых сталей (см. , , ) .Алюмино- и силикотермический Х. используют для выплавки , ,других и . Значительное количество Х. идёт на декоративные коррозионно-стойкие покрытия (см. ) .Широкое применение получил порошковый Х. в производстве металлокерамических изделий и материалов для сварочных электродов. Х. в виде иона Cr 3+- примесь в ,который используется как драгоценный камень и .Соединениями Х. протравливают ткани при крашении. Некоторые соли Х. используются как составная часть дубильных растворов в кожевенной промышленности; PbCrO 4, ZnCrO 4, SrCrO 4- как художественные краски. Из смеси хромита и магнезита изготовляют . Соединения Х. (особенно производные C 6+) токсичны. А. Б. Сучков.
Х. в организме. Х. - один из ,постоянно входит в состав тканей растений и животных. Среднее содержание Х. в растениях - 0,0005% (92-95% Х. накапливается в корнях), у животных - от десятитысячных до десятимиллионных долей процента. В планктонных организмах коэффициент накопления Х. огромен - 10 000 - 26 000. Высшие растения не переносят концентрации Х. выше 3Ч10 -4 моль/л.В листьях он присутствует в виде низкомолекулярного комплекса, не связанного с субклеточными структурами. Необходимость Х. для растений не доказана. У животных Х. участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов (структурный компонент глюкозоустойчивого фактора). Основной источник поступления Х. в организм животных и человека - пища. Снижение содержания Х. в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови и снижению чувствительности периферийных тканей к инсулину. М. Я. Школьник.
Отравлениях, и его соединениями встречаются при их производстве; в машиностроении (гальванические покрытия); металлургии (легирующие добавки, сплавы, огнеупоры); при изготовлении кож, красок и т.д. Токсичность соединений Х. зависит от их химической структуры: дихроматы токсичнее хроматов, соединения Cr (VI) токсичнее соединений Cr (II), Cr (lll). Начальные формы заболевания проявляются ощущением сухости и болью в носу, першением в горле, затруднением дыхания, кашлем и т.д.; они могут проходить при прекращении контакта с Х. При длительном контакте с соединениями Х. развиваются признаки хронического отравления: головная боль, слабость, диспепсия, потеря в весе и др. Нарушаются функции желудка, печени и поджелудочной железы. Возможны бронхит, бронхиальная астма, диффузный пневмосклероз. При воздействии Х. на кожу могут развиться дерматит, экзема. По некоторым данным, соединения Х., преимущественно Cr (lll), обладают канцерогенным действием. Профилактика отравлений: периодические медицинские осмотры с участием отоларинголога; при гальванических процессах - местная вентиляция в виде бортовых отсосов у ванн, использование перчаток, защитных мазей; при наличии пыли, содержащей Х., применяют респираторы, общие средства пылеподавления и пылеулавливания. А. А. Каспаров.
Лит.:Салли А. Г., Брэндз Э. А., Хром, 2 изд., М., 1971; Некрасов Б. В., Основы общей химии, М., 1973; Ахметов Н. С., Неорганическая химия, 2 изд., М., 1975; Реми Г., Курс неорганической химии, пер. с нем., т. 1-2, М., 1972-74; Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, пер. с англ., ч. 3, М., 1969; Грушко Я. М., Соединения хрома и профилактика отравлений ими, М., 1964; Bowen Н. J. М., Trace elements in biochemistry, L. - N. Y., 1966. Хрома Хро'ма,река на С.-В. Якут. АССР. Длина 685 км,площадь бассейна 19 700 км 2.Образуется при слиянии рр. Тэмтэкэн и Немалак-Арангас, стекающих с хребта Полоусный кряж, течёт по Яно-Индигирской низменности. Впадает в Хромскую губу Восточно-Сибирского моря. Питание снеговое и дождевое. Замерзает в конце сентября, вскрывается в конце мая. Перемерзает. Основной приток слева - Урюнг-Улах. Хрома окислы Хро'ма о'кислы,хрома оксиды, соединения хрома с кислородом: CrO, Cr 2O 3, CrO 2, CrO 3и др. Хрома закись, CrO, чёрные кристаллы; t пл1550 °С. Нерастворима в воде и горячих концентрированных HCl и H 2SO 4. Сильный восстановитель. Гидрат закиси хрома Cr (OH) 2при обезвоживании окисляется до Cr 2O 3. Получают CrO разложением гексакарбонила хрома Cr (CO) 6при 300 °С в вакууме. Применения не находит. Хрома окись, Cr 2O 3, тёмно-зелёные кристаллы; плотность 5,21 г\см 3, t пл1990 °С. В воде нерастворима. Обладает амфотерными свойствами. При сплавлении с сульфатами щелочных металлов даёт хрома сульфат, со щелочами - хромиты. Хрома окиси соответствует гидроокись Cr 2O 3Ч6H 2O; могут быть получены и др. гидратные формы, например Cr 2O 3Ч5H 2O, Cr 2O 3Ч7H 2O .Cr 2O 3является конечным продуктом термического разложения большинства соединений хрома; в технике её получают термическим разложением CrO 3при 500 °С или прокаливанием (например, K 2Cr 2O 3, Na 2Cr 2O 7) с древесным углём. Хрома окись используют как сырьё при алюминотермическом способе получения хрома, в производстве стойких к свету красок, для окраски стекол и керамики, в качестве полирующего материала, катализатора в неорганическом и органическом синтезе (при дегидрогенизации, ароматизации, гидрировании, крекинге и т.д.). Хрома двуокись, CrO 2, кристаллы чёрного цвета; плотность 4,8 г/см 3.Получают CrO 2нагреванием CrO 3или хлористого хромила CrO 2Cl 2до 360-400 °С и под высоким давлением в атмосфере кислорода. Хрома трёхокись, хромовый ангидрид, CrO 3, тёмно-красные кристаллы; плотность 2,8 г/см 3; t пл196 °С. Гигроскопична, расплывается на воздухе. С водой образует .Сильный окислитель. Получают действием H 2SO 4на дихромат натрия Na 2Cr 2O 7 (реже K 2Cr 2P 7). Применяют для получения электролизом, электролитического .Хрома трёхокись, так же как и др. соединения Cr (VI), ядовита. Лит.:Роде Т. В., Кислородные соединения хрома и хромовые катализаторы, М., 1962; См. также лит. при ст. . А. Б. Сучков. Хрома хлориды Хро'ма хлори'ды,соединения хрома с хлором: CrCl 2, CrCl 3, CrCl 4. Хлорид хрома (II), CrCl 2, белые гигроскопичные кристаллы; плотность 2,75 г/см 3; t пл824 °С. Водные растворы голубого цвета. Образует комплексы с аммиаком, гидразином, дипиридилом и др. соединениями. Получают восстановлением CrCl 3водородом при 700 °С или взаимодействием хлористого водорода с металлом при 600-700 °С. Применяют в хроматометрии. Хлорид хрома (III), CrCl 3, фиолетовые кристаллы; плотность 2,76 г/см 3; t пл1152 °С. При 600 °С возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl 2. В воде растворим в присутствии восстановителей (Cr 2+, Fe 2+). В технике получают высокотемпературным хлорированием хрома, феррохрома, а также хромовой руды в присутствии угля с раздельной конденсацией образующихся в двух последних случаях хлоридов хрома и железа. Применяют при электролитическом и металлотермическом получении . Хлорид хрома (IV), CrCl 4, неустойчив в твёрдом состоянии. Образуется в газовой фазе при нагревании CrCl 3в избытке хлора. Из соединений хрома с хлором и кислородом наиболее важен хлористый хромил, CrO 2Cl 2. Это тёмно-красная жидкость; плотность 1,911 г/см 3, t пл-96,5 °С; t kип117 °С. Окисляет большинство органических веществ. Образуется при действии сухого HCl на CrO 3. Применяется в качестве окислителя в органическом синтезе (получение ализарина, сахарина, ) .
Лит.см. при ст. . А. Б. Сучков. Хромаль Хрома'ль(от и ) ,общее название группы жаростойких сплавов на основе железа, содержащих 17-30% Cr и 4,5-6,0% Al. Сплавы характеризуются редким сочетанием высокой жаростойкости (до 1400 °С) и высокого удельного электрического сопротивления (1,3-1,5 мкомЧ м) .температура плавления 1500-1510 °С, плотность 7,15-7,30 г/см 3.Х., как и ,широко распространённые в технике материалы, которые применяются в виде проволоки и ленты для изготовления нагревательных элементов высокотемпературных электрических печей. Х. дешевле и более жаростойки, чем нихромы, но более сложны в производстве и требуют особых условий эксплуатации вследствие низкой прочности при температурах выше 1000 °С, охрупчивания в процессе службы, а также химического взаимодействия с парами и окислами некоторых распространённых в практике металлов. Х. обладают высокой жаростойкостью на воздухе, в водороде, окислительной атмосфере, содержащей серу и углерод. В СССР выпускают Х. марок 0Х23Ю5А, 0Х27Ю5А и др. Из зарубежных Х. наиболее известны сплавы и .
Лит.:Прецизионные сплавы. Справочник, М., 1974. Хромансиль Хроманси'ль(от и лат. Manganum - марганец, Silicium - кремний), конструкционная сталь, легированная хромом, марганцем и кремнием (около 1% каждого элемента); содержание углерода в различных марках Х. колеблется от 0,17 до 0,39%. Х. - дешёвая сталь, обладающая после термической обработки благоприятным сочетанием прочности и пластичности, а также хорошей обрабатываемостью. Применяется в виде листов, прутков, труб, ленты, поковок в различных отраслях машиностроения. В СССР выпускают Х. марок 20ХГСА, 30ХГСА и др. Лит.:Материалы в машиностроении. Справочник, т. 3, М., 1968. Хромат калия Хрома'т ка'лия,калиевая соль хромовой кислоты, K 2CrO 4. О свойствах и применении Х. к. см. в ст. . Хроматида Хромати'да,структурный элемент ,формирующийся в ядра клетки в результате репликации (удвоения) хромосом. В хромосома состоит из двух Х., каждая из которых после расхождения в дочерние ядра становится самостоятельной хромосомой. В гомологичные хромосомы, сближаясь попарно, образуют структуру из четырёх Х. (тетраду). Согласно однонитчатой модели хромосомы, каждая Х. содержит в поперечнике одну суперспирализованную и конденсированную двуцепотчатую молекулу (ДНК); многонитчатая модель хромосомы предполагает наличие в поперечнике каждой Х. нескольких молекул ДНК (в этом случае различают полухроматиды, четверть-хроматиды и т.д.). Экспериментально более подтверждена однонитчатая модель. И. И. Кикнадзе. Хроматизм Хромати'зм(от греч. chromatismуs - окраска), повышение или понижение на полутон диатонической ступени лада, обостряющее её тяготение к соседней ступени. Между диатонической ступенью и её повышенным или пониженным вариантом возникает хроматический полутон; принадлежность образующих его звуков к одной ступени (например, до - до-диез) отличает его от диатонического полутона (до - ре-бемоль). Х. обозначаются с помощью знаков .Последняя сравнительно с Х. представляет собой более широкое явление. Всякий Х. является альтерацией, но не всякая альтерация - Х. (например, альтерация звуков основного до-мажорного звукоряда, приводящая к образованию диатонического лада на др. ступенях). Если Х. - это реальное изменение диатонической ступени в одном голосе, об альтерации можно говорить и тогда, когда диатонический вариант той же ступени дан перед альтерированным звуком в др. голосе или вообще ей не предшествует. Хроматин
Хромати'н(от греч. chroma, родительный падеж chromatos - цвет, краска), вещество хромосом, находящееся в ядрах растительных и животных клеток; интенсивно окрашивается ядерными красителями; во время деления клетки формируется в определённые видимые структуры в
.Термин введён в 1880 немецким гистологом В. Флеммингом. В современной цитологии под Х. чаще всего подразумевают хромосомное вещество ядра клетки в
(между последовательными её делениями), т.к. хромосомы в этот период клеточного цикла под микроскопом плохо обнаруживаются. В состав Х. в определённых пропорциях входят:
(ДНК) (30-40%),
(РНК),
и негистоновые белки. Основной структурный компонент Х. - дезоксирибонуклеопротеидные нити (ДНП) диаметром 100-200
Различают генетически активный Х. (эухроматин) и неактивный (гетерохроматин). В ядрах клеток особей женского пола многих организмов (в частности, млекопитающих животных и человека) обнаружены крупные плотные глыбки Х., которых нет у особей мужского пола. Такой Х. назван «половым Х.». Образуется он, по-видимому, неактивными участками (в основном гетерохроматином одной из парных Х-хромосом). И. И. Кикнадзе. Хроматическая аберрация Хромати'ческая аберра'ция,одна из основных ,обусловленная зависимостью (ПП) прозрачных сред от длины волны света (см. ) .Х. а. может проявиться лишь в системах, включающих элементы из преломляющих материалов, например .Зеркалам Х. а. не свойственна; др. словами, зеркала ахроматичны. Существует два типа Х. а., не зависящих один от другого: хроматизм положения изображения и хроматизм увеличения. Первый состоит в том, что изображения точки, образуемые лучами разной длины волны, лежат на различных расстояниях от системы (положения главных на не совпадают для лучей разного цвета; рис. , отрезок O 1O 2). При этом типе Х. а. на экране, поставленном там, где формируется изображение, перпендикулярно оптической оси вместо одной светлой точки наблюдается совокупность цветных кружков. Хроматизм увеличения заключается в том, что поперечные изображений объекта, формируемых лучами разной длины волны, могут оказаться неодинаковыми. Это вызвано различием положений главных плоскостей системы (см. оптической системы) для лучей с неравными длинами волн, даже если их фокусы совпадают (но отличаются ) .Из-за хроматизма увеличения предметы конечных размеров дают изображения с цветной каймой. Исправить хроматизм положения в оптической системе тем труднее, чем для большего числа лучей разной длины волны совмещают их главные фокусы. В простейшем случае совмещения их лишь для лучей двух длин волн (и уменьшения взаимного удаления для лучей др. длин волн) оптической системы, обычно ,называются .В более совершенных фокусы совмещаются для лучей трёх длин волн, что достигается увеличением числа элементов с разными ПП и введением в оптическую систему зеркал. Такие системы широко применяются как фотография., астрономические и др. объективы. Ещё более тщательное исправление хроматизма положения требует дальнейшего усложнения конструкции системы тем большего, чем больше её и угол [число линз и зеркал увеличивается и (или) форма их усложняется]. При ахроматизации увеличения (исправлении Х. а. 2-го типа) необходимо совместить также главные плоскости для возможно большего числа лучей с разными длинами волн, что связано с большими трудностями. Лит.:Ландсберг Г. С., Оптика, 5 изд., М., 1976 (Общий курс физики); Герцбергер М., Современная геометрическая оптика, пер. с англ., М., 1962; Борн М., Вольф Э., Основы оптики, пер. с англ., М., 1973. 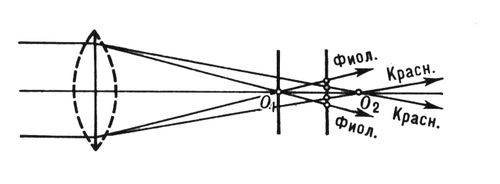
Рис. к ст. Хроматическая аберрация. Хроматическая гамма Хромати'ческая га'мма, с полутоновым расстоянием между ступенями, насчитывающая 12 звуков в пределах октавы. Рассматривается как мажорная или минорная гамма с проходящими полутонами. Отсюда 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 |
|||||||
 , основу каждой из которых, по мнению большинства исследователей, составляет одна молекула ДНК. Предложено две модели тонкой структуры элементарной нити Х.: суперспиральная (американские учёные Д. Пардон, М.
,1972) и глобулярная (американские учёные А.
,А. Л. Олинс и Д. Э. Олинс, 1974). Экспериментально более подтверждена глобулярная модель, предполагающая, что элементарная нить Х. - это гибкая цепь из повторяющихся субъединиц - нуклеосом, каждая из которых заключает в себе изогнутый участок ДНК размером 150-200 пар
и комплекс из 8 молекул гистонов.
, основу каждой из которых, по мнению большинства исследователей, составляет одна молекула ДНК. Предложено две модели тонкой структуры элементарной нити Х.: суперспиральная (американские учёные Д. Пардон, М.
,1972) и глобулярная (американские учёные А.
,А. Л. Олинс и Д. Э. Олинс, 1974). Экспериментально более подтверждена глобулярная модель, предполагающая, что элементарная нить Х. - это гибкая цепь из повторяющихся субъединиц - нуклеосом, каждая из которых заключает в себе изогнутый участок ДНК размером 150-200 пар
и комплекс из 8 молекул гистонов.