 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Азимов Айзек :: Раззаков Федор :: Чехов Антон Павлович :: Грин Александр :: Горький Максим :: Борхес Хорхе Луис :: Сименон Жорж :: Андреев Леонид Николаевич Популярные книги:: Ожерелье Иомалы :: Магия луны (Том 1) :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: Ночной орёл :: О «Двух душах» М. Горького :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер |
Большая Советская Энциклопедия (ХЛ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ХЛ) - Чтение (стр. 5)
)
,технике, например в текстильной промышленности для отбеливания тканей, для дегазации некоторых
(см.
)
.В медицине Х. применяют в качестве
(главным образом хлорамин Б, содержащий 25-29% активного хлора и оказывающий также дезодорирующее и сперматоцидное действие). Для дезинфекции рук используют 0,25-0,5%-ные растворы хлорамина Б, а для обеззараживания предметов ухода и выделений больных при кишечных и капельных инфекциях - 1-5%-ные растворы, а также хлорамин Т, дихлорамин. Х. применяют для
(таблетки «пантоцид»), лечения инфицированных ран, дезинфекции рук, неметаллического инструментария.
Хлорангидриды Хлорангидри'ды,см. . Хлоратор Хлора'тор,аппарат (установка) для дозирования газообразного хлора (хлор-газа) и приготовления его водного раствора (хлорной воды), применяемый при обеззараживании (дезинфекции) природных и сточных вод. Различают Х. напорные и вакуумные. Последние (получившие наибольшее распространение) обычно состоят из баллона, в котором осаждаются из хлор-газа капли жидкости, пыль и т. п., регулировочного вентиля, фильтра для окончательной очистки газа, редуктора, понижающего давление, измерителя расхода газа и смесителя хлор-газа с водой. Х. называют также аппараты, используемые в химической технологии для хлорирования органических и неорганических соединений. Хлорат-хлорид кальция Хлора'т-хлори'д ка'льция[смесь Ca(ClO 3) 2с CaCl 2], химический препарат, применяется в виде водного раствора на посевах хлопчатника и др. культур как и . Хлораты Хлора'ты,хлорноватокислые соли ,соли HClO 3; кристаллы, устойчивые при обычной температуре, разлагающиеся при нагревании или в присутствии катализаторов с выделением кислорода. Большинство Х. хорошо растворимо в воде и в некоторых органических растворителях; с органическими и легко окисляющимися веществами образуют взрывчатые смеси. В промышленном масштабе производятся Х. натрия, калия, кальция и магния. Хлорат калия (хлорноватокислый калий, бертоллетова соль), KClO 3; плотность 2,344 г/см 3, t пл370°C. Впервые получен в 1786 К. Л. (отсюда название бертоллетова соль) при пропускании хлора в концентрированный раствор едкого кали. Растворимость Х. калия в воде (в г/л): 32,4 (0 °С), 170,5 (50 °С), 437 (100 °С). KClO 3негигроскопичен. Х. калия разлагается с выделением кислорода при температуре около 400 °С, а в присутствии катализаторов (MnO 2, Fe 2O 3и др.) - при температуре около 150-200 °С. Химически чистый KCl 3взрывается при 550-600 °С. В смеси с серой, фосфором, многими органическими веществами взрывается при ударе или трении. Чувствительность к взрыву возрастает в присутствии броматов и аммониевых солей. Получается при обменном разложении Х. кальция или натрия с KCl. Применяется в производстве спичек и пиротехнических составов. Хлорат натрия, NaClO 3; плотность 2,49 г/см 3(15°C); t пл248 °С. Растворимость в воде (в г/л) :612 (0 °С), 870 (50 °С), 1190 (100 °С). Малогигроскопичен. По химическим свойствам сходен с KClO 3. Получают электролизом водных растворов NaCI в бездиафрагменных электролизёрах. Используется для получения двуокиси хлора (см. ) ,в производстве др. хлоратов и . Хлорат кальция, Ca(ClO 3) 2. Очень гигроскопичен; образует с водой кристаллогидраты Ca(ClO 3) 2ЧnH 2O (где n= 1-6); на воздухе расплывается. Х. к. получается хлорированием известкового молока: 6Ca(OH) 2+ 6Cl 2= Ca(ClO 3) 2+ 5CaCl 2Ч6H 2O. Используется как промежуточный продукт в производстве Х. калия, в сельском хозяйстве служит в качестве и . Хлорат магния, Mg(ClO 3) 2. Очень гигроскопичен, образует с водой кристаллогидраты, например Mg(ClO 3) 2Ч6H 2O; безводный Х. м. не получен. На воздухе расплывается. Кристаллогидрат получают сплавлением Х. натрия с бишофитом: 2NaClO 3+ MgCl 2Ч6H 2O = Mg(ClO 3) 2Ч6H 2O + 2NaCI. Огне- и взрывоопасен. Применяется для предуборочного удаления листьев с хлопчатника и для подсолнечника, риса, семенников зернобобовых культур, высадок сахарной свёклы и др. Х. малотоксичны; хронические отравления возникают при попадании внутрь и вдыхании пыли. Лит.см. при ст. . Л. М. Якименко. Хлорацетофенон Хлорацетофено'н,C 6H 5C(O)CH 2Cl, бесцветные кристаллы, t пл59 °С, t kип244-245°C, (максимальная концентрация) 0,11 мг/л(20°C); обладает очень сильным слезоточивым действием (лакриматор). Х. плохо растворим в воде, хорошо - в органических растворителях, гидролитически устойчив, на холоду практически не гидролизуется даже водными растворами щелочей; энергично реагирует со спиртовыми растворами Na 2S с образованием нетоксичного дифенацилсульфида (C 6H 5COCH 2) 2S. Х. получают хлорированием ацетофенона. Минимально действующая концентрация 0,0001 мг/л;непереносимая 0,002 мг/л(2 мин) .Защитой служит .Был предложен как в конце 1-й мировой войны 1914-18, но в боевой обстановке испытан не был. Хлорбензид Хлорбензи'д,хлорпарацид, 4-хлорфенил-4'-хлорбензилсульфид (4-СlC 6H 4SCH 2C 6H 4Cl-4), химический препарат для борьбы с растительноядными клещами ( ) . Хлорбензилат Хлорбензила'т[(ClC 6H 4) 2C(OH)COOC 2H 5], химический препарат для борьбы с растительноядными клещами ( ) . Хлорбензол Хлорбензо'л,бесцветная жидкость с характерным запахом, t kип131,7°C; практически нерастворим в воде, смешивается со многими органическими растворителями. В промышленности Х. получают каталитическим хлорированием бензола (75-85 °С, металлическое железо); используют его в производстве ,4,4'-дихлордифенил-трихлорэтана (ДДТ), полупродуктов в синтезе красителей и как растворитель в лабораторной практике. Хлорбутилкаучук Хлорбутилкаучу'к,продукт хлорирования . Хлорелла Хлоре'лла(Chlorella), род микроскопических одноклеточных из класса протококковых. Клетки шаровидные или эллипсоидные, с целлюлозной оболочкой, содержащие один пристенный хлоропласт с пиреноидом или без него и одно ядро; запасные продукты - крахмал и масло. Размножение автоспорами. В СССР около 10 видов, распространены повсеместно. Объект массового культивирования в качестве возможного источника пищи и корма, для биологической очистки сточных вод, регенерации воздуха в замкнутых экосистемах (на космических кораблях, подводных лодках). Лит.:Музафаров А. М., Таубаев Т. Т., Селяметов Р. А., Хлорелла и ее использование в животноводстве, Таш., 1974; Андреева В. М., Род Chlorella. Морфология, систематика, принципы классификации, Л., 1975; Fott В., Novбkovб М., A monograph of the genus Chiorella. The fresh water species, в кн.: Studies in phycology, Prague, 1969. Хлоридовозгонка Хлоридовозго'нка,один из процессов в цветной металлургии, имеющий целью отогнать образующиеся при обжиге хлориды металлов в газовую фазу и отделить их от непрохлорированной массы материала. Процесс основан на большой летучести хлоридов многих металлов и осуществляется при температурах, обеспечивающих высокое давление паров возгоняемых хлоридов и быстрое их улетучивание. Х. ведут в трубчатых и шахтных печах, электропечах, печах кипящего слоя. В качестве хлоринаторов применяют хлор, хлорид водорода, хлорид кальция, каменную соль и др. хлориды. Отходящие газы из хлоридовозгоночной печи пропускают через аппараты горячего пылеулавливания для отделения пыли от паров хлоридов и затем охлаждают для конденсации хлоридов металлов, которые улавливают в электрофильтрах или конденсаторах (сухой способ) либо в скрубберах (мокрый способ); свободный хлористый водород поглощают известковым молоком или раствором хлорида кальция и возвращают в «голову» процесса. Достоинства Х.: высокое извлечение металлов, обусловленное большой химической активностью хлора; почти полное отделение цветных металлов от железа за одну операцию; возможность селективной отгонки тех или иных хлоридов металлов путём изменения состава газовой фазы; высокая степень сокращения, обеспечивающая получение из бедного сырья богатого продукта - хлоридов, из которых затем получают товарные металлы. Недостаток процесса: необходимость поддержания высокого парциального давления, достигаемого многократным избытком хлора, который находится в обороте. Промышленное применение Х. получила в производстве титана, бериллия, циркония и др. редких металлов. Для получения титана брикеты из титановых шлаков с коксом при 700-800 °С продувают хлором в электрических шахтных печах или в хлораторах для хлорирования в расплаве. Восстановительная атмосфера обеспечивает практически полное хлорирование окислов титана и ряда др. металлов. Легковозгоняющиеся TiCl 4и SiCI 4конденсируются в виде жидкости, а AlCl 3, FeCI 3, VOCI 3- в виде твёрдой фазы; малолетучие хлориды кальция, магния, марганца вместе с непрохлорированными окислами остаются в твёрдом остатке. Х. начинает применяться и для извлечения тяжёлых цветных и драгоценных металлов. Так, пиритные огарки окатывают с хлоридом кальция и подвергают Х. при 1100-1200 °С в окислительной атмосфере. При этом возгоняют и улавливают свыше 94% меди, цинка, свинца, золота и серебра, а окислы железа, кремния, кальция и др. не хлорируются; обожжённые окатыши направляют в чёрную металлургию. Процессы Х. разрабатываются для селективного извлечения меди, олова, висмута, свинца, золота, серебра из сложного сульфидного сырья, для извлечения никеля, кобальта и марганца из окисленных никелевых руд и являются перспективными для переработки различных промышленных продуктов. Лит.:Коршунов Б. Г., Стефанюк С. Л., Введение в хлорную металлургию редких элементов, М., 1970. И. Д. Резник. Хлориды Хлори'ды,соединения хлора со всеми элементами, имеющими меньшее значение электроотрицательности, т. е. со всеми металлами и неметаллами, кроме кислорода и фтора (исключение - Х. азота, которые принято так называть, несмотря на то, что электроотрицательность азота больше, чем хлора). Х. металлов (или соли ) -твёрдые вещества, большинство из них плавится или возгоняется без разложения. В основном Х. металлов хорошо растворимы в воде; AgCl, CuCl, HgCl 2, TlCl и PbCl 2- малорастворимы. Х. щелочных и щёлочноземельных металлов имеют нейтральную реакцию. Растворы Х. др. металлов имеют кислую реакцию вследствие гидролиза, например: AlCl 3+ 3H 2O = Al (OH) 3+ 3HCl. Х. неметаллов могут быть газообразными (HCl), жидкими (PCl 3) или твёрдыми (PCl 5). Они гидролизуются водой, например: PCl 5+ 4H 2O = H 3PO 4+ 5HCl. Х. натрия, калия, магния, кальция широко распространены в природе (см. также ) .О свойствах, получении и применении Х. см. , , , , , и др. Хлориды азота Хлори'ды азо'та,хлорпроизводные аммиака (неорганические ): монохлорамин NH 2CI, дихлорамин NHCl 2и трихлорамин (трёххлористый азот) MCl 3. Х. а. образуются при взаимодействии аммиака или солей аммония с хлором или хлорноватистой кислотой. NH 2CI - бесцветная маслянистая жидкость с резким запахом; t пл-60 °С. При нагревании разлагается. NHCl 2в свободном состоянии не выделен. NCl 3- ярко-жёлтая маслянистая жидкость с острым раздражающим запахом; плотность 1,653 г /см 3 , t пл -40 °С, t kип71 °С. Под действием света медленно разлагается с выделением азота и хлора. NCl 3растворим в бензоле, сероуглероде, хлороформе; в воде нерастворим. Чувствителен к удару, взрывается при соприкосновении с органическими веществами, способными хлорироваться, например с каучуком, пробкой, жирами, скипидаром. Х. а. гидролизуются с образованием аммиака и .
Лит.см. при ст. . Хлориды природные Хлори'ды приро'дные,класс минералов, солей соляной кислоты HCl. По составу, свойствам и условиям образования выделяют две группы Х. п. В первой группе (28 минералов) - растворимые водные и безводные хлориды Na, К, NH 4, Mg, Ca, Al, Mn и Fe. Главные минералы: галит NaCI, KCl, нашатырь NH 4CI, бишофит MgCl 2Ч6H 2O, KMgCl 3Ч6H 2O, тахгидрит CaMgCl 4Ч12H 2O, риннеит NaK 3FeCl 6и др. Содержат 20-70% Cl. В основе кристаллических структур лежит плотнейшая кубическая упаковка атомов Cl. Атомы металлов расположены в октаэдрических пустотах. Химические связи в основном ионные. Кристаллизуются в кубической или тригональной системах. Обычно бесцветны; твердость по минералогической шкале 1-2, плотность 1600-3200 кг/м 3 .Гигроскопичны, хорошо растворяются в воде, частично в спирте; на вкус солёные или горькие. Слагают зернистые и плотные массы, прожилки и желваки в осадочных толщах; сростки кристаллов, налёты и корочки образуются в осадках озёр, солончаках и продуктах вулканической и фумарольной деятельности. Многие Х. п. широко используются в химической и пищевой промышленности, сельском хозяйстве. См. также ст. , . Ко второй группе (49 минералов) относят нерастворимые хлориды Cu, Pb, Ag, Hg, As, Sb и Bi, часто с дополнительными анионами О -, OH -; иногда с [NO 3] -, Fe -, [SO 4] 2+; главные: нантокит CuCl, атакамит Cu 2CI (OH) 3, коннелит Cu 19Cl (OH) 32SO 4Ч4H 2O, лаурионит PbCl (OH), матлокит PbFCl, мендипит Pb 3Cl 2O 2, хлорарнирит AgCl, Hg 2Cl 2, диаболейт PbCuCl 2(OH) 4, болеит Pb 3Cu 3AgCl 7(OH) 6и др. Содержат 6-35% Cl. Кристаллизуются в основном в ромбической и тетрагональной системах; нередки слоистые структуры с относительно высокой ковалентностью химических связей. Бесцветные, синие, зелёные, жёлтые. Образуют корочки, агрегаты кристаллов, налёты, землистые массы. Твердость по минералогической. шкале до 4, плотность 3700-8300 кг/м 3 .В воде нерастворимы. Образуются в зоне окисления рудных месторождений в условиях сухого климата; при воздействии солёных вод на рудные минералы и промышленные шлаки; в процессе вулканической деятельности. В составе окисленных руд используются как сырьё для получения Cu, Pb, Ag. Лит.:Минералы. Справочник, т. 2, в. 1, М., 1963. И. В. Островская. Хлорин Хлори'н,торговое название ,выпускаемого в СССР. Хлорирование (в цветной металлургии) Хлори'рованиев цветной металлургии, технологический процесс нагрева материалов, содержащих цветные металлы, в атмосфере хлора, хлорсодержащих газов или в присутствии хлористых солей с целью извлечения и разделения цветных металлов. В основе процесса лежит взаимодействие окислов или сульфидов металлов с хлором или хлоридом водорода по обратимым реакциям. Окислы, у которых этих реакций имеет большие отрицательные значения (PbO, ZnO, Ag 2O и др.), хлорируются при малых концентрациях хлора в газовой среде и в присутствии кислорода; окислы с большими положительными значениями гиббсовой энергии (SiO 2, TiO 2, Al 2O 3) практически не взаимодействуют с газообразным хлором, т.к. даже следы кислорода в газовой среде препятствуют образованию хлоридов. Х. окислов облегчается в присутствии веществ, связывающих свободный кислород и уменьшающих его концентрацию в газовой фазе, например углерода, водорода, сернистого ангидрида. Таким образом, изменяя состав газовой фазы и температуру процесса, можно подобрать условия селективного Х.; в частности, в присутствии кислорода и паров воды можно прохлорировать ряд цветных металлов, оставив в окисленной форме железо, а в восстановительной атмосфере перевести в форму хлоридов окислы железа. В качестве хлорирующих агентов, кроме элементарного хлора и HCl, применяют дешёвые соли - каменную соль (NaCl), сильвинит (KClЧ2NaCl), хлорид кальция (CaCl 2) и др. При этом Х., в особенности при использовании малолетучего CaCl 2, идёт преимущественно через разложение соли парами воды с образованием HCl; разложению соли-хлоринатора способствует присутствие SO 2или SO 2, образующих CaSO 4, CaSiO 3и т.п. Разновидности Х.: хлорирующий обжиг, и .Хлорирующий обжиг проводят при относительно низкой температуре, при которой образующиеся хлориды ещё нелетучи. Х. осуществляют в электропечах, печах кипящего слоя, трубчатых или многоподовых обжиговых печах. Процесс применяется в производстве магния для перевода окиси магния в хлорид, который затем подвергают электролизу, а также для извлечения кобальта и меди из бедных материалов, чаще всего из пиритных огарков и кобальт-никелевых штейнов; кобальт, медь, цинк переходят в форму хлоридов и выщелачиваются водой или слабой кислотой, а железо не хлорируется и остаётся в форме окислов в твёрдом остатке. Хлоридовозгонка, в отличие от хлорирующего обжига, ведётся при более высоких температурах, обеспечивающих улетучивание хлоридов металлов; процесс более универсален: позволяет извлекать больше различных цветных и редких металлов, а также золото и серебро. Сегрегация, в отличие от хлоридовозгонки, требует меньшего расхода хлоринаторов и ведётся при более низкой температуре, но для получения концентрата необходима дополнительная операция - флотация или магнитная сепарация. Х. применяется также для рафинирования расплавленных металлов от примесей: алюминия - от натрия и кальция, свинца - от цинка, олова - от свинца. Разрабатываются процессы удаления меди и кобальта из никелевого хлоридными расплавами. Лит.:Смирнов В. И., Тихонов А. И., Обжиг медных руд и концентратов, 2 изд., М., 1966; Морозов И. С., Применение хлора в металлургии редких и цветных металлов, М., 1966; Гудима Н. В., Шейн Я. П., Краткий справочник по металлургии цветных металлов, М., 1975. И. Д. Резник. Хлорирование воды Хлори'рование воды',обработка воды хлором и его соединениями. Наиболее распространённый способ ; основан на способности свободного хлора и его соединений угнетать ферментные системы микробов, катализирующие окислительно-восстановительные процессы. Для обеззараживания питьевой воды применяют хлор, двуокись хлора, хлорамин (см. ) и хлорную известь. Необходимая доза препарата устанавливается пробным Х. в.: она определяется хлор-поглощаемостью воды (количество хлора, необходимое для связывания главным образом содержащихся в воде органических соединений). Хлор вводят с избытком (остаточный хлор) с целью уничтожения микробов, попадающих в воду после её хлорирования. Содержание остаточного свободного хлора через 30 минпосле Х. в. должно быть не менее 0,3 мг/л.В некоторых случаях проводят двойное Х. в. - до очистки (предварительное Х. в.) и после неё (заключительное Х. в.); при наличии в воде веществ, которые после Х. в. могут придать ей неприятные запах и привкус, воду до хлорирования обрабатывают аммиаком или аммонийными солями. Х. в. применяют и для обеззараживания питьевой воды в полевых условиях; наиболее надёжен метод суперхлорирования, обеспечивающий избыток активного хлора не менее 10 мг/лпри экспозиции не менее 30 мин.Суперхлорирование применяется и для обеззараживания воды в системах централизованного водоснабжения при эпидемиологических показаниях. После суперхлорирования проводится дехлорирование - устранение избыточного хлора физическими или химическими методами. Х. в. применяют также для обеззараживания ,воды плавательных бассейнов, обесцвечивания, обезжелезивания производственных вод и пр. Лит.:Руководство по гигиене водоснабжения, под ред. С. Н. Черкинского, М., 1975. Хлорирование (химич.) Хлори'рованиеорганических соединений, процесс прямого замещения в органических соединениях атомов водорода атомами хлора. Х. может быть осуществлено действием свободного хлора или веществами, его генерирующими, например хлористым сульфурилом SO 2Cl 2(см. ) .Механизм Х. определяется природой органического соединения и условиями реакции. Так, насыщенные углеводороды взаимодействуют с хлором при облучении ультрафиолетовым светом (УФ-облучении) по радикально-цепному механизму:
Эта реакция лежит в основе промышленного способа получения из метана метилхлорида, метиленхдорида, хлороформа, четырёххлористого углерода, из пентановых фракций бензина - амилхлоридов. Х. органических соединений ароматического ряда протекает по ионному механизму в присутствии кислотного катализатора, например AlCl 3или FeCl 3. Т. о. в промышленности получают, например, : Cl 2+ FeCl 3® С ++ [FeCl 4] -; C 6H 6+ Cl +® C 6H 5Cl + Н +; [FeCl 4] -+ H +® FeCl 3+ HCl. Принимая во внимание различия в механизмах Х. органических соединений алифатических и ароматических рядов, регулируют Х. жирно-ароматических углеводородов: прибавление FeCl 3ведёт к замещению атомов водорода в ароматическом ядре, тогда как УФ-облучение и повышение температуры способствуют Х. боковых алифатических групп. Так, в промышленности Х. толуола получают хлортолуолы (в присутствии FeCl 3) или бензилхлорид C 6H 5CH 2Cl (под действием УФ-облучения). При высокой температуре удаётся осуществить прямое замещение атомов водорода на хлор и в алкильных группах олефинов (с сохранением кратной связи), например:
Эта реакция используется в промышленности для получения -исходного продукта в производстве . Иногда под Х. в более широком смысле понимают создание связи С-Cl любым способом, например присоединением по кратным связям хлора, хлористого водорода, хлорноватистой кислоты, хлористого нитрозила, замещением на хлор др. функциональных групп (гидроксильной в спиртах и карбоновых в кислотах, аминогруппы в ароматических аминах после предварительного их диазотирования и др.). Так, в промышленности присоединением хлора к этилену получают ,являющийся сырьём в одном из способов производства ; хлорированием ацетилена - ,применяемый для получения ,хлорированием некоторых каучуков - хлор-каучуки. Реакцией ненасыщенных соединений с хлористым водородом в промышленности производят винилхлорид, , .Х. используется также для получения (гексахлорана, полихлорпинена, полихлоркамфена), ,например эфиров 2,4-дихлор-феноксиуксусной кислоты, (заменителя ) и др. важных продуктов. Хлорированные полиолефины Хлори'рованные полиолефи'ны,синтетические полимеры, продукты хлорирования полиэтилена (в СССР называются ХПЭ) и полипропилена (ХПП). Х. п. отличаются разнообразием свойств, зависящих от типа, молекулярной массы и строения исходного полимера, а также от способа введения хлора и его количества. Например, ХПЭ, содержащий до 15% хлора, - пластик; 16-25% - термоэластопласт; 26-48% - эластомер (каучук); 49-60% - жёсткий кожеподобный материал; 61-75% - хрупкая смола. ХПЭ, содержащий 61-70% хлора, приближается по свойствам к поливинилхлориду. Плотность ХПЭ 0,92-1,61 г/см 3 .Прочность при растяжении высокохлорированных ХПЭ и ХПП достигает соответственно 25 и 32 Мн/м 2(250 и 320 кгс/см 2) .Ценные свойства Х. п. - хорошая адгезия к различным поверхностям и огнестойкость. ХПЭ стоек также к действию озона, кислорода, щелочей, растворов солей, сильных кислот, алифатических углеводородов, спиртов, масел, бензина, менее стоек к хлорированным ароматическим углеводородам. При действии света и тепла Х. п. могут отщеплять HCl и поэтому требуют стабилизации (см. ). Из ХПЭ-пластика изготовляют, например, прозрачные плёнки медицинского, бытового и с.-х. назначения. ХПЭ-эластомер применяют в производстве резинотехнических изделий; в смеси с поливинилхлоридом - для получения огне- и морозостойких пластмасс. ХПП перерабатывают в волокна и прозрачные прочные плёнки. ХПЭ и ХПП, содержащие 50-70% хлора, служат связующими лакокрасочных материалов, а также основой клеевых композиций и покрытий различного назначения. Зарубежные торговое название полимеров типа ХПЭ: тирин (США), галофлекс (Великобритания), хлорхостален (ФРГ), эласлен (Япония); полимеров типа ХПП - перлон Р (США). Мировое производство (1976) около 80 тыс. т.
Лит.:Энциклопедия полимеров, т. 3, М., 1977 Г. М. Ронкин. Хлористая кислота Хло'ристая кислота',HClO 2, одноосновная кислота, в которой хлор имеет степень окисления +3; существует только в разбавленных водных растворах. Константа диссоциации 1,1Ч10 -2(18°С). Получается при растворении в воде двуокиси хлора: 2ClO 2+ H 2O = HClO 2+ HClO 3. В промышленности используются соли Х. к. - ,в основном NaClO 2. Лит.см. при ст. . Хлористоводородная кислота Хлористоводоро'дная кислота',то же, что . Хлористый водород Хло'ристый водоро'д,HCl, при обычных условиях бесцветный газ с резким запахом; на воздухе при поглощении влаги образует туман, представляющий собой мельчайшие капельки .Масса 1 лХ. в. при 0°С и 0,1 Мн/м 2(1 кгс/см 2) 1,6391 г; плотность по воздуху 1,268; плотность жидкого Х. в при - 60°C 1,12 г/см 3; t пл-114,2°С; t kип-85,1°С. Критические константы: температура 51,4°C; давление 8,45 Мн/м 2 (84,5 кгс/см 2); плотность 0,42 г/см 3; удельный объём 2380 см 3 /г.Х. в. растворяется в воде с выделением тепла; при этом образуется соляная кислота. Под давлением 0,1 Мн/м 2(1 кгс /см 2) 1 лводы растворяет 500 лHCl при 2°С, 442 лпри 20°C, 339 лпри 60°C. Х. в. - стойкое соединение; при 1800°C он диссоциирует на Cl 2и H 2только в незначительной степени. Химически в отсутствие H 2O Х. в. малоактивен, в газообразном виде не реагирует с углеродом, фосфором, серой, железом. При нагревании с кислородом до 400-500°C в присутствии катализатора CuCl 2Х. 1, 2, 3, 4, 5, 6, 7 |
|||||||
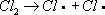 ;
;
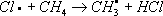 ;
; и т. д.
и т. д.