 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Раззаков Федор :: Азимов Айзек :: Чехов Антон Павлович :: Грин Александр :: Борхес Хорхе Луис :: Горький Максим :: Андреев Леонид Николаевич :: Сименон Жорж Популярные книги:: Ожерелье Иомалы :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: О «Двух душах» М. Горького :: Магия луны (Том 1) :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер :: Вторая книга Царств |
Большая Советская Энциклопедия (ХЛ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ХЛ) - Чтение (стр. 4)
Высевают Х., когда почва прогреется до 14-16 °С. Способы сева: широкорядный (междурядья 60-90
см)
,квадратно-гнездовой (по схеме 60 ґ60
смпо 6-8 семян в гнездо), пунктирный и частогнездовой (междурядья 60-90
см,расстояния между семенами или гнёздами 15-30
см)
.Норма высева опушенных семян 80-120
кг/га,оголённых семян для пунктирного способа сева 20-30
кг/га;глубина заделки 4-5
см.Уход за посевами: вегетационные поливы (2-11 поливов, оросительная норма от 2000 до 9000
м
3
/гаводы), прореживание (в гнёздах оставляют 2-3 растения, на 1 погонный метр рядка 3-6), рыхления междурядий, уничтожение сорняков (применяют гербициды), подкормки,
,перед уборкой
.Убирают хлопчатник машинами (см.
) и вручную при раскрытии коробочек;
-
,волокно из него выделяют
.
Вредители Х.: озимая и хлопковая совки, хлопковые тли, карадрина, паутинный клещ. Болезни: вилт, корневая гниль, гоммоз.
Лит.:Хлопководство, М., 1963; Хлопководство и применение минеральных удобрений в СССР, Душ., 1968; Жуковский П. М., Культурные растения и их сородичи, 3 изд., Л., 1971; Тер-Аванесян Д. В., Хлопчатник, Л., 1973. В. П. Карамышев. 
Куст хлопчатника с раскрытыми коробочками перед уборкой. 
Хлопчатник: 1 - цветок; 2 - лист; 3 - незрелая коробочка (3а - в разрезе); 4 - раскрывшаяся коробочка; 5 - летучка и семя; 6 - створки коробочки; 7 - типы ветвления: 7а - предельное, 7б - непредельное с укороченными междоузлиями, 7в - непредельное с междоузлиями средней длины, 7г - непредельное с длинными междоузлиями. Хлопчатобумажная промышленность Хлопчатобума'жная промы'шленность,см. в ст. . Хлопчатобумажная ткань Хлопчатобума'жная ткань,текстильная ткань из хлопчатобумажной или смешанной (выработанной из смеси хлопка и химических волокон) ,а также полученная переплетением хлопчатобумажных и химических (или смешанных) нитей. Использование и ручное изготовление пряжи и ткани из хлопка были распространены в Индии и Китае за много столетий до н. э. В Западной Европе Х. т. стали известны лишь во время крестовых походов. С 14 в. в Европе изготовляли кустарным способом в основном полубумажные ткани (основа льняная, уток хлопчатобумажный); часто Х. т. привозились из Ост-Индии. В 70-х гг. 18 в. в Великобритании благодаря усовершенствованию прядильной машины было начато машинное производство Х. т. Но поскольку это были ещё довольно грубые, толстые ткани, продолжался ввоз тонких Х. т. Первая хлопчатобумажная фабрика была построена в конце 18 в. в Манчестере (Великобритания). В России производство Х. т. возникло позже др. отраслей текстильной промышленности (суконной, полотняной и др.). Сравнительно крупные хлопчатобумажные предприятия, сначала ситценабивные, затем ткацкие и позднее прядильные, возникли во 2-й половине 18 и начале 19 вв. Первая ситценабивная фабрика появилась в 1755 как монопольное и привилегированное предприятие английских купцов; она работала на привозных Х. т. и на русских полотнах, изготовлявшихся на мануфактурах и в деревнях. После реформы 1861 хлопчатобумажные мануфактуры стали превращаться в фабрики, выпускавшие различные Х. т. Темпы роста выпуска Х. т. были довольно высокие. Тем не менее по объёму их производства Россия занимала (1913) одно из последних мест среди развитых стран. В СССР объём производства Х. т. составляет (1975) ~ 6,6 млрд. м 2(около 75% от общего объёма выпуска тканей). Ассортимент Х. т. насчитывает около 2500 артикулов. Ткани различаются по структуре, внешнему оформлению и назначению. Для выработки Х. т. применяются все основные виды ткацких переплетений (см. ) .Выпускаются суровыми, отбелёнными, мерсеризованными (см. ) ,гладкокрашеными, набивными, пестроткаными, меланжевыми, ворсованными. Для получения ворсованных тканей используют аппаратную пряжу, для получения внешних эффектов - фасонные нити (с утолщениями, петлями и т.п.). Х. т. гигиеничны, имеют высокую прочность, стойкость к истиранию, стирке, воздействию света, но не обладают необходимой упругостью, т. е. вытягиваются и сильно мнутся. По назначению Х. т. разделяются на бытовые и технические (см. ) .Около 80% Х. т. составляют бытовые ткани: одёжные (бельевые, сорочечные, платьевые, костюмные и др.), влаговпитывающие и декоративные. Бельевые ткани вырабатываются в основном из кардной и гребенной пряжи, главным образом полотняным переплетением. Тяжёлые ткани (масса 1 м 2100-165 г) -отбелённые и полотна - используются для мужского и постельного белья, лёгкие ткани (масса 1 м 270-100 г) - , и др. - для женского и детского белья. Для детского белья выпускаются также ткани с начёсом - фланели и др. Сорочечные Х. т. ( ,пике, репс и др.) вырабатываются главными и мелкоузорчатыми переплетениями из кардной и гребенной хлопчатобумажной и хлопко-вискозной пряжи (75% хлопка и 25% вискозного волокна), а также с использованием в утке вискозных нитей. Масса 1 м 2100-250 г.Платьевые Х. т. ( , , , и др.) вырабатываются всеми видами ткацких переплетений из хлопчатобумажной и хлопко-вискозной кардной и гребенной пряжи, а также с использованием вискозных и ацетатных нитей. В зависимости от сезонного назначения имеют массу 1 м 260-270 г.Костюмные Х. т. (трико, , и др.) изготовляются полотняным, саржевым и комбинированными переплетениями из одиночной и кручёной хлопчатобумажной и смешанной пряжи, содержащей до 25% капронового или лавсанового волокна. Масса 1 м 2 170-450 г. Влаговпитывающие Х. т. применяют для полотенец (лицевых, махровых) и носовых платков. Полотенца вырабатывают из кардной пряжи. Масса 1 м 2150-380 г.Обладают хорошей влагоёмкостью благодаря высокой гигроскопичности пряжи и использованию вафельного или ворсового переплетения. Носовые платки изготовляют из гребенной пряжи полотняным переплетением. Декоративные ткани (гобеленовые, ворсовые и др.) используются для обивки мебели и изготовления портьер. Вырабатываются из кручёных нитей полотняным, мелко- и крупноузорчатым переплетениями (иногда с использованием вискозной пряжи). Кроме перечисленных Х. т., вырабатываются также марля, технические ткани различного назначения, тарные и упаковочные ткани, а также байковые и летние одеяла, покрывала и скатерти. См. также , .
Лит.:Пожидаев Н. Н., Симоненко Д. Ф., Савчук Н. Г., Материалы для одежды, М, 1975. Н. В. Муллер, Л. В. Потапова. Хлопчатое дерево Хлопча'тое де'рево,хлопковое дерево, капоковое дерево (Ceiba pentandra), дерево семейства бомбаксовых, произрастающее в тропической Америке. Из его плодов получают .Культивируют в тропических странах обоих полушарий. Хлопы Хло'пы(польск. chBopi), зависимые крестьяне в феодальной Польше. Термин «Х.», содержавший первоначально уничижительный оттенок, применительно к истории употребляется в польской литературе и как синоним других наименований крестьян. Хлопья Хло'пья,пищевой продукт, вырабатываемый из зёрен кукурузы, пшеницы, риса, овса и др. злаковых культур; изготовляют путём удаления с зёрен оболочек, отделения зародышей, получения крупы, её варки в сахарно-солевом сиропе, плющения в тонкие лепестки и их обжарки в печах. В СССР выпускаются кукурузные и пшеничные Х. простые (натуральные), глазированные в сахаре или в шоколаде и солёные; готовы к употреблению в пищу без кулинарной обработки. Вырабатываются также овсяные сырые хлопья (т. н. «Геркулес») для варки каш. Хлор Хлор(лат. Chlorum), Cl, химический элемент VII группы периодической системы Менделеева, атомный номер 17, атомная масса 35,453; относится к семейству .При нормальных условиях (0°С, 0,1 Мн/м 2или 1 кгс/см 2) жёлто-зелёный газ с резким раздражающим запахом. Природный Х. состоит из двух стабильных изотопов: 35Cl (75,77%) и 37Cl (24,23%). Искусственно получены радиоактивные изотопы с массовыми числами 32, 33, 34, 36, 38, 39, 40 и периодами полураспада ( T 1 /2) соответственно 0,31; 2,5; 1,56 сек; 3 ,1Ч10 5лет; 37,3, 55,5 и 1,4 мин. 36Cl и 38Cl используются как . Историческая справка. Х. получен впервые в 1774 К. взаимодействием соляной кислоты с пиролюзитом MnO 2. Однако только в 1810 Г. установил, что хлор - элемент и назвал его chlorine (от греч. chlorуs - жёлто-зелёный). В 1813 Ж. Л. предложил для этого элемента название Х. Распространение в природ е. Х. встречается в природе только в виде соединений. Среднее содержание Х. в земной коре (кларк) 1,7Ч10 -2% по массе, в кислых изверженных породах - гранитах и др. 2,4Ч10 -2 ,в основных и ультраосновных 5Ч10 -3. Основную роль в истории Х. в земной коре играет водная миграция. В виде иона Cl он содержится в Мировом океане (1,93%), подземных рассолах и соляных озёрах. Число собственных минералов (преимущественно ) 97, главный из них галит NaCI (см. ) .Известны также крупные месторождения хлоридов калия и магния и смешанных хлоридов: KCl, (Na, K) CI, KCIЧMgCl 2Ч6H 2O, KCIЧMgSO 4Ч3H 2O, бишофит MgCI 2Ч6H 2O. В истории Земли большое значение имело поступление содержащегося в вулканических газах HCl в верхние части земной коры. Физические и химические свойства. Х. имеет
t
kип-34,05°С,
t
nл-101°С. Плотность газообразного Х. при нормальных условиях 3,214
г/л; насыщенного пара при 0°С 12,21
г/л; жидкого Х. при температуре кипения 1,557
г/см
3
;твёрдого Х. при - 102°C 1,9
г/см
3
.Давление насыщенных паров Х. при 0°С 0,369; при 25°C 0,772; при 100°C 3,814
Мн/м
2или соответственно 3,69; 7,72; 38,14
кгс/см
2
.Теплота плавления 90,3
кдж/кг(21,5
кал/г); теплота испарения 288
кдж/кг(68,8
кал/г); теплоёмкость газа при постоянном давлении 0,48
кдж/(
кгЧ
К) [0,11
кал/(
гЧ
°С)]
.Критические константы Х.: температура 144°C, давление 7,72
Мн/м
2(77,2
кгс/см
2)
,плотность 573
г/л, удельный объём 1,745Ч10
-3
л/г. Растворимость (в
г/л) Х. при парциальном давлении 0,1
Мн/м
2
,или 1
кгс/см
2
,в воде 14,8 (0°С), 5,8 (30°C), 2,8 (70°C); в растворе 300
г/лNaCI 1,42 (30°C), 0,64 (70°C). Ниже 9,6°С в водных растворах образуются гидраты Х. переменного состава ClЧ
nH
2O (где n = 6ё8); это жёлтые кристаллы кубической сингонии, разлагающиеся при повышении температуры на Х. и воду. Х. хорошо растворяется в TiCl
4, SiC1
4, SnCl
4и некоторых органических растворителях (особенно в гексане C
6H
14
и четырёххлористом углероде CCl
4). Молекула Х. двухатомна (Cl
2). Степень термической диссоциации Cl
2+ 243
кджЫ 2Cl
при 1000 К равна 2,07Ч10
-40%, при 2500 К 0,909%. Внешняя электронная конфигурация атома Cl 3
s
23
p
5
.В соответствии с этим Х. в соединениях проявляет степени окисления -1, +1, +3, +4, +5, +6 и +7. Ковалентный радиус атома 0,99
Химически Х. очень активен, непосредственно соединяется почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании) и с неметаллами (кроме углерода, азота, кислорода, инертных газов), образуя соответствующие ,вступает в реакцию со многими соединениями, замещает водород в предельных углеводородах и присоединяется к ненасыщенным соединениям. Х. вытесняет бром и йод из их соединений с водородом и металлами; из соединений Х. с этими элементами он вытесняется фтором. Щелочные металлы в присутствии следов влаги взаимодействуют с Х. с воспламенением, большинство металлов реагирует с сухим Х. только при нагревании. Сталь, а также некоторые металлы стойки в атмосфере сухого Х. в условиях невысоких температур, поэтому их используют для изготовления аппаратуры и хранилищ для сухого Х. Фосфор воспламеняется в атмосфере Х., образуя PCl 3, а при дальнейшем хлорировании - PCl 5; сера с Х. при нагревании даёт S 2Cl 2, SCl 2и др. S n Cl m . Мышьяк, сурьма, висмут, стронций, теллур энергично взаимодействуют с Х. Смесь Х. с водородом горит бесцветным или жёлто-зелёным пламенем с образованием (это цепная реакция), Максимальная температура водородно-хлорного пламени 2200°C. Смеси Х. с водородом, содержащие от 5,8 до 88,5% H 2, взрывоопасны. С кислородом Х. образует окислы: Cl 2O, ClO 2, Cl 2O 6, Cl 2O 7, Cl 2O 8(см. ) ,а также гипохлориты (соли ) , , и перхлораты. Все кислородные соединения хлора образуют взрывоопасные смеси с легко окисляющимися веществами. Окислы Х. малостойки и могут самопроизвольно взрываться, гипохлориты при хранении медленно разлагаются, хлораты и перхлораты могут взрываться под влиянием инициаторов. Х. в воде гидролизуется, образуя хлорноватистую и соляную кислоты: Cl 2+ H 2O Ы HClO + HCl. При хлорировании водных растворов щелочей на холоду образуются гипохлориты и хлориды: 2NaOH + Cl 2= NaCIO + NaCI + H 2O, а при нагревании - хлораты. Хлорированием сухой гидроокиси кальция получают . При взаимодействии аммиака с Х. образуется трёххлористый азот (см. ) .При хлорировании органических соединений Х. либо замещает водород: R-H + CI 2= RCl + HCI, либо присоединяется по кратным связям:
Х. образует с др. галогенами .Фториды ClF, ClF 3, ClF 5очень реакционноспособны; например, в атмосфере ClP 3стеклянная вата самовоспламеняется. Известны соединения хлора с кислородом и фтором - оксифториды Х.: ClO 3F, ClO 2F 3, ClOF, ClOF 3и перхлорат фтора FClO 4. Получение. Х. начали производить в промышленности в 1785 взаимодействием соляной кислоты с двуокисью марганца или пиролюзитом. В 1867 английский химик Г. Дикон разработал способ получения Х. окислением HCl кислородом воздуха в присутствии катализатора. С конца 19 - начала 20 вв. Х. получают электролизом водных растворов хлоридов щелочных металлов. По этим методам в 70-х гг. 20 в. производится 90-95% Х. в мире. Небольшие количества Х. получаются попутно при производстве магния, кальция, натрия и лития электролизом расплавленных хлоридов. В 1975 мировое производство Х. составляло около 25 млн. т.Применяются два основных метода электролиза водных растворов NaCI: 1) в электролизёрах с твёрдым катодом и пористой фильтрующей диафрагмой; 2) в электролизёрах с ртутным катодом. По обоим методам на графитовом или окисном титано-рутениевом аноде выделяется газообразный Х. По первому методу на катоде выделяется водород и образуется раствор NaOH и NaCl, из которого последующей переработкой выделяют товарную каустическую соду. По второму методу на катоде образуется амальгама натрия, при её разложении чистой водой в отдельном аппарате получаются раствор NaOH, водород и чистая ртуть, которая вновь идёт в производство. Оба метода дают на 1 тХ. 1,125 тNaOH. Электролиз с диафрагмой требует меньших капиталовложений для организации производства Х., даёт более дешёвый NaOH. Метод с ртутным катодом позволяет получать очень чистый NaOH, но потери ртути загрязняют окружающую среду. В 1970 по методу с ртутным катодом производилось 62,2% мировой выработки Х., с твёрдым катодом 33,6% и пр. способами 4,2%. После 1970 начали применять электролиз с твёрдым катодом и ионообменной мембраной, позволяющий получать чистый NaOH без использования ртути. Применение. Одной из важных отраслей химической промышленности является хлорная промышленность. Основные количества Х. перерабатываются на месте его производства в хлорсодержащие соединения. Хранят и перевозят Х. в жидком виде в баллонах, бочках, ж.-д. цистернах или в специально оборудованных судах. Для индустриальных стран характерно следующее примерное потребление Х.: на производство хлорсодержащих органических соединений - 60-75%; неорганических соединений, содержащих Х., - 10-20%; на отбелку целлюлозы и тканей - 5-15%; на санитарные нужды и хлорирование воды - 2-6% от общей выработки. Х. применяется также для хлорирования некоторых руд с целью извлечения титана, ниобия, циркония и др. О хлорсодержащих органических соединениях см. , , , , , , , , и др. О хлорсодержащих неорганических соединениях см. , , , , , и др. Л. М. Якименко.
Х. в организме. Х. - один из ,постоянный компонент тканей растений и животных. Содержание Х. в растениях (много Х. в ) -от тысячных долей процента до целых процентов, у животных - десятые и сотые доли процента. Суточная потребность взрослого человека в Х. (2-4 г) покрывается за счёт пищевых продуктов. С пищей Х. поступает обычно в избытке в виде хлорида натрия и хлорида калия. Особенно богаты Х. хлеб, мясные и молочные продукты. В организме животных Х. - основное осмотически активное вещество плазмы крови, лимфы, спинномозговой жидкости и некоторых тканей. Играет роль в ,способствуя удержанию тканями воды. Регуляция кислотно-щелочного равновесия в тканях осуществляется наряду с др. процессами путём изменения в распределении Х. между кровью и др. тканями. Х. участвует в энергетическом обмене у растений, активируя как ,так и фотофосфорилирование. Х. положительно влияет на поглощение корнями кислорода. Х. необходим для образования кислорода в процессе фотосинтеза изолированными .В состав большинства питательных сред для искусственного культивирования растений Х. не входит. Возможно, для развития растений достаточны весьма малые концентрации Х. М. Я. Школьник.
Отравления Х. возможны в химической, целлюлозно-бумажной, текстильной, фармацевтической промышленности и др. Х. раздражает слизистые оболочки глаз и дыхательных путей. К первичным воспалительным изменениям обычно присоединяется вторичная инфекция. Острое отравление развивается почти немедленно. При вдыхании средних и низких концентраций Х. отмечаются стеснение и боль в груди, сухой кашель, учащённое дыхание, резь в глазах, слезотечение, повышение содержания лейкоцитов в крови, температуры тела и т.п. Возможны бронхопневмония, токсический отёк лёгких, депрессивные состояния, судороги. В лёгких случаях выздоровление наступает через 3-7 сут.Как отдалённые последствия наблюдаются катары верхних дыхательных путей, рецидивирующий бронхит, пневмосклероз и др.; возможна активизация туберкулёза лёгких. При длительном вдыхании небольших концентраций Х. наблюдаются аналогичные, но медленно развивающиеся формы заболевания. Профилактика отравлений: герметизация производственного оборудования, эффективная вентиляция, при необходимости использование противогаза. Предельно допустимая концентрация Х. в воздухе производственных помещений 1 мг/м 3 .Производство Х., хлорной извести и др. хлорсодержащих соединений относится к производствам с вредными условиями труда, где по сов. законодательству ограничено применение труда женщин и несовершеннолетних. А. А. Каспаров.
Лит.:Якименко Л. М., Производство хлора, каустической соды и неорганических хлорпродуктов, М., 1974; Некрасов Б. В., Основы общей химии, 3 изд., [т.] 1, М., 1973; Вредные вещества в промышленности, под ред. Н. В, Лазарева, 6 изд., т. 2, Л., 1971; Comprehensive inorganic chemistry, ed. J. C. Bailar [a. o.], v. 1-5, Oxf. - [a. o.], 1973. Хлора окислы Хло'ра о'кислы,соединения хлора с кислородом: Cl 2O, ClO 2, Cl 2O 6, Cl 2O 7, Cl 2O 8. Х. окись (оксид хлора, ангидрид ) ,Cl 2O, жёлто-коричневый газ с резким запахом, похожим на запах хлора; t nл-121 °С; t kип2 °С. Энергичный окислитель; нестойкое соединение, в обычных условиях медленно разлагается, в концентрированном и сжиженном виде может самопроизвольно взрываться: 2Cl 2O = 2Cl 2+ O 2. Хорошо растворима в воде (в 1 объёме воды около 200 объёмов Cl 2O) и четырёххлористом углероде; при растворении в воде образуется хлорноватистая кислота HClO. Может быть получена взаимодействием хлора со свежеосаждённой сухой окисью ртути: 2HgO + 2Cl 2= HgCl 2+ Cl 2O. В промышленности получают водные растворы окиси хлора хлорированием карбонатов щелочных или щёлочноземельных металлов в воде. Используют окись хлора для производства гипохлорита кальция. Х. двуокись (диоксид хлора, смешанный ангидрид и ) ,ClO 2, желтовато-оранжевый газ с неприятным запахом; t пл-59 °С; t kип10 °С. Энергичный окислитель (особенно в кислой среде); в концентрированном виде взрывается; на свету постепенно разлагается, выше 50°C разложение сопровождается взрывом. Хорошо растворима в воде, серной и уксусной кислотах, четырёххлористом углероде. При взаимодействии с щелочными растворами образует и .Получают ClO 2частичным восстановлением хлоратов SO 2, щавелевой или соляной кислотами; в малых количествах действием хлора на хлорит натрия: 2NaClO 2+ Cl 2= 2NaCI + 2ClO 2. Широко используется в виде водного раствора или в газообразном виде в смеси с воздухом для отбелки и стерилизации целлюлозы, тканей, муки. Взаимодействие ClO 2с водными растворами NaOH в присутствии восстановителя используют для промышленного получения хлоритов. Х. трёхокись (смешанный ангидрид и хлорноватой кислоты), Cl 2O 6, дымящая жидкость тёмно-красного цвета; t nл3,5 °С; t kип203°C; при контакте с легкоокисляющимися веществами взрывается. В кристаллическом состоянии имеет строение перхлората хлорила ClO + 2ClO 4 -. Энергично реагирует с водой. Может быть получена окислением двуокиси хлора озоном или взаимодействием хлоратов с фтором: 2KClO 3+ F 2= 2KF + Cl 2O 6. Cl 2O 6всегда присутствует в продуктах термического разложения хлорной кислоты. Практического применения не находит. Хлорный ангидрид, Cl 2O 7, бесцветная жидкость; t nл-93 °С; t kип83°C; при хранении медленно разлагается и окрашивается продуктами распада - низшими окислами хлора. Cl 2O 7, особенно загрязнённый продуктами распада, самопроизвольно взрывается. При комнатной температуре растворяется в четырёххлористом углероде. С водой реагирует с образованием хлорной кислоты. При контакте с йодом взрывается. Cl 2O 7может быть получен обезвоживанием хлорной кислоты фосфорным ангидридом или олеумом, а также при низкотемпературном электролизе концентрированной хлорной кислоты на платиновом аноде. Практического применения не имеет. Cl 2O 8- промежуточный продукт при электролизе хлорной кислоты и её солей. В индивидуальном состоянии не выделен. Помимо перечисленных кислородных соединений хлора в литературе упоминается Cl 2O 4, отвечающее структуре перхлорита хлора ClOClO 3; может быть получено взаимодействием фторсульфоната хлора и CsClO 4. Лит.см. при ст. . Л. М. Якименко. Хлоралгидрат Хлоралгидра'т,лекарственный препарат; см. в ст. . Хлораль Хлора'ль,трихлоруксусный альдегид, CCl 3CHO, бесцветная жидкость с резким запахом, t kип97,75 °С. Х. энергично взаимодействует с водой, спиртом, аммиаком, образуя хорошо кристаллизующиеся продукты (см. ) .Получают хлорированием этилового спирта; используют в производстве , напримерхлорофоса, 4,4'-дихлордифенил-трихлорэтана (т. н. ДДТ), ,трихлоруксусной кислоты, хлороформа. Хлоральгидрат Хлоральгидра'т,2,2,2-трихлорэтандиол-1,1,ССl 3CH(OH) 2, бесцветные кристаллы, растворимые в воде, спирте и эфире, t nл53 °С. Получают Х. взаимодействием с водой. Х. - лекарственный препарат из группы .Обладает также успокаивающим, аналгезирующим и противосудорожным действием. Применяют внутрь (в порошках и таблетках) и в клизмах преимущественно при нарушениях сна, психическом возбуждении, эпилепсии; входит в состав зубных капель «Дента». Хлораминометрия Хлораминоме'трия,титриметрический метод определения восстановителей; основан на применении титрованных растворов -хлорамина Т или хлорамина Б. Реагенты проявляют окислительные свойства только в присутствии галогенид-ионов. Конечную точку титрования устанавливают визуально с помощью различных индикаторов, потенциометрически или амперометрически с платиновым вращающимся микроэлектродом. Х. используется для определения, напр As (III), Sb (III), Hg (I), Fe (II), I -, азотсодержащих (нитриты), серусодержащих (сероводород и его производные, сульфиты) соединений, альдегидов, кетонов и др. неорганических и органических соединений. Лит.:Берка А., Вултерин Я., Зыка Я., Новые ред-окс-методы в аналитической химии, М., 1968, с. 61-84. Хлорамины Хлорами'ны,хлорпроизводные аммиака (неорганические Х.) и аминов (органические Х.), в молекулах которых атом хлора связан с азотом. О неорганические Х. см. ст. . Органические Х.- жидкости или твёрдые вещества, обладающие резким запахом; раздражают верхние дыхательные пути. Например, N-xлордиметиламин (CH 3)2NCl кипит при 46 °С, N, N-дихлорметиламин CH 3KCl 2- при 58-60 °С, N,N-дихлорэтиламин C 2H 5NCl 2и N-xлордиэтиламин (C 2H 5)2NCl - при 91 °С;
Очень часто название «хлорамины» применяют для обозначения N-xлорпроизводных амидов органических и неорганических кислот. Большое практическое применение нашли хлор- и дихлорамиды ароматических сульфокислот, например т. н. хлорамин Б C 6H 5SO 2NNaCIЧ3H 2O (натриевая соль N-xлорамида бензолсульфокислоты), хлорамин Т (CH 3)C 6H 4SO 2NNaCIЧ3H 2O (натриевая соль N-xлорамида n-толуолсульфокислоты) - бесцветные кристаллы, t пл180-185°C и 175-180°C соответственно, хорошо растворимы в воде и спирте; дихлорамин Б (N, N-дихлорбензол-сульфамид) и дихлорамин Т (N,N-дихлор-n-толуолсульфамид) - кристаллы с запахом хлора, t пл69-72 °С и 80-83 °C соответственно, нерастворимы в воде, растворяются в органических растворителях (обычно используют дихлорэтан). Х, обладают окислительным и хлорирующим действием, благодаря чему их используют в аналитической химии (см. 1, 2, 3, 4, 5, 6, 7 |
|||||||
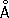 , ионный радиус Cl
-1,82
, ионный радиус Cl
-1,82
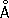 , сродство атома Х. к электрону 3,65
эв,энергия ионизации 12,97
эв.
, сродство атома Х. к электрону 3,65
эв,энергия ионизации 12,97
эв. образуя различные хлорсодержащие органические соединения (см.
)
.
образуя различные хлорсодержащие органические соединения (см.
)
. гексахлормеламин - желтоватые кристаллы,
t
nл149 °С. Водой (в т. ч. влагой воздуха) Х. разлагаются с образованием амина и хлорноватистой кислоты HOCl; растворы Х. в органических растворителях довольно устойчивы. Получают Х. действием хлора или хлорноватистой кислоты на амины и их соли.
гексахлормеламин - желтоватые кристаллы,
t
nл149 °С. Водой (в т. ч. влагой воздуха) Х. разлагаются с образованием амина и хлорноватистой кислоты HOCl; растворы Х. в органических растворителях довольно устойчивы. Получают Х. действием хлора или хлорноватистой кислоты на амины и их соли.