 |
|
Популярные авторы:: Борхес Хорхе Луис :: Эллисон Харлан :: Азимов Айзек :: БСЭ :: Грин Александр :: Чехов Антон Павлович :: Толстой Лев Николаевич :: Раззаков Федор :: Горький Максим :: Андреев Леонид Николаевич Популярные книги:: The Boarding House :: Дюна (Книги 1-3) :: Ярмарка Святого Петра :: Памятные встречи :: Колумбы каменного века :: Контактов не будет (сборник) :: Гость :: Сожженная заживо :: Каштанка :: Десятое правило волшебника, или Фантом |
Большая Советская Энциклопедия (ГА)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ГА) - Чтение (стр. 18)
Здесь k - Больцмана постоянная, m -масса молекулы. Уравнение (1) позволяет установить связь между средней кинетической энергией одной молекулы и температурой газа:
Эту зависимость часто рассматривают как молекулярно-кинетическое толкование температуры - температура есть мера кинетической энергии молекул. Поскольку молекулы идеального Г. обладают лишь кинетической энергией, внутренняя энергия такого Г. не зависит от занимаемого им объёма (закон Джоуля). Молекулярно-кинетическая теория рассматривает давление Г. на стенки сосуда, в котором он находится, как воздействие ударов молекул, усреднённое по поверхности и времени. Количественно давление ропределяется импульсом, передаваемым молекулами в единицу времени единице площади стенки:
где n -число молекул в единице объёма. Уравнения (2) и (3) позволяют записать уравнение состояния идеального Г. в виде p= nkT. (4) уравнение (4), записанное для 1 моляГ., содержащего N= 6,023- 10 23молекул (см. Авогадро число ) ,называют Клапейрона уравнением: pv= RT. (5) Здесь R= kN -универсальная газовая постоянная, v -объём, приходящийся на 1 моль.уравнение Клапейрона обобщает эмпирические газовые законы Бойля - Мариотта и Гей-Люссака (см. Бойля - Мариотта закон , Гей-Люссака законы ) .Из уравнения (5) следует также, что при одинаковых температуре и давлении идеальные Г., взятые в количестве 1 моля,имеют равные объёмы и в любом таком Г. в единице объёма содержится равное количество молекул (см. Авогадро закон ) . В условиях теплового равновесия температура и давление Г. по всему его объёму одинаковы, молекулы движутся хаотично, в Г. нет упорядоченных потоков. Возникновение в Г. перепадов (градиентов) температуры или давления приводит к нарушению равновесия и переносу в направлении градиента энергии, массы или др. физических величин. Кинетические свойства Г. - теплопроводность, диффузию, вязкость - молекулярно-кинетическая теория рассматривает с единой точки зрения:
диффузию
как перенос молекулами массы,
теплопроводность
как перенос ими энергии,
вязкость
как перенос количества движения. Модель идеального Г. для анализа явлений переноса непригодна, ибо в этих процессах существенную роль играют столкновения молекул (при которых происходит передача какой-нибудь из переносимых величин, например энергии) и «размер» молекул (влияющий на частоту столкновений). Поэтому в простейшем случае явления переноса в Г. рассматриваются для разреженного Г., молекулы которого в первом приближении считаются упругими шариками с определённым диаметром s
,причём эти шарики взаимодействуют друг с другом только в момент соударения. В этом приближении диаметр молекулы связан простым соотношением с её средней
длиной свободного пробега
Размер
В более строгой молекулярной теории при анализе явлений переноса в разреженных газах учитывается взаимодействие молекул при любых расстояниях между ними. Характер взаимодействия определяется т. н. потенциалом взаимодействия (см. Межмолекулярное взаимодействие ) .Строгое рассмотрение динамики парных взаимодействий (столкновений) приводит к тому, что в формулах для расчёта коэффициентов переноса появляются т. н. интегралы столкновений, являющиеся функциями только приведённой температуры T* = kT/e. Эта температура характеризует отношение кинетической энергии молекул ( ~kT) к их потенциальной энергии ( e- глубина потенциальной ямы при данном потенциале взаимодействия). Интегралы столкновений учитывают то обстоятельство, что сталкивающиеся молекулы в зависимости от их кинетической энергии, а значит и температуры Г., могут сближаться на различные расстояния, т. е. как бы изменять свой эффективный размер. Свойства реальных Г. При повышении плотности изменяются свойства Г., они перестают быть идеальными. Уравнение состояния (5) оказывается неприменимым, т. к. средние расстояния между молекулами Г. становятся сравнимыми с радиусом межмолекулярного взаимодействия. Для описания термодинамических свойств неидеальных, или, как их чаще называют, реальных, Г. пользуются различными уравнениями состояния, имеющими более или менее строгое теоретическое обоснование. Простейшим примером уравнения, которое качественно правильно описывает основные отличия реального Г. от идеального, служит уравнение Ван-дер-Ваальса. Оно учитывает, с одной стороны, существование сил притяжения между молекулами (их действие приводит к уменьшению давления Г.), с другой стороны - сил отталкивания, препятствующих безграничному сжатию Г. (см. Ван-дер-Ваальса уравнение ). К наиболее теоретически обоснованным, во всяком случае для состояний, удалённых от критической точки, относится вириальное уравнение состояния :
Значения вириальных коэффициентов В, С и т. д. определяются соударениями молекул: парными (В), тройными (С) и более высокого порядка для последующих коэффициентов. Существенно, что вириальные коэффициенты являются функциями только температуры. В Г. малой плотности наиболее вероятны парные столкновения молекул, т. е. для такого Г. в разложении (7) можно пренебречь всеми членами после члена с коэффициента В. В соответствии с температурным изменением В, при т. н. температуре Бойля Т В(см. Бойля точка ) Вобращается в нуль, и умеренно плотный Г. ведёт себя как идеальный, т. е. подчиняется уравнению (5). Физически это означает, что при Т Вмежмолекулярные силы притяжения и отталкивания практически компенсируют друг друга. Существование межмолекулярного взаимодействия в той или иной степени сказывается на всех свойствах реальных Г. Внутренняя энергия реального Г. оказывается зависящей от его объёма (от расстояний между молекулами), т. к. потенциальная энергия молекул определяется их взаимными расстояниями. С межмолекулярным взаимодействие связано также изменение температуры реального Г. при протекании его с мало постоянной скоростью через пористую перегородку (этот процесс называется дросселированием ). Мерой изменения температуры Г при дросселировании служит Джоуля - Томсона коэффициент который в зависимости от условий может быть положительным (охлаждение Г.), отрицательным (нагрев Г.) либо равным нулю при т. н. температуре инверсии (см. Джоуля - Томсона явление ). Эффект охлаждения Г при дросселировании широко применяется в технике как один из методов сжижения газов. Внутреннее строение молекул Г. слабо влияет на их термические свойства (давление, температуру, плотность и связь между ними). Для этих свойств в первом приближении существенна только молекулярная масса Г. Напротив, калорические свойства Г. (теплоёмкость, энтропия и др.), а также его электрические и магнитные свойства существенно зависят от внутреннего строения молекул. Например, для расчёта (в первом приближении) теплоёмкости Г. при постоянном объёме c vнеобходимо знать число внутренних степеней свободы молекулы (т. е. число возможных внутренних движений) i вн. В соответствии с равнораспределения законом классической статистической физики на каждую степень свободы молекулы Г. (поступательную, колебательную, вращательную) приходится энергия, равная 1/ 2· kT. Отсюда теплоёмкость 1 моля
Для точного расчёта калорических свойств Г. необходимо знать уровни энергии молекулы, сведения о которых в большинстве случаев получают из анализа спектров Г. Для большого числа веществ в состоянии идеального Г. калорические свойства вычислены с высокой точностью и их значения представлены в виде таблиц до температур 10-22 тыс. градусов. Электрические свойства Г. связаны в первую очередь с возможностью ионизации молекул или атомов, т. е. с появлением в Г. электрически заряженных частиц (ионов и электронов). При отсутствии заряженных частиц Г. являются хорошими диэлектриками. С ростом концентрации зарядов электропроводность Г. увеличивается. Зависимость электропроводности Г. от различных физических факторов рассмотрена в ст. Электрический разряд в газах . При температурах начиная с нескольких тыс. градусов всякий Г. частично ионизуется и превращается в плазму . Если концентрация зарядов в плазме невелика, то свойства её мало отличаются от свойств обычного Г. По магнитным свойствам Г. делятся на диамагнитные (к ним относятся, например, инертные газы, H 2, N 2, CO 2, H 2O) и парамагнитные (например, O 2). Диамагнитны те Г., молекулы которых не имеют постоянного магнитного момента и приобретают его лишь под влиянием внешнего поля (см. Диамагнетизм ). Те же Г., у которых молекулы обладают постоянным магнитным моментом, во внешнем магнитном поле ведут себя как парамагнетики (см. Парамагнетизм ). Учёт межмолекулярного взаимодействия и внутреннего строения молекул необходим при решении многих проблем физики Г., например при исследовании влияния верхних разреженных слоев атмосферы на движение ракет и спутников (см. Газовая динамика , Аэродинамика разреженных газов ). В современной физике Г. называют не только одно из агрегатных состояний вещества. К Г. с особыми свойствами относят, например, совокупность свободных электронов в металле (электронный Г.), фононов в жидком гелии (фононный Г.) и т. д. Г. элементарных частиц и квазичастиц обладающих целым спином , т. н. бозонов(например, фотонов, p-мезонов, фононов), называется бозе-газом. Его свойства рассматривает квантовая статистика Бозе - Эйнштейна. Свойства частиц Г. с полуцелым спином - фермионов (например, электронов, нейтронов, нейтрино, дырок проводимости и др.) рассматривает квантовая статистика Ферми - Дирака (см. Статистическая физика ). Физические свойства газов
Лит.:Кириллин В. А., Сычев В. В. и Шейндлин А. Е., Техническая термодинамика, М., 1969; Кикоин И. К. и Кикоин А. К., Молекулярная физика, М., 1963; Гиршфельдер Дж., Кертисс Ч., Берд Р., Молекулярная теория газов и жидкостей, пер. с англ., М., 1961; Термодинамические свойства индивидуальных веществ. Справочник, под ред. В. П. Глушко, 2 изд., т. 1-2, М., 1962. Э. Э. Шпильрейн. 
Рис. 1. р, Т-диаграмма состояния вещества. Область газообразного состояния заштрихована. Со стороны низких температур и давлений она ограничена кривыми сублимации (I) и парообразования (II). Т р- тройная точка, К - критическая точка. Штриховой линией показана критическая изохора вещества. 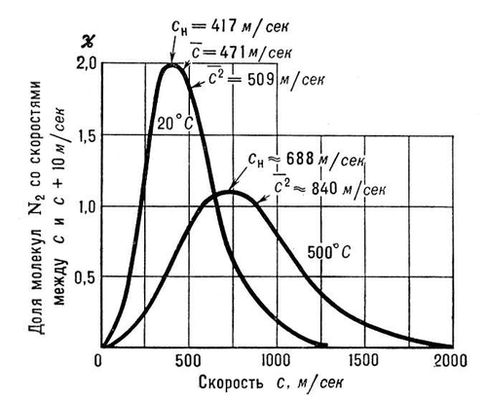
Рис. 2. Распределение Максвела для молекул азота при температурах 20 и 500°С. По оси ординат отложена доля молекул (в %), обладающих скоростями между с и (с + 10)
м/сек; с
н- наиболее вероятная скорость, которой обладает наибольшее число молекул при данной температуре;
Газы в металлах Га'зыв металлах. Г. попадают в твердые и жидкие металлы при их выплавке и электролитическом получении, при взаимодействии металлических изделий с атмосферой. Например, при производстве стали из чугуна в мартеновских печах или в конверторах в расплавленный металл из печной атмосферы попадают кислород и азот; при получении никеля электролизом его водных растворов твёрдый металл насыщается водородом, выделяющимся на катоде. Различают 3 вида взаимодействия межу Г. и металлами: адсорбцию , растворение и образование химических соединений. При адсорбции Г. взаимодействуют только с поверхностью металла и образуют на ней плёнки толщиной, равной диаметру одной или несколько молекул. Адсорбция уменьшается при повышении температуры и понижении давления Г. над металлом. Г., адсорбированные на металлических частях электровакуумных приборов (применяемых в измерительной аппаратуре), радиопередающих устройств, преобразователей электрической энергии, в процессе эксплуатации десорбируются и нарушают устойчивую работу аппаратуры (например, изменяют электропроводность). Удаление адсорбированных Г. при изготовлении такой аппаратуры достигается глубокой откачкой, применением поглотителей Г. ( геттеров ) и является одной из важнейших задач вакуумной техники. Большинство Г., кроме инертных, образует с твёрдыми и жидкими металлами истинные растворы. Г., молекулы которых состоят из нескольких атомов (например, сернистый газ, углекислый газ, водород, азот), при растворении в металлах распадаются на атомы. Это облегчает внедрение Г. в металл, т. к. уменьшает энергию, необходимую для того, чтобы раздвинуть сильно взаимодействующие друг с другом атомы металла. Кроме того, часть затрачиваемой энергии компенсируется её выигрышем при химическом взаимодействии атомов Г. и металла. Поэтому растворение многоатомных газов сопровождается их диссоциацией . Например, двухатомные газы водород и азот растворяются в железе по реакциям H 2= 2Н в железе; N 2„ = 2N в железе. Растворимость Г. в расплавленных металлах значительно выше, чем в твёрдых. Это часто приводит к ухудшению качества металлических слитков из-за образования в них газовых пузырей, внутренних раковин и пористости. Такие дефекты возникают вследствие того, что при постепенном затвердевании слитка (кристаллизации) в изложнице концентрация Г. в остающейся жидкости настолько повышается, что Г. выделяются в ее объеме, а образующиеся при этом пузыри не успевают всплыть и удалиться до полного затвердевания слитка. Г. часто образуют с металлами химические соединения: окислы, сульфиды, нитриды. Эти соединения нерастворимы в металлах и выделяются в виде самостоятельных фаз - т. н. неметаллических включений, присутствие которых сильно ухудшает механические и антикоррозионные свойства металлов и сплавов. Поэтому в промышленности применяются различные способы удаления Г. из металлов. Один из наиболее эффективных - использование вакуумирования. При этом благодаря понижению давления Г. происходит их выделение из металлов, протекающее особенно интенсивно, когда металл находится в расплавленном состоянии. Широко распространены выплавка металлов и сплавов, особенно стали, в вакуумных печах, вакуумирование жидкого металла при разливке и в ковшах (см. Вакуумная плавка , Дегазация стали ). С такой же целью применяют продувку жидкого металла инертными газами (например, аргоном). В ряде случаев осуществляют плавку или нагрев металла в защитной газовой атмосфере, не содержащей компонентов, вредных для металла. Лит.:Смителлс К., Газы и металлы, пер. с англ., М. - Л., 1940; Вакуумная металлургия, М., 1962; Жуховицкий А. А., Шварцман Л. А., Физическая химия, М., 1963; Дэшман С., Научные основы вакуумной техники, пер. с англ., М., 1964. Л. А. Шварцман, Л. В. Ванюкова. Газы в технике Га'зыв технике, применяются главным образом в качестве топлива; сырья для химической промышленности: химических агентов при сварке, газовой химико-термической обработке металлов, создании инертной или специальной атмосферы, в некоторых биохимических процессах и др.; теплоносителей; рабочего тела для выполнения механической работы (огнестрельное оружие, реактивные двигатели и снаряды, газовые турбины, парогазовые установки, пневмотранспорт и др.): физической среды для газового разряда (в газоразрядных трубках и др. приборах). В технике используется свыше 30 различных Г. Как топливо применяют природные газы горючие и получаемые искусственно в виде основной (генераторный Г.) или побочной (коксовый, доменный и др. Г.) продукции. Основные потребители природного Г. в чёрной металлургии - доменное и мартеновское производство. С использованием природного Г. производится ежегодно около 60% цемента, 60% стекла, свыше 60% керамзита, свыше 60% керамики. Перевод стекловаренных печей на природный Г. значительно улучшает технико-экономические показатели производства стекла. В топливном балансе машиностроительной промышленности на долю горючего Г. приходится около 40%. Основными потребителями являются нагревательные и термические печи. Применение в этих печах природного Г. вместо др. видов топлива позволяет снизить стоимость нагрева, улучшить его качество, повысить кпд печей и создать более благоприятные санитарно-гигиенические условия в производственных помещениях. В топливном балансе электростанций СССР удельный вес природного Г. составляет около 20%. Применение природного Г. на электростанциях даёт значительный эффект. Кпд котельных установок на электростанциях при переводе с твёрдого на газовое топливо увеличивается на 1-4%; уменьшается на 21-26% количество обслуживающего персонала. Суммарное снижение расхода топлива за счёт повышения кпд и снижения расхода электроэнергии на собственные нужды составляет 6-7%. Сжигание Г. в топках котлов малой производительности увеличивает кпд по сравнению с котлами, использующими твёрдое топливо, на 7-20% (в зависимости от сорта топлива) и позволяет повысить производительность на 30% и более. Использование природного Г. открывает широкие возможности для создания простых, менее металлоёмких и более экономичных котлов (паровых и водогрейных), работающих на природном Г. Некоторые Г. являются в то же время исходным сырьём для технологических процессов в химической промышленности (из них вырабатывается около 200 видов различных химических продуктов); на природном Г. работает ряд крупнейших химических комбинатов СССР. Из числа Г., используемых в качестве химических агентов, воздух (атмосферный или обогащенный кислородом) и кислород получили наибольшее распространение в металлургических, химических и смежных с ними отраслях промышленности (см. Воздух и Кислород в технике). Большое значение имеют также многие др. Г.: ацетилен, хлор, фтор и редкие Г. При газовой сварке большей частью используется пламя ацетилено-кислородной смеси, позволяющее развивать очень высокую температуру (около 3200 °С). В отдельных случаях применяют атомноводородную сварку, основанную на нагреве металла водородом, превращенным в атомарное состояние под действием электрической дуги. Тепловую обработку металлов в печах часто сопровождают воздействием химических агентов, находящихся в газообразном состоянии. Насыщение поверхностного слоя стали углеродом (см. Цементация ) производится путём длительного нагрева её в атмосфере Г., диссоциирующих с выделением атомарного углерода. В установках промышленного типа для газовой цементации применяют: природный Г., бутан-пропановую смесь и др. Во избежание чрезмерного выделения сажи (или смолистых веществ) к этим Г. подмешивают генераторный газ или дымовые газы, очищенные от углекислого газа и паров воды. Г. как химические агенты применяются также в практике химико-термической обработки поверхности стали при её азотировании , цианировании , алитировании , хромировании и др. При газовой цементации стали алюминием (или хромом) её нагревают в парах хлористого алюминия (хрома). Азот, генераторный газ из антрацита или древесного угля, продукты горения некоторых Г. (после удаления из них углекислого газа и паров воды) и продукты диссоциации аммиака в металлообрабатывающей промышленности служат в качестве специальных атмосфер для борьбы с окислением и обезуглероживанием металлов, которые происходят при их нагреве в атмосфере воздуха или дымовых газов. В качестве инертных веществ для продувки взрывоопасной аппаратуры (газгольдеров, газоочистных коробок, коммуникаций и т. п.) применяют водяной пар, углекислый газ и азот, а также смесь углекислого газа с азотом, например продукты горения газообразного топлива, сжигаемого с малым избытком воздуха. Технологические аппараты большой ёмкости продуваются инертными газами перед их заполнением Г. (например, водородом). При этом вытесняется находящийся в аппарате атмосферный воздух и предотвращается образование взрывчатой смеси Г. - воздух. В электроламповой промышленности для наполнения ламп накаливания применяются азот, криптон, ксенон и др. Наполнение ламп накаливания инертным газом уменьшает скорость испарения нити и т. о. увеличивает срок службы ламп. Использование для этих целей некоторых редких Г. позволяет значительно (до 30%) увеличить световую отдачу ламп накаливания, что имеет большое значение, т. к. на нужды освещения расходуется около 20% всей вырабатываемой в СССР энергии. Широко распространено наполнение ламп накаливания аргоно-азотной смесью, особенно подходящими наполнителями являются криптон и ксенон, обладающие высокой плотностью и минимальной теплопроводностью. Г. применяются также для интенсификации некоторых биохимических процессов, Углекислый газ и чистые продукты горения бессернистого топлива могут быть и пользованы в качестве углекислого удобрения. Повышенное содержание углекислого газа (до 0,3%) в атмосфере теплиц и оранжерей ускоряет рост и увеличивает плодоношение некоторых растений. Дозревание сорванных овощей и плодов (томатов, яблок и др.) можно ускорить хранением их в атмосфере этилена. В качестве теплоносителей широко распространены следующие Г.: продукты горения (дымовые Г.), воздух и реже газообразные продукты экзотермических процессов (окисления аммиака, получения серного ангидрида и др.). Дымовые газы как теплоноситель используют: для непосредственного обогрева изделий или материалов в печах и сушилках; для получения и подогрева промежуточных теплоносителей (водяного пара, горячей воды, воздуха и др.). Для регулирования процесса нагрева дымовыми газами их можно разбавлять воздухом или отходящими газами. Иногда дымовые газы служат для транспортировки угольной пыли и её подсушки во взвешенном состоянии, В этих случаях дымовые газы являются не только теплоносителем, но и физической средой для переноса твёрдых тел, находящихся в пылевидном состоянии. Воздух как промежуточный теплоноситель используют в тех случаях, когда недопустимо загрязнение нагреваемого продукта сажей и золой, содержащимися в некоторых дымовых газах. Чаще всего воздух как теплоноситель применяется в сушилках и в некоторых системах отопления помещений. В качестве рабочих веществ для совершения механической работы Г. распространены в газовых турбинах , в огнестрельном оружии, в реактивных двигателях и снарядах, а также в двигателях внутреннего сгорания. Для наполнения дирижаблей и аэростатов используются Г., имеющие невысокую плотность. Электрический разряд в Г. (или парах) широко применяется в электротехнике для выпрямления переменного тока, преобразования постоянного тока в переменный, генерации электрических колебаний, освещения газосветными лампами и ми. др. Подбором соответствующих газов или паров металлов можно повышать излучение газосветных ламп на заданном участке спектра. Этим достигается увеличение общей световой отдачи источника света (см. Электрический разряд в газах , Газосветная трубка ). Лит.:Кортунов А. К., Газовая умышленность СССР, М., 1967; Спейшер В. А., Сжигание газа на электростанциях и в промышленности, 2 изд., М., 1967; Использование газа в промышленных и энергетических установках, в сборнике: Теория и практика сжигания газа, в. 3-4, Л., 1967-68; Рябцев И. И., Волков А. Е., Производство газа из жидких топлив для синтеза аммиака и спиртов. М., 1968. В. А. Спейшер. Газы горючие Га'зы горю'чие,газообразные вещества, способные гореть. В широком смысле слова к Г. г. относятся водород, окись углерода, сероводород, газообразные углеводороды (например, метан, этан, этилен). В технике под Г. г. обычно понимают природные и искусственные смеси этих газов, разбавленных негорючими газами, такими как двуокись углерода, азот, инертные газы, пары воды. Наибольшее значение в промышленности имеют добываемые из недр земли газы природные горючие,в составе которых содержится до 99% газообразных углеводородов, главным образом метана и его ближайших гомологов. Природные Г. г. добывают из газовых месторождений или совместно с нефтью (см. Газы нефтяные попутные ) . Искусственные смеси Г. г. получают в результате термического разложения твёрдого и жидкого топлива. Наиболее распространены: коксовый газ-продукт, получаемый при коксовании твёрдого топлива, генераторный газ, образующийся при газификации топлив, газы нефтепереработки,которые получаются при термической и термокаталитической переработке нефти и нефтепродуктов, а также доменный газ,образующийся в процессе выплавки чугуна. В отличие от природных, искусственные Г. г. содержат в своём составе пепредельные углеводороды, окись углерода и иногда значительное количество водорода. В небольшом количестве Г. г. получают также методом подземной газификации углей . Основу развития газовой промышленности СССР и ряда др. стран составляют природные горючие газы, по запасам которых СССР занимает 1-е место в мире Удельный вес природных газов в общей добыче основных видов топлива составлял в СССР 17,9% (1968). Производство искусственных Г. г. не увеличивается из-за малой эффективности переработки твёрдых топлив. Природные газы - удобный и дешёвый вид топлива, всё шире используемый в самых различных отраслях промышленности и в коммунально-бытовом хозяйстве. Применение природных газов позволяет существенно упростить многие важные технологические процессы (см. Газы в технике). Лит.:Рябцев Н. И., Природные и искусственные газы, 3 изд., М., 1967; Стаскевич Н. Л., Справочное руководство по газоснабжению, Л., 1960. Н. И. Рябцев. Газы земной коры Га'зы земно'й коры',газы, встречающиеся в земной коре в свободном состоянии, в виде раствора в воде и нефти и в состоянии, сорбированном породами, особенно ископаемыми углями. Количество газов в геосферах Земли возрастает в глубь планеты (табл. 1). В зависимости от существа газообразующих процессов различают до 9 генетических групп Г. з. к., из которых важнейшими являются газы катагенетические, метаморфические, вулканические, биохимические, радиоактивного и воздушного происхождения; остальные группы газов (газы ядерных реакций, газы радиохимического происхождения и газы подкоровых глубин) имеют в условиях земной коры второстепенное значение. Газы катагенетического происхождения (см. Катагенез в литологии) возникают в результате преобразования органического вещества, заключённого в осадочных породах, при их погружении на глубины и одновременном увеличении давления от 10 до 200-250 мн/м 2(от 100 до 2000-2500 атм) и температуры (от 25-30 °С до 250-300 °C). К катагенетическим газам относится основная масса горючих газов (см. Газы природные горючие ) . 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


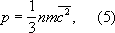
 :
:
 существенно влияет на процессы переноса в разреженном Г. В частности, если характерный размер объёма, занимаемого Г., больше
существенно влияет на процессы переноса в разреженном Г. В частности, если характерный размер объёма, занимаемого Г., больше
 , то теплопроводность и вязкость Г. не зависят от давления. Наоборот, когда
, то теплопроводность и вязкость Г. не зависят от давления. Наоборот, когда
 больше характерного размера, теплопроводность и вязкость Г. с уменьшением давления (а значит, и числа столкновений) начинают падать. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов с двойными стенками, воздух между которыми откачан (см.
Дьюара сосуды
).
больше характерного размера, теплопроводность и вязкость Г. с уменьшением давления (а значит, и числа столкновений) начинают падать. На этом явлении, в частности, основаны теплоизолирующие свойства сосудов с двойными стенками, воздух между которыми откачан (см.
Дьюара сосуды
).
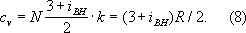
 - средняя арифметическая скорость молекул;
- средняя арифметическая скорость молекул;
 - средняя квадратичная скорость.
- средняя квадратичная скорость.