Азеотропная смесь содержит 38,26% HF,
t
kип112°С (750
мм рт. ст.), плотность 1,138
г/см
3. Ф. к. реагирует с окислами с образованием
. Растворяет фториды, образуя с ними комплексные соединения; интенсивно реагирует с силикатными материалами (в частности, со стеклом). Применяется как растворитель, служит для травления стекла, а также реагентом для получения фторидов.
Лит.см. при ст.
.
Фтористый водород
Фто'ристый водоро'д,HF, соединение фтора с водородом. Плотность 0,98
г/см
3(12°С),
t
пл— 83,37°С,
t
kип19,43°С. Выше 19,43°С — бесцветный газ с резким запахом, раздражающим дыхательные пути, ниже этой температуры — бесцветная легкоподвижная жидкость;
t
kpит230,2°С,
р
крит9,45
Мн/м
2(94,5
кгс/см
2), энтальпия образования — 271
кдж/моль(—64,8
ккал/моль). Молекулы Ф. в. ассоциированы, степень ассоциации зависит от агрегатного состояния, температуры и давления. В газообразном Ф. в. ассоциаты включают три или четыре молекулы HF. ф. в. смешивается с водой в любых соотношениях. Водный раствор Ф. в. —
.
Безводный Ф. в. реагирует с металлами, стоящими в ряду напряжений до водорода (за исключением Al, Mg, Pb, Fe, Ni). Ф. в. взаимодействует со многими окислами, например SiO
2+ 4HF = SiF
4+ 2H
2O (реакция травления стекла). Ф. в. присоединяется к органическим соединениям по кратной связи, а в ряде случаев вызывает полимеризацию этих соединений. При действии Ф. в. в присутствии катализатора на полигалогеналканы фтор замещает в них галоген. Ф. в. служит хорошим растворителем неорганических и органических соединений; при этом, в отличие от водных растворов, электролитической диссоциации подвергается сам Ф. в., а не растворённое вещество.
Промышленное получение
ф. в. основано на реакции плавикового шпата с 98%-ной серной кислотой: CaF
2+ H
2SO
4= 2HF + CaSO
4.
Ф. в. широко применяется для получения синтетического
, в производстве
, для синтеза
, для травления стекла, в качестве катализатора алкилирования при получении бензина из нефти и др.
Ф. в. токсичен; попадание на кожу вызывает ожоги, пары HF раздражают верхние дыхательные пути. Предельно допустимая концентрация паров Ф. в. в воздухе 0,0005
мг/л. Первая помощь — вдыхание кислорода; при попадании на кожу — погружение обожжённого участка в ледяной насыщенный раствор сернокислой магнезии или 70%-ный этиловый спирт.
Лит.см. примет.
.
А. В. Панкратов.
Фторкаучуки
Фторкаучу'ки',синтетические фторсодержащие каучукоподобные полимеры (эластомеры), отличающиеся высокой термостойкостью, негорючестью и устойчивостью к действию многих агрессивных сред. Наибольшее распространение в промышленности получили сополимеры винилиденфторида с гексафторпропиленом или с трифторхлорэтиленом (типа СКФ-26 и СКФ-32; см. табл.) — стабильные при хранении, нетоксичные продукты белого цвета с плотностью 1,80—1,86
г/см
3, температурой стеклования около — 20°С и молекулярной массой от 10 тыс. до 1 млн. Основные вулканизующие агенты для Ф. этого типа — диамины и их производные, реагирующие с макромолекулами по метиленовым группам (—СН
2—) с образованием сравнительно непрочных поперечных связей С—N. По этой причине в резинах, вулканизованных диаминами, при их эксплуатации в напряжённом (обычно сжатом) состоянии накапливаются большие остаточные деформации. Резины с меньшей остаточной деформацией сжатия могут быть получены методом радиационной
(в этом случае между макромолекулами образуются прочные поперечные связи С—С), а также при использовании в качестве вулканизующих агентов дикалиевых солей бисфенолов. В состав резиновых смесей на основе Ф. входят обычно наполнители, например сажа, фторид кальция, а также окислы магния и кальция, связывающие HF (его отщепление от макромолекулы при высоких температурах переработки Ф. или эксплуатации изделий вызывает коррозию металлического оборудования).
Типы фторкаучуков и структура их макромолекул
Тип каучука (торговые названия)
Структура макромолекулы
Сополимер винилиденфторида с гексафторпропиленом (СКФ-26 — СССР, Вайтон — США)
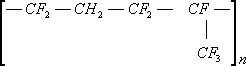
Сополимер винилиденфторида с трифторхлорзтиленом (СКФ-32 — СССР, Кель-F — США)
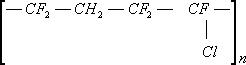
Сополимер винилиденфторида с перфторметилвиниловым эфиром (СКФ-260 — СССР)
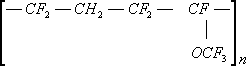
Сополимер тетрафторэтилена с трифторнитрозометаном
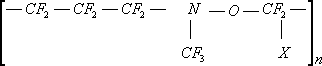
X=—COOH, —СєN, C
6F
5—
Сополимер тетрафторэтилена с перфторметилвиниловым эфиром (СКФ-460 — СССР, ECD-006 - США)

Перфторалкилентриазиновый

Перфторалкилакрилатный

Фторсилоксановый (СКТФТ — СССР)
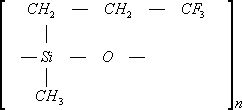
Прочность при растяжении резин из СКФ-26 и СКФ-32 составляет 16—27
Мн/м
2(160—270
кгс/см
2), относительное удлинение 250—500%. Резины стойки к топливам, маслам, различным окислителям, кислотам, но нестойки к щелочам, кетонам,
и ионизирующим излучениям. Температура длительной эксплуатации резин из СКФ-26 — 200—250°С, из СКФ-32 — 175—200°С; температура кратковременной эксплуатации — соответственно 300 и 250°С. Существенный их недостаток — низкая морозостойкость. Более морозостойкие резины могут быть получены на основе сополимеров винилиденфторида с перфторметилвиниловым эфиром (СКФ-260). температура стеклования Ф. этого типа около — 40°С.
Резины, стойкие к щелочам, любым растворителям и окислителям, включая фтор, получают из полностью фторированных каучуков, например сополимеров тетрафторэтилена с трифторнитрозометаном (для их вулканизации в макромолекулу вводят третий сомономер, содержащий функциональные группы, например карбоксильные). Такие резины отличаются, кроме того, хорошей морозостойкостью, однако их термостойкость из-за малой прочности связи N—O не превышает 175°С. Более термостойкие резины получают на основе сополимеров тетрафторэтилена с перфторметилвиниловым эфиром (СКФ-460). Хорошие механические свойства этих резин [прочность при растяжении 20—25
Мн/м
2(200—250
кгс/см
2), относительное удлинение до 230%] не изменяются после их выдержки на воздухе при температуре около 300°С в течение 1
мес. Достоинство резин на основе СКФ-460 — малая остаточная деформация сжатия даже в условиях эксплуатации при температуре около 250°С. Наибольшей термостойкостью (кратковременно до 370 и длительно до 300°С) характеризуются резины из перфторалкилентриазиновых каучуков, стойкие к кислотам и окислителям, но разрушающиеся в щелочах. Резины на основе некоторых Ф. этого типа морозостойки до —50°С.
Перфторалкилакрилатные каучуки значительно уступают др. фторкаучукам по термической и химической устойчивости, но обладают высокой масло- и водостойкостью. Маслостойкие фторсилоксановые каучуки (СКТФТ) близки по остальным свойствам к каучукоподобным полиорганосилоксанам, не содержащим в макромолекуле атомов фтора (см.
).
Основной метод синтеза Ф. — радикальная
мономеров в эмульсии. Применяют Ф. главным образом в производстве уплотнительных деталей, работающих в контакте с маслами, окислителями и другими агрессивными средами при 200°С и выше. Перфторалкилакрилатным латексом пропитывают ткани для спецодежды. Ф. дороги; используются главным образом в химической промышленности, в авиации и космической технике.
Лит.:Соколов С. В., Каган Е Г., Иванова Т. Л., Термостойкие эластомеры, «Журнал Всес. химического общества», 1974, т. 19, № 6; Amold R. G., Barney A. L., Thompson D. C., Fluoroelastomers, «Rubber Chemistry and Technology», 1973, v. 46, № 3. См. также лит. при ст.
.
С. В. Соколов.
К ст. Фторкаучуки.
Фторопласты
Фторопла'сты,принятое в СССР техническое название фторсодержащих
, представляющих собой гомополимеры фторпроизводных этилена и сополимеры их, например с др. фторпроизводными олефинами, олефинами, перфторалкилвиниловыми эфирами. Наибольшее значение имеют политетрафторэтилен (85% мирового производства всех Ф.) и политрифторхлорэтилен — кристаллические полимеры белого цвета, отличающиеся высокой химической стойкостью, термо-, морозо- и атмосферостойкостью, ценным комплексом физических свойств, негорючестью.
Политетрафторэтилен, [—CF
2—CF
2—]
n
, молекулярная масса 5·10
5—2·10
6, плотность около 2,2
г/см
3(20°С). Превосходит по химической стойкости платину, кварц, графит и все синтетические материалы; устойчив к действию сильных окислителей, восстановителей, кислот, щелочей, органических растворителей, разрушается лишь расплавленными или растворёнными в жидком аммиаке щелочными металлами, а также газообразным фтором и трёхфтористым хлором (при температурах около 150°С). В полифторированных углеводородах начинает набухать при температуре выше 327°С. Политетрафторэтилен характеризуется прочностью при растяжении 14—35
Мн/м
2, или 140—350
кгс/см
2, относительным удлинением 250—500%, исключительно высокими диэлектрическими свойствами (тангенс угла диэлектрических потерь при 60
гц— 1
Мгц0,0002—0,00025), почти не зависящими от частоты и температуры, высокой дугостойкостью (250
сек). Он не изменяется в воде, жидких топливах и маслах, устойчив в тропическом климате, к действию грибков; физиологически инертен. Сохраняет определённую эластичность при температурах до — 269°С; обладает хладотекучестью под нагрузкой и низкой адгезией, нестоек к радиации. При плавлении (327°С) полимер становится прозрачным и, не переходя в вязкотекучее состояние, разлагается при 415°С.
Политрифторхлорэтилен, [—CF2—CFCI—]
n
, молекулярная масса 56000—360000, плотность при 25°С 2,09—2,16
г/см
3(закристаллизованных образцов). Химически стоек к действию окислителей, щелочей, сильных кислот, набухает в ряде эфиров и галогенопроизводных углеводородов, растворяется в ароматических углеводородах при температурах выше их температур кипения. Политрифторхлорэтилен характеризуется прочностью при сжатии до 500
Мн/м
2, или 5000
кгс/см
2(для обожжённых образцов), хорошими диэлектрическими свойствами при низких частотах (тангенс угла диэлектрических потерь при 1
кгц0,024), высокой дугостойкостью (>360
сек), низкими хладотекучестью, влаго- и газопроницаемостью. Плавится при 210°С, причём при 240—270°С переходит в вязкотекучее состояние. Разлагается при 270°С, но уже при 170—200°С механические свойства полимера резко ухудшаются.
Интервал температур эксплуатации от — 196 до 130—190°С.
Сополимеры тетрафторэтилена с гексафторпропиленом, а также с перфторпропилвиниловым эфиром сочетают высокую химическую и термическую стойкость с хорошей перерабатываемостью; благодаря высокой текучести расплава второй сополимер пригоден в качестве высокотемпературного клея для фторопластов. Сополимеры тетрафторэтилена с перфторолефинами, содержащими сульфогруппу, — термически и химически устойчивые катионообменные смолы, превосходящие по кислотности все др. твёрдые
; успешно используются в качестве мембраны для топливных элементов. Сополимеры тетрафторэтилена с этиленом, винилиденфторидом (а также поливинилфторид и поливинилиденфторид) уступают рассмотренным выше гомополимерам по химической стойкости, но обладают рядом др. ценных качеств, в том числе высокой прочностью и хорошими технологическими свойствами.
Получают Ф. радикальной полимеризацией или сополимеризацией соответствующих мономеров. Перерабатывают методами, принятыми для термопластов, например
,
, за исключением политетрафторэтилена, который перерабатывают холодным таблетированием порошка под давлением 25—35
Мн/м
2, или 250—350
кгс/см
2, с последующим спеканием при 360—380°С. Из Ф. получают плёнки, транспортёрные ленты, антифрикционные материалы для подшипников и сальников, работающих без смазки, волокна и ткани, лабораторную посуду, химически стойкие покрытия, металлопласты. Низкомолекулярный политрифторхлорэтилен используют как химически стойкую смазку. Изделия из Ф. применяют в электро- и радиотехнике, авиации и ракетной технике, машиностроении, химической и атомной промышленности, в криогенной технике, пищевой промышленности и медицине.
В СССР Ф. выпускают под название фторлон: политетрафторэтилен — фторлон-4, политрифторхлорэтилен — фторлон-3, в США — под название тефлон и кель-F соответственно.
Лит.:Фторполимеры, пер, с англ., М., 1975; Энциклопедия полимеров, т. 3, М., 1977.
С. В. Соколов.
Фторорганические соединения
Фтороргани'ческие соедине'ния,органическое соединения, содержащие в молекулах одну или несколько связей F—C. Химия Ф. с. начала интенсивно развиваться лишь со 2-й половины 20 в., но уже выросла в большую специализированную область
. Её развитие было обусловлено потребностями молодой атомной промышленности в материалах, стойких к фторирующему действию UF
6, который применяется для
урана. Известны фторпроизводные всех типов органических соединений.
Номенклатура.Положение атома фтора в Ф. с. обозначают согласно правилам номенклатуры органических соединений (см.
). Для построения название полифторзамещённых соединений удобнее пользоваться приставкой «пер». Так, полностью фторировнные углеводороды называются перфторуглеводородами (или фторуглеродами), например CF
3(CF
2)
5CF
3называется перфторгептаном. Частично фторированные соединения можно рассматривать как производные перфторуглеводородов, например CF
3CFH (CF
2) CF
2H называется 1,6-дигидроперфторгептаном. Очень часто в название Ф. с. сочетание «перфтор» заменяют греческой буквой j; в этом случае, например, перфторэтан называется j-этаном. Для обозначения полностью фторированных углеводородов используют также частицу «фор» (фтор), которую включают в наименование соответствующего углеводорода, например название CF
4— метфоран, C
2F
6— этфоран.
Методы синтеза.Прямое фторирование, а также присоединение F
2по двойной связи — радикальные чрезвычайно экзотермические реакции:
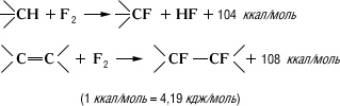
(1
ккал/моль= 4,19
кдж/моль)
Т. к. тепловой эффект фторирования больше, чем разрыва С—С-связей (80—85
ккал/моль), возможна деструкция фторируемых соединений. Во избежание этого необходим эффективный отвод тепла и разбавление смеси реагирующих веществ азотом. Для отвода тепла в реакционное пространство (трубка) вводят медную сетку или медные стружки, покрытые Ag, Co, Ni или др.; на поверхности сетки (стружек) образуются высшие фториды металлов, которые и служат фторирующими агентами, роль фтора при этом сводится, по-видимому, к их регенерации.
В металлофторидном процессе пары фторируемого вещества, сильно разбавленные азотом, пропускают через трубку с CoF
3:
1/
2(—CH
2—) + 2CoF
з®
1/
2(—CF
2—) + HF+ 2CoF
2+ 46
ккал/моль.
Образующийся CoF
3действием фтора при 250°С превращают опять в CoF
3. Выходы перфторуглеводородов 80—85%.
Важен метод электрохимического фторирования. Электролитом служит раствор фторируемого вещества в безводном фтористом водороде. В случае неэлектропроводных соединений обычно добавляют KF. Этим методом j-амины, j-окиси и др. Все рассмотренные выше процессы применяются в промышленности.
Обмен атомов хлора на фтор — важный промышленный метод введения фтора (см.
); может быть произведён безводным HF или
(например, NH
4F, KF, CbF
3Cl
2, AgF
2, HgF
2. Лёгкость обмена зависит от строения хлорсодержащего соединения. Так, хлорангидриды кислот часто легко превращаются во фторангидриды путём растворения их в безводном HF. Атомы Cl в этиленхлоргидрине, хлоруксусной кислоте и её производных легко обмениваются на F при реакции с KF в полярных растворителях (например, этиленгликоле); в моногалогенуглеводородах — лишь действием AgF
2или HgF
2при 150°С. Легче замещаются на фтор атомы хлора в соединениях, содержащих трихлорметильную группу. В промышленности для такого обмена применяют обычно растворы SbF
3или SbF
3Cl
2в безводном HF. Этим способом из хлороформа CHCl
3получают дифторхлорметан, используемый для производства тетрафторэтилена, из CCl
4— дифтордихлорметан (один из важнейших
), из C
2Cl
6— трифтортрихлорэтан (исходное вещество для производства трифторхлорэтилена).
Сравнительно легко на фтор обмениваются атомы хлора в гексахлорбензоле (действием KF при 450—530°С); C
6F
6и C
6F
5Cl при этом получаются с хорошими выходами. Аналогично реагируют и др. полихлорароматические и полихлоргетероциклические соединения.
Диазометод получения фторароматических соединений основан на образовании борфторида выделяют в твёрдом при нагревании:

Замена кислородсодержащих группировок в различных органических соединениях на фтор при помощи SF
4(например, в спиртах, альдегидах, кетонах, кислотах):
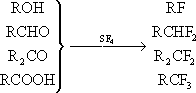
(R — органический остаток).
Присоединение безводного фтористого водорода к олефинам, галогенолефинам, окисям, изоцианатам, циклопарафинам и др., например:
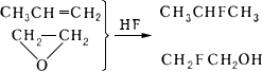
Сопряжённое присоединение фтора и др. атомов или групп к соединениям, содержащим кратные связи, легко происходит в избытке безводного HF, например фторнитрование:
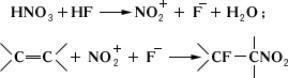
Методы получения фторолефинов. Дегалогенирование вицинальных дигалогенполифторалканов металлами (Zn, Mg и др.), например:
CF
2Cl — CF
2Cl + Zn ® CF
2= CF
2+ ZnCl
2.
Пиролиз политетрафторэтилена, приводящий к образованию перфторпропилена и перфторизобутилена наряду с тетрафторэтиленом, перфторбутиленом, фторциклобутаном и др.:
[—CF
2—]
n
® CF
3F = CF
2+ (CF
3)
2C = CF
2+ CF
2= CF
2+ CF
3CF
2CF = CF
2и др.
В промышленности этим способом (а также пиролизом тетрафторэтилена) получают перфторпропилен — важный мономер для производства фторкаучуков.
Пиролиз солей j-карбоновых кислот, например:
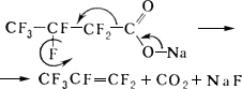
Фторированные спирты получают обычными методами синтеза
, например восстановлением эфиров j-карбоновых кислот, фторированных альдегидов и кетонов. Важный промышленный способ их получения —
тетрафторэтилена метанолом:
nCF
2= CF
2+ CH
3OH ® Н [—CF2CF2—]
n
СН
2ОН.
Свойства.Физические свойства. Низшие фторуглероды парафинового ряда (общая формула C
n
F
2
n+2) — газы, начиная с C
5— жидкости, высшие — твёрдые воскообразные соединения. Только первые четыре представителя этого ряда кипят несколько выше соответствующих углеводородных аналогов, все остальные — ниже.
При замещении одного атома водорода в молекуле углеводорода на F температура кипения повышается, но меньше, чем при замене его на хлор. При полной замене атомов водорода на фтор у любых производных углеводородов температуры кипения очень сильно понижаются (см. табл.).
Сравнение температур кипения некоторых соединений
Формула
t
кип, °С
Формула
t
кип, °С
CH
3CN
+78
CF
3CN
-64
CH
3NO
2
+102
CF
3NO
2
-31
NC(CH
2)
4CN
+265
NC(CF
2)
4CN
+63
CH
3CH2NH
2
+19
CF
3CF
2NF
2
-34.3
CH
3COCH
3
+56
CF
3COCF
3
+29
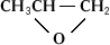
+35
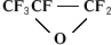
-28
Фторуглероды — хорошие диэлектрики (удельное электрическое сопротивление около 10
14
ом(
см; диэлектрическая проницаемость их значительно выше, чем у парафинов. Скорость распространения ультразвука во фторуглеродах необычайно низка (менее 800
м/сек).
Химические свойства наиболее важных типов Ф. с. Фторуглероды парафинового и алициклических рядов характеризуются необычайно высокими химической инертностью и термостойкостью. Для них известно небольшое число реакций, осуществляемых лишь при высоких температурах. Так, пиролиз перфторэтана начинается около 1000°C, перфторгептана — около 800°C. Фторуглероды не реагируют в обычных условиях и при умеренном нагревании с концентрированными кислотами, сильными окислителями, металлами, щелочами и др.; реакция с металлическим натрием и перекисью натрия начинается при 400°C; Zn, Al, Fe и Sn в этих условиях реагируют очень медленно; Cu, Ag, Hg и некоторые др. в реакцию не вступают.
Перфторбензол и некоторые др. перфторароматические соединения легко взаимодействуют с нуклеофильными реагентами, например с аммиаком, аминами, алкоголятами, сульфидом натрия и др. При этом после замены одного атома фтора замещается второй, находящийся в
положении к первому:
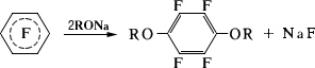
Пентафторхлорбензол образует
C
6F
5MgCl, широко используемое в органическом синтезе.
Перфторолефины, в отличие от олефинов, являющихся нуклеофилами, резко электрофильны. Они легко реагируют с различными нуклеофилами (см.
), причём в зависимости от типа последних образуются продукты присоединения или замещения атома F в винильном (
а) или аллильном (
б) положении на остаток нуклеофила (Nu):
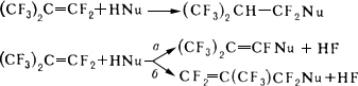
Электрофильные соединения реагируют с фторолефинами значительно труднее, чем с их углеводородными аналогами. Однако фторолефины присоединяют галогены, смешанные галогены, серный ангидрид и др. сильные электрофильные реагенты. Перфторолефины легко вступают в радикальные реакции, например
CF
2= CF
2+ N
2O
4® CF
2NO
2— CF
2NO
2+ CF
2NO
2— CF
2ONO,
легко полимеризуются и сополимеризуются (см.
,
). При окислении j-олефинов в щелочной среде образуются j-окиси (см. ниже).
Монофторметанол — нестойкая жидкость,
t
kип51°C; ди- и трифторметанолы не получены, но известны производные трифторметанола: трифторметилгипофторит CF
3OF — газ,
t
kип— 95°C, и алкоголяты CF
3OK и CF
3OCs. Фторзамещённые спирты (b-, g-, но не a-) — устойчивые, легко перегоняющиеся жидкости. Кислотные свойства спиртов усиливаются по мере накопления атомов фтора.
С увеличением содержания фтора в молекулах альдегидов и кетонов электрофильность карбонильного атома углерода резко усиливается. Перфторальдегиды и перфторкетоны, подобно хлоралю, образуют стойкие геминальные диолы, например CF
3—CH (OH)
2, CF
3—C (OH)
2—CF
3, и полуацетали; легче, чем их углеводородные аналоги, присоединяют NH
3, HCN, NH
2OH и др. нуклеофильные реагенты; легко подвергаются распаду с образованием фтороформа, например:
CF
3COCF
3+ NaOH ® CF
3H + CF
3COONa.
Частично фторированные кетоны и альдегиды характеризуются высоким содержанием енольных форм (см.
), склонных к образованию внутрикомплексных соединений; это свойство их используется для разделения редких и рассеянных элементов, например с помощью теноилтрифторацетона выделяют и очищают Be, Со, Hf, Zr, Ас, а также радиоактивные изотопы, образующиеся в ядерном реакторе.
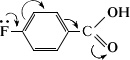
Фторзамещённые карбоновые кислоты сильнее незамещённых и соответствующих хлорзамещённых кислот. Однако
n-фторбензойная кислота слабее хлорбензойной вследствие большей способности атома F к сопряжению.
Под влиянием третичных аминов или ионов фтора j-окиси легко изомеризуются, а также полимеризуются, образуя исключительно стойкие к действию агрессивных сред масла.
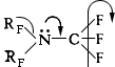
Первичные и вторичные перфторалкиламины типа CF
3NH
2и (CF
3)
2NH малоустойчивы, третичные — исключительно стойки к действию самых агрессивных сред; они лишены основных свойств вследствие сильного снижения электронной плотности на атоме азота.
Разнообразные органические соединения, несущие группы — NF
2, являются сильными окислителями.
Фторнитрозосоединения типа R
FN = O устойчивы; в отличие от водородных аналогов, окрашены в интенсивно-синий цвет, например трифторнитрозометан — синий газ,
t
kип— 84°C. При сополимеризации последнего с тетрафторэтиленом получается один из наиболее химически стойких фторкаучуков, т. н. нитрозокаучук.
Из Ф. с., содержащих серу, известны, например, фтормеркаптаны, сульфиды, ди- и полисульфиды, сульфоокиси, сульфоны, сульфоновые кислоты и их производные; промышленное применение нашли перфторсульфокислоты, в частности
, и дифтортиофосген CF
2S (в синтезе эластомеров).
Из фторалкильных соединений металлов и металлоидов наибольшее значение имеют соединения с Li, Mg, Hg, Si; сравнительно хорошо изучены соединения с Р, As, Sb. Перфтордиметилртуть (CF
3)
2Hg резко отличается от обычных ртутьорганических соединений. Это бесцветное кристаллическое вещество,
t
пл161°C, хорошо растворимо в воде; в отличие от (CH
3)
2Hg, практически не алкилирует. Диперфторвинилртуть — хороший перфторвинилирующий агент. Из соединений кремния наибольшее значение имеет CF
3CH
2CH
2SiCl
2((CH
3), применяемый для производства термостойкого фторсилоксанового эластомера (см.
).
Применение.Ф. с. широко применяются во всех областях техники с её экстремальными условиями эксплуатации. Ф. с. используют для получения фторопластов, превосходящих благородные металлы по устойчивости к действию агрессивных сред; термостойких фторкаучуков; антикоррозионных покрытий; как негорючие, термостойкие и неокисляющиеся смазочные масла и гидравлические жидкости; поверхностно-активные и пламягасящие вещества, пропелленты и хладагенты (см.
).
и её ангидрид применяются как промоторы этерификации; трифторнадуксусная кислота — специфический и удобный окислитель. В медицине Ф. с. применяют как лекарственные препараты и средства для наркоза (см.
), как материалы для изготовления искусственных кровеносных сосудов, клапанов для сердца. Кроме того, на примере Ф. с. изучены фундаментальные вопросы теории: природа водородной связи, вандерваальсовы силы, механизмы реакций и др.
Лит.:Кнунянц И. Л., Фокин А. В., Покорение неприступного элемента, М., 1963; Кнунянц И. Л., Сокольский Г. А., Электрохимическое фторирование, в кн.: Реакции и методы исследования органических соединений, кн. 6, М., 1957; Шеппард У., Шартс К., органическая химия фтора, пер. с англ., М., 1972; Успехи химии фтора, пер. с англ., т. 1—4, Л., 1964—70; Fluorine chemistry reviews, ed. P. Tarrant, v. 1—7, N. Y. — [a. o.], 1967—74; Chambers R. D., Fluorine in organic chemistry, N. Y. — [a. o.], 1973.
И. Л. Кнунянц.
Фторотан
Фторота'н,галотан, флуотан, CF
3—CHBrCl, 1,1,1-трифтор-2-хлор-2-бромэтан, бесцветная жидкость с запахом хлороформа,
t
kип50°C, плотность 1,87
г/см
3(20°C). Ф. практически нерастворим в воде, смешивается со спиртом и большинством др. органических растворителей; на свету медленно разлагается, поэтому его стабилизируют, например добавками 0,01—0,1% спирта или тимола. Получают Ф. обычно из трифторхлорэтилена:
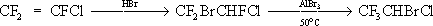
.
Применяют в медицине как эффективное средство для ингаляционного наркоза.
Фтороформ
Фторофо'рм,трифторметан, CHF
3, бесцветный газ,
t
kип— 82,5°C. В отличие от
, Ф. — инертное соединение, например устойчиво к действию щелочей. Получают из хлороформа обменной реакцией с SbF
3или HF, из трифторхлорметана (фреона-13) и Н
2, а также др. способами. Применяют как хладагент.

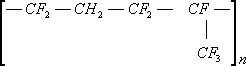 Сополимер винилиденфторида с трифторхлорзтиленом (СКФ-32 — СССР, Кель-F — США)
Сополимер винилиденфторида с трифторхлорзтиленом (СКФ-32 — СССР, Кель-F — США)
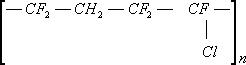 Сополимер винилиденфторида с перфторметилвиниловым эфиром (СКФ-260 — СССР)
Сополимер винилиденфторида с перфторметилвиниловым эфиром (СКФ-260 — СССР)
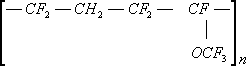 Сополимер тетрафторэтилена с трифторнитрозометаном
Сополимер тетрафторэтилена с трифторнитрозометаном
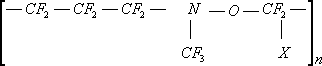 X=—COOH, —СєN, C
6F
5—
Сополимер тетрафторэтилена с перфторметилвиниловым эфиром (СКФ-460 — СССР, ECD-006 - США)
X=—COOH, —СєN, C
6F
5—
Сополимер тетрафторэтилена с перфторметилвиниловым эфиром (СКФ-460 — СССР, ECD-006 - США)
 Перфторалкилентриазиновый
Перфторалкилентриазиновый
 Перфторалкилакрилатный
Перфторалкилакрилатный
 Фторсилоксановый (СКТФТ — СССР)
Фторсилоксановый (СКТФТ — СССР)
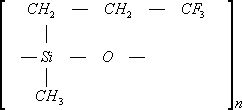 Прочность при растяжении резин из СКФ-26 и СКФ-32 составляет 16—27
Мн/м
2(160—270
кгс/см
2), относительное удлинение 250—500%. Резины стойки к топливам, маслам, различным окислителям, кислотам, но нестойки к щелочам, кетонам,
и ионизирующим излучениям. Температура длительной эксплуатации резин из СКФ-26 — 200—250°С, из СКФ-32 — 175—200°С; температура кратковременной эксплуатации — соответственно 300 и 250°С. Существенный их недостаток — низкая морозостойкость. Более морозостойкие резины могут быть получены на основе сополимеров винилиденфторида с перфторметилвиниловым эфиром (СКФ-260). температура стеклования Ф. этого типа около — 40°С.
Прочность при растяжении резин из СКФ-26 и СКФ-32 составляет 16—27
Мн/м
2(160—270
кгс/см
2), относительное удлинение 250—500%. Резины стойки к топливам, маслам, различным окислителям, кислотам, но нестойки к щелочам, кетонам,
и ионизирующим излучениям. Температура длительной эксплуатации резин из СКФ-26 — 200—250°С, из СКФ-32 — 175—200°С; температура кратковременной эксплуатации — соответственно 300 и 250°С. Существенный их недостаток — низкая морозостойкость. Более морозостойкие резины могут быть получены на основе сополимеров винилиденфторида с перфторметилвиниловым эфиром (СКФ-260). температура стеклования Ф. этого типа около — 40°С.




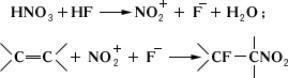

 +35
+35
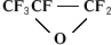 -28
Фторуглероды — хорошие диэлектрики (удельное электрическое сопротивление около 10
14
ом(
см; диэлектрическая проницаемость их значительно выше, чем у парафинов. Скорость распространения ультразвука во фторуглеродах необычайно низка (менее 800
м/сек).
-28
Фторуглероды — хорошие диэлектрики (удельное электрическое сопротивление около 10
14
ом(
см; диэлектрическая проницаемость их значительно выше, чем у парафинов. Скорость распространения ультразвука во фторуглеродах необычайно низка (менее 800
м/сек).



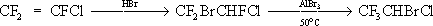 .
.