Большая Советская Энциклопедия (ФТ)
Фтабатэй Симэй
Фтаба'тэй Симэ'й(псевдоним; настоящее имя — Хасэгава Тацуноскэ) (28.2.1864, Токио, — 10.5.1909, Сингапур), японский писатель. Зачинатель япон. критического реализма и современного литературного языка. Учился на рус. отделении Токийского института иностранных языков. Большое влияние на творчество Ф. С. оказала рус. литература. В статье «Общая теория романа» (1886) изложены воззрения Ф. С. на сущность искусства, на реализм как творческий метод литературы. В романе «Плывущее облако» (1887—88) нарисован образ «лишнего человека», разочарованного в новой буржуазной действительности. Известны также романы «Его облик» (1906), «Обыкновенный человек» (1907). Перевёл сочинения Н. В. Гоголя, И. С. Тургенева, И. А. Гончарова, В. Г. Белинского, Н. А. Добролюбова, М. Горького.
Соч.: Дзэнсю, т. 1—8, Токио, 1937—38; в рус. пер. — Мои принципы художественного перевода, в кн.: Восточный альманах, в. 1, М., 1957.
Лит.:Карлина Р., Творческие связи Хасэгава Фтабатэя с русской литературой, в кн.: Японская литература. Исследования и материалы, М., 1959; Рехо К., Достоевский и японский реалистический роман конца XIX в., «Народы Азии и Африки», 1972, № 1; Накамура Мицуо, Фтабатэй Симэй, Токио, 1953.
К. Рехо.
Фтабатэй Симэй.
Фталазол
Фталазо'л,лекарственное средство из группы
. Благодаря медленному всасыванию из желудочно-кишечного тракта концентрируется в толстом кишечнике, где расщепляется с высвобождением активной (сульфаниламидной) части молекулы. Назначают в порошках и таблетках при дизентерии, колитах, гастроэнтеритах, для профилактики гнойных осложнений при операциях на кишечнике.
Фталан
Фтала'н,фольпет, N-трихлорметилтиофталимид,
, применяется для опрыскивания против грибных болезней плодовых культур (в т. ч. ягодных и винограда), картофеля, томата, а также для
семян. Выпускается в виде 50%-ного и 70%-ного препарата. Норма расхода 2—6
кг/га. Малотоксичен для человека и животных.
Фталевые кислоты
Фта'левые кисло'ты,бензолдикарбоновые кислоты, C
6H
4(COOH)
2, дикарбоновые кислоты ароматического ряда:
(или просто фталевая),
(изофталевая) и
Ф. к. (терефталевая); бесцветные кристаллы,
t
пл200°С (с разложением), 348°С и 425°С (в запаянном капилляре) соответственно.
о-Ф. к. получают и используют главным образом в виде её ангидрида (см.
). Практическое значение имеют сложные эфиры
о-Ф. к. C
6H
4(COOK)
2— высококипящие жидкости, применяемые как пластификаторы поливинилхлорида, полистирола и многих др. полимеров (см.
,
), в качестве манометрических жидкостей,
, например диметилфталат; динитрил
о-Ф. к. (фталонитрил) используют в производстве фталоцианиновых красителей и полифталоцианинов. Практическое значение имеют циклический имид (
), дихлорангидрид (фталилхлорид) и
. Широко применяются полиэфирные смолы на основе
о-Ф. к. и многоатомных спиртов, например глицерина и пентаэритрита, называемых соответственно глифталевыми и пентафталевыми смолами (см.
).
м-Ф. к. и
п-Ф. к. получают окислением
м-и
п
. На их основе в промышленности производят ароматические
, например поли-
м-фениленизофталамид, и
. Взаимодействием
п-Ф. к. или её диметилового эфира с этиленгликолем получают полиэтилентерефталат, используемый в производстве
.
В. Н. Фросин.
Фталевый ангидрид
Фта'левый ангидри'д,ангидридофталевой кислоты, бесцветные кристаллы, практически нерастворимые в воде, умеренно растворимые в органических растворителях,
t
пл130,8 °С,
t
kип284,5 °С.
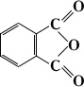
Ф. а. — важный исходный продукт в производстве различных производных
; сложных эфиров,
, фталонитрила и др. Конденсацией Ф. а. с фенолами получают красители, например
. Значительное количество Ф. а. используется в производстве глифталевых и пентафталевых смол (см.
), промежуточных продуктов и красителей — производных флуоресцеина, родамина и антрахинона; лекарственных средств, например
и фенилина (применяется при повышенной свёртываемости крови). Ф. а. получают каталитическим окислением нафталина, а также оксилола воздухом в газовой фазе.
Фталимид
Фталими'д,имид
о-фталевой кислоты, бесцветные кристаллы, ограниченно растворимые в воде и спирте,
t
пл238°С.
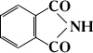
Обладая свойствами слабой кислоты, Ф. образует, например с растворами щелочей, металлические производные (C
8H
4O
2NK и др.), используемые для синтеза первичных аминов и a-аминокислот (
), в производстве
. N-Галогенозамещённые Ф., получаемые взаимодействием Ф. с хлором и бромом (например, C
8H
4O
2NBr), используют в лабораторной практике для галогенирования органических соединений. Получают Ф. из
и карбоната аммония или аммиака.
Фталофос
Фталофо'с,фосмет, О,О-диметил-(N-фталимидометил)-дитиофосфат, химический препарат для борьбы с вредителями плодовых, ягодных и полевых культур. Выпускается в виде концентрированных эмульсий или смачивающегося порошка. Норма расхода 0,5—3
кг/га. Высокотоксичен для человека и животных.
Фталоцианиновые красители
Фталоциани'новые краси'тели,группа красителей — производные тетрабензотетраазопорфирина (фталоцианина) и его комплексные соединения с металлами. Из Ф. к. наиболее широко применяется фталоцианин меди —
голубого цвета.
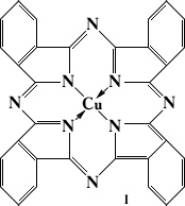
Важное значение для использования Ф. к. имеет их полиморфизм: так, например, для I известны a-, b- и g-модификации, существенно различающиеся по цвету и устойчивости в органических растворителях.
Получают I нагреванием при 160—200 °С фталевого ангидрида с мочевиной, хлоридом меди (CuCl) и катализатором (например, As
2O
5) в среде трихлорбензола, нитробензола или нагреванием фталодинитрила C
6H
4(CN)
2с CuCl; в последнем случае обычно образуется частично хлорированный голубой пигмент Затем для получения a- и g-форм I растворяют и переосаждают соответственно из 98 и 60%-ной серной кислоты, а для получения b-формы I механически измельчают в присутствии органических растворителей и хлорида или сульфата натрия.
Ф. к., содержащие 14—16 атомов хлора в бензольных остатках (пигмент ярко-зелёного цвета), получают хлорированием I. Растворимые в воде прямые Ф. к. получают сульфированием I.
бирюзового цвета синтезируют, действуя на I хлорсульфоновой кислотой и тионилхлоридом, а затем, превращая полученный тетрасульфохлорид в сульфамид, — взаимодействием с ароматическими аминами, содержащими активные группы. Водорастворимые Ф. к., так называемые алцианы, или цианалы, представляющие собой изотиурониевые соли I, содержат 1—3 группы
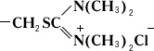
Их получают действием на I сначала параформальдегида и соляной кислоты, а затем тетраметилтиомочевины; при нанесении на ткань эти Ф. к. после обработки паром образуют в порах волокна пигмент. Другой метод получения Ф. к. в процессе крашения — взаимодействие 1-амино-3-иминоизоиндолина (фталоцианоген, или фталоген II) и солей меди в присутствии органических растворителей; прочный пигмент образуется при нагревании пропитанной этой смесью ткани до 120—150 °С.
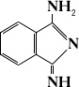
II
Нерастворимые в воде Ф. к. широко используются как пигменты в производстве полиграфических красок, пластмасс, резины и др.; водорастворимые (прямые, активные, сернистые и др.) — для крашения тканей.
Центральные фрагменты Ф. к. и биологических пигментов —
и
имеют сходное строение.
Лит.:Чекалин М. А., Пассет Б. В., Иоффе Б. А., Технология органических красителей и промежуточных продуктов, [Л.], 1972.
М. А. Чекалин.
Фтивазид
Фтивази'д,лекарственный препарат из группы
; оказывает избирательное бактериостатическое действие на микобактерии туберкулёза. Применяется внутрь в порошках и таблетках при различных формах туберкулёза.
Фтизиатрия
Фтизиатри'я(от греч. phthнsis — истощение, чахотка и iatrйia — лечение), раздел медицины, изучающий причины, механизмы развития, клинико-морфологические проявления, лечение, эпидемиологию и профилактику туберкулёза. В СССР — самостоятельная научно-практическая дисциплина, выделившаяся из
. Организация государственных лечебно-профилактических и научно-исследовательских учреждений, являвшихся и организационно-методическими центрами борьбы с туберкулёзом, была начата ещё в 1917. Она привела к созданию сети противотуберкулёзных диспансеров, санаториев, больниц и ряда научно-исследовательских институтов, занимающихся совершенствованием диагностики, профилактики и лечения различных форм туберкулёза, а также разработкой теоретических основ Ф. Специальные разделы Ф.: фтизиохирургия, фтизиопедиатрия, фтизиоурология и др. Современная Ф. применяет комплекс диагностических методов: клинических, рентгенологических, эндоскопических, биохимических, бактерио- и иммунологических и др. Традиционными для Ф. были лечение гигиено-диетическим и санаторным режимом, искусственым
,
. Во 2-й половине 20 в. они дополнены
, которые обладают специфическим действием на возбудителя болезни и стали основным методом её терапии, а также хирургическое лечением туберкулёза различных органов (главным образом лёгочного, костно-суставного, урогенитального). Успехи Ф. в области профилактики туберкулёза основаны как на улучшении экономических и санитарно-гигиенических условий жизни населения, так и на проведении специальных предупредительных мер (иммунизация
БЦЖ,
и т. д.).
В СССР в 1976 было более 23 тыс. фтизиатров; преподавание Ф. и подготовка фтизиатров (в интернатуре, клинической ординатуре и аспирантуре) осуществляются на соответствующих кафедрах медицинских институтов и институтов усовершенствования врачей; фтизиатров готовят также на базах институтов туберкулёза и крупных лечебно-профилактических учреждений. Всесоюзное научное общество фтизиатров (основано в 1947) входит в Международный противотуберкулёзный союз (основан в 1920), который издаёт “Bulletin of the International Union Against Tuberculosis” (P., с 1924). Международные конференции проводятся с 1888; 21-я конференция проходила в Москве (1971). В СССР издаётся журнал “Проблемы туберкулёза” (с 1923); отдельные вопросы Ф. освещают многие клинические журналы. За рубежом проблемы Ф. освещают преимущественно журналы, посвященные болезням органов дыхания (см. в ст.
).
Ф. В. Шебанов.
Лит.см. при ст.
.
Фтор
Фтор(лат. Fluorum), F, химический элемент VII группы периодической системы Менделеева, относится к
, атомный номер 9, атомная масса 18,998403; при нормальных условиях (0 °С; 0,1
Мн/м
2
,
или 1
кгс/см
2) — газ бледно-жёлтого цвета с резким запахом.
Природный Ф. состоит из одного стабильного изотопа
19F. Искусственно получены пять радиоактивных изотопов:
16F с периодом полураспада
Т
1
/2< 1
сек,
17F (
T
1/2= 70
сек),
18F (
T
1/2= 111
мин),
20F (
T
1/2= 11,4
сек),
21F (
T
1
/2= 5
сек).
Историческая справка. Первое соединение Ф. — флюорит (плавиковый шпат) CaF
2— описано в конце 15 в. под название «флюор» (от лат. fluo — теку, по свойству CaFa
2делать жидкотекучими вязкие шлаки металлургических производств). В 1771 К.
получил плавиковую кислоту. Свободный Ф. выделил А.
в 1886 электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF
3.
Химия Ф. начала развиваться с 1930-х гг., особенно быстро — в годы 2-й мировой войны 1939 — 45 и после неё в связи с потребностями атомной промышленности и ракетной техники. Название «Ф.» (от греч. phthуros — разрушение, гибель), предложенное А.
в 1810, употребляется только в рус. языке; во многих странах принято название «флюор».
Распространение в природе. Среднее содержание Ф. в земной коре (кларк) 6,25·10
-2% по массе; в кислых изверженных породах (гранитах) оно составляет 8·10
-2%, в основных — 3,7·10
-2%, в ультраосновных — 1·10
-2%. Ф. присутствует в вулканических газах и термальных водах. Важнейшие соединения Ф. —
,
и топаз (см.
). Всего известно 86 фторсодержащих минералов. Соединения Ф. находятся также в
,
и др. Ф. — важный
. В истории Земли источником поступления Ф. в биосферу были продукты извержения вулканов (газы и др.).
Физические и химические свойства. Газообразный Ф. имеет плотность 1,693
г/л(0°С и 0,1
Мн/м
2, или 1
кгс/см
2), жидкий — 1,5127
г/см
3(при температуре кипения);
t
пл— 219,61°С;
t
kип— 188,13°С. Молекула Ф. состоит из двух атомов (F
2); при 1000°С 50% молекул диссоциирует, энергия диссоциации около 155 ± 4
кдж/моль(37 ± 1
ккал/моль). Ф. плохо растворим в жидком фтористом водороде; растворимость 2,5·10
-3
гв 100
гHF при —70°С и 0,4·10
-3при —20°С; в жидком виде неограниченно растворим в жидком кислороде и озоне. Конфигурация внешних электронов атома Ф. 2
s
22
p
2. В соединениях проявляет степень окисления — 1. Ковалентный радиус атома 0,72Е, ионный радиус 1,33Е. Сродство к электрону 3,62
эв, энергия ионизации (F ® F
+) 17,418
эв. Высокими значениями сродства к электрону и энергии ионизации объясняется сильная электроотрицательность атома Ф., наибольшая среди всех др. элементов. Высокая реакционная способность Ф. обусловливает экзотермичность фторирования, которая, в свою очередь, определяется аномально малой величиной энергии диссоциации молекулы Ф. и большими величинами энергии связей атома Ф. с др. атомами. Прямое фторирование имеет цепной механизм и легко может перейти в горение и взрыв. Ф. реагирует со всеми элементами, кроме гелия, неона и аргона. С кислородом взаимодействует в тлеющем разряде, образуя при низких температурах
O
2F
2, O
3F
2и др. Реакции Ф. с др. галогенами экзотермичны, в результате образуются
. Хлор взаимодействует с Ф. при нагревании до 200—250°С, давая монофтористый хлор CIF и трёхфтористый хлор ClF
3. Известен также CIF
5, получаемый фторированием ClF
3при высокой температуре и давлении 25
Мн/м
2(250
кгс/см
2). Бром и йод воспламеняются в атмосфере Ф. при обычной температуре, при этом могут быть получены BrF
3, BrF
5, IF
5, IF
7. Ф. непосредственно реагирует с криптоном, ксеноном и радоном, образуя соответствующие фториды (например, XeF
4, XeF
6, KrF
2). Известны также оксифториды ксенона.
Взаимодействие Ф. с серой сопровождается выделением тепла и приводит к образованию многочисленных
. Селен и теллур образуют высшие фториды SeF
6TeF
6. Ф. с водородом реагируют с воспламенением; при этом образуется
. Это радикальная реакция с разветвлением цепей: HF* + H
2= HF + H
2*; H
2* + F
2= HF + Н + F (где HF* и H
2* — молекулы в колебательно-возбуждённом состоянии); реакция используется в химических лазерах. Ф. с азотом реагирует лишь в электрическом разряде (см.
). Древесный уголь при взаимодействии с Ф. воспламеняется при обычной температуре; графит реагирует с ним при сильном нагревании, при этом возможно образование твёрдого фтористого графита (CF)
xили газообразных перфторуглеродов CF
4, C
2F
6и др. С бором, кремнием, фосфором, мышьяком Ф. взаимодействует на холоду, образуя соответствующие фториды. Ф. энергично соединяется с большинством металлов; щелочные и щёлочноземельные металлы воспламеняются в атмосфере Ф. на холоду, Bi, Sn, Ti, Mo, W — при незначительном нагревании, Hg, Pb, U, V реагируют с Ф. при комнатной температуре, Pt — при температуре темно-красного каления. При взаимодействии металлов с Ф. образуются, как правило, высшие фториды, например UF
6, MoF
6, HgF
2. Некоторые металлы (Fe, Cu, Al, Ni, Mg, Zn) реагируют с Ф. с образованием защитной плёнки фторидов, препятствующей дальнейшей реакции.
При взаимодействии Ф. с окислами металлов на холоду образуются фториды металлов и кислород; возможно также образование оксифторидов металлов (например, MoO
2F
2). Окислы неметаллов либо присоединяют Ф., например SO
2+ F
2= SO
2F
2, либо кислород в них замещается на Ф., например SiO
2+ 2F
2= SiF
4+ O
2. Стекло очень медленно реагирует с Ф.; в присутствии воды реакция идёт быстро. Вода взаимодействует с Ф.: 2H
2O + 2F
2= 4HF + O
2; при этом образуется также OF
2и перекись водорода H
2O
2. Окислы азота NO и NO
2легко присоединяют Ф. с образованием соответственно фтористого нитрозила FNO и фтористого нитрила FNO
2. Окись углерода присоединяет Ф. при нагревании с образованием фтористого карбонила: CO + F
2= COF
2.
Гидроокиси металлов реагируют с Ф., образуя фторид металла и кислород, например 2Ba(OH)
2+ 2F
2= 2BaF
2+ 2H
2O + O
2. Водные растворы NaOH и KOH реагируют с Ф. при 0°С с образованием OF
2.
Галогениды металлов или неметаллов взаимодействуют с Ф. на холоду, причём Ф. замещает все галогены, Легко фторируются сульфиды, нитриды и карбиды. Гидриды металлов образуют с Ф. на холоду фторид металла и HF; аммиак (в парах) — N
2и HF. Ф. замещает водород в кислотах или металлы в их солях, например HNO
3(или NaNO
3) + F
2® FNO
3+ HF (или NaF); в более жёстких условиях Ф. вытесняет кислород из этих соединений, образуя сульфурилфторид, например Na
2SO
4+ 2F
2= 2NaF + SO
2F
2+ O
2. Карбонаты щелочных и щёлочноземельных металлов реагируют с Ф. при обычной температуре; при этом получаются соответствующий фторид, CO
2и O
2.
Ф. энергично реагирует с органическими веществами (см.
).
Получение. Источником для производства Ф. служит фтористый водород, получающийся в основном либо при действии серной кислоты H
2SO
4на флюорит CaF
2, либо при переработке апатитов и фосфоритов. Производство Ф. осуществляется электролизом расплава кислого фторида калия KF·(1,8—2,0)HF, который образуется при насыщении расплава KF·HF фтористым водородом до содержания 40—41% HF. Материалом для электролизёра обычно служит сталь; электроды — угольный анод и стальной катод. Электролиз ведётся при 95—100°С и напряжении 9—11
в; выход Ф. по току достигает 90—95%. Получающийся Ф. содержит до 5% HF, который удаляется вымораживанием с последующим поглощением фторидом натрия. Ф. хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (
), из меди, алюминия и его сплавов, латуни, нержавеющей стали.
Применение. Газообразный Ф. служит для фторирования UF
4, в UF
6, применяемого для
урана, а также для получения трёхфтористого хлора ClF
3(фторирующий агент), шестифтористой серы SF
6(газообразный изолятор в электротехнической промышленности), фторидов металлов (например, W и V). Жидкий Ф. — окислитель ракетных топлив.
Широкое применение получили многочисленные соединения Ф. —
,
,
, фторсульфоновая кислота (растворитель, катализатор, реагент для получения органических соединений, содержащих группу — SO
2F), BF
3(катализатор), фторорганические соединения и др.
Техника безопасности. Ф. токсичен, предельно допустимая концентрация его в воздухе примерно 2·10
-4
мг/л, а предельно допустимая концентрация при экспозиции не более 1
чсоставляет 1,5·10
-3
мг/л.
А. В. Панкратов.
Фтор в организме. Ф. постоянно входит в состав животных и растительных тканей; микроэлемент. В виде неорганических соединений содержится главным образом в костях животных и человека — 100—300
мг/кг; особенно много Ф. в зубах. Кости морских животных богаче Ф. по сравнению с костями наземных. Поступает в организм животных и человека преимущественно с питьевой водой, оптимальное содержание Ф. в которой 1—1,5
мг/л. При недостатке Ф. у человека развивается
, при повышенном поступлении —
. Высокие концентрации ионов Ф. опасны ввиду их способности к ингибированию ряда ферментативных реакций, а также к связыванию важных в биологическом отношении элементов (Р, Ca, Mg и др.), нарушающему их баланс в организме. Органические производные Ф. обнаружены только в некоторых растениях (например, в южноафриканском Dichapetalum cymosum). Основные из них — производные фторуксусной кислоты, токсичные как для др. растений, так и для животных. Биологическая роль Ф. изучена недостаточно. Установлена связь обмена Ф. с образованием костной ткани скелета и особенно зубов. Необходимость Ф. для растений не доказана.
В. Р. Полищук.
Отравления Ф. возможны у работающих в химической промышленности, при синтезе фторсодержащих соединений и производстве фосфорных удобрений. Ф. раздражает дыхательные пути, вызывает ожоги кожи. При остром отравлении возникают раздражение слизистых оболочек гортани и бронхов, глаз, слюнотечение, носовые кровотечения; в тяжёлых случаях — отёк лёгких, поражение центрльной нервной системы и др.; при хроническом — конъюнктивит, бронхит, пневмония, пневмосклероз, флюороз. Характерно поражение кожи типа экземы. Первая помощь: промывание глаз водой, при ожогах кожи — орошение 70%-ным спиртом; при ингаляционном отравлении — вдыхание кислорода. Профилактика: соблюдение правил техники безопасности, ношение специальной одежды, регулярные медицинские осмотры, включение в пищевой рацион кальция, витаминов. Препараты, содержащие Ф., применяют в медицинской практике в качестве противоопухолевых (5-фторурацил, фторафур, фторбензотэф), нейролептических (трифлуперидол, или триседил, фторфеназин, трифтазин и др.), антидепрессивных (фторацизин), наркотических (фторотан) и др. средств.
Лит.:Рысс И. Г., Химия фтора и его неорганических соединений, М., 1956; Фтор и его соединения, пер. с англ., т. 1—2, М., 1953—56; Профессиональные болезни, 3 изд., М., 1973.
Фториды
Фтори'ды,соединения фтора с другими элементами. Ф. элементов I и II групп преиодической системы Менделеева — твердые вещества с ионной связью элемент — фтор; Ф. большинства элементов VI—VII групп — газы с ковалентной связью элемент — фтор; соединения, содержащие связь C—F, образуют многочисленный класс
; высшие Ф. многих металлов (U, V, Mo, W, Re и др.) — летучие вещества. Ф. встречаются в природе (см.
). По химическим свойствам Ф. галогенов, инертных газов, кислорода и азота, а также многих др. элементов в высших степенях окисления (например, PtF
5, CoF
3, AgF
2) — окислители; Ф. мышьяка, сурьмы, бора — сильные льюисовские кислоты (см.
).
Получить Ф. можно взаимодействием фтора с элементами, действием фтористого водорода на металлы и другими способами.
Широкое применение находят фтористый водород, фториды кислорода, фториды азота. Ф. хлора ClF
3и ClF
5— окислители ракетных топлив; кроме того, ClF
3служит фторирующим агентом для получения гексафторида урана UF
6, применяемого в атомной промышленности для изотопов разделения урана; летучие Ф. металлов используются для нанесения металлических покрытий. Ф. лития, магния, кальция, стронция, бария и др. металллов применяют в качестве сырья для производства оптических стёкол. См. также
.
Лит.см. при ст.
.
А. В. Пакратов.
Фториды азота
Фтори'ды азо'та,неорганические соединения, содержащие связь N—F, например трифторид азота NF
3, тетрафторгидразин N
2F
4, дифторамин NF
2H, фтористый нитрозил FNO и др. Ф. а. — бесцветные газы со специфическим запахом. При нагревании разлагаются на элементы или трифторид азота и азот (за исключением NF
3и FNO). Проявляют свойства сильных окислителей. С органическими соединениями некоторые Ф. а. образуют многочисленные органические вещества, содержащие группы —NF
2и —NONF. Особенность Ф. а. состоит в том, что при взаимодействии с сильными льюисовскими кислотами (см.
) они образуют соли с фторазотными катионами
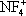
,
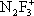
,
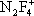
, F
2NO
+.
Трифторид азота, NF
3— газ;
t
пл— 208,5°С,
t
kип— 129,1°С. Окислительная способность проявляется при высоких температурах. Превращается в тетрафторгидразин при повышенных температурах и в присутствии меди, железа, ртути или угля. Получается электролизом расплава дифторида аммония или фторированием азотсодержащих веществ. Применяется в производстве тетрафторгидразина.
Тетрафторгидразин, N
2F
4— газ;
t
пл— 161,5°С,
t
kип— 74,2°С. Способен к диссоциации: N
2F
4Ы 2NF
2. При 150°С и давлении 0,1
Мн/м
2(1
кгс/см
2) степень диссоциации 0,2. Диссоциация N
2F
4обусловливает его дифтораминирующее действие, которое проявляется, например, в присоединении к олефинам:
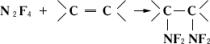
. Тетрафторгидразин получается конверсией трифторида азота над углём (промышленный метод), разложением NF
2H или окислением его растворов. Применяется для синтеза органических дифтораминосоединений.
Дифторамин, NF
2H — газ;
t
пл— 116°С,
t
kип— 23°С. Взрывается при ударе (особенно в жидком и твёрдом состояниях). Проявляет амфотерные свойства. В реакциях действует как дифтораминирующий агент. Получается действием серной кислоты на дифтораминомочевину (продукт фторирования мочевины) или на трифенилметил дифторамин, синтезируемый из N
2F
4и трифенилметилхлорида в присутствии ртути. Применяется для синтеза органических дифтораминосоединений.
Лит.:Панкратов А. В., Химия фторидов азота, М., 1973.
А. В. Панкратов.
Фториды галогенов
Фтори'ды галоге'нов,соединения фтора с др. галогенами. Известны следующие Ф. г.: CIF, CIF
3, CIF
5, BrF, BrF
3, BrF
5, IF, IF
5и IF
7. Подробно см. в ст.
.
Фториды кислорода
Фтори'ды кислоро'да,соединения, содержащие связь О—F, например дифторид OF
2, монофторид (диоксофторид) O
2F
2, нитрат фтора FNO
3, перхлорат фтора FClO
4. Фтор с кислородом образует в тлеющем разряде смесь стабильных радикалов F—O—O и атомов фтора; при конденсации этой смеси при —96°С образуются высшие фториды кислорода — O
2F
2, O
3F
2и др., стабильные лишь при низких температурах.
Все Ф. к. обладают сильной окислительной способностью.
Дифторид кислорода, OF
2— бесцветный газ с резким специфическим запахом, сильно токсичен; плотность 1,521
г/см
3при — 145°С,
t
пл— 224°С,
t
kип— 145°С. OFa медленно разлагается на элементы при температуре около 200°С. Чистый дифторид кислорода не взрывается. Слабо растворяется в воде, подвергаясь гидролизу. Жидкий OF
2неограниченно растворим в жидких фторе, кислороде и озоне. По химическим свойствам OF
2— сильный окислитель; он фторирует металлы при слабом нагревании; с водой, водородом, галогенами реагирует со взрывом при инициировании искрой или при нагревании. OF
2получается фторированием водного раствора едких натра или кали: 2F
2+ 2NaOH = OF
2+ 2NaF + H
2O, а также электролизом водного раствора HF.
Монофторид кислорода, диоксофторид, оксид фтора, O
2F
2— соединение нестабильно. При взаимодействии с льюисовскими кислотами (см.
) образует соли диоксигенильного катиона O
2
+, например: O
2F
2+ SbF
5= O
2SbF
6+
1/
2F
2. Получают из смеси фтора с кислородом в тлеющем разряде при температуре — 196°С. Применяют в лаборатории как сильный фторирующий и окисляющий агент.
Лит.см. при ст.
.
А. В. Панкратов.
Фториды природные
Фтори'ды приро'дные,класс минералов, природные соединения элементов Na, К, Ca, Mg, Al, редкоземельных элементов (TR), реже Cs, Sr, Pb, Bi, В с фтором. Известно около 35 Ф. п. Различают простые Ф. п.: группа виллиомита — NaF, флюорита — CaF
2, селлаита — MgF
2, флюоцерита — (Ce, La) F
3, и комплексные, в которых комплексообразователями являются В, Al, Mg, TR, Si, а роль адденда выполняет фтор: группа авогадрита — (К, CS)[BF
4], криолита — Na
3[AlF
6], гагаринита — NaCa [TRF
6], нейборита — Na [MgF
6], веберита — Na
2[MgAlF
7], томсенолита — NaCa [AlF
6]·H
2O, малладрита — Na
2SiF
6] и др. Наиболее распространён в природе
.
Ф. п. бесцветны или окрашены в светлые тона, прозрачные или просвечивающие, со стеклянным блеском, низкой твёрдостью (2—5 по минералогической шкале), плотностью (2000—3180
кг/м
3исключение составляют фториды редких земель) и весьма низкими показателями преломления (1,30—1,50; у флюоцерита 1,61).
Ф. п. возникают в возгонах вулканов (ферручит, авогадрит, криптогалит, малладрит и др.), встречаются как акцессорные минералы гранитов, щелочных пород и их эффузивных аналогов (флюорит). Они характерны для поздних стадий развития карбонатитов (флюорит), гранитных пегматитов, грейзенов и гидротермальных образований (флюорит), щелочных гранитов и связанных с ними метасоматитов (криолит, флюоцерит, гагаринит), а также луявритов, фойяитов и уртитов (виллиомит). Многие алюмофториды возникают при гидротермальном изменении криолита (томсенолит, ральстонит, пахнолит, веберит, хиолит и другие). В зоне окисления по эндогенным Ф. п. часто развиваются гипергенные: геарксутит, кридит, флюеллит, для осадочных толщ характерен флюорит (ратовкит). Практическое значение имеют флюорит и
.
Лит.:Минералы. Справочник, т. 2, в. 1, М., 1963.
А. И. Гинзбург.
Фтористоводородная кислота
Фтористоводоро'дная кислота',плавиковая кислота, водный раствор
HF; фтористый водород смешивается с водой в любых соотношениях.


 Ф. а. — важный исходный продукт в производстве различных производных
; сложных эфиров,
, фталонитрила и др. Конденсацией Ф. а. с фенолами получают красители, например
. Значительное количество Ф. а. используется в производстве глифталевых и пентафталевых смол (см.
), промежуточных продуктов и красителей — производных флуоресцеина, родамина и антрахинона; лекарственных средств, например
и фенилина (применяется при повышенной свёртываемости крови). Ф. а. получают каталитическим окислением нафталина, а также оксилола воздухом в газовой фазе.
Ф. а. — важный исходный продукт в производстве различных производных
; сложных эфиров,
, фталонитрила и др. Конденсацией Ф. а. с фенолами получают красители, например
. Значительное количество Ф. а. используется в производстве глифталевых и пентафталевых смол (см.
), промежуточных продуктов и красителей — производных флуоресцеина, родамина и антрахинона; лекарственных средств, например
и фенилина (применяется при повышенной свёртываемости крови). Ф. а. получают каталитическим окислением нафталина, а также оксилола воздухом в газовой фазе. Обладая свойствами слабой кислоты, Ф. образует, например с растворами щелочей, металлические производные (C
8H
4O
2NK и др.), используемые для синтеза первичных аминов и a-аминокислот (
), в производстве
. N-Галогенозамещённые Ф., получаемые взаимодействием Ф. с хлором и бромом (например, C
8H
4O
2NBr), используют в лабораторной практике для галогенирования органических соединений. Получают Ф. из
и карбоната аммония или аммиака.
Обладая свойствами слабой кислоты, Ф. образует, например с растворами щелочей, металлические производные (C
8H
4O
2NK и др.), используемые для синтеза первичных аминов и a-аминокислот (
), в производстве
. N-Галогенозамещённые Ф., получаемые взаимодействием Ф. с хлором и бромом (например, C
8H
4O
2NBr), используют в лабораторной практике для галогенирования органических соединений. Получают Ф. из
и карбоната аммония или аммиака.


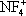 ,
,
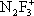 ,
,
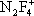 , F
2NO
+.
, F
2NO
+.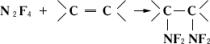 . Тетрафторгидразин получается конверсией трифторида азота над углём (промышленный метод), разложением NF
2H или окислением его растворов. Применяется для синтеза органических дифтораминосоединений.
. Тетрафторгидразин получается конверсией трифторида азота над углём (промышленный метод), разложением NF
2H или окислением его растворов. Применяется для синтеза органических дифтораминосоединений.