 |
|
Популярные авторы:: БСЭ :: Желязны Роджер :: Толстой Лев Николаевич :: Joyce James :: Раззаков Федор :: Станюкович Константин Михайлович :: Чехов Антон Павлович :: Андерсон Пол Уильям :: Лавкрафт Говард Филлипс :: Грин Александр Популярные книги:: The Boarding House :: Бурый волк :: Пошехонская старина :: Подземная Москва :: Основание :: Мальтийский сокол :: Как мы изобрели фотосинтезатор :: Вторая книга Паралипоменон :: 10 лекций о Каббале :: Тварь в лунном свете |
Мониторинг дыхания: пульсоксиметрия, капнография, оксиметрия.ModernLib.Net / Шурыгин А. / Мониторинг дыхания: пульсоксиметрия, капнография, оксиметрия. - Чтение (стр. 5)
Поэтому при проведении ИВЛ больным с гиповолемией рекомендуется уменьшать дыхательный объем компенсаторно увеличивать частоту вентиляции, снижать отношение вдох: выдох до 1:3 и избегать применения ПДКВ. Подбор режима, основанный на этих принципах, позволяет существенно снизить пиковое и среднее внутригрудное давление и тем самым уменьшить отрицательное влияние ИВЛ на венозный возврат. Перевыполнение этих рекомендаций логически приводит нас к оптимальному способу вентиляции при гиповолемии - высокочастотной ИВЛ, которая должна осуществляться с относительно невысокой частотой (80-120 в 1 мин) и отношением вдох: выдох, равному 1:3. Обнаружение вышеперечисленных пульсоксиметрических признаков гиповолемии доступно только при использовании монитора соответствующего класса. Такой монитор должен обладать свойством отражения реальной амплитуды ФПГ столбчатым индикатором (самый частый вариант) или в цифровом виде ("амплитудный фактор" DATEX). Желательно, чтобы пульсоксиметр запоминал и воспроизводил в виде трендов изменения не только SpO2, но и амплитуды ФПГ*. * Тренд амплитуды ФПГ выводится на дисплей лишь у единичных моделей пульсоксиметров. К ним относятся, например, мониторы серии AURA фирмы CURATIVUS. Такие явления, как дыхательные волны на ФПГ, лучше определяются при малой скорости записи, когда на экране помещается большое количество циклов, но для этого должна иметься возможность регулировать временной масштаб дисплея. И наконец, надо помнить, что при гиповолемии ушной датчик обычно дает более качественный сигнал, чем пальцевой. Кстати, пульсоксиметрия предоставляет возможность оценить эффективность специального приема, с помощью которого удается в большинстве случаев существенно уменьшить отрицательное влияние ИВЛ на гемодинамику при гиповолемии. Речь идет о режиме ИВЛ с активным выдохом (отрицательном давлении в фазе выдоха, NEEP). Снижение давления в дыхательных путях в фазе выдоха до (-3)-(-8) см вод. ст. увеличивает венозный возврат и ударный объем, что проявляется возрастанием амплитуды волн ФПГ. Увеличение дыхательных волн на ФПГ при вентиляции в этом режиме обусловлено циклическим возрастанием венозною возбрзла. в фазе активного выдоха 1. Адекватная терапия острой гиповолемии приводит к нормализации пульсоксиметрических показателей. При отсутствии специфических травм или других сопутствующих обстоятельств стойкое снижение SpO2 после коррекции волемических расстройств обусловлено двумя причинами: 1. Гипергидратацией легочной ткани при избыточном объеме инфузий. SpО2 удается постепенно нормализовать, проводя терапию диуретиками и применяя сеансы дыхания в режиме ПДКВ или НПД. 2. Неуклонно прогрессирующее снижение SpО2 должно настораживать, поскольку может оказаться первым признаком повреждения легких по типу респираторяого дистресс-синдро-ма. В этом случае положительное действие дегидратационной терапии на SpO2 оказывается неотчетливым и нестойким, а, поначалу эффективная, оксигенотерапия вскоре неспособна устранить артериальную гипоксемию. Пульсоксиметрия ори оксигенотерапии. Увеличение концентрации кислорода во вдыхаемой или вдуваемой газовой смеси - универсальный способ коррекции артериальной гипоксемии. У большинства пациентов одной только оксигенотерапии, как правило, достаточно для того, чтобы нормализовать или хотя бы повысить Sр02. Однако, руководствуясь принципом: "Если больной дышит плохо, пусть он плохо дышит кислородом' 1, - полезно иметь в виду следующее: • беспричинной гипоксемии не бывает; • кислород ликвидирует гипоксемию, но не причину, ее породившую; • к кислороду необходимо относиться так же, как к любому другому медицинскому препарату; его нужно применять по определенным показаниям, в определенных дозах.и помнить, что он обладает весьма опасными побочными эффектами; В настоящее время наблюдается крайне сдержанное, а нередко и откровенно негативное отношение к атому режиму, в основном из-за его способности провоцировать раннее экспираторное закрытие дыхательных путей (ЭЗДП). Об этой опасности действительно необходимо помнить, как, впрочем, и о том, что в неумелых руках любой метод лечения обычно' реализуется побочными действиями, а не лечебным эффектом.. • концентрация кислорода в дыхательной смеси должна быть той минимальной, которая достаточна для коррекции гипоксемии; • предельная безопасная для длительного использования концентрация кислорода в дыхательной смеси, по последним данным, равна 50 %; • токсическое влияние высоких концентраций кислорода на легкие не имеет специфических проявлений и всплывает в виде ателектазов, гнойного трахеобронхита или респираторного дистресс-синдрома, которые в дальнейшем соотносят с чем угодно, но не с оксигенотерапией; • и наконец, к кислороду в полной мере относится "золотое правило" интенсивной терапии: лучший лист назначений - не тот, к которому нечего добавить, а тот, из которого нечего вычеркнуть. Пульсоксиметрия - ключ к решению многих перечисленных выше проблем. Мониторинг оксигенации помогает не только своевременно обнаружить гипоксемию, но также установить ее причину, подобрать оптимальную концентрацию кислорода в дыхательной смеси и в нужный момент безопасно перевести больного на дыхание атмосферным воздухом. Нормальная величина SpO2 находится в диапазоне 94-98 %, причем у пациентов молодого и среднего возраста, не имеющих легочной патологии, преобладают значения сатурации 96-98 %, а у пожилых больных чаще встречается Sp02 94-96 %, что обусловлено возрастными изменениями в легких. У пациентов с хронической легочной патологией отмечается адаптация к более низкому уровню сатурации. Попытка искусственной "нормализации" SpO2 у таких больных может закончиться угнетением спонтанного дыхания. При нормальном уровне SpO2 оксигенотерапия показана: 1. При выраженной острой недостаточности кровообращения или очень глубокой анемии, когда приходится надеяться даже на незначительное увеличение системного транспорта кислорода за счет до насыщения кислородом оставшихся 2-4 % гемоглобина. 2. В качестве профилактической меры при реальном риске внезапного развития гипоксемииу пациентов с нестабильным дыханием, например в раннем послеоперационном периоде или при неврологической патологии, затрагивающей дыхательный центр или дыхательную мускулатуру. В таких случаях обычно бывает достаточно повысить FiOa до 30-40 %. К числу показаний мы не относим отравление угарным газом, при котором значение Sp02 всегда является артефактным. Снижение Sp02 до 90-94 % расценивается как умеренная артериальная гипоксемия. Если она обнаруживается у больных, дышащих атмосферным воздухом, вопрос о необходимости оксигенотерапии решается индивидуально. Надо помнить, что неглубокую гипоксемию человек может довольно длительно переносить без печальных последствий. Исключение составляют пациенты с тяжелой анемией, недостаточностью кровообращения, нарушениями коронарного или мозгового кровотока, гиперметаболизмом. Выраженная артериальная гипоксемия (SpO2 =85-90 %) - это следствие и признак серьезного нарушения газообмена и безусловное показание для назначения кислорода. Нормализация пульсоксиметрических параметров на фоне оксигенотерапии не отменяет необходимости выяснения причины расстройства и ее устранения с использованием приемов, рассмотренных выше. При глубокой гипоксемии (SpO2 «85 %) оксигенотерапия служит экстренной первичной мерой коррекции и фоном для применения более сложных и требующих времени методов лечения, выбор которых определяется причиной нарушения газообмена. Пульсоксиметрия позволяет реализовать важнейший принцип оксигенотерапии - использование кислорода в концентрации, не превышающей ту минимальную; которая требуется, чтобы удерживать SpO2 в пределах нормальных значений. После заполнения гемоглобиновой емкости артериальной крови на 98-100 % дальнейшее увеличение FiO2 становится бессмысленным, поскольку приводит лишь к незначительному приросту оксигенации крови за счет физически растворенного в ней кислорода. Стремление увеличить количество физически растворенного в крови кислорода оправдано лишь: • при крайне низком содержании гемоглобина; • при выраженной недостаточности кровообращения; • при отравлении окисью углерода; • при необходимости денитрогенации организма. В подавляющем большинстве случаев применение кислорода в концентрациях, превышающих минимально достаточную для практически полного насыщения гемоглобина артериальной крови (SpO2 =98-100%), не содействует сколько-нибудь заметному улучшению оксигенации тканей, но повышает риск гипероксического повреждения легких и приводит к непроизводительному расходу газа. Пульсоксиметр измеряет степень заполнения кислородом гемоглобиновой емкости артериальной крови и потому не способен выявлять гипероксию. После того как достигается 100 % сатурация гемоглобина (у здорового человека этого добиваются назначением 30 % кислорода), дальнейшее увеличение Fi02 приводит лишь к росту напряжения и содержания физически растворенного кислорода в крови, на который пульсоксиметр не реагирует. В подобных случаях монитор будет показывать на дисплее один и тот же, максимально возможный, уровень сатурации (Sp02 = 100 %), начиная с Fi02 - 0,3 и далее, при увеличении концентрации кислорода во вдыхаемом газе вплоть до использования чистого кислорода. В случаях, когда пульсоксиметр отображает на индикаторе SpO2 = 100 %, врач не может быть уверен в том, что концентрация кислорода не избыточна (рис. 1.16). Чтобы выйти из этого положения, достаточно плавно уменьшить содержание кислорода в дыхательной смеси до того уровня, при котором Sp02 составит 98-99 % или вовсе вернется в границы нормы. При снижении SpO2 со 100 до 98 % уменьшение содержания кислорода в артериальной крови столь несущественно, что в подавляющем большинстве случаев может быть произведено незаметно для здоровья больного. Зато врач приобретает надежный ориентир, помогающий отслеживать в мониторном режиме правильность дозирования кислорода. В дальнейшем регулировать FiOa нужно таким образом, чтобы поддерживать Sp02 на 1-3 % ниже 100 %. Тем самым обеспечиваются нормальное насыщение гемоглобина артериальной крови Кислородом и минимальная достаточная концентрация кислорода во вдыхаемом газе. Благодаря такому подходу не только сокращается риск ги-пероксического повреждения легких, но и экономно расходуется сжатый кислород. При катастрофическом поражении легких, сопровождающемся массивным шунтированием крови и глубокой гипоксемией, даже вентиляция 100 % кислородом не позволяет нормализовать Sp02. В этих случаях приходится идти на вынужденный компромисс, выбирая между наименьшим допустимым уровнем SpO2 и максимально приемлемой для длительного применения концентрацией кислорода во вдуваемом газе. И если повышение Fi02 c 50 дo 100 % дает увеличение SpO2 с 75 до 78 %, задумайтесь, не слишком ли высока цена за столь незначительный результат. Диагноз "токсическое поражение легких кислородом" практически не встречается ни в историях болезни, ни в протоколах патологоанатомического исследования, но это говорит лишь о неумении распознавать патологию, а не о ее отсутствии. Разумеется, сказанное выше относится к многочасовой и многосуточной оксигенотерапии, в том числе и при длительной ИВЛ. При кратковременном лечении кислородом критерии к его дози-рованию не столь жестки и основная цель пульсоксиметрии состоит в предупреждении гипоксемии и своевременном прекращении оксигенотерапии. 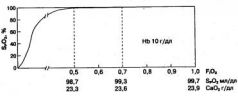 отчетливо видна нецелесообразность применения Fi02 выше 50 % Пульсоксиметрия при ИВЛ. Обеспечение оксигенации артериальной крови - одна из основных конечных задач ИВЛ, и уже только поэтому пульсоксиметрия является обязательным методом мониторинга у пациентов, подключенных к дыхательной аппаратуре. Это требовании содержится практически во всех стандартах обеспечения безопасности пациентов. Искусственная вентиляция легких способна влиять на все параметры пульсоксиметрии, так что умение анализировать эти изменения помогает вовремя сориентироваться в ситуации. Однако диагностические возможности метода в данном случае не ограничиваются простым контролем SpO2. ИВЛ радикальным образом изменяет работу всех звеньев процесса легочного газообмена, и в ситуациях, порожденных этим вмешательством, пульсоксиметр предоставляет богатую информацию для размышления. ИВЛ на фоне гиповолемии. Иногда во время проведения ИВЛ наблюдается снижение амплитуды фотоплетизмограммы. Наиболее частая причина этого - уменьшение сердечного выброса из-за роста внутригрудного давления на фоне скрытой гиповолемии. Амплитуда ФПГ может снижаться даже при компенсированной гиповолемии, что, как правило, сочетается с тахикардией, возникновением дыхательных волн, а также с умеренной гипоксемией, легко уступающей повышению FiO2. При декомпенсированной гиповолемии, приводящей к уменьшению минутного объема кровообращения и аварийному перераспределению кровотока, применение ИВЛ чревато катастрофическими последствиями для легочной и системной гемодинамики. В некоторых случаях перфузия периферии нарушается настолько сильно, что монитор не улавливает пульсацию артериол. Резкое снижение фотоплетизмограммы или ее исчезновение с дисплея монитора в таких ситуациях сопровождается сообщением "low perfusion" ("нарушение перфузии") или "low quality signal" ("сигнал низкого качества") и свидетельствует о плачевном состоянии периферического кровотока. При появлении этих симптомов (а они обычно полностью вписываются в общеклиническую картину) необходимо добиваться не только подъема артериального, и центрального венозного давления, но и нормализации пульсоксиметрического статуса. Гиповолемия всегда сопровождается уменьшением давления в легочных капиллярах, особенно в верхних зонах легких, и повышенное альвеолярное давление при искусственном вдохе пережимает межальвеолярные сосуды, направляя кровоток в нижние отделы, вентиляция которых недостаточна для обработки возросшего потока крови. Регионарная гиповентиляция вызывает падение SpO2, что, в сочетании с малым минутным объемом кровообращения, а нередко и анемией, приводит к резкому сокращению доставки кислорода к тканям. Экстренная мера коррекции гипоксии (помимо инфузионной и медикаментозной терапии) - временное изменение режима вентиляции, которое имеет своей целью снижение альвеолярного и внутригрудного давления и включает: (1) отказ от использования ПДКВ; (2) в отдельных случаях - применение активного выдоха с разрежением от -3 до -8 см вод. ст.; (3) уменьшение дыхательного объема с соответствующим увеличением частоты вентиляции или (4) переход на ВЧ ИВЛ с частотой 80-100 в 1 мин и отношением вдох: выдох, равным 1: 3. Гипоксемия, обусловленная регионарной гиповентиляцией, поддается коррекции посредством повышения Fi02. Как правило, принятие этих мер позволяет добиться заметного улучшения пульсоксиметрических показателей задолго до ликвидации гиповолемии. ИВЛ при тяжелом поражении легких. В данной ситуации, требующей применения ИВЛ, пульсоксиметр служит непрерывным поставщиком информации, важность которой трудно переоценить. Респираторному дистресс-синдрому, обширной пневмонии, аспирационному пневмониту и прочим вариантам критического поражения легких сопутствуют комплексные расстройства газообмена и кровообращения, когда выбор оптимального метода и режима ИВЛ является сложнейшей задачей, которую невозможно решать вслепую. Этот выбор подразумевает поиск компромисса между (1) необходимостью создания в течение всего дыхательного цикла повышенного внутрилегочного давления, обеспечивающего поддержание альвеол в раскрытом состоянии, и (2) стремлением причинить при этом минимальный урон объему и распределению легочного кровотока. Увеличение пикового и среднего внутрилегочного давления способно оказать двойственное действие на сатурацию артериальной крови. С одной стороны, высокое давление надува позволяет ввести в жесткие легкие нужный дыхательный объем и тем самым избежать гиповентиляции. Повышенное давление, в том числе и во время выдоха (ПДКВ), требуется также для расправления множественных микро- и макроателектазов и поддержания жестких легких в раскрытом состоянии в течение всего дыхательного цикла. Достижение данной цели сопровождается уменьшением гиповентиляции, шунтирования и диффузионных расстройств. Это проявляется постепенным возрастанием SpO2 и дает возможность снизить FiOa, что при длительной ИВЛ имеет большое значение. В процессе объемной ИВЛ при расправлении ателектазов происходит также падение давления вдоха на манометре респиратора, поскольку дыхательный объем начинает распределяться в возросшем объеме легочной ткани. При вентиляции с ограниченным давлением вдоха (PCV) увеличению объема функционирующей легочной ткани и повышению растяжимости легких сопутствуют самопроизвольный прирост дыхательного объема и возникновение гипервентиляции. С другой стороны, высокое внутрилегочное давление способно вызывать компрессию капилляров в межальвеолярных перегородках, дополнительное увеличение легочного сосудистого сопротивления и уменьшение минутного объема кровообращения, что на дисплее пульсоксиметра отражается снижением амплитуды ФПГ и появлением волн, синхронных с ритмом респиратора. Поскольку сжатие капилляров высоким давлением возможно только в работающих альвеолах, кровоток, минуя их, направляется в пневмонические очаги, ателектазы и инфильтраты (рис. 1.17). Это приводит к усилению шунтирования и падению Sp02.  Комплексная оценка пульсоксиметрических показателей в динамике помогает ориентироваться в событиях, происходящих в пораженных легких под воздействием ИВЛ, и установить баланс между противоречивыми требованиями при выборе и последующей доработке режима вентиляции. В рассмотренной выше ситуации тяжелого поражения легких отказ от применения ПДКВ или, тем более, использование активного выдоха недопустимы, потому что при рестриктивной патологии такие действия приводят к ателектазированию, уменьшению ФОЕ и резкому ухудшению легочного газообмена. Наиболее выгодные условия для работы правого желудочка создаются при ИВЛ с инверсией отношения вдох: выдох, благодаря которой удается снизить ПДКВ и сократить дыхательный объем за счет более выгодного распределения внутрилегочного давления в течение дыхательного цикла. Повысить выброс правого желудочка, подавленный искусственной вентиляцией, помогают инфузии добутамина (добутрекса), усиливающего сократимость миокарда. Эти действия позволяют увеличить объем кровообращения, улучшить распределение легочного кровотока и уменьшить степень артериальной гипоксемии. Результаты коррекции отчетливо прослеживаются на трендах ФПГ и SpO2. Необходимо учитывать, что при глубокой гипоксемии и плохой перфузии периферии точность измерения SpO2 может существенно снизиться. В этих условиях данные пульсоксиметрии требуют периодического сопоставления с результатами лабораторного измерения газового состава артериальной крови. Резкие бессистемные колебания всех параметров пульсоксиметрии наблюдаются при нарушении адаптации пациента к режиму ИВЛ. Эти артефакты бывают обусловлены движением больного, волнами венозного давления при "сопротивлении" респиратору, нарушением процесса вентиляции и повышением потребности в кислороде. Причину легко определить при взгляде на пациента и по неправильной форме ФПГ. Ориентироваться на данные пульсоксиметрии в такие моменты нельзя. Причины внезапного падения SpO2 во время и в связи с ИВЛ: • разгерметизация системы "пациент-респиратор"; • развитие пневмоторакса; • смещение интубационной трубки в бронх; • нарушение подачи кислорода; • неисправность респиратора. Массивное кровотечение на фоне ИВЛ сопровождается значительно более выраженными изменениями на дисплее пульсоксиметра, чем при самостоятельном дыхании. Генез и характер этих изменений, включающих и гипоксемию, обсужден выше. Видимо, излишне напоминать о том, что принятие ответственных решений должно базироваться на достоверной информации, источником которой является пульсоксиметр, произведенный фирмой, имеющей надежную репутацию на рынке мониторов.
Пульсоксиметрия в анестезиологии
|
|||||||
