Мониторинг дыхания: пульсоксиметрия, капнография, оксиметрия.
ModernLib.Net / Шурыгин А. / Мониторинг дыхания: пульсоксиметрия, капнография, оксиметрия. - Чтение
(Весь текст)
Шурыгин И. А.
Мониторинг дыхания: пульсоксиметрия, капнография, оксиметрия.
Compilated by Virus
СПб.: "Невский Диалект"; М.: "Издательство БИНОМ", 2000.- 301 с.: ил. Рецензент проф. В. С. Щелкунов В книге впервые в России, представлена исчерпывающая информация о применении неинвазивного мониторинга дыхания в анестезиологии и интенсивной терапии. Подробно рассмотрены технические, физиологические и клинические аспекты трех основных методов - пульсоксиметрии, капнографии и оксиметрии. Большое внимание уделено способам правильной интерпретации данных мониторинга в различных клинических ситуациях. На многочисленных примерах показано, как использовать мониторы и мониторные комплексы в качестве надежных диагностических инструментов и извлекать из получаемых показателей максимум полезной информации. В заключительной части подробно освещены вопросы оснащения рабочих мест мониторной техникой, рассмотрены организационные и коммерческие стороны этой проблемы. Представленные сведения систематизированы, что обеспечивает их быстрое и полное усвоение читателем. Для анестезиологов, реаниматологов, интенсивистов, врачей скорой помощи и специалистов, использующих в работе методы мониторного контроля дыхания.
Пульсоксиметрия
Технология метода
Основу метода пульсоксиметрии составляет измерение поглощения света определенной длины волны гемоглобином крови. Гемоглобин служит своего рода фильтром, причем "цвет" и "толщина" этого естественного фильтра могут меняться.
"Цвет" фильтра зависит от количества кислорода, связанного с гемоглобином, или, иными словами, от процентного содержания оксигемоглобина. На этом базируется способность пульсок-симетра устанавливать степень оксигенации крови.
На изменения "толщины" фильтра влияет пульсация артериол: каждая пульсовая волна увеличивает количество крови в артериях и артериолах. Врач определяет это как пульс, а пульсок-симетр - как "утолщение" фильтра. Так измеряются частота пульса и амплитуда пульсовой волны.
Таким образом, применение одного принципа измерения позволяет определить сразу три диагностических параметра: степень насыщения гемоглобина крови кислородом, частоту пульса и его "объемную" амплитуду.
Поскольку измерение производится путем просвечивания тканей, метод получил название "трансмиссионная пульсоксиметрия". В настоящее время интенсивно разрабатывается другой вариант метода, заключающийся в анализе светового потока, отраженного тканями (отраженная пульсоксиметрия). Выпуск серийных приборов, работающих по этому принципу, освоен лишь несколькими фирмами.
Оксигемометрия
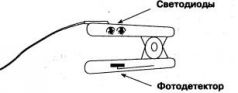
Заглянув внутрь датчика работающего пульсоксиметра, мы обнаружим источник красного света, который называется светодиодом (LED - light emitting diod). В действительности в датчике их два, и оба функционируют, но мы видим лишь красный свет, поскольку второй фотодиод дает невидимое глазом инфракрасное излучение. На противоположной части датчика располагается фотодетектор, который определяет интенсивность падающего на него светового потока. Заметим, что фотодетектор измеряет излучение обоих светодиодов, а заодно способен улавливать и окружающий свет. Когда между светодиодами и фотодетектором находится палец или мочка уха пациента, часть излучаемого света поглощается, рассеивается, отражается тканями и кровью, и световой поток, достигающий детектора, ослабляется. Из всех этих явлений нас, конечно же, интересует поглощение светового потока кровью, протекающей по сосудам, и не всей кровью, а только артериальной, поскольку цель пульсоксиметрии - измерение степени насыщения гемоглобина артериальной крови кислородом. Гемоглобин - общее название белков крови, содержащихся в эритроцитах и состоящих из четырех цепочек бесцветного белка глобина, каждая из которых включает одну группу гема. Разновидности гемоглобина имеют собственные названия и обозначения (фетальный НЬ, MetHb и пр.).
Рис. 1.1. Датчик пульсоксиметра
Оксигемоглобин - полностью оксигенированный гемоглобин, каждая молекула которого содержит четыре молекулы кислорода (О2). Обозначается НЬО2. Дезоксигемоглобин - гемоглобин, не содержащий кислорода. Называется также восстановленным, или редуцированным, гемоглобином и обозначается НЬ. Ткани, через которые проходят оба световых потока, являются неизбирательным фильтром и равномерно ослабляют излучение обоих светодиодов. Степень ослабления зависит от толщины тканей, наличия кожного пигмента, лака для ногтей и прочих препятствий на пути света. Гемоглобин, в отличие от тканей,- это цветной фильтр, причем на цвет фильтра влияет степень насыщения гемоглобина кислородом. Дезоксигемоглобин, имеющий темно-вишневый цвет, интенсивно поглощает красный свет и слабо задерживает инфракрасный. Поэтому если на кровь, не содержащую кислорода, направить красный и инфракрасный свет, то первый будет почти полностью задержан, а второй - лишь несколько ослаблен. И наоборот, оксигемоглобин хорошо рассеивает красный свет (и потому сам имеет красный цвет), но интенсивно поглощает инфракрасное излучение. О том, какой из двух световых потоков пройдет через оксигенированную кровь, мы предоставляем догадаться читателю. Таким образом, соотношение двух световых потоков, дошедших до фотодетектора через мочку уха или палец, зависит от степени насыщения (сатурации) гемоглобина крови кислородом. По этим данным, используя специальный алгоритм, рассчитывают процентное содержание в крови оксигемоглобина. Невольно возникает вопрос: если принцип измерения оксигенации крови так прост, то почему пульсоксиметры появились лишь в конце 80-х годов XX столетия?
Краткая история метода
Первая попытка гемоксиметрии относится к 1874 году, когда Вирордт обнаружил, что поток красного света, проходя через кисть, ослабевает после наложения жгута. В 30-60-х годах нашего века предпринимается множество попыток создать устройство для быстрого выявления гипоксемии (отметим прибор, сделанный Карлом Мэттесом в Лейпциге в 1936 году, и гемокси-метр, сконструированный Гленом Милликаном в Кембридже в 1940 году, предназначенный для диагностирования гипоксии у пилотов). Важность применения гемоксиметров в операционной впервые доказал Эрл Вуд, руководитель исследовательской группы клиники Мэйо, который в 1951 году писал: "Во многих случаях этот инструмент определял аноксемию, когда пульс, кровяное давление и цвет кожи оставались без изменений".
Широкому распространению гемоксиметров в те годы препятствовали два обстоятельства.
Во- первых, приборы были громоздкими и неудобными. Компактных электронных схем не существовало (микропроцессоры появились гораздо позже), свет нужных длин волн получали с помощью светофильтров, установленных в датчике, а процедуры калибровки были слишком сложны для повседневной работы.
Второе обстоятельство заключалось в диагностической ценности результатов гемоксиметрии. Световой поток, проходя через ткани, встречает на своем пути не только артериальную, но также венозную и капиллярную кровь, а значит, результат измерения зависит как от насыщения гемоглобина артериальной крови кислородом, так и от состояния периферического кровотока и метаболизма тканей. Эту проблему пытались решать, нагревая мочку уха с помощью термоэлемента, чтобы вызвать гиперемию и сделать локальный кровоток явно избыточным по отношению к метаболическим потребностям тканей ("артериализация" венозной крови). Датчики становились еще более громоздкими, а мониторинг иногда заканчивался ожогами. "Конечно, возможно, что когда-нибудь создадут монитор для обнаружения артериальной десатурации, но в связи с серьезными практическими проблемами разработка такого устройства в наше время кажется делом невероятным",- писал в своей книге Дж. Ф. Нанн, не предполагая, что всего через 6 лет появится первая действующая модель пульсоксиметра.
В 1972 году Такуо Аояги, инженер японской корпорации NIHON KOHDEN, изучавший неинвазивный метод измерения сердечного выброса, обнаружил, что по колебаниям абсорбции света, вызванной пульсацией артериол, можно рассчитать оксигенацию именно артериальной крови. Необходимость в нагреве тканей отпала, и прибором стали измерять именно то, что от него требовалось. Такова история становления пульсоксиметрии и первого пульсоксиметра (модель OLV-5100), выпущенного корпорацией NIHON KOHDEN в 1975 году. Этот прибор не нуждался в калибровках, но в качестве источника света в нем по-прежнему использовалась система светофильтров. Особого успеха на рынке он не имел, однако начало было положено.
Необходимо отметить, что в те же годы эту тему в Японии разрабатывала корпорация MINOLTA. Ее модель Oximet MET-1471 со стекловолоконным кабелем, передающим световые потоки светодиодов от монитора к пальцевому датчику, была выпущена в 1977 году.
Через несколько лет американский исследователь Скотт Вилбер использовал принцип Т. Аояги, но взял в качестве источников излучения светодиоды, что позволило создать легкий и компактный ушной датчик. В этом отношении пульсоксиметрии повезло: спектр поглощения гемоглобина случайно оказался в диапазоне излучения кремниевых светодиодов, обладающих поистине бесценными достоинствами: миниатюрностью, надежностью, ничтожным потреблением энергии и способностью давать очень яркое излучение в узком диапазоне частот.
Кроме того, С. Вилбер впервые употребил для калибровки монитора и обработки данных микропроцессор, а также запатентовал собственный алгоритм расчета сатурации. Объединение принципа Т. Аояги и полупроводниковых технологий позволило С. Вилберу создать первый пульсоксиметр современного образца. К его производству приступила компания BIOX, которая за это вскоре была поглощена корпорацией OHMEDA.
К 1990 году выпуском пульсоксиметров занимались уже более 30 фирм, а объем годовых продаж достиг 65 тыс. единиц.
Итак, чем же отличается пульсоксиметрия от своей предшественницы - гемоксиметрии? Знать приведенные ниже технико-физиологические подробности полезно, чтобы правильно пользоваться прибором и не совершать типичных ошибок.
Принцип пульсоксиметрии
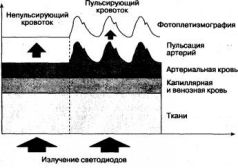
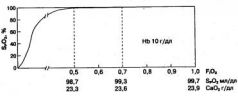
На рис. 1.2 условно, в виде слоев, показаны препятствия, которые световые потоки, излучаемые светодиодами, встречают на пути к фотодетектору. Рис. 1.2. Поглощение световых потоков от светодиодов тканями Свет частично рассеивается, поглощается и отражается тканями пальца или мочки уха. Напомним, что красный и инфракрасный потоки при прохождении через ткани ослабляются в равной степени. Толщина этого биологического фильтра в каждом случае индивидуальна, но при стабильном положении датчика практически постоянна. Она легко учитывается пульсоксиметром, который настраивает интенсивность свечения светодиодов, чтобы излучаемый ими свет мог в достаточном количестве проникать сквозь толщу тканей. Однако при движении больного или смещении датчика расстояние между светодиодами и фотодетектором становится непостоянным, что приводит к появлению артефактов. Следующее препятствие на пути светового потока - венозная и капиллярная кровь - первый избирательный фильтр, который ослабляет красное и инфракрасное излучение неодинаково. Соотношение величин двух световых потоков, прошедших через данный фильтр, зависит от концентрации окси- и дезоксигемоглобина в крови. Но поскольку пульсация венул и капилляров незначительна, объем крови, содержащийся в них, можно считать постоянной величиной, которая просто измеряется и легко учитывается при расчетах. Однако если датчик слишком сильно сдавливает палец или мочку уха, тем самым нарушая отток крови от тканей, пульсация артериального кровотока способна передаваться на вены. Пульсоксиметр не отличает пульсацию артерий от пульсации вен, а потому начинает включать в расчет абсорбцию света венозной кровью, занижая результат. Это необходимо иметь в виду при установке датчика. Артефактное занижение SpO
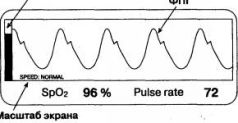
2может происходить и при выраженной вазодилатации, когда артериолы перестают сглаживать периферический кровоток и пульсации крови достигают венул. Еще одна вероятная причина пульсации вен, влияющей на точность работы пульсоксиметра,- недостаточность трикуспидального клапана, при которой каждое сокращение правого желудочка сопровождается регургитацией крови в венозную систему. Такое явление наблюдается не только при органических пороках сердца, но и при острой дилатации правого желудочка, например при массивной тромбоэмболии легочной артерии. Сходные по природе артефакты возникают и в момент кашля, порождающего мощные волны давления в венозной системе (в чем нетрудно убедиться, покашляв после подключения пульсоксиметра). Высокие венозные волны могут появляться на фотоплетизмограмме, если датчик находится значительно ниже уровня сердца. Чтобы самому убедиться в этом, достаточно встать и опустить руку с датчиком вниз. Во многих случаях такой маневр сопровождается удвоением частоты пульса и занижением сатурации. Поэтому некоторые фирмы рекомендуют располагать руку с помещенным на ней датчиком на уровне сердца. К сожалению, распознать такого рода артефакты в клинических условиях непросто. Для этого требуется синхронное инвазивное или лабораторное измерение S»02. Лишь в единичных моделях пульсоксиметров есть специальные программы анализа сигнала и обнаружения артефактов. Вот почему в случаях, описанных выше, ориентироваться на показания пульсоксиметра следует с осторожностью. Перед тем как принять в расчет показания монитора, обратите внимание на форму фотоплетизмограммы. При наличии дополнительных волн и пиков воздержитесь от выводов и действий, основанных на показаниях пульсоксиметра. Если степень гипоксемии, выявленная пульсоксиметром, переполняет чашу Вашего терпения и требует незамедлительных действий, определите газовый состав артериальной крови: РaО2 - самый надежный показатель, который не подведет. Следующий слой на схеме - это кровь, остающаяся в артериолах к концу каждой пульсации, своего рода "конечно-систолический объем" артериального русла. Поглощение световых потоков данным слоем содержит столь нужную информацию об артериальном оксигемоглобине, однако извлечь ее невозможно: непульсирующий компонент артериального объема также рассматривается пульсоксиметром лишь как досадная помеха на пути к цели. Итак, из трех вышеназванных слоев выходят два - по-разному ослабленных, но постоянных - световых потока. Вся эта история обретает смысл после того, как они проникают через последний слой - кровь, пульсирующую в артериях. В момент, предшествующий сердечному сокращению, ослабление световых потоков обусловлено первыми тремя слоями: на фотодиод падает излучение, которое пульсоксиметр расценивает как фоновое. Когда до артерий доходит очередная пульсовая волна, объем крови в них увеличивается и поглощение света изменяется. На пике пульсовой волны различие между фоновым и текущим током фотодетектора становится максимальным. Пульсоксиметр измеряет это различие и считает, что причина его - в дополнительном количестве артериальной крови, появившейся на пути излучения. Этой информации оказывается достаточно, чтобы по специальному алгоритму рассчитать степень насыщения гемоглобина артериальной крови кислородом. К сожалению, сам принцип измерения является источником многих артефактов, потому что любые быстрые изменения сигнала, независимо от их происхождения, монитор может расценить как исходную информацию для расчета Sp02. В различных моделях пульсоксиметров степень насыщения гемоглобина артериальной крови кислородом (в % от общего содержания гемоглобина) обозначается неодинаково: SAT - сатурация (насыщение); НЬО2- процентное содержание НЬО2 от общего количества гемоглобина; Sа02 - насыщение артериальной крови кислородом; SpO2 - насыщение артериальной крови кислородом, измеренное методом пульсоксиметрии. Последнее обозначение - наиболее употребляемое и самое корректное, поскольку предполагает, что результат измерения зависит от особенностей метода. Например, SpO2 при наличии в крови карбоксигемоглобина будет выше истинной величины SaO2, измеренной лабораторным методом. В общении с коллегами частое применение правильных, но длинных выражений, типа "сатурация гемоглобина артериальной крови кислородом" или "процентное содержание оксигемоглобина в артериальной крови", поможет быстро завоевать репутацию зануды и умника. Понимая это, многие врачи для удобства в разговоре и записях прибегают к сокращениям, которые не всегда оказываются удачными ("сатурация кислорода" и пр.). Возникновение профессионального жаргона неизбежно, но он не должен искажать суть явления. Говоря о физиологическом процессе, лучше пользоваться словами "оксигенация артериальной крови", а сам параметр SpO2 обозначать термином "сатурация", подразумевая, что речь идет именно о кислороде и артериальной крови. Для записей в историях болезни идеально подходит обозначение "Sp02". В современных моделях пульсоксиметров пульсация артериол выводится на дисплей в виде кривой. Поскольку эта кривая отражает колебания объема артериального русла, измеренные фотометрическим методом, она называется фотоплетизмограммой (ФПГ). Типичная форма ФПГ показана на рис. 1.3. Диагностическое значение ФПГ мы будем обсуждать ниже, здесь же остановимся на вопросе о скорости реакции пульсоксиметра на колебания сатурации.
Рис. 1.3. Дисплей пульсоксиметра Казалось бы, данная реакция должна быть мгновенной, так как расчет сатурации производится микропроцессором незамедлительно. В действительности же информация о снижении или повышении SaOa отражается на дисплее с некоторой задержкой; в отдельных случаях она составляет несколько десятков секунд. Главная причина задержки заключается в том, что датчик монитора измеряет сатурацию на самой периферии кровеносного русла, да в к тому же нередко устанавливается на самых удаленных от центра частях тела - пальцах. При каждом сердечном сокращении волна давления распространяется по артериям с очень большой скоростью, и интервал между тонами сердца и волнами на ФПГ исчисляется долями секунды. Поэтому можно считать, что фотоплетизмограмма колеблется практически синхронно с сердечными сокращениями. Но скорость кровотока значительно ниже скорости распространения волн давления в сосудах, а порция крови, оттекающей от сердца, передает информацию о гипоксемии лишь тогда, когда доходит до периферии и попадает в поле зрения датчика. Поверхностные волны от чернил, вылитых в ведро воды, "добегают" до его краев гораздо быстрее, чем краска. Итак, скорость реакции пульсоксиметра на изменения SpO2 определяется линейной скоростью артериального кровотока, которая, в свою очередь, зависит от сердечного выброса и просвета сосудов. В норме кровь очередного ударного объема достигает пальцевого датчика через 3-5 с, а ушного - через 2-3 с после сердечного сокращения, но при выраженной периферической вазоконстрикции или гипокинетическом состоянии кровообращения этот интервал может увеличиваться до 20-30 с, а иногда и до 1-1,5 мин. При нарушениях кровообращения ушной датчик реагирует быстрее и надежнее, чем пальцевой. Пульсоксиметр способен рассчитывать Sp02 по каждой волне ФПГ, а частоту пульса - по каждому интервалу между волнами, однако если бы все эти данные выводились на дисплей, то полезная информация потонула бы в пляске цифр. Пульсоксиметр показывает усредненные параметры за некоторый период наблюдения. В разных моделях этот период составляет от 3 до 20 с или от 2 до 20 циклов. В простейших моделях интервал обновления данных задается жестко и обычно равняется 5 с. При наличии усовершенствованного монитора врач имеет возможность изменять период усреднения. Длительный интервал (10-20 с) позволяет точнее определять частоту пульса при брадикардии и аритмиях, но скорость реакции прибора на изменение Sp02 снижается. При тахикардии целесообразнее уменьшить интервал обновления данных, а в остальных случаях лучше выбирать средний вариант (4-6 с). И хотя в рекламных материалах возможность изменения интервала обновления данных подчеркивается как достоинство модели, на практике к ней прибегают не столь уж часто. Таким образом, время реакции числового дисплея монитора на внезапное изменение сатурации складывается из (1) времени кровотока на участке "сердце-палец" и (2) интервала обновления данных на дисплее. Пульсоксиметр отражает на дисплее уровень сатурации с задержкой в пределах от 10 с до 1,5 мин. Поэтому не удивляйтесь, если уровень сатурации при острой гипоксемии продолжает снижаться в течение какого-то времени после увеличения концентрации кислорода в дыхательной смеси. В потенциально опасных ситуациях, когда счет идет на секунды, например при трудной интубации трахеи или при аспирации мокроты из трахеобронхиального дерева у тяжелых больных, всегда имейте в виду эту поправку и прекращайте процедуру раньше, чем показания пульсоксиметра достигнут предельно допустимого уровня. В некоторых моделях мониторов предусмотрена возможность изменять временной масштаб экрана. При медленном движении фотоплетизмограммы на дисплее помещается большое количество волн. Такой масштаб удобен, когда необходимо проанализировать выраженность аритмии, дыхательные волны, артефакты и другие изменения ФПГ в пределах нескольких соседних циклов. И наоборот, ускоренное прохождение сигнала по дисплею позволяет оценить форму каждой отдельной волны. Обычно же следует выбирать нормальную скорость движения кривой.
Погрешности и их источники
Потенциальная возможность возникновения погрешностей заложена как в самом принципе измерения Sp02 и частоты пульса, так и в его технической реализации. Вред, который они причиняют в операционных и палатах интенсивной терапии, достаточно серьезен: • ложная информация иногда приводит к принятию неправильных решений; • частая необоснованная активация аларма снижает доверие медперсонала к методу в целом; • на беспокойный монитор перестают обращать внимание, и появление реальной опасности остается незамеченным; • частая ложная активация аларма провоцирует нехорошее, но вполне естественное желание отключить аларм-систему (что во многих случаях и предпринимается); • работающий монитор становится дополнительным источником раздражающего шума. Специальные исследования, выполненные за рубежом, показали, что пульсоксиметры являются источником более чем половины всех тревожных звуковых сигналов, раздающихся в стандартно оборудованных отделениях интенсивной терапии. При этом в 95 % случаев причиной активации аларма пульсоксиметра служит не реальная опасность, а артефакты(показания монитора, которые обусловлены не истинными значениями параметров, а действием посторонних факторов) или неправильная настройка аларм-системы. Приблизительно в 60 % случаев персонал отключает ее, не пытаясь разобраться в том, почему произошло срабатывание. С одной стороны, это проблема поведения человека в атмосфере, перенасыщенной технологиями, с другой - явный намек разработчикам приборов для мониторинга. Наибольшая склонность к отображению артефактной информации отмечается у простейших моделей пульсоксиметров, не имеющих специальных систем защиты от помех. Лишь в последние годы появились эффективные программы анализа сигнала, способные не только распознавать артефакты, но также выделять и отображать на дисплее достоверную информацию даже в крайне неблагоприятных условиях работы. В частности, применение технологии SET (signal extraction technology) американской фирмы MASIMO позволяет уменьшить частоту активизации аларма на 93 % по сравнению с исходной, причем исключительно за счет подавления артефактов. Эффективные программы подавления артефактов работают также в мониторах фирм BCI и CURATIVUS. Но все-таки чаще приходится работать с мониторами, реагирующими на артефакты не менее бурно, чем на реальную опасность. Поэтому анестезиолог должен знать типичные причины возникновения артефактов и уметь их распознавать. Погрешности, связанные с освещением. При взгляде на светодиоды датчика может создаться впечатление, что они излучают непрерывный поток света. На самом деле это не так: фотодиоды по очереди мигают с высокой частотой, измеряемой сотнями герц. Согласно требованиям Международной организации стандартов (ISO) частота засветки должна быть кратной частоте электросети, чтобы мерцание электрических ламп не влияло на процесс измерения. Каждый цикл датчика состоит из трех фаз. Сначала на тысячные доли секунды включается красный светодиод, и фотодетектор измеряет падающий на него поток красного света, а также окружающий свет, проникающий в датчик извне. Затем то же самое проделывает инфракрасный светодиод, после чего оба диода гаснут. В этот момент фотодетектор измеряет фон - окружающий свет, достигающий фотодетектора,- который исключается программой из расчета SpO2. Поэтому датчики многих пульсоксиметров можно помещать на освещенные места без ущерба для результата. Правда, несмотря на эти хитрости, свет отдельных типов ламп все же способен существенно искажать показания пульсоксиметра. Данным свойством обладают, в частности, мерцающий в физиологическом диапазоне частот свет ксеноновых ламп, а также излучение некоторых инфракрасных светильников. Пульсоксиметры различных фирм неодинаково реагируют на помехи такого рода. Оценить погрешности своего оборудования можно, сравнив показания пульсоксиметра при освещенном и закрытом от света датчике. Погрешности, вызванные наводкой. На точности показаний пульсоксиметра сказывается постороннее электромагнитное излучение, в океане которого работает монитор. У фотодетектора датчика электрический сигнал очень слабый, особенно в условиях нарушенной перфузии тканей, и наводка от работающей рядом электрохирургической аппаратуры может быть видна на фотоплетизмограмме (рис. 1.5). Это сильно влияет на точность измерения. Проблема обычно решается одним из двух способов - эффективным экранированием кабеля датчика и применением схем, подавляющих наводку, что позволяет сделать прибор почти нечувствительным к внешнему электромагнитному излучению (DATASCOPE, DATEX, CURATIVUS и некоторые др.),- или не решается вовсе. Мониторы фирмы OHMEDA, плохо защищенные от наводки, ведут себя, тем не менее, честно: они распознают проблему, прекращают измерение до момента ее исчезновения и сообщают об этом на дисплее. К сожалению, большинство моделей пульсоксиметров (CRITICARE, INVIVO, NELLCOR, PHYSIOCONTROL, CATALYST и др.') при появлении наводки отображают на дисплее неправильную величину сатурации, особенно при плохом периферическом кровотоке. 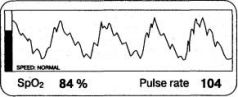 Рис. 1.5. Погрешность, вызванная электронаводкой Датчик и его кабель должны находиться как можно дальше от кабелей электроинструмента. Погрешности, порожденные низкой амплитудой ФПГ. Способность пульсоксиметра выделять полезный сигнал для расчета SpO2 зависит от объема пульсаций, то есть от амплитуды фотоплетизмограммы. При ослаблении периферического кровотока монитор вынужден прибегать к значительному усилению электрического сигнала, но при этом неизбежно нарастает и фоновый шум фотодетектора. При критическом снижении амплитуды ФПГ соотношение сигнал/шум становится настолько низким, что сказывается на точности расчета SpO-г. Пульсоксиметры разных фирм ведут себя в этой ситуации неодинаково. "Честные" модели либо прекращают индикацию SpO2, либо предупреждают на дисплее, что не ручаются за точность данных. Остальные же не моргнув глазом показывают величину, рассчитанную зачастую не из сигнала, а из шума. Однажды нам довелось наблюдать, как пульсоксиметр "ТРИТОН" (Екатеринбург) исправно продолжал показывать вполне приличную сатурацию и нормальный пульс после окончания безуспешной реанимации (факт остановки сердца не вызывал сомнений, поскольку больному была выполнена торакотомия). Еще один фактор, влияющий на величину Sp02,- концентрация гемоглобина в крови. При глубокой анемии, сочетающейся с расстройствами периферического кровотока, точность измерения Sp02 уменьшается на несколько процентов. Причина снижения точности очевидна: именно гемоглобин является носителем исходной информации для пульсоксиметра. Кстати, по способности правильно измерять SpO2 даже в самых тяжелых условиях, при очень малой амплитуде ФПГ, модели пульсоксиметров различаются весьма существенно. Эта способность зависит и от алгоритмов, по которым работает прибор, и от качества элементов, из которых он изготовлен, и от программ компенсации и калибровки. Хороший пульсоксиметр продолжает давать надежную информацию и в тех ситуациях, когда она поистине на вес золота: при лечении больных с критическими нарушениями кровообращения. К сожалению, многие типы мониторов удовлетворительно функционируют только в льготных условиях. Как правило, рассчитывать на отличные рабочие характеристики прибора можно в тех случаях, когда он произведен известной фирмой, имеющей хорошую репутацию. При этом, несмотря на более высокую стоимость, соотношение цена/качество обычно оказывается ниже, чем у дешевых, но ненадежных приборов "третьих" фирм. Существует простой способ проверки монитора. Зафиксируйте датчик на своем пальце, положите руку на стол и включите пульсоксиметр. На дисплее высветятся значения ЗрОаи частоты пульса, измеренные в идеальных условиях. Запомните их, встаньте и поднимите руку с датчиком вверх. В результате кровенаполнение тканей пальца и амплитуда пульсаций резко уменьшатся. Пульсоксиметру потребуется несколько секунд для того, чтобы подобрать интенсивность свечения фотодиодов и новый коэффициент усиления сигнала и заново рассчитать сатурацию и частоту пульса. Данные параметры не должны отличаться от исходных: поднятие руки никак не влияет на оксигенацию крови в легких. Если пульсоксиметр показывает другие значения или вообще прекращает работать, значит, он непригоден для мониторинга больных с тяжелыми расстройствами кровообращения. Артефакты, вызванные движением больного. Самая частая причина ошибок пульсоксиметра - движения больного. Их обнаружение и коррекция - задача достаточно сложная. Эффективность решения данной проблемы во многом определяет репутацию модели. При движениях пациента на ФПГ образуются дополнительные волны, обусловленные не пульсацией артериальной крови, а изменением расстояния и оптической плотности структур между светодиодами и фотодетектором (рис. 1.6). Читатель может легко убедиться в этом, надев датчик на палец и помахав рукой. Возникающие изменения указанных выше показателей обычно находятся в физиологическом диапазоне, включаются в расчет Sp02 и частоты пульса и приводят к грубейшим ошибкам. С такой проблемой чаще приходится сталкиваться в палатах интенсивной терапии и при транспортировке больного, нежели в операционной. Артефакты, возникающие вследствие движения больного, обычно кратковременны, но могут наблюдаться часто. При мышечной дрожи, выраженном двигательном беспокойстве или судорогах целесообразно вообще отказаться от пульсоксиметрии, чтобы не оплачивать ложные данные расходами на покупку нового датчика взамен сломанного*. Цена многоразового пальцевого датчика в настоящее время составляет от 150 до 400 долларов. Рис. 1.6. Артефакты, вызванные движением больного В настоящее время применяются различные способы борьбы с артефактами, вызванными движением. Если на дисплее монитора отражается фотоплетизмограмма, то по неправильной форме кривой нетрудно обнаружить влияние движений пациента на измерение и не принимать во внимание получаемые в этот момент данные (важный аргумент в пользу приобретения мониторов с полноценным дисплеем). Некоторые модели допускают возможность увеличения периода усреднения данных (см. выше). При этом некорректные измерения "разбавляются" истинными, и величина ошибки уменьшается. Так работают, например, пульсоксиметр Biox 3700e (OHMEDA), мониторы ММ200 (ARTEMA) и др. У метода есть два недостатка: ошибка до конца не устраняется (снижается лишь ее величина), а реакция прибора на внезапные события замедляется. В программном обеспечении некоторых моделей заложено "умение" распознавать артефакты, порожденные движениями больного и прочими причинами, по нетипичному поведению ФПГ или резким колебаниям SpO2, нехарактерным для физиологических изменений. Например, снижение SpO2 за 3 секунды с 94 до 60 % программа монитора всегда расценивает как артефакт, подает соответствующее сообщение на дисплей и "замораживает" последние истинные показатели. Анализ фотоплетизмограммы с целью увеличения точности измерения SpO2 применяется в модели NELLCOR (Symphony N 3000), снабженной программой коррекции различных артефактов, имеющей фирменное название OXISMART. Обнаружения артефактов и повышение точности работы в условиях нарушенной перфузии обеспечивает и технология выделения сигнала (SET, Signal Extraction Technology), недавно разработанная американской корпорацией MASIMO. Еще одним примером является технология SAC (Serial AutoCorrection), применяемая в мониторах фирм BCI и CURATIVUS. Другой способ - сравнение ФПГ и ЭКГ. О движениях пациента свидетельствует несоответствие волн ФПГ зубцам R на ЭКГ. Эта идея была предложена фирмой NELLCOR, названа ею C-lock и реализована в пульсоксиметре N 200 и последующих моделях. В настоящее время данный принцип в той или иной модификации применяется в пульсоксиметрах различных фирм (CRITICARE, DATEX и др.). Принцип C-lock оказался весьма эффективным. Так, еще в 1993 г. санитарная авиация Германии внесла его в стандарт оборудования вертолетов и автомобилей для транспортировки больных, обнаружив, что частота возникновения артефактов, вызванных вибрацией и тряской, при использовании этого способа снижается в 8 раз (испытывались мониторы PROPAQ 106EL американской фирмы PROTOCOL SYSTEMS INC.). Недостаток метода состоит в том, что только ради борьбы с погрешностями приходится подключать к больному электрокардиомонитор. Тем самым пульсоксиметрия лишается одного из основных своих преимуществ - предельной простоты процедуры. Правда, при отсутствии необходимости или желания встроенный модуль ЭКГ можно и не включать, постаравшись забыть о затратах на его приобретение. Кроме того, при мышечной дрожи наводка на ЭКГ может сделать C-lock бесполезным. Недостаток обернулся достоинством, когда кривую ЭКГ начали выводить на экран. Мониторинг стал комплексным и более дешевым, поскольку теперь покупатели любовались электрокардиограммой, не платя за дополнительные блок питания, дисплей и корпус. Удивительно, что такой простой и естественный шаг предприняли уже другие фирмы, а не автор идеи C-lock - фирма NELLCOR, которая до последнего времени упорно рассматривала ЭКГ-сигнал только как средство для обнаружения артефактов. И наконец, история эта получила завершение, когда фирма DATEX вывела на дисплей своей модели SATLITE PLUS частоту сердечных сокращений, рассчитанную по ЭКГ, в результате чего появилась возможность не терять этот показатель при движениях больного или критическом снижении амплитуды ФПГ, а также мониторировать дефицит пульса при мерцательной аритмии. При использовании простейших моделей пульсоксиметров проблема артефактов, вызванных движением, остается нерешенной, в связи с чем ориентироваться на их показания можно только при неподвижном датчике. Существуют элементарные правила, придерживаясь которых можно уменьшить эти артефакты или вовсе избежать их. • Артефакты возникают реже, если датчик имеет небольшой вес и гибкий легкий кабель. • Пальцевой датчик необходимо устанавливать правильно: кабель должен находиться на тыльной поверхности пальца. • Кабель датчика можно фиксировать клейкой лентой к руке. Если кабель свисает с кровати, он - за счет своего веса - провоцирует смещение датчика. Для дополнительной фиксации кабеля к простыне пользуйтесь специальной клипсой. • Рука подвижного пациента должна быть фиксирована к кровати, но так, чтобы при этом не нарушался кровоток. Помимо гуманных соображений здесь присутствуют еще и практические: вместо артефакта, порожденного движением, есть вероятность получить его собрата, вызванного низкой амплитудой пульса. • Стабильности мониторинга способствует правильный выбор датчика, если фирма-производитель предоставляет такую возможность. Датчики-клипсы смещаются легко, особенно если их внутренняя поверхность выполнена из скользкого материала'. Более надежно при движениях больного работают ' С целью уменьшения скольжения внутренняя поверхность датчиков выполняется и.ч резины. Описаны случаи аллергических реакций на натуральный латекс, который нередко используется в датчиках. гибкие датчики, которые фиксируются клейкой лентой или специальными ленточными фиксаторами. Такие датчики выпускаются разными фирмами и часто имеют собственные названия: FLEXALITE и VERSALITE (DATEX), OXISENSOR D-25 (NELLCOR-PB), Y-SENSOR (NOVAMETRIX) и др.
Проблема точности измерения
Любой измерительный прибор дает ту или иную погрешность, поэтому нам остается лишь учитывать ее предполагаемую величину. Каждый параметр измеряется с определенной степенью точности, которая устраивает или не устраивает нас, в зависимости от того, что мы собираемся с ним делать. Даже бегло ознакомившись с технической сутью метода, лежащего в основе работы пульсоксиметра, легко заметить, как много заложено в нем потенциальных источников ошибок. И нам необходимо знать, в какой степени мы можем доверять своему монитору, ведь от его показаний зависит принятие важных, а иногда и рискованных решений.
В числе прочих факторов на точность работы монитора влияет качество светодиодов. В идеале измерение должно производиться при длине волны красного света 660 нанометров (нм) и инфракрасного - 940 нм (в некоторых моделях используются другие, но близкие длины волн). Однако светодиоды не являются источниками монохроматического света, а излучают хотя и узкий, но конечный спектр световых частот, в котором имеется одна, преобладающая по интенсивности. Она-то в основном и формирует световой поток, участвующий в измерении. Каждому экземпляру светодиода присуща собственная уникальная характеристика излучения. При отклонении от идеальной длины волны на каждые 3 нм ошибка в измерении Sp02 составляет 0,5 %, а разброс значений в партии может превышать ± 15 нм. Если бы каждый пульсоксиметр снабжался единственным датчиком, с данной проблемой справились бы, внеся поправочные коэффициенты, но срок жизни датчика значительно короче, чем самого монитора. Кроме того, отдельные фирмы предлагают широкий выбор датчиков на все случаи жизни. Чтобы величина SpO2 не зависела от датчика, светодиоды тестируют и из всей партии отбирают лучшие. Это достаточно дорогой, но эффективный способ решения проблемы. Насколько нам известно, самые жесткие критерии отбора (± 2 нм) применяются в фирме DATEX. В другом варианте в ходе производства определяется пиковая длина волны излучения каждого светодиода. Эта информация кодируется в каждом датчике резистором с конкретной величиной сопротивления. После подключения датчика пульсоксиметр считывает код и выбирает соответствующую калибровочную кривую для расчета SpO2. Это усложняет технику, но позволяет полнее использовать партию светодиодов (NELLCOR).
И тот и другой способ связаны с дополнительными расходами на производство, и в конечном итоге их оплатит покупатель. Некоторые мелкие фирмы-производители вообще не ломают голову над этой и другими проблемами или покупают для своих моделей готовые датчики известных фирм.
Сатурация, рассчитанная из сигнала фотодетектора, является для монитора "сырой" информацией и никогда не совпадает с истинной величиной SaOz. Для того чтобы привести этот показатель в порядок, в процессе разработки каждой модели осуществляется сравнение показаний пульсоксиметра с сатурацией, измеренной эталонным методом. В качестве эталона применяется SaOs, измеренная точным гемоксиметром в пробе артериальной крови испытуемого, который дышит газовыми смесями с различным содержанием кислорода. По результатам многочисленных синхронных измерений устанавливается эмпирическая зависимость SpО2 от SaO2, которая называется калибровочной кривой и вводится в алгоритм окончательного расчета показателя. Но даже таким способом добиться полного совпадения показаний пульсоксиметра с Эталоном в реальных клинических условиях не удается. Поэтому в паспорте любой модели должны быть указаны пределы точности результатов.
Обычно погрешность показаний пульсоксиметров находится в пределах:
± 2 % при SpO2 от 100 до 70 %;
± 3 % при Sp02 от 69 до 50 %.
При сатурации ниже 50 % точность не гарантируется, потому что в этом диапазоне добывание данных для калибровки опасно для жизни испытуемых добровольцев. Полезно также иметь в виду следующее: чем ниже насыщение артериальной крови кислородом, тем меньше точность измерения SpO2, хотя динамика изменений этого показателя (снижение или повышение) отражается верно и при очень низком уровне сатурации. Причина снижения точности метода при глубокой гипоксемии заключается в особенностях кривой поглощения гемоглобином красного света.
Глядя на приведенные выше цифры, не следует считать, что когда на дисплее пульсоксиметра величина SpO2 равна 82 %, то истинное значение располагается в пределах от 80 до 84 %. На самом деле в паспорте сообщается не максимальная величина ошибки, а стандартное отклонение (SD - Standard Deviation), показатель, говорящий совсем о другом. Стандартное отклонение ±2 % означает, что лишь в 68 % измерений (то есть примерно в 2/3 всех случаев) SpO2 действительно находится в пределах ± 2 % от истинного значения, а в 95 % случаев не выходит за рамки двух SD, то есть ± 4 %. Нам остается лишь согласиться с тем, что в 5 % случаев пульсоксиметр имеет право показывать SрО2 = 90 % при истинной величине SaO2 = 85 %. Различие в 5 % сатурации далеко не безобидно, особенно на пологой части кривой диссоциации оксигемоглобина.
Необходимо помнить, что калибровочную кривую можно получить только в исследованиях у здоровых людей с нормальным кровообращением, уровнем гемоглобина и прочими имеющими значение показателями. Жестокая реальность клиники» конечно же, далека от тепличных лабораторных условий и вносит свою поправку в точность работы монитора. Серьезные фирмы сами строят калибровочные кривые для своих моделей и постоянно совершенствуют алгоритмы повышения точности измерений. Мелкие же производители пульсоксиметров обычно либо покупают, либо другими способами заимствуют эту информацию, а точность выводят, сравнивая показания собственной модели и мониторов известных фирм. В результате ошибки одного прибора наслаиваются на ошибки другого и точность измерения резко снижается. Зато такой подход к делу позволяет выпускать дешевую продукцию низкого качества и завоевывать беднейшую часть рынка за счет демпинговых цен.
Что способна дать практическому врачу вся эта техническая информация, которая на первый взгляд являет собой проблемы промышленности, а не медицины? Помимо удовольствия знать, умение выбирать монитор и понимание той грустной истины, что мы можем доверять ему не больше, чем вынуждены. Любой специалист, работающий с пульсоксиметрами, знает, как легко оказаться во власти гипноза цифр, сияющих на дисплее монитоpa. И действительно, простота получения важнейшей объективной информации, свойственная данному методу, нередко заслоняет собой проблемы точности измерения, скорости реакции, воспроизводимости результатов… Вместе с тем в некоторых клинических ситуациях эти незаметные проблемы, занимающие в сознании врача крошечный уголок где-то на заднем плане, могут сыграть с ним злую шутку. Чтобы этого не случилось, мы даем вам два совета.
Совет первый. При покупке монитора целесообразнее останавливать свой выбор на моделях крупных фирм, имеющих устойчивую репутацию и располагающих достаточными ресурсами для создания и непрерывного совершенствования высококлассных моделей. Их аппараты заметно дороже, но надежность информации этого стоит. Лучше доплатить за решенные проблемы, чем бесплатно получить ворох нерешенных.
Совет второй. При оценке данных, поступающих от монитора, всегда руководствуйтесь здравым смыслом. Чаще всего одно не противоречит другому, но в случаях, когда возникают сомнения или предстоит принять ответственное решение, лучше определить частоту пульса вручную, а оксигенацию артериальной крови - лабораторным, методом. Такой контроль позволяет быстро избавиться от.излишней доверчивости.
Физиологические основы пульсоксиметрии
Транспорт кислорода в организме - сложнейший процесс. Он включает множество последовательных этапов, в силу чего прочность всей цепочки определяется прочностью слабейшего ее звена. Одно из таких звеньев - насыщение венозной крови кислородом в легких. Сам этот процесс до сих пор остается скрытым от нашего взгляда. Не случайно Дж. Ф. Нанн, автор современного руководства по клинической физиологии дыхания, сравнил легкие с "черным ящиком", внутрь которого нельзя заглянуть; о том же, что в нем происходит, можно лишь догадываться, анализируя кровь и газ, поступающие в легкие и покидающие их. Знание механизмов легочного газообмена во многих случаях позволяет восстановить картину их нарушения по характерным изменениям состава крови и газа. Полученный таким образом патофизиологический диагноз помогает понять, что происходит с больным, выбирать и контролировать терапию.
Пульсоксиметрия предоставляет возможность непрерывно наблюдать лишь за одним из звеньев цепи процессов газообмена - качеством оксигенации артериальной крови в легких. На протяжении от левого желудочка до артериол газовый состав крови в артериях остается практически неизменным, поэтому, хотя территориально датчик пульсоксиметра расположен довольно далеко от легких, величина SpO2 является одной из ключевых характеристик легочного газообмена.
Кривая диссоциации оксигемоглобина
Нормальная кривая диссоциации оксигемоглобина представлена на рис. 1.7; В исходной ее точке, когда РаО2 гемоглобин не содержит кислорода и SaО2 также равняется нулю. По мере повышения Ра02 гемоглобин начинает быстро насыщаться кислородом, превращаясь в оксигемоглобин: небольшого увеличения напряжения кислорода оказывается достаточно для существенного прироста содержания НЬО2. При 40 мм рт. ст. содержание НЬО2 достигает уже 75 %. Затем наклон кривой становится все более и более пологим. На этом участке кривой гемоглобин уже менее охотно присоединяет к себе кислород, и для насыщения оставшихся 25 % НЬ требуется поднять Ра02 с 40 до 150 мм рт. ст. Впрочем, в естественных условиях гемоглобин артериальной Крови никогда не насыщается кислородом полностью, потому НТО при дыхании атмосферным воздухом Ра02 не превышает 100 мм рт. ст. (см. ранее). Рис. 1.7. Кривая диссоциации оксигемоглобина Нормальному уровню Ра02 (92- 98 мм рт. ст.) соответствует S,0; 94-98 %. Добиться полного насыщения гемоглобина кислородом можно только посредством увеличения содержания кислорода во вдыхаемом газе." Выбирая пульсоксиметр, обычно проверяют его на себе. Если монитор показывает SpО2= 100 % (а такие модели-оптимисты встречаются достаточно часто), подумайте, стоит ли его покупать. Испытывать пульсоксиметр должен.некурящий человек, так как «осле выкуренной сигареты до 8-10 % гемоглобина крови превращаются в карбоксигемоглобин. При этом пульсоксиметр завышает Sa02, и модель может оказаться незаслуженно скомпрометированной. Зависимость SaO2 от РaО2 для каждого больного можно описать эмпирическими формулами (уравнение Хилла, алгоритмы Кел-мана, Северингхауза и др.), в которых учитываются температура, рН и прочие факторы. Данные формулы в разных модификациях обычно вводят в современные автоматические приборы контроля КЩС и газового состава крови (Radiometer, AVL, Instrumentation Laboratories и пр.), которые вычисляют сатурацию гемоглобина по напряжению кислорода в крови. Собственно, сама кривая диссоциации оксигемоглобина и является графическим выражением этих уравнений. Более простой показатель положения кривой диссоциации - индекс Рм; он равен напряжению кислорода в крови, при котором сатурация гемоглобина составляет 50 % (рис. 1.7). Нормальная величина P50 равна 27 мм рт. ст. Ее уменьшение соответствует сдвигу кривой влево, а увеличение - сдвигу вправо. После полного насыщения гемоглобина кислородом дальнейшее повышение Ра02 сопровождается лишь незначительным приростом СаО2 за счет физически растворенного кислорода. Поэтому увеличение концентрации кислорода во вдыхаемом или вдуваемом газе (F1O2) сверх уровня, достаточного для полного насыщения гемоглобиновой емкости (Sa02 = 99-100 %), редко бывает оправданным. Проходя через капилляры, артериальная кровь отдает тканям часть содержащегося в ней кислорода и превращается в венозную (PvO2 = 40 мм рт. ст., SvO2 = 75 %). Таким образом, в газообмене участвует лишь около 25 % запаса кислорода артериальной крови, а сатурация и десатурация гемоглобина происходят, на пологом участке кривой диссоциации. Патология дыхательной системы приводит к нарушению ок-сигенации крови в легких с развитием артериальной гипоксемии, степень которой количественно оценивается пульсоксиметром. В этих условиях снабжение тканей кислородом осуществляется в "аварийном" режиме, на крутом участке кривой, где незначительного падения РаО2 оказывается достаточно для отделения от оксигемоглобина требуемого количества кислорода. Аварийность режима заключается в уменьшении напряжения и, следовательно, содержания кислорода в тканях, о чем свидетельствует низкое напряжение кислорода в венозной крови. Гемоглобин как транспортный белок призван решать две задачи: присоединять кислород в легких и отдавать его тканям. Эти задачи противоположны по своей сути, но выполняются одним и тем же веществом, поэтому стремление гемоглобина связываться с кислородом (сродство гемоглобина к кислороду) должно быть достаточным - чтобы обеспечить оксигенацию крови в легких, но не избыточным - чтобы не нарушить процесс отдачи кислорода на периферии. Нормальное положение кривой диссоциации оксигемоглобина как раз и соответствует оптимальной готовности гемоглобина к реализации обеих задач. Но при определенных условиях баланс между стремлением гемоглобина присоединить кислород и готовностью его отдать нарушается. Графически это выражается сдвигом кривой диссоциации вправо или влево (рис. 1.8). Рис. 1.8. Сдвиг кривой диссоциации оксигемоглобина При ацидозе (респираторном или метаболическом), гипертермии и увеличении концентрации 2,3-дифосфоглицерата (2,3-ДФГ) в эритроцитах сродство гемоглобина к кислороду снижается и кривая диссоциации НЬО2 сдвигается вправо. При этом насыщение гемоглобина кислородом в легких ухудшается (уменьшение Sp02 при прежнем РаО2), но отделение кислорода от оксигемоглобина в капиллярах облегчается. Если газообмен в легких не нарушен, то даже существенный сдвиг кривой диссоциации вправо сопровождается весьма незначительным снижением Sp02, поскольку события в легких происходят на пологом участке кривой. В тканях же напряжение кислорода повышается. В отношении кислородного гомеостаза это в целом безопасная ситуация. Некоторые специалисты даже счи- тают, что при нормальной работе легких ацидоз способствует снабжению тканей кислородом. Иная картина наблюдается при грубой патологии дыхания, когда от легких оттекает кровь с низким напряжением кислорода, соответствующим крутому участку кривой диссоциации НЬО2. Если при этом кривая сдвинута вправо, SpO2 может оказаться намного ниже, чем при нормальном положении кривой. Данное обстоятельство - дополнительный удар по снабжению тканей кислородом и важный вклад в дело развития гипоксии. Таким образом, при исходной артериальной гипоксемии (низком уровне РаС»2) метаболический ацидоз, гиперкапния и гипер-термия способны заметно снизить сатурацию гемоглобина (Sp02) и, следовательно, содержание кислорода в артериальной крови. Алкалоз (респираторный или метаболический), гипотермия и уменьшение концентрации 2,3-ДФГ повышают сродство гемоглобина к кислороду, и кривая диссоциации НЬ02 сдвигается влево. В этих условиях гемоглобин жадно присоединяет к себе кислород в легких (SpO2 возрастает при прежнем РаО2) и неохотно отдает его тканям. Считается, что сдвиг кривой диссоциации влево всегда неблагоприятно сказывается на оксигенации тканей, ибо небольшой прирост содержания (но не напряжения) кислорода в артериальной крови не окупает последующего нежелания оксигемоглобина делиться кислородом с тканями на периферии. Пожалуй, от левого положения кривой диссоциации НЬО2 не страдают только новорожденные. Но это отдельная тема. Непостоянство отношений между РаО2 и SpO2 может затруднить осмысление данных пульсоксиметрии: далеко не всегда известно, по какой кривой диссоциации работает гемоглобин в данный момент.
О дисгемоглобинах, красителях и лаке для ногтей
Еще одно обстоятельство, которое влияет на показания пульсоксиметра,- это наличие в крови дополнительных фракций гемоглобина. К ним принадлежат дисгемоглобины (карбокси- и метгемоглобин), а также фетальный гемоглобин.
В норме содержание карбоксигемоглобина (СОНЬ) в крови невелико (1-3 %) и не сказывается на величине SpO2. Однако при отравлении угарным газом или у больных с недавно полученными ожогами пламенем карбоксигемоглобин может составлять десятки процентов от общего количества гемоглобина. СОНЬ поглощает, свет почти так же, как НЬО2, поэтому вместо насыщения гемоглобина кислородом пульсоксиметр у таких пациентов показывает сумму процентных концентраций СОНЬ и НЬОа. Например, если SаО2 = 65 %, а СОНЬ = 25 %, пульсоксиметр высветит на дисплее величину SpO2, близкую к 90 %.
При карбоксигемоглобинемии пульсоксиметр завышает степень насыщения гемоглобина кислородом.
Метгемоглобинемия возникает в результате действия на гемоглобин метгемоглобинобразующих веществ. К ним относятся не только определенные яды, но и некоторые лекарственные препараты, в частности нитропруссид натрия или сульфаленмеглюмин. MetHb поглощает красный и инфракрасный свет так же, как и гемоглобин, насыщенный кислородом на 85 %.
При умеренной метгемоглобинемии пульсоксиметр занижает SpO2, а при выраженной метгемоглобинемии показывает величину, близкую к 85 %, которая почти не зависит от колебаний SaO2.;
Фетальный гемоглобин (HbF) содержится в эритроцитах плода и у детей первого года жизни. В невысокой концентрации (до 5 %) он также может быть обнаружен у женщин в первом триместре беременности. HbF отличается от гемоглобина взрослых (который обозначается "НЬА" [от англ. adult - взрослый]) значительно большим сродством к кислороду. И это неудивительно. Напряжение кислорода в оксигенированной крови, оттекающей по пупочной вене от плаценты к плоду, составляет всего 30 мм рт. ст., и лишь сдвинутое влево положение кривой диссоциации фетального оксигемоглобина обеспечивает при этом Sa02 = 75 %. Метаболизм плода настроен на низкое напряжение кислорода в тканях, а увеличение метаболизма после рождения компенсируется возрастанием РaО2 и SaO2 при переходе на дыхание атмосферным воздухом.
Фетальный гемоглобин отличается от гемоглобина взрослых только аминокислотным составом двух глобиновых цепей, что делает HbF менее чувствительным К изменению концентрации
2,3- ДФГ, чем и объясняется высокое сродство фетального гемоглобина к кислороду.
Как реагирует пульсоксиметр на присутствие в крови фетального гемоглобина? Практически никак. Величина Sp02 у новорожденных соответствует истинному значению Sа02, потому что гемовые группы HbF и НЬА, определяющие светопоглощающие свойства гемоглобина, идентичны, а молекулы глобина - бесцветны и не влияют на измерение. Особенности пульсоксиметрии в неонатологии относятся в основном к интерпретации данных мониторинга. В частности, необходимо учитывать высокое сродство фетального гемоглобина к кислороду и существенное различие нормальных значений параметров кислородного гомеостаза у новорожденного и взрослого.
За несколько недель до срока рождения в эритроцитах плода начинается.синтез взрослого гемоглобина, и к моменту рождения ребенка содержание НЬА достигает 15-25 %. Из-за резкого преобладания HbF кривая диссоциации оксигемоглобина у новорожденного сдвинута влево (Р50 = 19- 22 мм рт. ст.). Через неделю после появления ребенка на свет HbF постепенно начинает замещаться на НЬА.
Внутривенное введение Красителей. 'Некоторые красители, применяемые с диагностической целью, способны изменять светопоглощающие свойства крови именно в том частотном диапазоне, который используется в пульсоксиметрии (сильное поглощение, света; с длиной волны 660 нм). К, таким веществам (относятся метиленовый синий (метиленблау), и, в меньшей степени, индоцианин. Их внутривенное введение сопровождается быстрым и выраженным. снижением величины SpO2, которое длится 5-10 мин. На этом основан простои тест на правильность установки внутривенного катетера: если сразу после введения красителя наблюдается резкое снижение сатурации, катетер находится в вене.
Лак для ногтей обычно не искажает показания пульсоксиметра. В некоторых случаях он способен уменьшить сигналы обоих светодиодов, но это не сказывается на расчете SpO2. Правда, имеются сообщения о том, что синий лак может избирательно ослаблять излучение одного из светодиодов (660 нм), что приводит к артефактному занижению SpO2. Это следует иметь в виду, работая с пациентками, которые поступают в операционную в полной боевой раскраске.
Амплитуда ФПГ
Фотоплетизмограмма - не только исходный материал для расчета Sp02: она также обладает собственным диагностическим значением. Амплитуда ФПГ отражает объемную пульсацию артериол и, значит, характеризует периферический креветок. Хорошие модели пульсоксиметров способны улавливать даже резко ослабленную пульсацию, когда величина периферического кровотока достигает лишь 4-5 % от нормальной. Разумеется, фотоплетизмограмма непригодна для количественной оценки кровоснабжения периферии, но она позволяет составить довольно точное впечатление о локальном кровотоке. Пренебрегать такой возможностью ненужно, тем более что метод неинвазивен и длительность его применения не ограничена.
Отображение ФПГ на дисплее предусмотрено не во всех моделях пульсоксиметров. Не забывайте об этом, выбирая монитор.
В клинических условиях амплитуда ФПГ способна изменяться в десятки раз, поэтому на дисплее зубцы кривой в одних случаях не помещаются на экране, а в других - уменьшаются до такой степени, что становятся неразличимыми. Чтобы, ФПГ всегда имела удобный для анализа вид и стандартную высоту, она подвергается автоматическому масштабированию (autoscaling); эта процедура производится при каждом стойком изменении амплитуды. В результате даже при плачевном состоянии периферического кровотока кривая на дисплее может иметь нормальный внешний вид и по ее форме трудно заподозрить неладное. В программном обеспечении некоторых мониторов содержится набор стандартных масштабов, и выбор новой шкалы осуществляется автоматически лишь в тех случаях, когда пики кривой выходят за пределы дисплея или сливаются с изолинией. Такой способ представления данных удобен тем, что позволяет в заданных диапазонах отслеживать изменения амплитуды ФПГ.
Для предотвращения потери информации о реальной амплитуде ФПГ на дисплее некоторых моделей предусмотрен специальный индикатор. Как правило, это столбик, высота которого отражает истинную величину пиков кривой. Максимальная высота столбика присуща нормальному периферическому кровотоку; при нарушении кровоснабжения столбик снижается. В дальнейшем, рассматривая амплитуду ФПГ, мы будем иметь в виду показания именно этого индикатора.
Отдельного упоминания заслуживает другой, более удобный, но редкий способ отображения ФПГ. После первоначального автоматического масштабирования врач вручную выбирает более удачный, с его точки зрения, постоянный масштаб и наблюдает за изменениями формы и высоты фотоплетизмограммы в динамике. Так работают, например; мониторы фирм DATEX n'BRUEL amp; KJAER. Пульсоксиметры фирмы DATEX, кроме того; выдают численный параметр (он называется "амплитудный фактор"), отражающий реальный объем артериальных пульсаций. Мониторы с такой организацией дисплея позволяют отслеживать ситуации, когда амплитуда ФПГ превышает норму. Диагностическое значение этой функции приводится в разделе о клинических аспектах метода.
Фотоплетизмограмма по форме весьма похожа на кривую артериального давления, но, в отличие от последней, характеризует колебания объема микрососудов.
Амплитуда ФПГ зависит от тонуса. микрососудов и ударного объема сердца.
Вот почему изменения фотоплетизмограммы далеко не всегда соответствуют изменениям артериального давления. При артериальной гипотензии, вызванной вазодилататорами, кривая на экране пульсоксиметра Может иметь высокую амплитуду. И наоборот, снижение волн ФПГ при вазоконстрикции иногда Наблюдается и на фоне артериальной гипертензии.
Микрососуды тканей пальца богато иннервированы волокнами симпатической системы и содержат большое количество рецепторов для "плавающих" катехоламинов. Поэтому активация симпатической системы, инфузия а1-адреномиметиков, в2-адре-ноблокаторов, ангиотензина и других сосудосуживающих препаратов сопровождается снижением амплитуды ФПГ. Необходимо помнить, что данные, получаемые при пульсоксиметрии, из-за специфики регуляции пальцевого кровотока не всегда пригодны для суждения о кровоснабжении внутренних органов. Пример такого несоответствия - холодовая вазоконстрикция.
Второй фактор, от которого зависит форма фотоплетизмографической кривой,- ударный объем сердца, определяющий наполнение пульсовой волны. Его непосредственное влияние на амплитуду отдельных волн ФПГ прекрасно видно на экране пульсоксиметра при парадоксальном или альтернирующем пульсе. Кроме того, влияние сердечного выброса на форму ФПГ может быть и опосредованным, поскольку его снижение часто сопровождается периферической вазоконстрикцией.
Снижение амплитуды ФПГ служит признаком периферической вазоконстрикции и/или уменьшения ударного объема, а повышение амплитуды свидетельствует об обратном. Тонус сосудов - основной фактор, определяющий высоту волн фотоплетизмограммы.
К сожалению, пульсоксиметрия в своем современном варианте не позволяет дифференцировать вазоконстрикцию от уменьшения ударного объема. Принципиальная возможность такой дифференцировки, основанной на математическом анализе формы пульсовой волны, существует, но в серийных мониторах еще не реализована.
Форма ФПГ
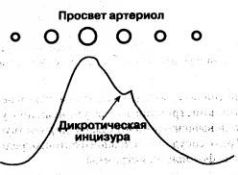
Форма волны ФПГ индивидуальна, но полной клинической ее интерпретации пока нет. На нисходящем колене каждой волны заметна вырезки - дикротическая инцизура,- которая соответствует закрытию аортального клапана. 3а инцизурой следует дополнительный пик-дикротический зубец (рис. 1.9). Чёткость изображения инцизуры и зубца на дисплеях разных моделей пульсоксиметров неодинакова, и нередко они представлены едва заметной волной. При выраженной артериальной гипертензии или аортальной недостаточности дикротический зубец может быть очень высоким (рис. 1.10) и пульсоксиметр интерпретирует его как самостоятельную пульсовую волну. В результате частота пульса артефактно завышается. В каждом случае, когда данные пульсоксиметрии свидетельствуют о выраженной тахикардии, непременно обратите внимание на форму ФПГ и посчитайте пульс вручную. При работе с пульсоксиметром, не выводящим ФПГ на дисплей, коррекции тахикардии, обязательно должна предшествовать проверка частоты пульса. Наличие высокого дикротического зубца - типичная причина расхождения показаний пульсоксиметра и ЭКГ-монитора, поэтому такие артефакты нехарактерны для моделей, в которых использован принцип C-lock. Рис. 1.9. Волна ФПГ как отражение пульсации артериол Рис. 1.10. Высокий дикротический зубец, имитирующий волну ФПГ Иногда в промежутках между пиками ФПГ наблюдаются дополнительные колебания - венозные волны (об их происхождении и роли см. "Артефакты и их источники", с. 22). Пульсоксиметрия позволяет непрерывно контролировать важнейшую функцию легких - насыщение гемоглобина крови кислородом. При всей несомненной полезности этой информации нельзя забывать, что SpO2 - лишь один из многих параметров, используемых для описания кислородного гомеостаза. Надеемся, что приведенных выше фрагментарных сведений из физиологии достаточно для того, чтобы понять, насколько непростой может стать трактовка этого показателя, когда он вырван из клинико-физиологического контекста. Тем не менее пульсоксиметрия - самый распространенный, а во многих случаях и вообще единственный доступный метод определения оксигенации. Мониторинг амплитуды фотоплетизмограммы - простой и неинвазивный метод ориентировочной оценки периферического артериального кровотока. Если причина изменения ФПГ лежит на поверхности, заключение, сделанное врачом, поможет своевременно принять правильные меры и контролировать их эффективность. Однако при наличии сложных расстройств кровообращения, когда амплитуда ФПГ формируется под влиянием сразу нескольких факторов, она теряет самостоятельное диагностическое значение и становится лишь дополнительным аргументом в дифференциальной диагностике. В следующей главе мы расскажем, как выжимать из этих параметров максимум пользы.
Несколько практических советов
Перед началом работы постарайтесь расположить прибор так, чтобы его существованию ничто не угрожало. Шнур питания и кабель датчика не должны болтаться под ногами у персонала:
скорее рано, чем поздно, монитор окажется на полу, а на такие случаи гарантия бесплатного ремонта не распространяется. Разумнее всего найти и приспособить для него удобное постоянное место.
Отучите медицинский персонал использовать верхнюю панель монитора в качестве места для хранения ампул, флаконов, ларингоскопа или контейнеров для трахеальных катетеров. Некоторые модели снабжены специальной подставкой, позволяющей наклонять прибор, чтобы улучшить обзор дисплея. Прибегните к ее помощи еще и потому, что на наклонную плоскость никто ничего положить не сможет.
Мониторы с жидкокристаллическим дисплеем нужно размещать так, чтобы обеспечить максимальный сектор обзора на высоте глаз стоящего человека. Желательно покупать мониторы с регулируемой яркостью дисплея.
Если пульсоксиметр реагирует на наводку от электроаппаратуры (а это легко проверить самому), постарайтесь поместить кабель датчика как можно дальше от кабелей электрооборудования. Электрическая дефибрилляция безопасна для пульсоксиметра.
У больного с двигательным беспокойством или судорожным синдромом применяйте ушной или гибкий Y-образный датчик. В любом случае датчик должен быть на виду у персонала, поэтому лучше покупать пульсоксиметры, не реагирующие на окружающий свет. Обидно извлечь из-под одеяла обломки того, что когда-то называлось датчиком и стоило несколько сотен долларов.
Трудно удержаться, чтобы не привести совет, данный фирмой DATEX:
Относитесь к датчику так же бережно, как к собственным часам или очкам.
Если датчик сломался, а запасного такого же нет, не подключайте к монитору датчик другой фирмы, даже если у него такой же штекер. Это типичная ошибка, чреватая самыми разнообразными - и всегда плохими - последствиями: ожогами, поломкой оборудования, резким снижением точности измерения и пр. В мире существует большое, но все же ограниченное число типов разъемов, в связи с чем разные фирмы иногда просто вынуждены использовать одинаковые штекеры. Не полагаясь на здравомыслие врачей, фирмы приводят соответствующие предупреждения в руководствах к мониторам, наклеивают их на кабель датчика и даже публикуют в профессиональных журналах, но авантюризм порой оказывается сильнее. Некоторые крупные фирмы, например NELLCOR-PURITAN BENNET, продают свои датчики вместе с патентованной технологией их калибровки другим производителям пульсоксиметров, однако об этом всегда сообщается в документации.
У пациентов с выраженными расстройствами периферического кровообращения попробуйте переместить датчик на соседний палец или другую руку. Попытайтесь согреть руку грелкой или помассируйте ее. В некоторых случаях улучшить локальный кровоток удается с помощью нитроглицериновой мази, нанесенной тонким слоем на мочку уха или палец.
Более надежный сигнал в условиях нарушенного периферического кровотока можно получить с ушного датчика.
Нежелательно размещать датчик на той руке, которая используется для измерения артериального давления, так как это приводит к необоснованной активации аларма при каждом раздувании манжеты. У больных с атеросклеротическим или иным поражением артерий верхних конечностей датчик следует устанавливать на той руке, где амплитуда ФПГ выше. После катетеризации лучевой артерии не исключено снижение амплитуды ФПГ на этой руке.
Рекомендуется менять место установки датчика-клипсы (ушного или пальцевого) через каждые 4-5 ч, а при нарушениях периферического кровотока это необходимо делать чаще.
При охлаждении тела человека амплитуда ФПГ на периферии часто резко снижается. Такое состояние наблюдается у пациентов к концу длительных операций. Терморегуляция у них подавлена, теплопотеря повышена, а температура в операционной далека от комфортной, и пациент накрыт одной стерильной простыней. Это надо иметь в виду, выполняя пульсоксиметрию в раннем послеоперационном периоде.
Пульсоксиметрию, как любой другой метод мониторинга, следует применять лишь тогда, когда в ней есть необходимость. Пульсоксиметр редко включают без надобности, но часто забывают отключить, когда таковая отпала. Нужно помнить, что срок службы прибора (в большей степени это относится к датчикам) зависит от суммарного наработанного времени.
Настройка аларм-системы
Любой пульсоксиметр имеет, по крайней мере, четыре регулируемых аларма: два - на выход Sp02 и два - на выход частоты пульса за нижний или верхний установленный предел. Обычно звуковой сигнал (при желании его временно или насовсем отключают) дублируется световым, а в некоторых моделях - еще и мерцанием соответствующего параметра на дисплее. Тональность звуковых сигналов разных алармов не всегда одинакова.
У многофункциональных мониторов во время неинвазивного автоматического измерения артериального давления аларм пульсоксиметра отключается.
Неправильно настроенная аларм-система может или задергать персонал ложными вызовами, или не сработать при появлении опасности.
Настройка алармов частоты пульса достаточно понятна и не отличается от таковой у электрокардиоскопов. Аларм-система же Sр02 нуждается в пояснениях.
Колебания SpO2 в пределах 1-2 % являются нормальными. Такие изменения, как правило, не поддаются интерпретации и не требуют коррекций.
Поэтому слишком узкий диапазон между нижним и верхним пределами аларма может послужить причиной частых необоснованных сигналов, которые нервируют персонал. В конце концов на "беспокойный" монитор прекращают обращать внимание или вовсе отключают аларм, и начало настоящего осложнения остается незамеченным.
Установка верхнего допустимого предела Sp02 преследует две цели:
o Получение сигнала об избыточном содержании кислорода во вдыхаемой (вдуваемой) газовой смеси. (См. об этом подробно в разделе об оксигенотерапии.)
o Получение сигнала об улучшении легочного газообмена при исходной стойкой гипоксемии.
Втех случаях, когда возможности респираторной терапии исчерпаны и от легких оттекает кровь со стойко сниженным содержанием оксигемоглобина, есть смысл установить верхний предел аларм-системы SpO2 на несколько процентов выше текущего стабильного значения, тем самым поставив пульсоксиметру задачу сообщить о положительной динамике патологического процесса. В неонатологии верхний предел аларма обычно устанавливается на уровне 95 %. После появления младенца на свет его легкие частично заполнены фетальной легочной жидкостью, которая
исчезает в течение первых суток. Кроме того, в первые дни после рождения до окончательной стабилизации легочной ткани
происходит образование и расправление микро- и макроателектазов. Все это приводит к уменьшению дыхательной поверхности легких и интенсивному шунтированию в них крови. После досрочных родов РаО2 новорожденного при дыхании атмосферным воздухом постепенно увеличивается от 40- 50 мм рт. ст. в первые часы до 80 мм рт. ст. к концу первой недели внеутробной жизни. Таким образом, в первые дни после рождения верхняя граница нормы Sa02 возрастает с 90 до 95 %. Превышение этого уровня при оксигенотерапии считается не только ненужным, но и вредным, поскольку грозит развитием бронхопульмональной дисплазии и ретролентальной фиброплазии. Поэтому неонатальный режим работы пульсоксиметра (neonatal mode) включает в себя и автоматическую установку верхнего допустимого предела SpO2 на уровне 95 % с целью обнаружения избытка кислорода во вдуваемом или вдыхаемом газе.
Нижний допустимый предел SpO2 при включении пульсоксиметра обычно автоматически фиксируется на уровне 95 %, что соответствует Ра02 -= 85 мм рт. ст. Таков он и есть, когда мониторинг выполняется у пациента со здоровыми легкими. При наличии у больного дыхательной недостаточности, порождающей гипоксемию, нижний предел аларма следует установить на 3-5% меньше текущего устойчивого уровня SpO2.
В любом случае сигнал тревоги должен обращать внимание врача на такое снижение сатурации, которое говорит об опасной тенденции и побуждает к действиям.
Пульсоксиметрия в диагностике гипоксемии
Цианоз. До появления пульсоксиметрии главным признаком гипоксемии считался цианоз. Применение пульсоксиметра, прибора гораздо более чувствительного, чем глаз, не отменяет необходимости в наблюдении за цветом кожных покровов больного, поскольку монитор улавливает не всякий цианоз. Пульсоксиметр способен распознавать выраженные нарушения оксигенации артериальной крови при обычном цвете кожных покровов или показывать норму в случаях, когда цианотичность больных бросается в глаза, и при этом не ошибаться.
Окраска кожи зависит от цвета крови в сосудах сосочкового слоя дермы. Основное количество крови находится в венозной части микроциркуляторной системы; цвет именно этой крови и определяет окраску кожи или слизистой оболочки. Общий объем артериол и капилляров невелик, и кровь, содержащаяся в них, оказывает влияние не столько на цвет кожных покровов, сколько
на.оттенок этого цвета ("багровый", "пепельный", "чугунный" цианоз и др. образные уточнения).
Особенность кожного кровотока заключается в том, что он явно избыточен по отношению к метаболическим потребностям кожи, поскольку обслуживает не только обмен веществ, но и теплообмен. Кроме того, венозное русло кожного покрова человека - это основное депо крови. Из каждого миллилитра артериальной крови, притекающей к коже, ее ткани извлекают для своих нужд лишь очень небольшое количество кислорода. В результате по содержанию кислорода (и, соответственно, по насыщению им гемоглобина) венозная кровь, оттекающая от кожи, не слишком сильно отличается от артериальной. Различие становится и вовсе ничтожным при резком увеличении притока артериальной крови к коже (например, при нагревании или растирании кожи, гиперкапнии, инфузии нитропруссида натрия и других вазодилататоров, ингаляции фторотана, применении горчичников и т.д.). Нормальный розоватый цвет кожных покровов преимущественно обусловлен высокой концентрацией 0ксигемоглобина в венулах кожи.
Интенсивность цианоза зависит от количества восстановленного гемоглобина в крови и от объема сосудистого ложа (в самой емкой, венозной его части). Поэтому при выраженной анемии или вазоконстрикции оценка цианоза затруднена. Большую роль играет и качество освещения: в мерцании некоторых люминесцентных ламп порой отчетливо видится то, чего на самом деле нет.
Существуют две главные причины цианоза: (1) артериальная гипоксемия и (2) ухудшение периферического кровотока. Они могут сочетаться.
Цианоз при нарушениях оксигенации крови в легких. В условиях артериальной гипоксемии к тканям от легких притекает кровь с исходно сниженным содержанием оксигемоглобина, в связи с чем сатурация гемоглобина венозной крови также уменьшается и венозная кровь становится более темной, что воспринимается как цианоз. Такой цианоз называется центральным и часто является диффузным. Кожные покровы в этом случае обычно хорошо снабжаются кровью, поэтому остаются теплыми, что подтверждается нормальной амплитудой фотоплетизмо-граммы. Поскольку первичная причина такого цианоза состоит в нарушении сатурации артериальной крови, пульсоксиметр позволяет не только обнаружить, но и дать точную количественную оценку глубины гипоксемии даже на той стадии, когда зрение еще не улавливает изменения окраски кожи.
Считается, что когда SpO2 опускается до 90 %, увидеть цианоз удается лишь в половине случаев. Напомним, что при нормальном положении кривой диссоциации оксигемоглобина этому уровню сатурации соответствует РаО2 = 57 мм рт. ст., что значительно ниже нормы. Даже десатурация артериальной крови до 85 % (РаО2 = 50 мм рт. ст.), что расценивается как серьезная гипоксемия, требующая коррекции, не всегда сопровождается развитием цианоза. В этом можно убедиться, сопоставляя Sp02 и внешний вид больных. Широкое применение пульсоксимет-рии рассеяло иллюзии анестезиологов относительно нормальной оксигенации пациентов во время наркоза.
Мониторинг показал, что эпизоды гипоксемии в операционной возникают в 20 (!) раз чаще, чем обнаруживаются при обычном наблюдении за больным.
Описано немало случаев, когда опытные врачи не могли распознать цианоз у пациентов с глубочайшей артериальной десатурацией, замаскированной анемией или вазоконстрикцией. Не случайно с внедрением пульсоксиметров в операционных и палатах интенсивной терапии резко сократилась частота эпи-' зодов недиагностированной или несвоевременно обнаруженной гипоксемии.
Кстати, недорогой портативный пульсоксиметр, помещающийся в кармане халата, постепенно становится таким же традиционным инструментом терапевта, как фонендоскоп, тонометр и авторучка, и обычно используется не в мониторном режиме, а для разовых измерений при обходе больных. SpO2 служит объективным показателем состояния легочного газообмена - в отличие от весьма субъективной оценки цианоза "на глаз". Миниатюрный пульсоксиметр, в котором корпус прибора и датчик смонтированы в единое целое, имеет размер спичечного коробка;
выпускается фирмой NONIN.
Цианоз при нарушениях кровообращения. Ухудшение перфузии периферии сопровождается возникновением акроцианоза. При отсутствии легочной патологии пульсоксиметр в такой ситуации показывает нормальный уровень SpO2 но из уменьшенного объема хорошо оксигенированной артериальной крови, притекающей к тканям кожи, последние извлекают прежнее количество кислорода. В результате усиленной десатурации оксигемоглобина в кожных капиллярах венозная кровь приобретает более темный цвет, что визуально воспринимается как цианоз, но не сказывается - и не может сказаться - на величине Sp02. Основные причины акроцианоза: (1) снижение сердечного выброса и (2) периферическая вазоконстрикция. В обоих случаях акроцианоз - это свидетельство нарушения кровоснабжения тканей. Акроцианоз наблюдается даже при нормальной сатурации гемоглобина артериальной крови.
К пульсоксиметрическим признакам нарушения перфузии тканей относится уменьшение амплитуды фотоплетизмограм-мы. Разумеется, этот симптом становится доступным, если монитор способен отражать на дисплее реальную амплитуду ФПГ. В крайне тяжелых случаях кожа приобретает бледно-цианотичный вид, а пульсоксиметр не хочет работать и дает сообщение типа "low perfusion" (нарушенная перфузия) или "low quality signal" (сигнал низкого качества). Подобные сообщения следует расценивать не как досадную помеху для мониторинга, а как признак серьезного неблагополучия.
Нарушения перфузии, определяемые монитором, могут иметь самые разные причины: от безобидной холодовой вазокон-стрикции до опасного генерализованного артериолоспазма или уменьшения сердечного выброса. Какую полезную информацию дает пульсоксиметр у таких больных?
Во- первых, данные пульсоксиметрии -хорошее подспорье в дифференциальной диагностике цианозов, поскольку помогают исключить или подтвердить участие дыхательной системы (по SpOa) и системы кровообращения (по амплитуде ФПГ) в нарушении транспорта кислорода.
Во- вторых, благодаря пульсоксиметрии становится обоснованным отказ от оксигенотерапии -универсального стереотипа в лечении цианотичных больных, при условии что SpOz находится в пределах нормы. Тем самым у врача появляется возможность сосредоточить усилия на решении действительных проблем: "раскрытии" периферии, ликвидации гиповолемии, повышении сократимости миокарда и пр.
В- третьих, пульсоксиметр, отражающий амплитуду фотопле-тизмограммы, позволяет судить о состоянии периферического кровотока, что ранее было недоступно. Восстановление нормальных пульсаций на ФПГ свидетельствует об улучшении кровоснабжения тканей и, как правило, совпадает с уменьшением степени акроцианоза.
Таким образом, пульсоксиметрия при гипоксемии облегчает дифференциальную диагностику, выбор лечения и контроль его эффективности, помогая адаптировать терапию к особенностям конкретного случая.
Причины артериальной гипоксемии
Артериальная гипоксемия - это следствие и признак нарушения способности дыхательной системы оксигенировать притекающую к легким венозную кровь. Исключение составляют лишь дисгемоглобинемии, при которых, кстати, пульсоксиметрический контроль Sp02 неэффективен из-за грубых артефактов. Значение пульсоксиметрии не сводится только к распознаванию артериальной гипоксемии и наблюдению за ее динамикой. Иногда удается определить причину нарушения оксигенации крови в легких и, следовательно, выбрать оптимальный способ коррекции. Нужно отметить, что возможности пульсоксиметрии в дифференциальной диагностике гипоксемии скромнее, чем у лабораторного или мониторного газового анализа, ибо существующая система описания расстройств газообмена традиционно ориентирована на такие параметры, как напряжение, концентрация и парциальное давление дыхательных газов. Недостаточная точность измерения Sp02 и всегда присутствующая вероятность сдвига кривой диссоциации оксигемоглобина не позволяют использовать этот параметр для расчета РаО2. Но все же пульсоксиметрия, в сравнении с газовым анализом, обладает неоспоримым достоинством: в настоящее время это единственный широкодоступный способ обеспечить сколь угодно длительное непрерывное наблюдение за степенью насыщения артериальной крови кислородом. Непрерывный мониторинг сатурации гемоглобина артериальной крови в сочетании с пониманием типичных механизмов нарушений легочного газообмена позволяет сделать ряд ценных выводов. Существует несколько приемов, с помощью которых можно уточнить причину гипоксемии, выявленной пульсоксиметром. 1. Необходимо учитывать, в какой клинической ситуации возникает артериальная гипоксемия, и сопоставлять SpO2 с данными лабораторного и инструментального исследования. Например, если гипоксемия диагностируется у больного со свежей невосполненной кровопотерей, то наиболее вероятная причина снижения SpO2 - нарушение регионарных вентиляционно-перфузионных отношений в легких. Такая гипоксемия легко устраняется простой ингаляцией кислорода и инфузией. 2. Амплитуда фотоплетизмограммы в некоторых случаях позволяет подтвердить предположения, основанные на наблюдениях за SрО2. В приведенном выше примере (пациент с невосполненной кровопотерей) на дисплее пульсоксиметра отмечаются снижение пиков ФПГ, а также "дыхательные волны" - колебания кривой, синхронные с дыханием,- которые характерны именно для гиповолемии. 3. Высокоинформативна реакция SpO2 на различные лечебные воздействия (оксигенотерапию, инфузию, режим ПДКВ, изменение положения тела и пр.). Так, стойко сниженная сатурация даже на фоне применения кислорода в высокой концентрации характерна для массивного шунтирования крови в легких. 4. Изучение динамики сатурации, о которой лучше всего судить по тренду SpO2, также позволяет сделать определенные заключения. Неожиданное резкое снижение SpO2 характерно для внезапных событий, таких как смещение интубационной трубки в бронх или развитие напряженного пневмоторакса. Постепенное снижение сатурации, которую не удается нормализовать оксигенотерапией и подбором режима ИВЛ, типично для комплексных расстройств газообмена, возникающих, например, при РДС или тотальной пневмонии. Лабильная гипоксемия наблюдается при накоплении в бронхах мокроты, периодически нарушающей вентиляцию некоторых регионов легких. 5. Желательно сочетать пульсоксиметрию с другими методами мониторинга дыхания (капнографией, оксиметрией, спирометрией). Данные разных мониторов взаимно дополняют друг друга и даже в сложных случаях помогают восстановить картину нарушения легочного газообмена. Причины артериальной гипоксемии. Таковых пять (они могут встречаться по отдельности, однако часто имеет место их сочетание): • гиповентиляция; • уменьшение содержания кислорода во вдыхаемом газе; • шунтирование крови в легких; • гиповентиляция отдельных легочных зон; • нарушение диффузии кислорода из альвеол в кровь легочных капилляров. В каждом из вышеперечисленных случаев гипоксемия углубляется при увеличении потребности организма в кислороде. Пульсоксиметрия при гиповентиляции и апноэ. Снижение минутного объема вентиляции легких приводит к уменьшению доставки кислорода в альвеолы и нарушению эвакуации углекислого газа из альвеолярного пространства. При этом доставка в альвеолы углекислого газа с периферии и извлечение из них кислорода кровью, протекающей по легким, не прекращаются. В результате содержание кислорода в альвеолярном газе уменьшается, а концентрация CU2 возрастает. Соответственно изменяется и газовый состав крови, оттекающей от легких. При гиповентиляции развиваются артериальная гипоксемия, выявляемая пульсоксиметром по снижению SpO2, и гиперкапния, сопровождающаяся расширением артери-ол, увеличением амплитуды ФПГ и тахикардией (рис. 1.11). Степень гипо- или гипервентиляции традиционно оценивают по напряжению СОа в артериальной крови, потому что величина данного показателя зависит только от соответствия минутного объема альвеолярной вентиляции скорости продукции углекислоты. Внутрилегочный обмен кислорода подчиняется значительно более сложным законам. Поэтому снижение Sp02 можно определенно связать с гиповентиляцией лишь тогда, когда для этого есть реальные клинические предпосылки и нет оснований подозревать участие других механизмов, вызывающих гипоксемию. Диагностика гиповентиляции по снижению SpO2 в каждом случае требует обязательного соотнесения величины этого показателя с конкретной клинической ситуацией. Несомненным преимуществом пульсоксиметрии при гиповентиляции служит своевременность распознавания этого расстройства по самому опасному последствию - гипоксемии, способной быстро привести к тяжелым осложнениям. Пульсоксиметр реагирует на внезапное снижение объема вентиляции значительно раньше, чем капнограф. Как быстро развивается артериальная гипоксемия при остановке дыхания? Для анестезиолога и интенсивиста ответ на этот вопрос имеет исключительное практическое значение. Ведь речь идет о времени, которым располагает специалист, чтобы успеть интубировать больного после введения миорелаксанта, или о допустимой продолжительности аспирации мокроты у пациента, которому выполняется ИВЛ, или о любой другой ситуации, когда возникает или искусственно вызывается апноэ. В целом скорость появления и развития гипоксемии после остановки вентиляции определяется двумя факторами: (1) потребностью организма в кислороде и (2) запасами кислорода в организме, доступными для использования в физиологическом диапазоне РаО2. Потребность взрослого человека в кислороде в покое в среднем равна 250 мл/мин. При адекватной анестезии она снижается до 200 мл/мин, а при недостаточном обезболивании может увеличиться. Повышенная потребность в кислороде отмечается при гиперметаболических состояниях, например при стрессе. Рис. 1.11. Эпизоды апноэ на тренде SpO2 при дыхании воздухом Условность приведенных здесь величин очевидна. Минутное потребление кислорода зависит от массы тела и состояния метаболизма, которое, в свою очередь, определяется множеством факторов.мышечной дрожи, гипертермии или септическом шоке. Лидером среди гиперметаболических состояний является синдром злокачественной гипертермии - редчайшее осложнение общей анестезии, при котором потребность в кислороде возрастает в десятки раз. Запасы кислорода в организме невелики и у взрослого человека, дышащего воздухом, составляют в среднем 1,5 л, а при дыхании чистым кислородом возрастают до 4- 4,5 л. Поэтому предварительная вентиляция пациента кислородом (преоксиге-нация) существенно увеличивает допустимую продолжительность последующего апноэ. В этом можно убедиться, просматривая тренды SpO2, записанные, например, во время интубаций при вводных наркозах*. Объем кислорода в легких при дыхании атмосферным воздухом - около 450 мл, а при дыхании чистым кислородом он повышается до 3 л (размер функциональной остаточной емкости, ФОЕ - объема газа, содержащегося в легких к концу спокойного выдоха). Любая патология, приводящая к уменьшению ФОЕ или нарушающая использование этого резерва кислорода, укорачивает срок между моментом остановки дыхания и появлением артериальной гипоксемии. Ниже перечислены основные причины уменьшения ФОЕ, знание которых позволяет выделить из общей массы больных группу особого риска в отношении форсированного развития гипоксемии при апноэ: • ожирение; • высокое внутрибрюшное давление (парез кишечника, асцит, беременность и пр.), особенно в положении лежа или в положении Тренделенбурга; • релаксация диафрагмы; • уменьшение количества работающей легочной ткани (обширные резекции легких, пневмония, ателектазы, РДС, пробки мокроты, пневмо- или гемоторакс и пр.); • общая анестезия; • период новорожденности. Ряд проблем, связанных с преоксигенацией, подробнее рассмотрен в гл. "Оксиметрия". Основные причины нарушения утилизации внутрилегочного газа: • альвеолярное мертвое пространство (тромбозы и эмболии легочных сосудов) - кислород таких участков недоступен для ^использования; • наличие в легких обширных зон с выраженным преобладанием вентиляции над кровотоком (низкое давление в легочной артерии, например при гиповолемии). В крови человека содержится около 850 мл кислорода, связанного преимущественно с гемоглобином. При дыхании чистым кислородом его запас увеличивается приблизительно до 950 мл. При апноэ или гиповентиляции этот резерв начинает расходоваться с того момента, когда уровень кислорода в альвеолярном газе опускается ниже нормы. От количества газа, содержащегося в крови, во многом зависит скорость углубления гипоксемии. При невосполненной кровопотере или анемии безопасная длительность апноэ укорачивается. У детей, особенно у новорожденных, гипоксемия, обусловленная апноэ, развивается гораздо быстрее, чем у взрослых. Как скоро обнаруживает пульсоксиметр гиповентиляцию или апноэ? При дыхании атмосферным воздухом в легких практически нет избытка кислорода, который мог бы некоторое время поддерживать нормальный уровень РаО2 в условиях апноэ. Поэтому любое промедление в доставке новых порций кислорода в альвеолы быстро приводит к снижению парциального давления этого газа в легких и возникновению артериальной гипоксемии. Заметное уменьшение сатурации происходит уже через 30 с после внезапного сокращения объема вентиляции, но порции артериальной крови, несущей эту информацию, требуется 5-10, а при нарушениях кровообращения - до 40 с и более, чтобы достичь пульсоксиметрического датчика. К этому времени следует добавить от 2 до 15 с для обновления цифр на мониторе дисплея. Таким образом, пульсоксиметру необходимо в среднем от 40 до 60 с (а при низком минутном объеме кровообращения - до 2 мин) для того, чтобы обнаружить гиповентиляцию или апноэ, вызванные внезапным событием, например западением языка, перегибом интубационной трубки, рекураризацией или разгерметизацией контура респиратора. По скорости реакции на внезапную гиповентиляцию пульсоксиметр уступает только быстродействующему оксиметру - монитору, предназначенному для измерения концентрации кислорода в выдыхаемом газе, а при апноэ - также и капнографу, который в этом случае регистрирует прекращение колебаний концентрации углекислого газа. До внедрения пульсоксиметрии врачи, ведущие таких больных, были вынуждены руководствоваться лишь вышеперечисленными факторами и действовать сообразно предполагаемому сценарию развития событий. Пульсоксиметрия позволила измерить то, о чем раньше приходилось судить по весьма ненадежному внешнему признаку - скорости появления и нарастания цианоза. В результате допустимый срок интубации трахеи у больного с ожирением или эффективность преоксигенации перед аспирацией мокроты у больного с РДС перестали быть убедительными физиологическимиабстракциями, а превратились в конкретные цифровые показатели, которые легко контролировать у любого пациента. Так, благодаря повседневной практике работы под мониторным контролем, удалось пересмотреть клиническую значимость диффузионной гипоксии, возникающей при выходе из наркоза закисью азота, определить режим преоксигенации перед интубацией трахеи и разобраться с некоторыми другими предположениями, рекомендациями и ритуалами. Важнейшая роль мониторинга заключается в предоставлении возможности понимающему специалисту увидеть и оценить работу патофизиологических механизмов у больного. Вот почему в анестезиологии и интенсивной терапии мониторинг служит мостиком между физиологическими концепциями и реальностью клинической практики. Привычка анализировать данные мониторинга, "вписывать" их в конкретную клиническую ситуацию весьма полезна, поскольку именно так формируется умение уяснить суть происходящего и накапливается осмысленный клинический опыт. В конце концов, монитор - это своего рода дополнительный орган чувств врача, и обидно использовать его возможности на уровне простейших условных рефлексов. В тех случаях. Когда гиповентиляция развивается постепенно, в течение нескольких часов или суток (как, например, при полирадикулоневрите или миастеническом кризе), капнограф и пульсоксиметр реагируют на нее синхронно. В такой ситуации несомненное достоинство пульсоксиметрии - реальность выполнения длительного мониторинга у неинтубированного больного. Динамику нарастания расстройств дыхания можно контролировать по тренду SpO2 (рис. 1.12). – К сожалению, описанные выше возможности пульсоксиметрии применимы лишь тогда, когда больной дышит атмосферным воздухом. При увеличении концентрации кислорода во вдыхаемом или вдуваемом газе даже небольшого дыхательного объема хватает, чтобы обеспечить поступление в альвеолы необходимого количества кислорода. На фоне оксигенотерапии даже глубокая гиповентиляция может не сопровождаться снижением SpO2 и, соответственно, не выявляться пульсоксиметром. Гипоксемия, обусловленная гиповентиляцией, быстро и полностью устраняется двумя способами (их можно сочетать): увеличением объема вентиляции и повышением концентрации кислорода в дыхательной смеси. Оксигенотерапия позволяет в наикратчайшие сроки преодолеть наиболее опасное проявление гиповентиляции (не устраняя саму гиповентиляцию), а пульс-оксиметрия - контролировать результат; Очень часто этого бывает достаточно, чтобы выиграть время для принятия более радикальных мер. Какой должна быть концентрация кислорода в дыхательной смеси, чтобы ликвидировать гипоксемию, вызванную гиповентиляцией? Известно, что данный показатель зависит от степени снижения минутного объема вентиляции и от потребности организма в кислороде. Однако в практической работе эти знания бесполезны, потому что никто и никогда не рассчитывает FiQ2 Рис. 1.12. Тренд SpO2 при постепенно прогрессирующей гиповентиляции заранее. Параметр всегда выбирается интуитивно и часто оказывается выше или ниже необходимого. Во многих случаях изменения в состоянии больного требуют в дальнейшем соответствующего изменения концентрации кислорода во вдыхаемом газе. Пульсоксиметрия позволяет правильно выбирать концентрацию кислорода как при гиповентиляции, так и при других нарушениях оксигенации крови в легких, и непрерывно контролировать адекватность оксигенотерапии. (Подробнее эта тема обсуждается ниже.) Нужно помнить, что избавиться от задержки углекислоты в организме таким способом нельзя. Поэтому капнограф дает информацию о гиповентиляции и тогда, когда она замаскирована оксигенотерапией и не распознается пульсоксиметром. Сниженное содержание кислорода во вдыхаемом газе. При уменьшении содержания кислорода во вдыхаемом газе снижается парциальное давление кислорода в альвеолах. В результате напряжение кислорода и, соответственно, сатурация гемоглобина в крови, оттекающей от легких, падают и через некоторое время устанавливаются на новом, более низком уровне. При этом пульсоксиметр обнаруживает артериальную гипоксемию, выраженность которой зависит от степени уменьшения Fi02. Снижение содержания кислорода во вдыхаемом газе может быть вызвано двумя причинами: • избыточной концентрацией других компонентов газовой смеси (как правило, закиси азота); • существенным падением атмосферного давления (дыханием разреженным воздухом высокогорья или транспортировкой пациента в самолете с негерметичным салоном). Содержание кислорода в газовой смеси измеряется оксиметром - монитором, специально предназначенным для этой цели. Однако оксиметры до сих пор имеются далеко не во всех отделениях анестезии и интенсивной терапии, а сам метод, которому в этой книге посвящена отдельная глава, применяется значительно реже, чем пульсоксиметрия. Поэтому вероятнее всего сигнал о неблагополучии поступит от пульсоксиметра, а выяснять причину гипоксемии придется по ситуации. Сниженное содержание кислорода в атмосферном воздухе - явление достаточно нетипичное, за исключением тех случаев, когда больница находится в горной местности. Однако риск формирования гипоксической дыхательной смеси во время наркоза вполне реален. При любой десатурации, возникающей во время анестезии с применением закиси азота, необходимо в первую очередь проверить правильность дозирования кислорода и анестетика. Гипоксемия, вызванная шунтом. Шунтирование крови в легких - одна из наиболее частых причин артериальной гипоксемии у пациентов в отделении интенсивной терапии и операционной.. Шунт - это часть легочного кровотока, проходящая но невентилируемым участкам легких. Венозная кровь, притекающая к легким и попадающая в шунты, не изменяет свой состав и на выходе из легких встречается с кровью, оттекающей от нормально работающих альвеол. В результате смешивания этих двух потоков образуется артериальная кровь, напряжение кислорода в которой снижено из-за примеси венозной крови (рис. 1.13). Поэтому шунтирование крови относят к группе расстройств легочного газообмена, объединенных названием "венозная примесь". Рис. 1.13. Шунтирование крови в легких Прекращению вентиляции отдельных кровоснабжаемых участков легких способствуют самые разные причины: * полная обструкция части дыхательных путей Пробками вязкой мокроты, аспирированными рвотными массами, сгустками крови, опухолью и пр.; при герметичной эндобронхиальной интубации в шунт может мгновенно превратиться целое легкое; • пневмония - в пневмонических очагах альвеолы безвоздушны, так как заполнены экссудатом, а кровоток усилен из-за воспалительной гиперемии; • микро- и макроателектазы - пожалуй, особенно частая причина шунтирования; • при альвеолярном отеке легких зоны, заполненные транссудатом, превращаются в шунт; • массивное, шунтирование крови происходит при респираторном дистресс-синдроме (РДС) через зоны интерстициального отека и консолидации альвеолярной ткани, множественные микроателектазы и участки с локальной обструкцией бронхов. Еще один вероятный механизм шунтирования - раскрытие артериовенозных анастомозов, имеющихся в легких, но не функционирующих в нормальных условиях. Факт существования таких анастомозов доказан экспериментально, но в целом проблема изучена недостаточно. Предполагается, что эти анастомозы предназначены для сброса части венозной крови при резком повышении давления в легочной артерии. Уменьшить, или ликвидировать шунтирование можно, лишь устранив его, причину. Возрастание SpО2 после удаления мокроты, "раскашливания" больного, применения режимов ПДКВ (PEEP - англ.) или НПД (СРАР - англ.), увеличения среднего давления в дыхательных путях при ИВЛ, подтягивания слишком глубоко введенной интубационной трубки свидетельствует о том, что причиной артериальной гипоксемии был шунт. Степень артериальной гипоксемии напрямую зависит от объема шунтирования. Вместе с тем при одинаковом объеме шунтирования SpO2 оказывается меньше у больных с анемией, сниженным минутным объемом кровообращения или повышенной потребностью в кислороде. У таких пациентов ткани усиленно извлекают кислород из артериальной крови. В результате от органов оттекает венозная кровь с резко сниженным содержанием кислорода. Шунтирование в легких венозной крови с аномально низким содержанием кислорода способствует дополнительному уменьшению Sp02. Поэтому коррекция гипоксемии, обусловленной шунтированием, включает также меры по нормализации системной гемодинамики и ликвидированию анемии. Пульсоксиметрия позволяет контролировать эффективность этих-мер»; К сожалению, во многих случаях рассчитывать на быстрое устранение шунта не приходится; наоборот, прогрессирование пневмонии, РДС или аспирационного пневмонита сопровождается вовлечением в патологический процесс все новых и новых участков легочной ткани,увеличением шунта и углублением гипоксемии. Чтобы выиграть время, необходимое для лечения критической легочной патологии, применяют оксигенотерапию, которая уменьшает гипоксемию при работающих шунтах. Механизм действия оксигенотерапии при гипоксемии, порожденной шунтом, довольно прост. При дыхании воздухом от нормально функционирующих легочных зон оттекает кровь, гемоглобин которой насыщен кислородом на 94-98 %. У больных с утолщенными альвеолокапиллярными мембранами этот показатель может быть и ниже из-за диффузионных расстройств. Использование газовой смеси с повышенной концентрацией кислорода позволяет насытить оставшиеся 2-6 % гемоглобина крови, протекающей по функционирующим альвеолам, а также увеличить, хоть и незначительно, количество кислорода, растворенного в плазме. При небольшом объеме шунтирования этого дополнительного количества кислорода, попавшего в кровь, оттекающую от здоровых легочных зон, достаточно, чтобы поднять сатурацию крови, поступившей из шунтов, до нормального уровня. Понятно, что при массивном шунтировании этот механизм малоэффективен и гипоксемия остается резистентной к оксигенотерапии. Считается, что в случаях, когда в легких шунтируется до 10 % минутного объема кровообращения, гипоксемию можно полностью устранить ингаляцией 30 % кислорода. При 30 % шунте нормализовать SpO2 удается, только применяя чистый кислород. При объеме шунтирования свыше 50 % общего кровотока гипоксемия резистентна к оксигенотерапии, и даже с помощью 100 % кислорода удается увеличить SpO2 лишь на несколько процентов. Зная механизм действия оксигенотерапии при шунтировании, нетрудно понять, почему это так. Разумеется, приведенные здесь цифры' имеют ориёнтировочный характер, но весьма Типичны для подавляющего числа случаев. Реакция SpO2 на увеличение концентрации кислорода во вдыхаемом газе - важный критерий в диагностике шунтирования крови в легких. Гипоксемия при регионарной гиповентиляции. Шунтирование крови в легких происходит при полном прекращении вентиляции кровоснабжаемого участка легких. Однако часто вентиляция отдельных легочных зон сохраняется, но становится недостаточной для обеспечения в них нормального газообмена. Возникает регионарная гиповентиляция. В идеальном случае объем вентиляции легких в целом и каждого легочного региона в частности; должен соответствовать объему общего и регионарного кровотока. Но даже у здорового человека в легких, наряду с такими "идеальными" регионами, есть области, где вентиляция избыточна по отношению к крово-току (зоны с высокими вентиляционно-перфузионными отношениями). Сатурация гемоглобина крови, оттекающей от этих зон, на несколько процентов выше, чем в идеальных регионах. Существуют также регионы, вентиляция которых недостаточна для полноценной обработки потока венозной крови (зоны с низкими вентиляционно-перфузионными отношениями) От таких областей поступает кровь с уменьшенной сатурацией. В норме избыточная сатурация крови в одних регионах эффективно компенсирует нехватку сатурации в других. Таким образом формируется нормальный газовый состав артериальной крови (рис. 1.14). Рис. 1.14. Влияние различий регионарных вентиляционно-перфузионных отношений на SpO2 при дыхании атмосферным воздухом .Возможности этого естественного компенсирующего механизма ограничены кислородной емкостью основного переносчика кислорода - гемоглобина и достаточны лишь для нормально работающих легких. В условиях патологии объем регионов с низкими вентиляционно-перфузионными отношениями порой увеличивается настолько, что полная компенсация становится невозможной. Когда поток недонасышенной кислородом крови от гиповенти-лируемых регионов резко возрастает, несколько дополнительных процентов сатурации, заработанные небольшим потоком крови в гипервентилируемых зонах, неспособны исправить ситуацию. Возникает артериальная гипоксемия, которую помогает выявить пульсоксиметр. Развитие гипоксемии по вышеописанному механизму происходит лишь в том случае, когда больной дышит воздухом. Увеличение концентрации кислорода во вдыхаемом или вдуваемом газе (FiO2) до 25-50 % позволяет существенно увеличить, а во многих случаях и полностью нормализовать SpO2. Гипервентиляция (спонтанная или аппаратная) при венти-ляционио-перфузионном дисбалансе также способствует повышению Sp02 но ее эффективность меньше, чем у ок-сигенотерапии. Появление в легких областей с низкими вентиляционно-перфузионными отношениями обусловлено двумя причинами: (1) локальным уменьшением вентиляции или (2) локальным увеличением кровотока. Вентиляция региона может уменьшиться из-за сужения бронха, снижения растяжимости отдельных участков легочной ткани, пареза или болевого ограничения подвижности одного из куполов диафрагмы, одностороннего пневмо-, гемо- или гидроторакса. Основные конкретные причины нарушения вентиляции отдельных легочных регионов: • уменьшение просвета бронхов вследствие скоплений мокроты; • регионарный бронхиолоспазм; • отек слизистой оболочки бронхиол, преобладающий в нижних отделах легких; • сдавление мелких бронхов инфильтратами при РДС или очаговой пневмонии; • частичное перекрытие крупных бронхов глубоко введенной интубационной трубкой; • опухоль, наличие инородного тела в бронхах; • увеличение жесткости отдельных участков легочной ткани, например при интерстициальном отеке, преобладающем в нижних зонах; • недавно расправленный ателектаз; • экспираторное закрытие дыхательных путей. Локальное увеличение легочного кровотока происходит в результате его патологического перераспределения. Когда давление в легочной артерии снижается и становится недостаточным для подъема крови в верхние зоны легких, кровоток осуществляется главным образом через нижележащие отделы, вентиляция которых перестает соответствовать возросшему потоку крови. Сходная картина наблюдается при росте внутрилегочного давления (например при ИВЛ), которое пережимает альвеолярные капилляры в верхних зонах легких и тем самым направляет кровоток в нижние регионы, где капиллярное давление выше. Особенно выраженное снижение Sp02 наблюдается при сочетании этих двух факторов, например при ИВЛ на фоне гиповолемии. Причины перераспределения легочного кровотока, которые могут вызвать артериальную гипоксемию: • снижение давления в легочной артерии: – гиповолемия, в том числе скрытая; " – общая анестезия; – применение некоторых вазодилататоров, действующих на артериолы малого круга; – снижение минутного объема кровообращения; • высокое внутрилегочное давление: – ИВЛ; – ПДКВ.НПД; – ауто-ПДКВ. Даже беглое знакомство с этим коротким списком позволяет сделать вывод, что на перераспределение кровотока в легких влияют причины функционального характера:) нарушения, кровообращения, воздействие медикаментов, режимы вентиляция. В этих случаях гипоксемия возникает не в связи с поражением бронхо-легочного аппарата, а в результате нарушения условий его работы. Своевременная коррекция функциональных расстройств приводит к быстрой нормализации Sp02. Итак, артериальная гипоксемия, обусловленная снижением регионарных вентиляционно-перфузионных отношений, порождается самыми разнообразными причинами (не исключено их сочетание). Пульсоксиметр может обнаружить снижение Sp02 у больного с кровотечением, высоким спинальным или эпидуральным блоком, задержкой мокроты, пневмотораксом или при "жестком" режиме ИВЛ; и во всех этих случаях работает один и тот же механизм развития гипоксемии - недостаточная по отношению к кровотоку вентиляция отдельных легочных регионов. Этим обстоятельством объясняется общее для всех перечисленных ситуаций явление: быстрое и полное устранение артериальной гипоксемии ингаляцией кислорода в относительно невысокой концентрации. Именно поэтому гипоксемия, вызванная регионарной гиповентиляцией, чаще наблюдается у пациентов, дышащих атмосферным воздухом. Оксигенотерапия во многих случаях; способна замаскировать данный тип расстройств легочного газообмена. Механизм действия оксигеноте-рапии на газообмен в гиповентилируемых регионах аналогичен таковому на легкие в целом при общей гиповентиляции: достаточно увеличить концентрацию кислорода в гиповентилируемых альвеолах, чтобы нормализовать сатурацию протекающей по ним крови. Гипоксемия при диффузионных расстройствах. Теоретические аспекты нарушения диффузии Кислорода через барьер, отделяющий гемоглобин эритроцитов от альвеолярного газа, разработаны достаточно подробно. Этого, к сожалению, нельзя сказать о клинической оценке диффузионных расстройств при анестезии и интенсивной терапии. Несмотря на ясные представления о механизмах нарушения диффузии кислорода в легких, практическая медицина критических состояний в настоящее время не располагает общедоступными методами выявления (не говоря уже о точной количественной оценке) диффузионных расстройств у конкретного больного. Уменьшение диффузионной способности легких сказывается прежде всего на переносе кислорода из альвеол в кровь. Внутрилегочный обмен углекислого газа не страдает даже при выраженных диффузионных расстройствах, так как СО2, в силу своей высокой растворимости в водных средах, обладает очень большой проникающей способностью. Причины нарушения диффузии кислорода из альвеол в кровь легочных капилляров достаточно разнообразны: • уменьшение общей площади функционирующих альвеол (сокращение эффективной дыхательной поверхности): – обширные резекции легочной ткани, пульмонэктомия; – множественные ателектазы, коллапс легкого; – обширная пневмония; – РДС; – массивная тромбоэмболия легочных сосудов; • утолщение альвеолокапиллярной мембраны из-за ее отека или фиброза; • в обоих случаях гипоксемия усиливается при увеличении линейной скорости движения крови по легочным сосудам, когда времени нахождения эритроцита в капилляре не хватает для завершения сатурации гемоглобина: – гипердинамические состояния кровообращения (сепсис, инфузия адреномиметиков, физическая нагрузка и пр.): – уменьшение количества функционирующих легочных сосудов: резекции легких, тромбозы и эмболии в системе малого) круга. Три вышеперечисленных фактора, ограничивающие диффузию и вызывающие артериальную гипоксемию, встречаются при различной патологии. Гипоксемия, обусловленная диффузионными расстройствами, обычно легко устраняется ингаляцией кислорода. При повышении концентрации кислорода в альвеолах возрастает движущая сила диффузии - разность напряжений газа по обе стороны альвеоло-капиллярной мембраны. В результате гипоксемия уменьшается или исчезает, хотя Причина, по которой она возникла, остается. Лишь при крайне выраженных диффузионных расстройствах эффект оксигенотерапии может быть неполным. В клинической практике гипоксемия, развивающаяся вследствие нарушений диффузии, наблюдается очень часто, но, к сожалению, в каждом случае мы можем лишь предполагать наличие нарушений, опираясь на здравый смысл и знание прикладной физиологии.
Гипоксемия смешанного происхождения
Нередко артериальная гипоксемия порождается несколькими механизмами, действующими одновременно. Рассмотрим на двух примерах, как у таких больных использовать данные пуль-соксиметрии для диагностики этих механизмов и определения патогенетически обоснованных мер коррекции гипоксемии. Пример 1 Ситуация: у больного через несколько минут после введения раствора местного анестетика в эпидуральный катетер развилась клиническая картина тотального спинального блока с резким уменьшением SpO2. На дисплее пульсоксиметра отмечается появление дыхательных волн. Причины гипоксемии: (1) общая гиповентиляция, вызванная релаксацией межреберных мышц и диафрагмы, и (2) регионарная гиповентиляция вследствие перераспределения легочного кровотока, вызванного относительной гиповолемией. Проблемы: ИВЛ, которая может потребоваться для решения первой проблемы, приводит к критическому снижению венозного возврата и усиливает неравномерность распределения легочного кровотока. Коррекция гипоксемии: (1) ингаляция 100 % кислорода через маску или интубационную трубку, (2) при выраженной гиповентиляции - вспомогательная ИВЛ, лучше в высокочастотном режиме с минимальным положительным давлением, а при апноэ - ИВЛ (лучше - ВЧ ИВЛ или ИВЛ с активным выдохом), (3) форсированная инфузионная терапия, применение эфедрина или других вазопрессоров. Комментарий: оксигенотерапия - универсальное средство, которое эффективно как при общей, так и при регионарной гиповентиляции. При недостаточности этой меры (низкий уровень Sp02 и/или признаки нарастающей гиперкапнии) приходится устранять гиповентиляцию с помощью ИВЛ. Искусственная вентиляция легких воздухом (например, мешком AMBU) ликвидирует компонент гипоксемии, связанный с общей гиповентиляцией, но усиливает неравномерность распределения легочного кровотока(гиповолемия!) и поэтому неспособна нормализовать Sp02. Необходимо поднять Fi Оад принять активные меры для увеличения венозного возврата. Режим ИВЛ следует подбирать так, чтобы среднее давление в дыхательных путях было минимальным. Пример 2 Ситуация: больному с субтотальной пневмонией осуществляется ИВЛ с повышенным давлением вдоха и отношением вдох: выдох 1: 2. Несмотря на высокое содержание кислорода во вдуваемом газе, SpO; остается резко сниженным. На фоне инфузии добутамина, начатой в связи с синдромом малого сердечного выброса, отмечено увеличение SpO2. Причины гипоксемии: (1) шунтировавйе крови через пневмонические очаги, (2) диффузионные расстройства, вызванные резчайшим сокращением дыхательной поверхности, (3) выраженное уменьшение функциональной остаточной емкости, запаса кислорода в которой недостаточно для оксигенации капиллярной крови в фазе выдоха, то есть на протяжении 1/3 каждого дыхательного цикла. Проблемы: высокое давление во время искусственного вдоха пережимает капилляры в работающих зонах легких, в результате чего кровоток направляется в шунты. Коррекция гипоксемии: увеличение сократимости правого желудочка под действием добутамина приводит К дополнительному повышению давления в легочной артерии, которое противодействует компрессии легочных капилляров во время вдоха в работающих участках легких. За счет этого увеличивается кровоток по вентилируемым зонам и возрастает Sp02. Кроме того, увеличение минутного объема кровообращения обычно сопровождается некоторым повышением содержания кислорода в венозной крови, попадающей затем в легочные шунты. Это также способствует росту SpO2. Комментарий: можно несколько уменьшить шунтирование и увеличить дыхательную поверхность, расправив микроателектазы, которые всегда имеются в подобных ситуациях. Это достигается специальным подбором метода искусственной вентиляции и параметров режима. Повысить ФОБ удается с помощью ПДКВ или, лучше, применением ИВЛ с инверсией фаз дыхательного цикла. Мониторинг Sp02 позволяет непрерывно контролировать результат!
Применение пульсоксиметрии в типичных клинических ситуациях
Пульсоксиметрия при гиповолемии. Острая гиповолемия - самый частый компонент расстройств кровообращения при критических состояниях. Но, несмотря на это обстоятельство, диагностика несоответствия объема циркулирующей крови емкости сосудистого русла во многих случаяхсвязана со значительными трудностями. Поэтому выбор объема и состава инфузионной и медикаментозной терапии гиповолемии в основном зависит от опыта врача, а контроль эффективности лечения нередко сводится к оценке внешнего вида больного, измерению центрального венозного и артериального давления и контролю диуреза. Пульсоксиметрия не принадлежит к точным методам мониторинга гемодииамики, однако нарушения системного и легочного кровообращения, вызванные гиповолемией, приводят к типичным изменениям пульсоксиметрических показателей, которые дополняют общую картину. Комплекс изменений на дисплее пульсоксиметра, возникающий при гиповолемии, складывается из следующих симптомов. • Снижение 5р0г, обусловленное выраженной неравномерностью легочного кровотока. Этот признак очень типичен для гиповолемии, но может быть выявлен только у больных, дышащих воздухом или смесью N2O: 02 с высоким содержанием закиси азота. Для коррекции гипоксемии, вызванной гиповолемией, обычно достаточно умеренного (до 30-50 %) увеличения содержания кислорода во вдыхаемом газе. • Тахикардия - компенсаторная реакция, направленная на поддержание сердечного выброса. • Снижение амплитуды фотоплетизмограммы в результате периферического артериолоспазма и уменьшения ударного объема. При выраженных расстройствах кровообращения пульсирующий сигнал настолько затухает, что пульсоксиметр иногда вообще отказывается работать. Увеличение амплитуды ФПГ на фоне интенсивной терапии свидетельствует о восстановлении периферического кровотока. Нужно иметь в виду, что артериолоспазм, возникший из-за гиповолемии, способен сохраняться некоторое время после нормализации ОЦК. Дыхательные волны на фотоплетизмограмме (рис. 1.15) - колебания высоты волн, синхронные с дыханием*. На этот признак редко обращают внимание, хотя при гиповолемии он порой появляется раньше остальных. Дыхательные волны отражают возросшую чувствительность венозного возврата к колебаниям внутригрудного давления, что в большей степени характерно для гиповолемии ив несколько меньшей - для ИВЛ. * В некоторых моделях пульсоксиметров имеется функция автоматического приведения ФПГ к изолинии -чтобы придать картинке на дисплее "красивый" вид. Эта любезность разработчиков лишает нас одного из самых чувствительных и демонстративных симптомов гиноволемии. Автоматическое масштабирование ФПГ (autoscaling) обычно не сглаживает дыхательные волны, так как ЭТА функция включается при более или менее стойком изменении амплитуды. Рис. 1.15. Типичная пульсоксиметрическая картина при гиповолемии: гипоксемия, тахикардия, низкая амплитуда ФПГ и дыхательные волны Последний из перечисленных симптомов нуждается в пояснениях. При самостоятельном дыхании каждому вдоху соответствуют снижение внутригрудного давления и временное увеличение венозного возврата. Поэтому несколько сердечных циклов, приходящихся на фазу вдоха, характеризуются возросшим ударным объемом. На ФПГ им соответствуют высокие пульсовые волны. Клиническим эквивалентом дыхательных волн является парадоксальный пульс, но чувствительность пульсоксиметра в данном случае выше, чем у пальцев врача (если этот врач не китаец). При ИВЛ наблюдается обратная картина. Вдувание газа в легкие приводит к росту внутригрудного давления. При гиповолемии это сопровождается временным ограничением венозного возврата и снижением волн ФПГ. В фазе выдоха амплитуда ФПГ увеличивается, возвращаясь к исходному уровню. Поэтому при проведении ИВЛ больным с гиповолемией рекомендуется уменьшать дыхательный объем компенсаторно увеличивать частоту вентиляции, снижать отношение вдох: выдох до 1:3 и избегать применения ПДКВ. Подбор режима, основанный на этих принципах, позволяет существенно снизить пиковое и среднее внутригрудное давление и тем самым уменьшить отрицательное влияние ИВЛ на венозный возврат. Перевыполнение этих рекомендаций логически приводит нас к оптимальному способу вентиляции при гиповолемии - высокочастотной ИВЛ, которая должна осуществляться с относительно невысокой частотой (80-120 в 1 мин) и отношением вдох: выдох, равному 1:3. Обнаружение вышеперечисленных пульсоксиметрических признаков гиповолемии доступно только при использовании монитора соответствующего класса. Такой монитор должен обладать свойством отражения реальной амплитуды ФПГ столбчатым индикатором (самый частый вариант) или в цифровом виде ("амплитудный фактор" DATEX). Желательно, чтобы пульсоксиметр запоминал и воспроизводил в виде трендов изменения не только SpO2, но и амплитуды ФПГ*. * Тренд амплитуды ФПГ выводится на дисплей лишь у единичных моделей пульсоксиметров. К ним относятся, например, мониторы серии AURA фирмы CURATIVUS. Такие явления, как дыхательные волны на ФПГ, лучше определяются при малой скорости записи, когда на экране помещается большое количество циклов, но для этого должна иметься возможность регулировать временной масштаб дисплея. И наконец, надо помнить, что при гиповолемии ушной датчик обычно дает более качественный сигнал, чем пальцевой. Кстати, пульсоксиметрия предоставляет возможность оценить эффективность специального приема, с помощью которого удается в большинстве случаев существенно уменьшить отрицательное влияние ИВЛ на гемодинамику при гиповолемии. Речь идет о режиме ИВЛ с активным выдохом (отрицательном давлении в фазе выдоха, NEEP). Снижение давления в дыхательных путях в фазе выдоха до (-3)-(-8) см вод. ст. увеличивает венозный возврат и ударный объем, что проявляется возрастанием амплитуды волн ФПГ. Увеличение дыхательных волн на ФПГ при вентиляции в этом режиме обусловлено циклическим возрастанием венозною возбрзла. в фазе активного выдоха
1. Адекватная терапия острой гиповолемии приводит к нормализации пульсоксиметрических показателей. При отсутствии специфических травм или других сопутствующих обстоятельств стойкое снижение SpO2 после коррекции волемических расстройств обусловлено двумя причинами: 1. Гипергидратацией легочной ткани при избыточном объеме инфузий. SpО2 удается постепенно нормализовать, проводя терапию диуретиками и применяя сеансы дыхания в режиме ПДКВ или НПД. 2. Неуклонно прогрессирующее снижение SpО2 должно настораживать, поскольку может оказаться первым признаком повреждения легких по типу респираторяого дистресс-синдро-ма. В этом случае положительное действие дегидратационной терапии на SpO2 оказывается неотчетливым и нестойким, а, поначалу эффективная, оксигенотерапия вскоре неспособна устранить артериальную гипоксемию. Пульсоксиметрия ори оксигенотерапии. Увеличение концентрации кислорода во вдыхаемой или вдуваемой газовой смеси - универсальный способ коррекции артериальной гипоксемии. У большинства пациентов одной только оксигенотерапии, как правило, достаточно для того, чтобы нормализовать или хотя бы повысить Sр02. Однако, руководствуясь принципом: "Если больной дышит плохо, пусть он плохо дышит кислородом'
1, - полезно иметь в виду следующее: • беспричинной гипоксемии не бывает; • кислород ликвидирует гипоксемию, но не причину, ее породившую; • к кислороду необходимо относиться так же, как к любому другому медицинскому препарату; его нужно применять по определенным показаниям, в определенных дозах.и помнить, что он обладает весьма опасными побочными эффектами; В настоящее время наблюдается крайне сдержанное, а нередко и откровенно негативное отношение к атому режиму, в основном из-за его способности провоцировать раннее экспираторное закрытие дыхательных путей (ЭЗДП). Об этой опасности действительно необходимо помнить, как, впрочем, и о том, что в неумелых руках любой метод лечения обычно' реализуется побочными действиями, а не лечебным эффектом.. • концентрация кислорода в дыхательной смеси должна быть той минимальной, которая достаточна для коррекции гипоксемии; • предельная безопасная для длительного использования концентрация кислорода в дыхательной смеси, по последним данным, равна 50 %; • токсическое влияние высоких концентраций кислорода на легкие не имеет специфических проявлений и всплывает в виде ателектазов, гнойного трахеобронхита или респираторного дистресс-синдрома, которые в дальнейшем соотносят с чем угодно, но не с оксигенотерапией; • и наконец, к кислороду в полной мере относится "золотое правило" интенсивной терапии: лучший лист назначений - не тот, к которому нечего добавить, а тот, из которого нечего вычеркнуть. Пульсоксиметрия - ключ к решению многих перечисленных выше проблем. Мониторинг оксигенации помогает не только своевременно обнаружить гипоксемию, но также установить ее причину, подобрать оптимальную концентрацию кислорода в дыхательной смеси и в нужный момент безопасно перевести больного на дыхание атмосферным воздухом. Нормальная величина SpO2 находится в диапазоне 94-98 %, причем у пациентов молодого и среднего возраста, не имеющих легочной патологии, преобладают значения сатурации 96-98 %, а у пожилых больных чаще встречается Sp02 94-96 %, что обусловлено возрастными изменениями в легких. У пациентов с хронической легочной патологией отмечается адаптация к более низкому уровню сатурации. Попытка искусственной "нормализации" SpO2 у таких больных может закончиться угнетением спонтанного дыхания. При нормальном уровне SpO2 оксигенотерапия показана: 1. При выраженной острой недостаточности кровообращения или очень глубокой анемии, когда приходится надеяться даже на незначительное увеличение системного транспорта кислорода за счет до насыщения кислородом оставшихся 2-4 % гемоглобина. 2. В качестве профилактической меры при реальном риске внезапного развития гипоксемииу пациентов с нестабильным дыханием, например в раннем послеоперационном периоде или при неврологической патологии, затрагивающей дыхательный центр или дыхательную мускулатуру. В таких случаях обычно бывает достаточно повысить FiOa до 30-40 %. К числу показаний мы не относим отравление угарным газом, при котором значение Sp02 всегда является артефактным. Снижение Sp02 до 90-94 % расценивается как умеренная артериальная гипоксемия. Если она обнаруживается у больных, дышащих атмосферным воздухом, вопрос о необходимости оксигенотерапии решается индивидуально. Надо помнить, что неглубокую гипоксемию человек может довольно длительно переносить без печальных последствий. Исключение составляют пациенты с тяжелой анемией, недостаточностью кровообращения, нарушениями коронарного или мозгового кровотока, гиперметаболизмом. Выраженная артериальная гипоксемия (SpO2
=85-90 %) - это следствие и признак серьезного нарушения газообмена и безусловное показание для назначения кислорода. Нормализация пульсоксиметрических параметров на фоне оксигенотерапии не отменяет необходимости выяснения причины расстройства и ее устранения с использованием приемов, рассмотренных выше. При глубокой гипоксемии (SpO2 «85 %) оксигенотерапия служит экстренной первичной мерой коррекции и фоном для применения более сложных и требующих времени методов лечения, выбор которых определяется причиной нарушения газообмена. Пульсоксиметрия позволяет реализовать важнейший принцип оксигенотерапии - использование кислорода в концентрации, не превышающей ту минимальную; которая требуется, чтобы удерживать SpO2 в пределах нормальных значений. После заполнения гемоглобиновой емкости артериальной крови на 98-100 % дальнейшее увеличение FiO2 становится бессмысленным, поскольку приводит лишь к незначительному приросту оксигенации крови за счет физически растворенного в ней кислорода. Стремление увеличить количество физически растворенного в крови кислорода оправдано лишь: • при крайне низком содержании гемоглобина; • при выраженной недостаточности кровообращения; • при отравлении окисью углерода; • при необходимости денитрогенации организма. В подавляющем большинстве случаев применение кислорода в концентрациях, превышающих минимально достаточную для практически полного насыщения гемоглобина артериальной крови (SpO2 =98-100%), не содействует сколько-нибудь заметному улучшению оксигенации тканей, но повышает риск гипероксического повреждения легких и приводит к непроизводительному расходу газа. Пульсоксиметр измеряет степень заполнения кислородом гемоглобиновой емкости артериальной крови и потому не способен выявлять гипероксию. После того как достигается 100 % сатурация гемоглобина (у здорового человека этого добиваются назначением 30 % кислорода), дальнейшее увеличение Fi02 приводит лишь к росту напряжения и содержания физически растворенного кислорода в крови, на который пульсоксиметр не реагирует. В подобных случаях монитор будет показывать на дисплее один и тот же, максимально возможный, уровень сатурации (Sp02 = 100 %), начиная с Fi02 - 0,3 и далее, при увеличении концентрации кислорода во вдыхаемом газе вплоть до использования чистого кислорода. В случаях, когда пульсоксиметр отображает на индикаторе SpO2 = 100 %, врач не может быть уверен в том, что концентрация кислорода не избыточна (рис. 1.16). Чтобы выйти из этого положения, достаточно плавно уменьшить содержание кислорода в дыхательной смеси до того уровня, при котором Sp02 составит 98-99 % или вовсе вернется в границы нормы. При снижении SpO2 со 100 до 98 % уменьшение содержания кислорода в артериальной крови столь несущественно, что в подавляющем большинстве случаев может быть произведено незаметно для здоровья больного. Зато врач приобретает надежный ориентир, помогающий отслеживать в мониторном режиме правильность дозирования кислорода. В дальнейшем регулировать FiOa нужно таким образом, чтобы поддерживать Sp02 на 1-3 % ниже 100 %. Тем самым обеспечиваются нормальное насыщение гемоглобина артериальной крови Кислородом и минимальная достаточная концентрация кислорода во вдыхаемом газе. Благодаря такому подходу не только сокращается риск ги-пероксического повреждения легких, но и экономно расходуется сжатый кислород. При катастрофическом поражении легких, сопровождающемся массивным шунтированием крови и глубокой гипоксемией, даже вентиляция 100 % кислородом не позволяет нормализовать Sp02. В этих случаях приходится идти на вынужденный компромисс, выбирая между наименьшим допустимым уровнем SpO2 и максимально приемлемой для длительного применения концентрацией кислорода во вдуваемом газе. И если повышение Fi02 c 50 дo 100 % дает увеличение SpO2 с 75 до 78 %, задумайтесь, не слишком ли высока цена за столь незначительный результат. Диагноз "токсическое поражение легких кислородом" практически не встречается ни в историях болезни, ни в протоколах патологоанатомического исследования, но это говорит лишь о неумении распознавать патологию, а не о ее отсутствии. Разумеется, сказанное выше относится к многочасовой и многосуточной оксигенотерапии, в том числе и при длительной ИВЛ. При кратковременном лечении кислородом критерии к его дози-рованию не столь жестки и основная цель пульсоксиметрии состоит в предупреждении гипоксемии и своевременном прекращении оксигенотерапии. Рис. 1.16. Пример влияния FiO2 на SpO2 отчетливо видна нецелесообразность применения Fi02 выше 50 % Пульсоксиметрия при ИВЛ. Обеспечение оксигенации артериальной крови - одна из основных конечных задач ИВЛ, и уже только поэтому пульсоксиметрия является обязательным методом мониторинга у пациентов, подключенных к дыхательной аппаратуре. Это требовании содержится практически во всех стандартах обеспечения безопасности пациентов. Искусственная вентиляция легких способна влиять на все параметры пульсоксиметрии, так что умение анализировать эти изменения помогает вовремя сориентироваться в ситуации. Однако диагностические возможности метода в данном случае не ограничиваются простым контролем SpO2. ИВЛ радикальным образом изменяет работу всех звеньев процесса легочного газообмена, и в ситуациях, порожденных этим вмешательством, пульсоксиметр предоставляет богатую информацию для размышления. ИВЛ на фоне гиповолемии. Иногда во время проведения ИВЛ наблюдается снижение амплитуды фотоплетизмограммы. Наиболее частая причина этого - уменьшение сердечного выброса из-за роста внутригрудного давления на фоне скрытой гиповолемии. Амплитуда ФПГ может снижаться даже при компенсированной гиповолемии, что, как правило, сочетается с тахикардией, возникновением дыхательных волн, а также с умеренной гипоксемией, легко уступающей повышению FiO2. При декомпенсированной гиповолемии, приводящей к уменьшению минутного объема кровообращения и аварийному перераспределению кровотока, применение ИВЛ чревато катастрофическими последствиями для легочной и системной гемодинамики. В некоторых случаях перфузия периферии нарушается настолько сильно, что монитор не улавливает пульсацию артериол. Резкое снижение фотоплетизмограммы или ее исчезновение с дисплея монитора в таких ситуациях сопровождается сообщением "low perfusion" ("нарушение перфузии") или "low quality signal" ("сигнал низкого качества") и свидетельствует о плачевном состоянии периферического кровотока. При появлении этих симптомов (а они обычно полностью вписываются в общеклиническую картину) необходимо добиваться не только подъема артериального, и центрального венозного давления, но и нормализации пульсоксиметрического статуса. Гиповолемия всегда сопровождается уменьшением давления в легочных капиллярах, особенно в верхних зонах легких, и повышенное альвеолярное давление при искусственном вдохе пережимает межальвеолярные сосуды, направляя кровоток в нижние отделы, вентиляция которых недостаточна для обработки возросшего потока крови. Регионарная гиповентиляция вызывает падение SpO2, что, в сочетании с малым минутным объемом кровообращения, а нередко и анемией, приводит к резкому сокращению доставки кислорода к тканям. Экстренная мера коррекции гипоксии (помимо инфузионной и медикаментозной терапии) - временное изменение режима вентиляции, которое имеет своей целью снижение альвеолярного и внутригрудного давления и включает: (1) отказ от использования ПДКВ; (2) в отдельных случаях - применение активного выдоха с разрежением от -3 до -8 см вод. ст.; (3) уменьшение дыхательного объема с соответствующим увеличением частоты вентиляции или (4) переход на ВЧ ИВЛ с частотой 80-100 в 1 мин и отношением вдох: выдох, равным 1: 3. Гипоксемия, обусловленная регионарной гиповентиляцией, поддается коррекции посредством повышения Fi02. Как правило, принятие этих мер позволяет добиться заметного улучшения пульсоксиметрических показателей задолго до ликвидации гиповолемии. ИВЛ при тяжелом поражении легких. В данной ситуации, требующей применения ИВЛ, пульсоксиметр служит непрерывным поставщиком информации, важность которой трудно переоценить. Респираторному дистресс-синдрому, обширной пневмонии, аспирационному пневмониту и прочим вариантам критического поражения легких сопутствуют комплексные расстройства газообмена и кровообращения, когда выбор оптимального метода и режима ИВЛ является сложнейшей задачей, которую невозможно решать вслепую. Этот выбор подразумевает поиск компромисса между (1) необходимостью создания в течение всего дыхательного цикла повышенного внутрилегочного давления, обеспечивающего поддержание альвеол в раскрытом состоянии, и (2) стремлением причинить при этом минимальный урон объему и распределению легочного кровотока. Увеличение пикового и среднего внутрилегочного давления способно оказать двойственное действие на сатурацию артериальной крови. С одной стороны, высокое давление надува позволяет ввести в жесткие легкие нужный дыхательный объем и тем самым избежать гиповентиляции. Повышенное давление, в том числе и во время выдоха (ПДКВ), требуется также для расправления множественных микро- и макроателектазов и поддержания жестких легких в раскрытом состоянии в течение всего дыхательного цикла. Достижение данной цели сопровождается уменьшением гиповентиляции, шунтирования и диффузионных расстройств. Это проявляется постепенным возрастанием SpO2 и дает возможность снизить FiOa, что при длительной ИВЛ имеет большое значение. В процессе объемной ИВЛ при расправлении ателектазов происходит также падение давления вдоха на манометре респиратора, поскольку дыхательный объем начинает распределяться в возросшем объеме легочной ткани. При вентиляции с ограниченным давлением вдоха (PCV) увеличению объема функционирующей легочной ткани и повышению растяжимости легких сопутствуют самопроизвольный прирост дыхательного объема и возникновение гипервентиляции. С другой стороны, высокое внутрилегочное давление способно вызывать компрессию капилляров в межальвеолярных перегородках, дополнительное увеличение легочного сосудистого сопротивления и уменьшение минутного объема кровообращения, что на дисплее пульсоксиметра отражается снижением амплитуды ФПГ и появлением волн, синхронных с ритмом респиратора. Поскольку сжатие капилляров высоким давлением возможно только в работающих альвеолах, кровоток, минуя их, направляется в пневмонические очаги, ателектазы и инфильтраты (рис. 1.17). Это приводит к усилению шунтирования и падению Sp02. Рис. 1.17. Шунтирование крови при очаговом поражении легких (вверху) и усиление шунтирования при ИВЛ с избыточным давлением вдоха(внизу) Комплексная оценка пульсоксиметрических показателей в динамике помогает ориентироваться в событиях, происходящих в пораженных легких под воздействием ИВЛ, и установить баланс между противоречивыми требованиями при выборе и последующей доработке режима вентиляции. В рассмотренной выше ситуации тяжелого поражения легких отказ от применения ПДКВ или, тем более, использование активного выдоха недопустимы, потому что при рестриктивной патологии такие действия приводят к ателектазированию, уменьшению ФОЕ и резкому ухудшению легочного газообмена. Наиболее выгодные условия для работы правого желудочка создаются при ИВЛ с инверсией отношения вдох: выдох, благодаря которой удается снизить ПДКВ и сократить дыхательный объем за счет более выгодного распределения внутрилегочного давления в течение дыхательного цикла. Повысить выброс правого желудочка, подавленный искусственной вентиляцией, помогают инфузии добутамина (добутрекса), усиливающего сократимость миокарда. Эти действия позволяют увеличить объем кровообращения, улучшить распределение легочного кровотока и уменьшить степень артериальной гипоксемии. Результаты коррекции отчетливо прослеживаются на трендах ФПГ и SpO2. Необходимо учитывать, что при глубокой гипоксемии и плохой перфузии периферии точность измерения SpO2 может существенно снизиться. В этих условиях данные пульсоксиметрии требуют периодического сопоставления с результатами лабораторного измерения газового состава артериальной крови. Резкие бессистемные колебания всех параметров пульсоксиметрии наблюдаются при нарушении адаптации пациента к режиму ИВЛ. Эти артефакты бывают обусловлены движением больного, волнами венозного давления при "сопротивлении" респиратору, нарушением процесса вентиляции и повышением потребности в кислороде. Причину легко определить при взгляде на пациента и по неправильной форме ФПГ. Ориентироваться на данные пульсоксиметрии в такие моменты нельзя. Причины внезапного падения SpO2 во время и в связи с ИВЛ: • разгерметизация системы "пациент-респиратор"; • развитие пневмоторакса; • смещение интубационной трубки в бронх; • нарушение подачи кислорода; • неисправность респиратора. Массивное кровотечение на фоне ИВЛ сопровождается значительно более выраженными изменениями на дисплее пульсоксиметра, чем при самостоятельном дыхании. Генез и характер этих изменений, включающих и гипоксемию, обсужден выше. Видимо, излишне напоминать о том, что принятие ответственных решений должно базироваться на достоверной информации, источником которой является пульсоксиметр, произведенный фирмой, имеющей надежную репутацию на рынке мониторов.
Пульсоксиметрия в анестезиологии
В начале 80-х годов, когда пульсоксиметрия еще только внедрялась в клиническую практику, некоторые страховые компании предусматривали специальные меры для поощрения анестезиологов, применявших пульсоксиметры в операционной, поскольку затраты на своевременное предупреждение осложнений анестезии оказывались значительно ниже, чем на их лечение. Анестезиологическое пособие всегда сопряжено с фармакологическим и инструментальным вмешательством в работу систем дыхания и кровообращения. Разнообразные нарушения в работе этих систем могут возникать и вследствие хирургического вмешательства, например при анестезии, кровопотере, манипуляциях в рефлексогенных зонах, изменении операционного положения больного, операциях на сердце, сосудах, легких, головном мозге. Грамотно поставленный мониторинг значительно повышает своевременность и эффективность распознавания, предупреждения и коррекции осложнений у таких больных. Благодаря высокой информативности, неинвазивности, простоте и экономичности в применении пульсоксиметрия отнесена к обязательным методам мониторинга при любой анестезии. Этот тезис, впервые приведенный в Гарвардском стандарте анестезии (1985 год), в настоящее время является общепризнанным. В анестезиологической практике представлены все варианты расстройств кровообращения и дыхания, рассмотренные в предыдущих разделах. Основные принципы пульсоксиметрической диагностики данных расстройств приведены выше и не нуждаются в дополнительных комментариях. Вместе с тем пульсоксиметрия позволяет решать некоторые проблемы, специфичные именно для анестезиологии. Пульсоксиметрия при общей анестезии. У большинства пациентов каждому этапу анестезиологического пособия соответствует собственная типичная динамика пульсоксиметрических показателей (рис. 1.18). Рис. 1.18. Характерные изменения ФПГ на различных этапах общей анестезии. В верхней части - фрагменты ФПГ, в нижней - тренд амплитуды ФПГ Период, непосредственно предшествующий анестезии, характеризуется психоэмоциональным стрессом, приводящим к активации симпатической системы и выбросу в кровь катехоламинов. Вот почему в этом периоде у многих больных наблюдаются периферический вазоспазм и тахикардия. Своим внешне спокойным поведением больной может ввести в заблуждение врача, но не пульсоксиметр. Перед началом наркоза пульсоксиметр обнаруживает снижение амплитуды ФПГ и увеличение ЧСС. При адекватной премедикации, включающей транквилизаторы и наркотические анальгетики, амплитуда ФПГ часто (но не всегда) нормализуется. Не следует забывать и о другой, вполне вероятной, причине снижения пульсовых волн - холодовой вазоконстрикции, которая имеет место в том случае, если температура в помещении некомфортная. У пациентов с хронической дыхательной недостаточностью или тяжелым поражением головного мозга использование указанных выше препаратов чревато угнетением дыхания и уменьшением SpO2. Вводный наркоз способствует исчезновению негативного эмоционального фона. Некоторые препараты, используемые для индукции, оказывают вазодилатирующее действие (тиопентал, дроперидол, летучие анестетики). Поэтому во время вводного наркоза происходит увеличение амплитуды ФПГ. Обычно при индукции производится преоксигенация, в процессе которой азот, содержащийся в легких, частично замещается кислородом, и Sp02 быстро поднимается до 100%., Ларингоскопия и интубация трахеи сопровождаются механическим раздражением мощных рефлексогенных зон и возбуждением симпатической системы, которое проявляется вазо-спазмом, артериальной гипертензией, тахикардией и, довольно часто, транзиторными нарушениями ритма сердца. В такие минуты внимание анестезиолога полностью сосредоточено на выполняемых действиях, но при просмотре трендов, хранящихся в памяти пульсоксиметра, нередко обнаруживается снижение амплитуды ФПГ и постепенное ее восстановление после завершения манипуляции. Рефлекторные реакции, возникающие при интубации трахеи, в большинстве случаев не имеют клинического значения, однако у больных с ИБС, гипертонической болезнью, аритмиями, глубокой сердечной недостаточностью, гормонально-активными опухолями, аневризмами мозговых сосудов их необходимо избегать, углубляя вводный наркоз или используя местную анестезию слизистых оболочек. Исходя из анализа трендов ФПГ, врач составляет представление об эффективности этих мер и совершенствует их. При затянувшейся интубации трахеи пульсоксиметр дает возможность контролировать допустимую продолжительность этой манипуляции по уровню SpO2, для чего нужно установить минимальное время обновления данных на дисплее монитора (режим "fast response"), чтобы сократить промежуток от момента возникновения гипоксемии до ее регистрации монитором. Кожный разрез зачастую выполняется до достижения стабильной глубины анестезии. Этот мощный болевой стимул приводит к выраженной периферической вазоконстрикции. Амплитуда ФПГ позволяет оценить адекватность обезболивания к непосредственному началу оперативного вмешательства. Любопытно, что снижение пульсовых волн, спровоцированное болью, на данном и последующих этапах может быть зарегистрировано даже в тех случаях, когда ЧСС и артериальное давление остаются стабильными. В настоящее время не вызывает сомнения тот факт, что боль, испытанная пациентом в ходе операции, усиливает болевой синдром в постоперационном периоде. Это положение легло в основу метода "предварительной анестезии" ("preemptive anesthesia") - инфильтрационной или регионарной блокады зоны кожного разреза, помогающей существенно уменьшить потребность в наркотических анальгетиках после операции. Наблюдение за амплитудой ФПГ служит доступным способом определения эффективности данной меры. Снижение пульсовой волны и появление тахикардии в процессе оперативного вмешательства может свидетельствовать о недостаточной глубине анестезии, развитии гиповолемии или гипервентиляции. Амплитуда ФПГ очень чувствительна к адекватности обезболивания: она резко снижается при возникновении боли и быстро возрастает после углубления анестезии. Надо помнить и о такой тривиальной причине уменьшения ФПГ, как холодовая вазоконстрикция. При длительном оперативном вмешательстве в условиях общей анестезии возникает гипотермия, поэтому амплитуда ФПГ во время операции постепенно уменьшается. Передозировка общих анестетиков сопровождается выраженной вазодилатацией и проявляется на дисплее монитора увеличением амплитуды ФПГ. Сходные признаки имеет и гиперкапния, обусловленная недостаточным объемом вентиляции или нарушением работы контура наркозного аппарата. У пациента, находящегося под наркозом, величина SpO2 зависит от четырех факторов: концентрации кислорода в газовой смеси, минутного объема вентиляции, адекватности ОЦК и правильности положения интубационной трубки. (Обсуждение всех четырех факторов содержится выше.) Применение надежного пульсоксиметра позволяет без риска развития гипоксемии назначать закись азота в более высоких концентрациях, чем те, которые устанавливаются ротаметрами по стандартным соотношениям N2O: О2*. * В этих случаях крайне желательно также применение оксиметра. В раннем послеоперационном периоде происходит восстановление самостоятельного дыхания, сознания и болевой чувствительности. На этом этапе пациент обычно неспособен к полноценному контакту с окружающими, но о появлении у него боли и неприятных ощущений можно судить по снижению амплитуды ФПГ. Для комфортного выхода из наркоза характерно наличие нормальной или незначительно сниженной амплитуды пульсовой волны. Вторая серьезная проблема, возникающая сразу после окончания анестезии,- артериальная гипоксемия. Она редко сопровождает регионарную анестезию, но очень часто наблюдается после масочных, и особенно - интубационных наркозов. Операции на органах грудной клетки и верхнего этажа брюшной полости приводят к более выраженной и длительной послеоперационной гипоксемии, чем вмешательства на нижнем этаже брюшной полости и на конечностях. Частота и степень десатурации напрямую зависят от дозы фентанила или концентрации фторотана, применявшихся при наркозе. К факторам риска также относятся пожилой возраст больного и наличие у него ожирения. В ближайшем посленаркозном периоде, длительность которого составляет около 20 мин, выраженная гипоксемия (Sp02 = 85-90 %) при дыхании атмосферным воздухом отмечается в среднем у 40-60 % пациентов, глубокая гипоксемия (SpO2 «85 %) - у 10-20 %, а в остальных случаях SpO2 редко превышает 94 %. Основные причины гипоксемии на этом этапе: (1) центральная депрессия дыхания, обусловленная действием наркотических препаратов и гипервентиляцией во время наркоза; (2) остаточная миорелаксация; (3) нарушения проходимости верхних дыхательных путей; (4) множественные микроателектазы, факт появления которых у больных во время наркоза доказан, хотя их этиология до сих пор остается неясной, Возникновение гипоксемии после окончания наркоза и при транспортировке пациента из операционной не является неожиданностью для анестезиологов. Эффективная мера, уменьшающая риск осложнений в ближайшем послеоперационном периоде,- ингаляция кислорода в концентрации 30-40 % у больных, принадлежащих к группе риска; а применение портативного пульсоксиметра во время транспортировки пациента вошло во многие стандарты безопасности. В раннем послеоперационном периоде (= 6 ч) в ряде случаев сохраняется необходимость в оксигенотерапии через маску, носовые канюли или назофарингеальный катетер. Снижение сатурации на данном этапе чаще всего обусловлено неполным восстановлением дыхания после наркоза и болевым синдромом, из-за которого пациент вынужден дышать поверхностно и сдерживать кашель, препятствуя тем самым раскрытию микроателектазов. Депрессия дыхания может быть вызвана наркотическими анальгетиками, назначаемыми после операции. Эти проблемы решаются посредством грамотного использования оксигенотерапии и сеансов дыхания в режиме ПДКВ, правильного выбора метода послеоперационной анальгезии и ранней активизации больного. В данной ситуации пульсоксиметрический скрининг позволяет выделить группы пациентов, которым действительно необходимы ингаляции кислорода, выявлять случаи внезапно развивающейся гипоксемии и в нужный момент прекращать ингаляцию кислорода. Считается, что оксигенотерапия в раннем послеоперационном периоде не показана больным, у которых при дыхании атмосферным воздухом в течение 20 мин SpO; не опускается ниже 92 %. Такой подход оправдан как для определения целесообразности оксигенотерапии, так и для решения вопроса об ее отмене. При наличии серьезной патологии органов дыхания и кровообращения прибегают к более жестким критериям. Доказано, что количество сэкономленного кислорода при таком подходе полностью окупает затраты, связанные с применением пульсоксиметров. Пульсоксиметрия при эпидуральной и спинальной анестезии. Регионарная анестезия как самостоятельный метод обезболивания или как компонент комбинированной анестезии является, по-видимому, самым радикальным методом антиноцицептивной защиты. Вместе с тем эпидуральная и спинальная анестезия сопровождаются специфическими изменениями в системах кровообращения и дыхания, которые влияют на все параметры пульсоксиметрии, Поэтому умение интерпретировать данные пульсоксиметрии позволяет получать важную информацию о состоянии пациента и течении анестезии. Рассмотрим, каким образом отражаются на дисплее пульсоксиметра типичные изменения кровообращения и дыхания, сопутствующие эпидуральной или спинальной анестезии. Конкретные физиологические механизмы влияния спиналь-ных методов обезболивания на дыхание и кровообращение немногочисленны, но весьма весомы: • частичная (регионарная) или полная блокада симпатической системы: – артериолодилатация в зоне блокады; – компенсаторное сужение артериол вне зоны блокады; – венодилатация, приводящая к относительной гиповолемии; – брадикардия, вызванная десимпатизацией сердца; • релаксация дыхательной мускулатуры; • угнетение дыхательного центра наркотическими анальгетиками, введенными субарахноидально; • острая ишемия дыхательного центра при критической декомпенсации гемодинамики. В каждом случае включение и степень проявления этих эффектов зависят от нескольких факторов, в частности от доз применяемых препаратов, уровня блокады, исходного состояния кровообращения, режима инфузионной терапии, положения пациента на операционном столе, сопутствующей патологии и пр. Сужение артериол вне зоны симпатической блокады, направленное на поддержание общего периферического сопротивления, проявляется снижением амплитуды ФПГ. Умеренная вазоконстрикция вне зоны блокады, приводящая к некоторому уменьшению амплитуды ФПГ,- нормальная компенсаторная реакция сердечно-сосудистой системы на внезапное увеличение просвета артериол в блокированных областях. Резкое снижение амплитуды волн ФПГ при эпидуральной/ спинальной анестезии служит признаком гиповолемии, недостаточного обезболивания или эмоционального стресса. Гипотония венозного русла, обусловленная его десимпатизаци-ей, приводит к развитию относительной гиповолемии, о которой свидетельствуют: (1) дыхательные волны на ФПГ и (2) дополнительное уменьшение амплитуды пульсаций. При невысоком уровне блока этим изменениям иногда сопутствует тахикардия, но при верхнегрудном блоке даже на фоне выраженной гиповолемии нередко наблюдается брадикардия. Серьезный аргумент в пользу наличия гиповолемии - снижение Sp02 при дыхании воздухом. Гипоксемия возникает из-за нарушения вентиляционно-перфузионных отношений в легких и исчезает на фоне ингаляции кислорода и/или активной инфузионной терапии и/или применения вазопрессоров. Пульсоксиметрические признаки гиповолемии становятся более выраженными при невосполненной кровопотере, гипогидратации, опускании ножного конца стола или кровати, искусственной вентиляции легких, а в акушерской практике - при компрессии нижней полой вены беременной маткой. Увеличение амплитуды ФПГ обычно бывает связано с артериолодилатацией, обусловленной симпатической блокадой. Данный симптом обнаруживается лишь в тех случаях, когда датчик пульсоксиметра установлен в зоне блокады'. Увеличение амплитуды ФПГ можно увидеть на дисплеях лишь тех пульсоксиметров, которые не производят автоматическое масштабирование сигнала или имеют специальный индикатор реальной амплитуды волн. При верхнем грудном блоке амплитуда ФПГ может оставаться нормальной даже при выраженной гиповолемии. Симпатическая иннервация сосудов верхних конечностей и кожного покрова головы исходит из сегментов Thi-s и не соответствует иннервации дерматомов. Это следует иметь в виду, если датчик пульсоксиметра расположен на пальце кисти (сенсорная иннервация C6-8) или на ухе (С2). При верхнем грудном блоке не исключено повышение волн ФПГ, несмотря на то что чувствительность и движения в руке, на которой зафиксирован датчик, сохранены. Блокада тонких немиелинизированных волокон симпатической системы наступает раньше и длится значительно дольше моторного и соматического сенсорного блока и может быть вызвана даже слабоконцентрированным раствором местного анестетика. Также полезно помнить, что граница зоны симпатической блокады в среднем на 2 сегмента выше границы сенсорного блока и на 4 сегмента выше границы моторного блока (одно из проявлений так называемого дифференциального блока). Брадикардия, обусловленная дисбалансом между отделами вегетативной системы - нарушением симпатической иннервации сердца (Th1-5) с преобладанием вагусного влияния,- относится к типичным проявлениям высокого грудного блока и эффективно купируется атропином или эфедрином. При спинальной анестезии пульсоксиметр позволяет своевременно обнаруживать быстро прогрессирующую брадикардию, которая является самым ранним предвестником опаснейшего осложнения метода - вазо-вагальной синкопы. Глубокой брадикардии и артериальной гипотонии при спинальных методах обезболивания регулярно сопутствует и заметное уменьшение SpO2, если больной дышит атмосферным воздухом. В этих случаях следует иметь в виду, что высокая периферическая вазоплегия (датчик попадает в зону симпатической блокады) в некоторых случаях обеспечивает нормальную амплитуду ФПГ даже при катастрофическом падении артериального давления. Существует несколько причин снижения SpO2 при эпидуральной или спинальной анестезии. Первая (и наиболее частая) - гиповолемия (см. выше). Другая возможная причина артериальной гипоксемии - гиповентиляция, которая иногда наблюдается при использовании седативных препаратов во время спинальной анестезии. Убедиться в том, что гипоксемия обусловлена исключительно гиповентиляцией, можно, попросив пациента, дышащего воздухом, сделать несколько энергичных вдохов. Через несколько секунд уровень SpO2 на некоторое время нормализуется. При гипоксемии, связанной с гиповолеми-ей, эффективность этого приема не столь высока. Введение в эпидуральное пространство или спинномозговой канал наркотических анальгетиков (морфина, фентанила и других агонистов) в отдельных случаях сопровождается угнетением дыхательного центра, которое может развиться как вскоре после инъекции, так и много часов спустя. В этих случаях пациенты даже при выраженной гиповентиляции чувствуют себя комфортно и не предъявляют жалоб на нехватку воздуха, но по явному снижению сатурации, а также появлению гиперемии кожных покровов (признак гиперкапнии) и брадипноэ можно догадаться о серьезных проблемах с дыханием. Первый из перечисленных признаков обычно оказывается самым ранним. Это не всегда предсказуемое, но потенциально опасное осложнение чаще отмечается при назначении повышенных доз наркотического анальгетика и купируется инфузией раствора налоксона. Длительный пульсоксиметрический мониторинг с правильно настроенной аларм-системой помогает своевременно обнаружить данное осложнение. Умеренная гипоксемия, вызванная неглубокой гиповентиляцией, легко уступает ингаляции кислорода через лицевую маску или носовые канюли. При выраженной гиповентиляции в операционной требуется вспомогательная вентиляция легких через маску, а в послеоперационном периоде - продолжительная инфузия раствора налоксона. Если в операционной у больного возникает центральная гиповентиляция, пульсоксиметрический мониторинг должен быть продолжен и в послеоперационном периоде. Гиповентиляция порой возникает также вследствие релаксации межреберных мышц и диафрагмы. Такая картина наблюдается при блокаде грудных и шейных сегментов концентрированными растворами местных анестетиков и часто сочетается с серьезными расстройствами кровообращения. Больные при этом проявляют беспокойство, а нередко и явный страх и активно жалуются на нехватку воздуха. В некоторых случаях для нормализации SpО2 бывает достаточно ограничиться ингаляцией кислорода через лицевую маску и устранением препятствий для экскурсий диафрагмы*. При неэффективности этих мер требуется аккуратная вспомогательная вентиляция через маску мешком наркозного аппарата. Глубокая гиповентиляция или апноэ, вызванные нарушением иннервации дыхательной мускулатуры, включая диафрагму (С3-5), и острой ишемией дыхательного центра, развиваются при одном из опаснейших и, к счастью, редких осложнений анестезии - тотальном спинальном блоке. Его клиническая картина так выразительна, что роль пульсоксиметрии сводится не столько к диагностике самого осложнения, сколько к контролю эффективности интенсивной терапии. * Таким препятствием обычно оказывается сам хирург, опирающийся на живот или грудь больного в процессе операции. Движения диафрагмы могут быть также ограничены зеркалами и прочими инструментами Использование пульсоксиметра при выполнении эпидуральной или спинальной блокады позволяет вовремя определить наличие всевозможных нежелательных отклонений от нормального течения анестезии. Данные мониторинга необходимо сопоставлять с клинической картиной и результатами других методов контроля. Каждый эпизод снижения Sp02 имеет свою причину и должен побуждать врача не только к коррекции самой гипоксемии (этого зачастую нетрудно достичь обычной ингаляцией кислорода), но также к выявлению и устранению вызвавших ее расстройств. Каждый клинический случай имеет свой набор наиболее вероятных причин артериальной гипоксемии; внимательная оценка состояния больного помогает обнаружить именно ту, которая привела к десатурации. Умение распознавать причину артериальной гипоксемии или изменения амплитуды пульсовой волны во многих случаях приносит большую пользу. Пульсоксиметрия - самый распространенный метод мониторинга, и уменьшение SpO2 нередко оказывается единственным ранним сигналом неблагополучия. Ориентируясь на показания пульсоксиметра, можно, к примеру, своевременно увеличить темп инфузионной терапии при эпидуральной анестезии, исправить положение интубационной трубки, удалить катетером накопившуюся мокроту, заподозрить развитие пневмо- или гидроторакса. Положительная динамика сатурации после ликвидации нарушения подтверждает истинность Вашего предположения. Умение находить связь между колебаниями показателей на дисплее пульсоксиметра и динамикой в состоянии пациента должно стать привычкой, которую, однако, нужно развивать. Незначительные интеллектуальные затраты на приобретение этого навыка окупаются очень быстро. Следует учесть, что пульсоксиметрия начинается не с подключения монитора к больному, а с грамотного выбора модели монитора. Надежность, способность улавливать сигнал даже при выраженных нарушениях периферического кровотока, удобное и четкое представление данных на дисплее, наличие алгоритмов коррекции артефактов, большой объем и хорошая организация памяти, несложная и интуитивно понятная система управления монитором - вот далеко не полный список требований к модели, которая в руках понимающего специалиста позволяет реализовать разнообразные возможности метода, которые были рассмотрены в данной главе.
Капнография
Технология метода
Если снять заднюю панель современного капнографа, взгляду откроется хитросплетение разноцветных проводов, соединяющих электронные платы между собой и с различными устройствами. Мы, конечно же, не собираемся описывать обстоятельно каждую деталь (ведь эта книга предназначена для врачей, а не для инженеров), а обсудим лишь главные принципы, лежащие в основе метода измерения концентрации углекислого газа, и те технические подробности, которые действительно необходимо знать, чтобы удачно выбрать модель монитора и правильно обращаться с ним. Ну и, наконец, для того, чтобы в тандеме "врач-монитор" интеллектуальное превосходство оставалось бы на стороне врача.
Договоримся о терминах
Прежде чем приступить к разбору технических аспектов метода, давайте остановимся на тех терминах, которыми мы будем постоянно пользоваться.
Капнометрия - измерение концентрации углекислого газа в газовой смеси (вдыхаемом или выдыхаемом газе, газонаркотической смеси, атмосферном воздухе).
Капнометр - прибор для измерения концентрации углекислого газа в газовой смеси.
Капнограф - прибор, отображающий на экране в виде графика результаты измерения концентрации углекислого газа.
Отдельного рассмотрения требует центральная фигура этой главы - углекислый газ,- поскольку во врачебной среде наблюдается путаница в терминах, его касающихся.
Исходное химическое название этого вещества, независимо от его агрегатного состояния,- диоксид углерода (или двуокись углерода). В случаях, когда речь идет о двуокиси углерода как компоненте газовой смеси, ее называют углекислым газом. Растворившись в воде, крови или любой другой жидкости, СО2 перестает быть газом и в таком состоянии может называться только двуокисью (диоксидом) углерода. Повсеместно распространенный не только в быту, но и в медицине термин "углекислота", которым нередко обозначают углекислый газ, не должен использоваться для обозначения двуокиси углерода, которая кислотой не является. Углекислота, точнее, угольная кислота (Н2СО3),- это продукт химической реакции между двуокисью углерода и водой. Она - отнюдь не летучее соединение, а потому выдыхать ее никак нельзя.
Из истории капнографии
Прообраз современных капнографов был изобретен в Германии во время Второй мировой войны и не имел никакого отношения к медицине. С помощью первого прибора немцы по выбросу углекислого газа осуществляли контроль за полетами реактивных снарядов ФАУ-2, направляемых на Лондон. После окончания войны патент на эту установку, в числе прочих, попал в США, где в начале 50-х годов анестезиолог Джеймс О. Элам и исследователь Макс Листон использовали его для создания первого медицинского быстродействующего инфракрасного капнографа, который можно было применять в операционной. Прибор оказался очень громоздким и неудобным: один только датчик, устанавливаемый на интубационной трубке, весил около 5 кг. Клиническое применение инфракрасной капнографии отложили до лучших времен, хотя необходимость в ней обострилась именно в 50-е годы, когда Данию и США охватила эпидемия полиомиелита и в длительной ИВЛ нуждались тысячи пациентов. Любопытно, что в конце 40-х годов физиолог клиники Мэйо Ричард В. Стоу также разработал инфракрасный капнометр; известность, однако, В. Стоу получил позднее - как изобретатель СО2-электрода, до сих пор использующегося в клинических газоанализаторах.
В отличие от пульсоксиметрии, свалившейся на врачей как снег на голову и являвшей собой не столь уж ценный, как сперва полагали, подарок от инженеров, капнография имела честь принадлежать к числу тех "избранных" методов, которого с нетерпением ждали. Поэтому, как только промышленность освоила выпуск надежных, миниатюрных и простых мониторов (а это произошло в 70-х годах), капнографы быстро получили широчайшее распространение в анестезиологии и интенсивной терапии. В 1992 году Всемирная федерация анестезиологических обществ включила в Стандарты безопасности рекомендацию об использовании капнографии при каждом интубационном наркозе, хотя в 1989 году в Стандарте безопасности анестезии, принятом в штате Нью-Йорк, капнография уже рассматривалась как обязательный метод мониторинга у всех интубированных больных.
По мере накопления и осмысления клинического опыта стало ясно, что со своей основной задачей - контролем вентиляции легких - капнография справляется не всегда. Вместе с тем, как это нередко случается, обнаружилось, что диагностических возможностей у метода гораздо больше, чем предполагалось вначале. Сегодня капнография успешно применяется для диагностики тромбоэмболии легочной артерии, оценки качества кровотока после реанимации и в ряде других ситуаций. Форма капнограммы также имеет самостоятельное диагностическое значение, и умение читать ее позволяет выявлять некоторые нарушения дыхания. Но прежде чем приступить к подробному обсуждению, давайте познакомимся с устройством и принципом действия капнографа
Принципы капнометрии
Концентрацию углекислого газа в газовой смеси определяют различными способами. Однако для целей клинического мониторинга пригодны лишь те из них, которые отвечают следующим требованиям: • обеспечивают длительное измерение с немедленным отображением текущего значения; • гарантируют достаточную для клиники точность измерения; • реализуются в надежных, компактных и нетрудоемких в обслуживании мониторах; • не нуждаются в частых калибровках; при этом сама процедура калибровки должна быть простой и недорого стоящей; • не представляют даже потенциальной опасности для пациентов и не дополняют вредными факторами (шум, электромагнитное излучение, инкубация инфекции и пр.) и без того нелегкую жизнь операционных и палат интенсивной терапии. В настоящее время медицинская промышленность выпускает капнографы, работа которых основана на использовании одного из четырех способов определения СО2: • масс-спектрометрии; • рамановской спектрометрии; • инфракрасного оптического анализа; • инфракрасного оптико-акустического анализа. В последнее десятилетие наиболее широкое распространение в мире получили инфракрасные капнографы, и в нашей стране риск встречи с монитором иного принципа действия крайне невысок. Ниже мы рассмотрим все перечисленные методы газового анализа, но более подробно осветим устройство и работу инфракрасных анализаторов. Масс- спектрометрия. Этот метод газового анализа применяется с 1950 года, однако активное внедрение масс-спектрометров в анестезиологии началось с 1970 года, после усовершенствования системы (рис. 2.1). Рис. 2.1. Устройство масс-спектрометра Масс- спектрометры -очень дорогие приборы, поэтому лечебные учреждения приобретают мультиплексные модели, в которых один анализатор попеременно измеряет состав газовых смесей, поступающих от нескольких (до 16-ти) больных, находящихся в десятках метров от прибора. Небольшая часть вдыхаемого и выдыхаемого газа специальной помпой постоянно доставляется от пациента по тонкой трубке-магистрали в вакуумную камеру прибора. Разреженный газ подвергается бомбардировке пучком электронов, превращающих молекулы газовой смеси в заряженные частицы - ионы. Газовые ионы фокусируются электромагнитным полем в пучок, разгоняются:и попадают в мощное постоянное магнитное поле, которое изменяет траекторию их полета. Отметим, что степень отклонения каждого иона зависит от его массы и заряда: тяжелые ионы отклоняются меньше, чем легкие. Таким образом смесь ионизированных газов разделяется на потоки, состоящие из отдельных компонентов газовой смеси. На пути каждого потока устанавливается счетчик ионов. Месторасположение каждого счетчика на коллекторе соответствует определенной величине соотношения масса: заряд иона. Не вдаваясь во множество несущественных для врача технических Проблем, запомним, что общее количество ионов, достигших коллектора, принимают за 100 %, а по количеству разрядов отдельных счетчиков вычисляют процентное соотношение компонентов исследуемой газовой смеси. Программное обеспечение современных моделей масс-спектрометров предполагает, что в состав газовой смеси входят азот, кислород, углекислый газ, закись азота, галотан, энфлюран и изофлюран. Сумма их концентраций должна равняться 100 %. Появление в дыхательной смеси какого-либо другого газа (гелия, ксенона, пропеллента аэрозоля и т. д.), для которого не предусмотрен отдельный счетчик, приводит к резкому искажению результатов измерения. Перечислим достоинства и недостатки масс-спектрометров. Достоинства: • высокая точность измерения; • определение всех компонентов газовой смеси одним методом и в одной пробе. Недостатки: • высокая цена (оборудование окупается, если к одному монитору подключено несколько рабочих мест); • необходимость в квалифицированном обслуживании; • поломка одного монитора приводит к остановке мониторинга у нескольких пациентов; • монитор потребляет много электроэнергии и производит много шума и тепла; • задержка в измерении и отображении данных иногда составляет от 5 до 15, а в отдельных случаях до 60 с, что связано с большой протяженностью газовых магистралей и разделением времени измерения между несколькими больными. Внедрение в медицинскую практику масс-спектрометров можно рассматривать как своего рода вынужденную попытку решить наболевшую проблему весьма сложным в техническом отношении способом, не дожидаясь появления более простых решений. По этой причине масс-спектрометры получили довольно ограниченное распространение. Например, в США к началу 90-х годов они имелись лишь в 300 госпиталях. Сегодня масс-спектрографами, отличающимися высочайшей точностью измерения, оснащены в основном научно-исследовательские центры. Современный уровень развития техники позволил создать и прикроватные масс-спектрометры, однако в нашей стране их практически нет. В медицине критических состояний повсеместное использование мониторинга газовых смесей стало возможным благодаря появлению более простых, дешевых и компактных мультигазовых мониторов; их сейчас выпускают десятки фирм. Мультиплексный принцип организации мониторинга в отделениях (один монитор одновременно обслуживает несколько пациентов) уступил место принципу центральных мониторных станций, когда каждый больной обеспечен отдельным прикроватным монитором, но данные от каждого монитора обрабатываются центральным компьютером, который осуществляет анализ, отображение и архивирование информации (PCMS - Personal Computer Monitor Station). Рамановская спектрометрия. В мониторах, работающих по этому принципу, исследуемая газовая смесь поступает в измерительную камеру, где облучается потоком света, источником которого служит аргоновый лазер. В результате молекулы газа переходят в возбужденное состояние, а затем, возвращаясь в исходное состояние, излучают свет более низкой энергии и большей длины волны. Это явление известно в физике как "рамановский сдвиг"*. Величина волнового сдвига специфична для каждого газа, а интенсивность вторичного излучения зависит от концентрации газа. Таким способом можно одновременно определить концентрацию всех компонентов газовой смеси, включая кислород и азот.
* По имени индийского физика Ч. В. Рамана, открывшего это явление и 1928 г К этому способу измерения прибегают очень редко. Принцип рамановской спектрометрии положен в основу действия монитора модели RASCAL П американской фирмы OHMEDA. Достоинство метода - возможность измерения концентраций любых компонентов газовой смеси. Главный недостаток монитора - недолговечность аргоновой лазерной трубки, которая требует периодической замены, что обходится весьма недешево. Инфракрасный оптический анализ основан на способности молекул газа поглощать инфракрасное излучение определенной длины волны (рис. 2.2). Этим свойством обладают не все газы, а лишь те, молекулы которых состоят из разных атомов. К ним относятся углекислый газ (СО2), закись азота (N20), пары воды (Н2О) и летучие анестетики (галотан, энфлюран, изофлюран, се-вофлюран и пр.). Симметричные молекулы кислорода, азота или гелия не поглощают инфракрасное (ИК) излучение, и их присутствие не влияет на результаты измерения. Рис. 2.2. Спектры поглощения некоторых газов Каждому газу присущ свой собственный спектр поглощения (рис. 2.2), поэтому, применяя излучения разных длин волн инфракрасного диапазона, можно определять содержание различных компонентов в одной пробе газа. Например, углекислый газ поглощает ИК-излучение с длиной волны 4,25 мкм, спектр поглощения N2O состоит из 4 составляющих, максимальная из которых имеет длину волны 3,86 мкм, а спектр поглощения летучих анестетиков приходится на 3,2-3,4 мкм. Величина концентрации водяного пара в газовой смеси не представляет существенного интереса, но наличие примеси воды может искажать результаты и нарушать работу прибора из-за конденсации. Вот почему перед попаданием в измерительную камеру анализируемый газ должен быть обезвожен. Вдыхаемый и выдыхаемый газ поступает в прозрачную измерительную камеру, на которую направлен исходящий из специального источника поток инфракрасного излучения. В диапазоне его частот присутствуют и частоты, специфичные для газов, концентрацию которых определяют. Между излучателем и измерительной камерой находятся вращающаяся крыльчатка-прерыватель потока и фильтр, пропускающий лучи строго определенной длины волны (для СО2, как указывалось выше, она составляет 4,25 мкм). После прохождения через измерительную камеру часть излучения поглощается, а оставшаяся часть падает на фотодетектор, определяющий интенсивность светового потока (рис. 2.3). Чем больше молекул СО2 или другого измеряемого газа содержится в камере, тем интенсивнее поглощается ИК-излучение и тем меньше ток, генерируемый фотодетектором. Нетрудно заметить сходство этой схемы с устройством датчика пульсоксиметра. Крыльчатка-прерыватель попеременно освещает ИК-лучами измерительную и эталонную камеры. Это дает возможность выявить, какая часть светового потока поглощается газовой смесью. По калибровочной зависимости между концентрацией газа и силой тока фотодетектора монитор рассчитывает парциальное давление углекислого газа или другого компонента газовой смеси. Частота вращения крыльчатки не должна быть кратной частоте переменного тока электросети (50-60 Гц) и обычно составляет 70-90 об/с. От частоты прерываний зависят плавность процесса измерения и скорость реакции системы на изменение концентрации газа. В многофункциональных мониторах, способных определять не только углекислый газ, но и газообразные анестетики, крыльчатку заменяют диском с вмонтированными в него фильтрами, каждый из которых пропускает излучение, поглощаемое определенным газом. Таким образом, на фотодетектор попеременно попадают ИК-лучи разных длин волн. Впрочем, это - лишь одно из нескольких технических решений, применяемых разными фирмами. Серьезная проблема в инфракрасной капнографии связана с чрезвычайной близостью спектров поглощения углекислого газа (4,25 мкм) и закиси азота (максимальное поглощение - на длине волны 3,86 мкм), причем одна из полос спектра поглощения N2O практически накладывается на ту полосу поглощения СО2, с помощью которой осуществляется измерение (рис. 2.2). Поэтому в присутствии закиси азота капнограф дает завышенные результаты измерения СО2; ошибка оказывается тем значительней, чем больше концентрация N2O в газовой смеси. Артефакты в измерении CO2 во время наркоза закисью азота иногда настолько существенны, что дело может закончиться необоснованной коррекцией режима вентиляции. Рис 2.2. Устройство инфракрасного С02-анализатора В мониторах, измеряющих концентрации СО2 и N20 по отдельности, имеется специальный алгоритм для исправления такой ошибки. Более простые модели либо не обращают внимания на эту проблему, либо просят указать, используется закись азота или нет. При получении подтверждения они включают элементарный алгоритм коррекции, который учитывает только сам факт применения закиси азота, но не ее концентрацию. Точность коррекции в этом случае невысока, но для клинических целей она достаточна. Если Вы забыли отключить алгоритм, он будет продолжать работать и после окончания анестезии, искажая результат. В любом случае документация, прилагаемая к монитору, содержит сведения о способе решения данной проблемы. Инфракрасный фотоакустический анализ. На этом принципе работают, пожалуй, только мониторы датской фирмы BRUEL amp; KJAER, например модель В amp; К 1304 - мультигазовый монитор с пульсоксиметрическим блоком. Измерительные блоки BRUEL amp; KJAER установлены также и в мониторе MERLIN фирмы HEWLETT PACKARD. Суть принципа заключается в том, что переход молекул газа в возбужденное состояние под воздействием инфракрасных волн сопровождается появлением звука, улавливаемого микрофоном. На диске-прерывателе находятся фильтры, попеременно пропускающие ИК-лучи с длинами волн, соответствующими линиям спектров поглощения исследуемых газов. Амплитуда звука определяется концентрацией газа. Встроенная программа анализирует фонограмму и выделяет из нее сигналы, соответствующие каждому компоненту газовой смеси. Метод отличается высокой точностью и стабильностью, а приборы, функционирующие на этом принципе, имеют хорошую репутацию.
Способы представления концентрации газа
В некоторых моделях мониторов предусмотрена возможность выбора единиц измерения содержания СО2 в газовой смеси (кПа, мм рт. ст., %). Между способами отображения информации есть не формальное, а весьма существенное различие.
Относительная концентрация газа измеряется в объемных.процентах (%). Так, концентрация С02, равная 5 %, означает, что в 100 мл газовой смеси содержится 5 мл углекислого газа.
Относительная концентрация, выраженная десятичной дробью, называется "фракционной концентрацией", или "фракцией газа в газовой смеси". Например, фракция кислорода, равная 0,21,- это то же, что концентрация кислорода, равная 21 %.
Относительная концентрация - самый традиционный, но не самый удачный способ отображения содержания газа в газовой смеси. Дело в том, что при изменении атмосферного давления газ становится либо более плотным, либо более разреженным, и хотя процентные соотношения компонентов газовой смеси при этом остаются прежними, количество молекул газа в каждом проценте изменяется, а соответственно, изменяется и эффективность альвеолярной вентиляции. Кроме того, выражение концентрации в процентах оказывается крайне неудобным, когда требуется сравнить содержание С02 в выдыхаемом газе с напряжением СО2 в крови. И наконец, хеморецепторы организма не понимают, что такое относительная концентрация, и упрямо ориентируются на концентрацию абсолютную.
В физиологии дыхания объемная концентрация газа обозначается знаком F, за которым следуют подстрочный индекс, обозначающий газовую смесь (I - вдыхаемый газ, Е - выдыхаемый, А - альвеолярный, ЕТ - конечная часть выдыхаемого газа и пр.), и формула самого газа.
Например, FiCO2* - это процентное содержание углекислого газа во вдыхаемом газе; FiETC02 читается как "процентная концентрация углекислого газа в конечной порции выдыхаемого газа", a FiO2 - это фракция кислорода во вдыхаемом газе.
* В соответствии со стандартами физиологии, формула газа должна обозначаться в виде подстрочного индекса, но на практике это правило оказалось настолько неудобным, что в последние годы его не выполняют даже профессиональные журналы.
Процентный состав газовой смеси определяют с помощью масс-спектрометров.
Парциальное давление газа в газовой смеси (от лат. pars - часть) измеряется в миллиметрах ртутного столба (мм рт. ст.) или в килопаскалях (кПа), на которые уже не первое десятилетие лениво пытается перейти весь мир.
Парциальное давление газа - это та часть общего барометрического давления, которая обеспечивается молекулами данного компонента газовой смеси.
На каждый газ в смеси приходится часть барометрического давления, соответствующая объемной концентрации этого газа. Поэтому сумма парциальных давлений всех компонентов газовой смеси равна барометрическому давлению (закон Дальтона),
В физиологии дыхания парциальное давление обозначается символом Р (от англ. pressure - давление), за которым следуют индекс газовой смеси и формула самого газа.
Так, РetСОа - это парциальное давление углекислого газа в конечной части выдыхаемого газа, а РaС02 - парциальное давление СО2 в альвеолярном газе.
Например, если вдыхаемый газ содержит 30 % кислорода, 68 % закиси азота и 2 % фторотана (галотана), а атмосферное давление равно 760 мм рт. ст., то
Pi02 = (760 X 30 %) - 228 мм рт. ст.
Р1N20 = (760Х68%) ° 516,8 мм рт. ст.
PiHAL = (760X 2%)
=15,2 мм рт. ст.
Итого: 100 % = 760 мм рт. ст.
Зная величину атмосферного давления и парциального давления газа, легко вычислить его процентную концентрацию:
Относительная концентрация газа (%)=
(парциальное давление газа/барометрическое давление) х 100%
Парциальное давление - это один из показателей абсолютной концентрации, то есть количества молекул газа в единице объема газовой смеси. При этом концентрация газа выражается через давление, которое обеспечивают его молекулы. Чем больше молекул газа в единице объема, тем выше парциальное давление этого газа.
При колебаниях атмосферного давления соответственно изменяются и парциальные давления газов, отражая изменения их абсолютных концентраций, хотя процентные соотношения компонентов смеси остаются прежними.
Если в рассмотренном нами примере атмосферное давление снижается с 760 до 730 мм рт. ст., то парциальные давления газов также уменьшатся:
P102 =(730Х30%) = 219 мм рт. ст. Р1N20 х (730Х68%) = 496,4 мм рт. ст.
P1HAL - (730Х2%) = 14,6ммрт.ст.
Итого: 100% = 730 мм рт. ст.
Исчисление концентрации газа в единицах давления удобно тем, что предоставляет возможность сравнивать парциальное давление газа в газовой смеси (например, в альвеолярном или вдыхаемом газе) с напряжением этого газа в крови или в тканях и тем самым определять градиент давлений, от которого зависят направление и скорость газообмена в легких и в тканях.
Инфракрасные капнографы измеряют абсолютные концентрации углекислого газа и летучих анестетиков и выражают их в мм рт. ст. или в кПа. Процентная концентрация газа, высвечиваемая на дисплее, всегда является расчетной величиной, для получения которой программа монитора оперирует данными встроенных барометра и термометра.
При использовании данных капнографии следует иметь в виду еще одно обстоятельство. На величину реального парциального давления углекислого газа влияют пары воды, которыми насыщен альвеолярный газ. Парциальное давление воды при 37 °С составляет 47 мм рт. ст., а на долю остальных компонентов альвеолярного газа приходится 760-47 =713 мм рт. ст. Поэтому парциальному давлению С02 в альвеолах, равному 40 мм рт. ст., соответствует концентрация этого газа, составляющая
FaCO2 = 40/713 х 100 = 5,6 %.
Перед поступлением в измерительную камеру капнографа проба газа искусственно обезвоживается. При исчезновении любого из компонентов газовой смеси относительные концентрации всех других повышаются. В связи с тем что капнографы калибруются сухими газами, поправка, связанная с изменением влажности, не вносится, и программное обеспечение капнографа производит пересчет парциального давления в процентную концентрацию, исходя из условий измерения, а не из условий альвеолярной среды. Например, если измеренное парциальное давление С02 равно 35 мм рт. ст., то при атмосферном давлении 760 мм рт. ст. рассчитанная капнографом относительная концентрация углекислого газа составит
FetСО2 = 35/760 х 100 = 4,6 %.
Несоответствие между измеренной и реальной величинами РetС02 равно нескольким мм рт. ст. и в клинической практике обычно не берется во внимание.
В капнографах, имеющих встроенный барометр, поправка на колебания атмосферного давления производится автоматически.
Системы газоанализаторов
Все модели капнографов (как, впрочем, и других газоанализаторов) различаются не только по принципу, лежащему в основе измерения, но и по способам доставки газа в измерительную камеру. Таких способов три: • капнометрия вне дыхательного потока с непрерывным отбором пробы газа (sidestream analysis); • капнометрия в дыхательном потоке (mainstream analysis); • компромиссный вариант. Капнометрия вне дыхательного потока (sidestream analysis) получила наиболее широкое распространение. Суть способа проста и заключается в следующем: из потока вдыхаемого и выдыхаемого газа (например, из интубационной трубки или наркозной маски) небольшая его часть непрерывно откачивается по тонкой пластиковой трубке и подается в измерительную камеру, расположенную внутри монитора (рис. 2.4). После выполнения анализа газ сбрасывается в атмосферу. Если мониторинг применяется во время анестезии, проводимой малопоточным методом (по закрытому контуру), то газ из капнографа возвращается в контур подругой трубке-магистрали. В этом случае перед возвратом в наркозный аппарат газ должен пройти через бактериальный фильтр.
Рис. 2.4. Капнометрия вне дыхательного потока
Капнографы, работающие по этому принципу, имеют систему обезвоживания газовой смеси, встроенную газовую помпу и снабжены одноразовыми комплектами тонких газовых магистралей со специальными адаптерами для подключения к дыхательному контуру. Газовая помпа обеспечивает всасывание анализируемой пробы газа с постоянной (обычно 150-200 мл/мин) скоростью. При более низкой скорости всасывания точность измерения концентрации и отображения капнограммы снижаются. От скорости всасывания зависит скорость поступления газа в измерительную камеру, то есть задержка измерения. Поломка помпы - одна из самых частых причин отказа монитора. Выбирая модель, уточните средний срок службы газовой помпы (так называемую наработку на отказ) и стоимость ее замены. Например, из документации монитора RGM фирмы OHMEDA следует, что средние эксплуатационные расходы, связанные с заменой помпы по истечении срока гарантии, составят 204 доллара в год. Помпы, которыми снабжаются мониторы фирмы DATEX, не нуждаются в замене по меньшей мере 5 ле*. Газовая помпа выходит из строя особенно быстро, если монитор часто и подолгу оставляют включенным без необходимости (в промежутках между наркозами или после полной стабилизации дыхания пациента). В комплексных мониторах, как правило, не предусмотрено раздельное включение блоков, поэтому в тех случаях, когда такой монитор применяется только для пульсоксиметрии, помпа газоанализатора работает вхолостую и износ ее ускоряется. Газовая магистраль - это тонкая гибкая трубка из прозрачного пластика. Ее длина и внутренний диаметр определяются фирмой-изготовителем и обеспечивают заданную скорость доставки газа в анализатор. Переполнение магистрали конденсатом может приводить к искажению формы капнограммы и нарушению процесса измерения. Адаптер (пробоотборник) имеет боковой порт для подключения магистрали и выполняется в разных вариантах: это может быть прямой или угловой патрубок, вставляемый между интубационной трубкой (маской, трахеостомической канюлей) и тройником контура наркозного аппарата или респиратора; есть также адаптеры со специальными защитными устройствами, предотвращающими попадание мокроты в магистраль. Универсальный адаптер D-lite (DATEX) позволяет, помимо забора газа, измерять давление в контуре и определять некоторые параметры механики дыхания. Для педиатрических пациентов существуют адаптеры, позволяющие вводить катетер-пробоотборник до уровня бифуркации трахеи, что повышает точность измерения газового состава у детей до 12 лет. У неинтубированных больных применяются адаптеры в форме носовых канюль. Крупные фирмы предоставляют большой выбор адаптеров для самых разных ситуаций. При подсоединении адаптера необходимо следить, чтобы магистраль отходила от него вверх,- это предотвращает затекание в нее конденсата. Система обезвоживания газа - пожалуй, самое уязвимое место в конструкции инфракрасного капнографа. От нормального ее функционирования полностью зависит работа монитора. Расходы на обслуживание данной системы, при неудачном выборе модели, могут за несколько лет превысить стоимость самого монитора. Как упоминалось выше, обезвоживание газовой смеси требуется для того, чтобы не допустить конденсации воды внутри измерительной камеры и повысить точность измерения концентрации СО2. Самый распространенный способ обезвоживания газа - пропускание его через специальный фильтр, помещенный в кассету-водоотделитель (картридж). Вода, извлеченная из газовой смеси, стекает в прозрачный накопительный резервуар, который по мере заполнения необходимо опорожнять. Поэтому вся система обезвоживания находится снаружи монитора, чаще - на его передней панели, и доступна для обзора и обслуживания. В некоторых моделях капнографов при переполнении водосборника происходит заброс жидкости в измерительную камеру, что выводит анализатор из строя. Картриджи, будучи одноразовыми, регенерации не подлежат. К замене картриджей приходится прибегать довольно часто. Так, в модели OXICAP (OHMEDA) картридж при регулярной эксплуатации монитора меняют в среднем один раз в неделю, что.выливается в 520 долларов в год. В некоторых моделях капнографов для каждого пациента предусмотрен отдельный фильтр (например, картридж Watercheck фирмы CRITICARE). Накопление влаги и отказ фильтра происходят особенно быстро при высоком содержании воды во вдыхаемом газе (например; когда больному проводится ИВЛ качественно увлажненной газовой смесью и особенно когда в шланг вдоха респиратора включен аэрозольный ингалятор). В настоящее время самой эффективной и экономичной системой удаления паров воды из газа является водоуловитель D-fend фирмы DATEX, снабженный гидрофобной мембраной, пропускающей газ и задерживающей воду и микроорганизмы. Средний срок его службы составляет около двух месяцев, а на замену отработавших элементов тратится 96 долларов в год. Конденсат, стекающий в резервуар, нередко бывает инфицирован, а сам резервуар выступает в роли инкубатора микроорганизмов. Поэтому при опорожнении водосборника необходимо пользоваться резиновыми перчатками и соблюдать прочие меры предосторожности, указанные в документации. Многие фирмы применяют для извлечения влаги из газа капиллярные трубки, выполненные из полимера нафиона (nafion). Этот чрезвычайно дорогой материал выпускается в небольшом количестве единственным заводом, который принадлежит компании Perma Pure Products Inc. Нафион обладает уникальным свойством избирательно пропускать молекулы воды, оставаясь непроницаемым для остальных газов. При прохождении газовой смеси по нафионовой трубке молекулы воды покидают ее просвет, уходя в более сухой окружающий атмосферный воздух. В результате газ на выходе из трубки имеет ту же влажность, что атмосфера, что вполне приемлемо для нормальной работы прибора. Капнографы с такой системой обезвоживания газа легко узнать по отсутствию на передней панели фильтра с влагосборником. Срок работы нафионовой трубки больше, чем таковой у фильтра, однако периодическая замена данного элемента необходима, и стоит это недешево. Время реакции системы на внезапное изменение концентрации С02 (response time) складывается из двух составляющих: 1. Время доставки газовой смеси из дыхательных путей в измерительную камеру (delay time); у систем sidestream оно достигает 1,5 с. Время доставки зависит от скорости откачки газа, а также от длины магистрали. Оно уменьшается при укорочении магистрали. 2. Скорость измерения (rise time) - определяется как период от момента поступления порции газа в измерительнуюкамеру до момента подъема сигнала фотодетектора от нуля До 90 % истинной величины. Скорость измерения зависит от марки измерительной системы и обычно составляет 0,35-0,55 с. В целом быстродействие инфракрасных капнографов с непрерывным отбором пробы газа соответствует большинству клинических целей - определение частоты дыхания, своевременное выявление гипо- или гипервентиляции, апноэ, разгерметизации системы и пр. Резкое укорочение времени реакции системы требуется лишь в особых случаях, когда необходима синхронизация капнограммы и спирограммы, например для измерения анатомического мертвого пространства или расчета темпа продукции СО2. Калибровка капнографа осуществляется с целью проверки соответствия силы тока фотодетектора концентрации углекислого газа. Обычно полная калибровка монитора выполняется по двум точкам. Процедура установки нуля производится по атмосферному воздуху, а потому является бесплатной. В некоторых мониторах предусмотрена калибровка по воздуху автоматически при каждом включении. У таких моделей присоединять адаптер к интубационной трубке следует только после сигнала о готовности монитора к работе. Вторую точку прямой находят с помощью специальной калибровочной газовой смеси, содержащей СО2 и другие компоненты в известных концентрациях. Каждая фирма-производитель мониторов выпускает баллончики со сжатой калибровочной газовой смесью, которая помимо С02 может также включать N02 O2 и летучие анестетики. К баллонам прилагаются специальные устройства для подачи смеси в монитор и инструкция. Капнографов, работающих по принципу sidestream и не нуждающихся в калибровках, пока еще не создано, так что отсутствие калибровочных баллонов в комплекте поставки прибора означает лишь одно: их забыли заказать при составлении контракта. В связи с тем что капнограф нередко требует частой калибровки, фирмы стараются до предела упростить эту манипуляцию. Некоторые модели (в частности, OXICAP [OHMEDA]) сами управляют процессом калибровки, выводя на экран соответствующие команды для врача. Периодичность калибровок газовой смесью из баллонов неодинакова: один раз в две недели (OHMEDA), ежемесячно (В amp;К, MARQUETTE) или два раза в год (DATEX). Соответственно различаются и финансовые затраты на калибровочный газ, составляя от 10 до 100 долларов в год на один монитор. Из сказанного выше ясно, насколько серьезен вопрос покупки монитора. Последствия недостаточно продуманного выбора фирмы-поставщика или неосведомленности о предстоящих затратах на расходные материалы самые плачевные: отработав некоторое время, дорогостоящий и нужный прибор ляжет мертвым грузом на больничном складе в ожидании списания. Стремительное развитие мониторной техники привело к тому, что темп морального старения модели способен превышать скорость ее физического износа. Помните, что мониторы оправдывают расходы на их приобретение лишь при активном использовании. Достоинства системы: • возможность применения легких и дешевых одноразовых адаптеров для присоединения к дыхательным путям; • защищенность всех сложных, хрупких и дорогостоящих частей измерительной системы, находящихся внутри корпуса прибора; • наличие адаптеров для самых разных клинических ситуаций; • возможность мониторинга у неинтубированных больных; • возможность одновременного определения нескольких газов в одной пробе. Недостатки системы: • необходимость в специальном устройстве для удаления паров воды из газовой смеси; • наличие газовой помпы - самой ненадежной части системы; • повышенное время реакции измерительной системы (если это имеет значение); • затраты на приобретение расходных материалов (адаптеров, магистралей, фильтров, калибровочного газа). Капнометрия в дыхательном потоке (mainstream analysis) распространена меньше, чем предыдущий метод. Адаптер в этой системе представляет собой устанавливаемую между интубационной трубкой и тройником контура кювету, через которую на проток проходит весь вдыхаемый и выдыхаемый газ (рис. 2.5). В ней имеются два сапфировых окошка, прозрачные для ИК-лучей. Адаптеры моделей mainstream бывают одно- или многоразовыми и стоят значительно дороже, чем таковые у капнографов sidestream. На адаптер снаружи надевается съемный датчик, в который вмонтированы источник монохроматического ИК-излучения и вся измерительная система. Конденсации паров воды на сапфировых окошках препятствует подогрев адаптера. Вес датчика может составлять от 10 до 60 г, а цена этого миниатюрного устройства может достигать 1500 долларов. После включения монитора требуется некоторое время для разогрева датчика. Задержка с началом мониторинга невелика и обычно находится в пределах от 20 с до 3 мин. Некоторые капнографы этого типа не нуждаются в периодических калибровках, но требуют регулярного (по крайней мере один раз в год) метрологического контроля датчика.  Представители данного класса мониторов - CAPNOGARD, CО2SMO (NOVAMETRIX), CAPNOCHECK (BCI), PROPAQ М106 (PROTOCOL SYSTEMS), ULTRA CAP (NELLCOR-PB и некоторые другие. Достоинства системы: • повышенное быстродействие (время реакции 30-60 мс); • отсутствие необходимости в обезвоживании газовой смеси; • оптимальна при анестезии по закрытому контуру. Недостатки системы: • увеличенный риск смещения или перегиба интубационной рубки из-за повышенного веса устанавливаемых на ней деталей; • повышенный риск поломки самой дорогой части монитора - датчика; • невозможность определения иных газов, кроме СО2; • невозможность использования разнообразных адаптеров; • высокая стоимость расходных материалов (адаптера, датчика). Компромиссный вариант системы предложен фирмой NELL-COR и реализован в модели N 1000. Измерительная система капнографа вынесена за пределы корпуса монитора в отдельный небольшой блок вблизи пациента. По сути, это вариант системы sidestream с укороченной магистралью. Достоинства системы: • сохранение многих преимуществ системы sidestream (использование разнообразных легких и дешевых адаптеров, мультигазовый мониторинг, надежная защита измерительной системы); • увеличение быстродействия системы за счет резкого укорочения газовой магистрали; • уменьшение скорости откачки пробы газа в измерительную камеру до 50 мл/мин без потери качества измерения. Недостаток системы: • наличие дополнительного блока и возможное появление неудобств, связанных с его размещением на самой дефицитной и загроможденной территории в операционной или в палате интенсивной терапии - в непосредственной близости от пациента. И наконец, некоторые фирмы предоставляют врачам возможность самостоятельно решать, какой из вышеперечисленных систем пользоваться. Например, в мониторе Capnocheck Dual Stream (фирма BCI, США) предусмотрена возможность применения как одной, так и другой технологии.
Рабочие характеристики капнографа
Сегодня медицинские капнографы выпускаются десятками различных фирм. Нередко одна фирма предлагает несколько моделей мониторов, каждая из которых имеет свои плюсы и минусы. Мы намеренно не приводим здесь сравнительную характеристику даже самых известных современных систем: при нынешних темпах развития и совершенствования мониторной техники такая информация очень быстро устаревает. Достаточно знать общие принципы оценки основных рабочих характеристик капнографов.
Необходимая точность измерения концентрации СО2 обеспечивается любым из четырех методов анализа; важен не сам метод, а то, насколько качественно он реализован. Например, истинность показаний инфракрасного капнографа зависит от того, есть ли в нем алгоритм коррекции погрешностей, обусловленных колебаниями температуры, атмосферного давления и концентрации закиси азота.
Наиболее высокой точностью отличаются масс-спектрометры, однако прежде чем остановить на них свой выбор, подумайте, не слишком ли дорого Вы платите за дополнительный знак после запятой, который, как правило, не имеет никакой диагностической ценности.
Выведение на дисплей капнограммы - один из главнейших плюсов модели, резко увеличивающий диагностические возможности метода. Отсутствие этой функции существенно удешевляет монитор, но оправдано лишь у портативных транспортных моделей.
Удобство представления данных мониторинга на дисплее весьма значимо для восприятия информации. На дисплеях моделей некоторых фирм, не уделяющих этому вопросу должного внимания, она порой демонстрируется в виде трудно читаемой смеси графиков, трендов, цифр, индексов и сообщений. При покупке модели полюбопытствуйте, возможен ли выбор скорости движения кривой по экрану, ибо переключение между режимами дисплея позволяет, в одних случаях, рассматривать форму каждой дыхательной волны, а в других - оценивать колебания ритма и иных характеристик дыхания.
Наличие и объем памяти - важнейшая характеристика монитора, позволяющая проводить ретроспективный анализ данных. Играет роль и способ представления трендов на дисплее - возможность выбора шкалы времени, доступность цифровых показателей, относящихся к любому моменту процесса мониторинга. В одних моделях данные хранятся в памяти монитора лишь до выключения прибора из сети, а в других, имеющих аккумулятор,- неопределенно долго. Некоторые модели способны сохранять в памяти протоколы мониторинга нескольких больных. (Эти вопросы детально раскрыты в последней главе.)
Встроенный аккумулятор утяжеляет прибор, увеличивает его габариты и к тому же стоит больших денег. К автономному питанию прибегают при транспортировке пациентов в больнице и за ее пределами, в медицине катастроф, а также в лечебных учреждениях, где часто возникают перебои в электроснабжении. И если первое предназначение аккумулятора для российского уха звучит не совсем привычно, то второе и третье недоумения вызывать, похоже, не должно. Необходимо обращать внимание на длительность работы монитора при питании от аккумулятора, а также на способ подзарядки аккумулятора - ручной (что связано с дополнительными хлопотами) или автоматический - при очередном подключении к электросети.
Надежность и долговечность модели гарантируют лишь крупные фирмы с солидной репутацией в данной области. Но даже в этом случае, перед тем как сделать окончательный выбор, стоит.поинтересоваться мнением представителей фирм-конкурентов: они с готовностью поведают Вам о приглянувшейся модели все то, что фирма-производитель старается не подчеркивать. Другой надежный прием - посоветоваться с коллегами, работающими с такими мониторами в других больницах. Вы, в частности, узнаете, что если вовремя не слить конденсат из водоуловителя заинтересовавшей вас модели, то жидкость бесшумно проникнет в анализатор и прибор выйдет из строя. У другого монитора помпа ломается не позже чем через три месяца со дня его доставки. Третья модель калибруется только специалистами завода, который находится по другую сторону Атлантики. Словом, сто раз услышать иногда оказывается полезнее, чем один раз увидеть, особенно после оплаты банковского счета.
Затраты на поддержание монитора в рабочем состоянии столь же неизбежны и регулярны, как покупка бензина для автомобиля, а посему их обязательно нужно учитывать при выборе модели. Как правило, они сводятся к приобретению расходных материалов - калибровочного таза, фильтров и адаптеров с магистралями. Решающее значение имеют периодичность замены элементов и их цена: из произведения этих факторов складываются эксплуатационные расходы, объем которых в особо неудачных случаях за 2-3 года перекрывает стоимость самого монитора. Большую, если не определяющую роль имеет и доступность сервисной поддержки. Нередко покупатели дорогих мониторов, "связавшись" с посредниками-однодневками, вскоре остаются один на один с массой проблем. Специфика российского рынка вынуждает подходить к выбору фирм-поставщиков с предельной осторожностью и отдавать предпочтение тем из них, у кого широко развита и стабильно работает сеть региональных представительств. Впрочем, эти соображения относятся к поиску и приобретению не только капнографов.
Физиологические основы капнографии
Вряд ли необходимо доказывать, как важен контроль вентиляции легких во время анестезии, при ИВЛ или у пациента с нестабильным дыханием. Пожалуй, самый распространенный способ такого контроля - визуальное наблюдение за дыхательными движениями больного и интуитивная оценка качества вентиляции. Вторым доступным, простым, а потому широко применяемым методом является спирометрия, проводимая в мониторном режиме; она позволяет следить за частотой дыхания, дыхательным объемом и их произведением - минутным объемом вентиляции (самостоятельной или аппаратной). При всей несомненной информативности вышеперечисленных параметров такой
мониторинг оставляет врача без ответа на главный вопрос: насколько объем вентиляции легких соответствует текущим потребностям конкретного больного? В элементарных случаях сравнивают получаемые данные с номограммами или таблицами нормативов. Но о каких нормативах может идти речь у больных с РДС, массивной кровопотерей, септическим шоком, тромбоэмболией легочной артерии и прочими типичными для нашей специальности диагнозами?
Своим быстрым повсеместным внедрением капнография обязана именно этой проблеме. Мониторный контроль концентрации СО2 в выдыхаемом газе казался очевидным решением задачи. Но, как нередко случается, вскоре выявилось, что в некоторых случаях вынести заключение о достаточности объема вентиляции, полагаясь на данные капнографии, нельзя. Вместе с тем обнаружилось, что диагностические возможности метода выходят далеко за рамки его первоначального предназначения.
Проблема адекватности вентиляции легких
У большинства пациентов, нуждающихся в помощи врача-анестезиолога и интенсивиста, требуемый объем вентиляции определяется не только их ростом и весом, но также:
o интенсивностью метаболизма, который по отношению к объему вентиляции выступает в роли "заказчика", однако при этом сам зависит от множества различных факторов и подвержен значительным колебаниям;
o эффективностью, с которой легкие способны включать в газообмен поступающий в них газ и которая резко снижается при увеличении мертвого пространства или при дыхании малыми o дыхательными объемами;
o различными "недыхательными" проблемами, которые организм пытается решать за счет дыхания (например, компенсировать метаболический ацидоз гипервентиляцией);
o измененной настройкой параметров газообмена у больных с хронической дыхательной недостаточностью или у жителей высокогорных районов.
Если судить о достаточности вентиляции по показателям спирограммы, приведенным к росту и весу пациентов, нетрудно пропустить гиповентиляцию у пациента с разлитым перитонитом, ожогами, политравмой или передозировать объем вентиляции больному с отравлением барбитуратами или при гипотермии.
Приняв за конечную цель вентиляции поддержание нормального газового состава крови, оттекающей от легких, вы должны в каждом случае судить о качестве вентиляции по содержанию дыхательных газов в артериальной крови. Оговорим сразу, что РаОз на роль индикатора гипо- и, тем более, гипервентиляции легких не годится: в списке факторов, влияющих на его величину, с объемом легочной вентиляции соседствуют такие мощные механизмы, как шунтирование крови, нарушения альвеолокапиллярной диффузии и внутрилегочного распределения вентиляции и кро-вотока. Поэтому нередки случаи, когда выраженная гипоксемия наблюдается и при гипервентиляции и когда простым повышением содержания кислорода во вдыхаемом газе можно нормализовать РдОа у больного с резко сниженным объемом дыхания.
И наоборот, углекислый газ прекрасно растворяется в воде, благодаря чему легко проходит даже через утолщенную альвеолокапиллярную мембрану. Содержание СС»2 в крови почти линейно зависит от его напряжения, что делает легочный обмен этого газа малочувствительным к регионарным нарушениям вентиляционно-перфузионных отношений. Даже выраженное шунтирование крови в легких не грозит гиперкапнией. Вот почему напряжение углекислого газа в крови, оттекающей от легких (РаСО2), определяется исключительно объемом вентиляции перфузируемых альвеол и позволяет делать вывод о том, достаточен он или нет.
Приемлемым считается такой объем вентиляции альвеол, который поддерживает напряжение СО2 в артериальной крови на нормальном уровне (40 ± 4 мм рт. ст.), так что в функциональном отношении термины "нормовентиляция" и "нормокапния" являются синонимами.
Однако анализ газового состава артериальной крови повторяют в лучшем случае несколько раз в сутки. Когда речь идет о показателях, подверженных быстрым и существенным изменениям, одиночные лабораторные пробы предоставляют возможность судить о динамике процесса так же, как несколько кадров - о кинофильме в целом. Существует мониторный метод контроля газового состава крови с помощью оптодов, введенных в кровеносный сосуд, но он сложен и очень дорогостоящ. Транскутанный мониторинг газового состава крови, получивший было распространение в 80-е годы, в настоящее время применяется почти исключительно в педиатрии.
Физиология дыхания предложила другой, более простой выход этой ситуации. Известно, что напряжение углекислого газа в артериальной крови практически не отличается от парциального давления СО2 в альвеолярном газе (РаСО2). Измерив РАС02 и мысленно уравняв его с PаC02, вы находите ответ на воnpoc, достаточен ли минутный объем легочной вентиляции. А если вы к тому же помните, что пробу альвеолярного газа нетрудно получить при каждом выдохе пациента, вам остается лишь наблюдать за вентиляцией больного в мониторном режиме, отслеживая ее изменения с каждым дыхательным циклом. Капнограф регистрирует четыре показателя, обладающие диагностической ценностью: 1. Парциальное давление или объемную концентрацию СО;;
в конечной порции выдыхаемого газа (РктСО2 или РктСО2 соответственно). Различия между этими параметрами и единицы их измерения уже обсуждались. По изложенным выше причинам мы будем пользоваться в основном показателем РetСО2.
2. Частоту спонтанного дыхания или искусственной вентиляции, которая обычно обозначается "f" и выражается в размерности "ВРМ" (от англ. breaths per minute - вдохов в минуту), "СРМ" (от англ. cycles per minute - циклов в минуту) или, что то же, 1/min или min-1.
3. Парциальное давление или объемную концентрацию СО2 во вдыхаемом газе (PiCO2 или FiC02 соответственно).
4. Форму капнограммы.
Причинами изменений всех вышеперечисленных показателей служат определенные физиологические сдвиги, возникающие при патологических состояниях. Поэтому клиническая интерпретация параметров капнограммы базируется на ясном понимании физиологических основ обмена углекислого газа в организме. Ниже мы приведем лишь тот минимум сведений, который необходим для осмысленной работы с капнографом. Более подробную информацию на эту тему читатель найдет в специальных руководствах по нормальной и прикладной физиологии дыхания.
Образование и запасы CO 2 в организме
Образование двуокиси углерода в организме. Двуокись углерода - один из конечных продуктов аэробного метаболизма. Основной постоянный источник СО2 - митохондрии, в которых окисление углеродсодержащих субстратов в цикле Кребса сопровождается образованием энергии, запасаемой в высокоэнергетических соединениях. Кроме того, некоторое количество СО2 дает бикарбонатный буфер при возникновении метаболического ацидоза. При постепенном углублении ацидоза избыток углекислого газа успевает покинуть организм, однако при стремительно развивающемся ацидозе, в частности при остановке сердечной деятельности, этот механизм способствует усилению гиперкарбии. Третий (ятрогенный и довольно мощный) источник СО2 - бикарбонат натрия (NaHCO2), вводимый внутривенно для коррекции метаболического ацидоза. Инфузия 50 мл 8 % раствора сопровождается быстрым образованием примерно 1 л CO2, подлежащего эвакуации из организма. Соответственно должен увеличиться и минутный объем вентиляции легких. И наконец, какое-то количество СО2 всасывается в кровь через брюшину при лапароскопии. На темп образования СО2 влияют многие факторы: масса тела, интенсивность метаболизма, состав питания больного и пр. Понятно, что этот показатель очень вариабелен и зависит от конкретного состояния пациента в данный момент времени. Стало быть, такой же изменчивой величиной является и минутный объем дыхания, поддерживающий нормальную вентиляцию. Скорость метаболической продукции СО2 у взрослого человека в покое равняется в среднем 150 мл/мин. Приведенная здесь величина, как это принято в физиологии дыхания, выражает объем газа при стандартных условиях (STPD): атмосферном давлении 760 мм рт. ст., относительной влажности О % и температуре 0С. В реальных же условиях такое количество согретого газа занимает приблизительно в 1,2 раза больший объем (180мл). При гиперметаболических состояниях продукция СО2 может возрасти в несколько раз. Примерами являются стресс, гипертермия, гипертиреоз, физическая нагрузка (двигательное возбуждение, судорожный синдром, сопротивление респиратору), сепсис, обширные ожоги, питание смесями и растворами с высоким содержанием углеводов, синдром злокачественной гипертермии. Неадекватная анестезия во время операции также чревата увеличением образования двуокиси углерода. Продукция СО2 существенно снижается при гипотермии, миорелаксации и глубокой седации. Формы содержания СО2 в организме. Двуокись углерода в организме присутствует в нескольких формах, которые обеспечивают ее хранение и транспортировку. Отметим, что, хотя растворимость СО; в плазме довольно велика (примерно в 25 раз выше, чем таковая у кислорода), ее все же недостаточно для доставки кровью в легкие всей образующейся в организме двуокиси углерода. Но если для кислорода в крови предусмотрен специальный транспортный белок (гемоглобин), то почти 90 % Двуокиси углерода, поступающей из тканей в кровь, обратимо превращается в эритроцитах в ионы бикарбоната, которые и являются основной транспортной формой СО2. Некоторую часть СО2 переносит гемоглобин в форме карбаминовых соединений. В пересчете на углекислый газ, в 100 мл артериальной крови содержится около 50 мл СО2, а в венозной крови - около 55 мл. Таким образом, каждые 100 мл крови удаляют из тканей в альвеолярный газ около 5 мл СО2. Благодаря хорошей растворимости двуокиси углерода в водных средах и разнообразию ее транспортных форм существенное изменение содержания СО2 в крови сопровождается относительно небольшим изменением напряжения углекислого газа. Так, ежеминутное поступление в кровоток из тканей 150 мл СО2 при нормальном минутном объеме кровообращения обеспечивает артериовенозную разницу, равную всего 6 мм рт. ст. Для сравнения, поступление из альвеол в кровь примерно такого же количества кислорода приводит к увеличению напряжения кислорода в крови на 60 мм рт. ст. Зависимость содержания СОа в крови от напряжения приближается к прямолинейной форме, в отличие от S-образной, характерной для кислорода. Запасы СО2 в организме. Общее количество двуокиси углерода в организме огромно - около 110- 120 л. Этим ограничивается способность капнографии немедленно обнаружить внезапно развившуюся гиповентиляцию. Запасы СО2 состоят из целого ряда химических соединений, в которые обратимо превращается поступающая из клеток двуокись углерода и которые легко отдают ее при снижении напряжения СО2 в крови. Основная форма хранения двуокиси углерода в организме - бикарбонаты. Существуют так называемые центральные и периферические запасы С02 (рис. 2.6). Они различаются по доступности, то есть по скорости и интенсивности включения в обмен при изменениях напряжения СО2 в крови. Взаимодействие между этими запасами - главный фактор, определяющий скорость развития и стойкость гипо- или гиперкарбии при изменениях объема вентиляции легких. Периферические (тканевые) запасы СО2 в пересчете на газ составляют около 110 л и делятся на три неравные части. Большая часть периферических запасов двуокиси углерода содержится в костной и жировой тканях (рис. 2.6, А), то есть в тканях с низкой собственной метаболической активностью и бедным кровоснабжением. Поэтому увеличение или опустошение этих запасов при изменениях продукции СО2 или альвеолярной вентиляции совершается в течение десятков часов. Меньшая часть периферических запасов СО2 находится в мышцах и других органах с умеренным кровоснабжением (рис. 2.6, В). Стабилизация этих запасов на новом уровне при колебаниях вентиляции и метаболизма осуществляется за десятки минут. Рис. 2.6. Запасы СО2 в организме И наконец, небольшое количество СО2, подверженное очень быстрым изменениям при колебаниях альвеолярной вентиляции или продукции двуокиси углерода, содержится в органах с интенсивным кровоснабжением и малой собственной массой (головной мозг, почки) (рис. 2.6, С). Периферические запасы СО2 в связи с их значительным объемом, играют роль буфера, который препятствует резким изменениям напряжения углекислого газа в организме при кратковременных колебаниях объема легочной вентиляции или темпа продукции СО;. При апноэ и связанной с ним задержкой СО2 в тканях гиперкапния нарастает очень медленно, по 2- 3 мм рт. ст. в 1 мин. Таким способом организм существенно замедляет скорость развития респираторного ацидоза. В этом отношении обмен СО2 существенно отличается от обмена кислорода, запасы которого в организме крайне невелики, чем обусловлено как катастрофически быстрое нарастание гипоксии при острых нарушениях дыхания, так и очень быстрое восстановление исходного состояния при возобновлении вентиляции. Центральные запасы СО2 содержатся в крови и составляют около 2,5 л углекислого газа. Это - самая небольшая, но чрезвычайно мобильная часть СО2 которая способна быстро реагировать на колебания объема альвеолярной вентиляции. Центральные запасы СО2 можно рассматривать как своего рода челнок, постоянно снующий от тканей к легким и обратно. Содержание двуокиси углерода в венозной крови, оттекающей от тканей, определяется напряжением СО2 в тканях, а количество С02 в артериальной крови, оттекающей от легких, контролируется объемом альвеолярной вентиляции. Так, после кратковременной гипервентиляции, не успевшей заметно уменьшить периферические запасы СО2 и тем самым снизить напряжение СО2 в венозной крови, РаСО2 почти тут же возвращается к первоначальному уровню.
Внутрилегочный обмен CO 2
Доставка С02 в легкие. Двуокись углерода, будучи хорошо растворимым соединением, легко проникает через любые биологические мембраны. Поэтому напряжение СОа в венозной крови, оттекающей от органов (PvCO2), практически равняется напряжению С02 в тканях. В норме содержание СО2 в смешанной венозной крови - около 32 мл/100 мл крови, что соответствует РvСО2, 46 мм рт. ст. Количество СО2 в венозной крови - довольно постоянный параметр, поскольку оно стабилизируется периферическими запасами двуокиси углерода. Основные причины венозной гиперкарбии: • гиповентиляция, которая приводит к постепенному увеличению периферических запасов СО2; • несоответствие минутного объема кровообращения метаболическим потребностям (гиподинамический режим кровообращения); ' • рециркуляция углекислого газа в контуре наркозного аппарата или респиратора; • преднамеренная подача углекислого газа в контур наркозного аппарата (это нетипично для анестезиологической практики в России, но традиционно используется в Великобритании). Диффузия СО2 в альвеолярный газ (рис. 2.7). Венозную кровь, поступающую в легочные капилляры, отделяет от альвеолярного пространства тонкая альвеолокапиллярная мембрана, хорошо проницаемая для углекислого газа. Легочная вентиляция поддерживает постоянное парциальное давление углекислого газа в альвеолах (РAСО2); оно составляет 40 мм рт. ст. (нормальными считаются колебания данного параметра в пределах 36- 44 мм рт. ст.). Под влиянием градиента давлений СO2 между венозной кровью (46 мм рт. ст.) и альвеолярным газом (40 мм рт. ст.) углекислый газ переходит из капиллярной крови в просвет альвеол, а оттуда удаляется в атмосферу с выдыхаемым газом. Напряжение С02 на протяжении легочного капилляра уменьшается, и этот процесс продолжается до тех пор, пока оно не снизится до уровня парциального давления С02 в альвеолярном газе (то есть до 40 мм рт. ст.).
Рис. 2.7. Диффузия СО; из капилляров в альвеолы
Таким образом, от альвеол оттекает кровь, напряжение СО2 которой практически равно парциальному давлению СО2 в альвеолярном газе. Изменяя объем альвеолярной вентиляции, организм регулирует напряжение СO2 в артериальной крови, поступающей к органам. Во многих случаях инвазивную и относительно трудоемкую процедуру определения напряжения СО; в артериальной крови можно заменить измерением парциального давления CO2 в альвеолярном газе. Данное положение и лежит в основе капнометрии. При этом за альвеолярную принимается концентрация углекислого газа, измеренная в самом конце выдоха, когда из дыхательных путей выходит именно альвеолярный газ*. В показателе РetСО2 индекс ЕТ - аббревиатура от англ. "end tidal" - конечная часть дыхательного объема. Нетрудно заметить, что вся 6е-Зупречная на первый взгляд схема базируется на нескольких допущениях (см. ниже) и работает лишь в том случае, если все они ^выполняются. * На заре физиологии дыхания конечная часть выдыхаемого газа называлась пробой Холдёйна-Пристли, в наше время этот термин вышел из употребления. • Парциальное давление CO2 в альвеолярном газе должно быть равно напряжению СО2 в крови, оттекающей от альвеол. • Дыхательный объем должен быть достаточно велик для того, чтобы в конце выдоха из дыхательных путей поступал газ альвеолярного пространства. •.Концентрации СО2 в различных участках легких должны быть одинаковыми. Довольно легко обнаружить, что из трех перечисленных условий только первое выполняется практически всегда, второе же не соблюдается при поверхностном дыхании или при высокочастотной вентиляции легких. Третье условие - по принципиальным причинам - невыполнимо вообще. Поэтому полное равенство, а следовательно, и абсолютная взаимозаменяемость РetСО2 и РaС02 в каждом случае являет собой недостижимый идеал. В норме разница между РetСО2 и PaCO2 существует, однако ее величина достигает лишь нескольких мм рт, ст. Это означает, что в большинстве случаев РetСО2 служит достаточно надежным показателем адекватности вентиляции. Впрочем, любой метод измерения дает ту или иную погрешность, тем не менее результаты измерения годны к использованию, если величина погрешности известна и незначительна. Вместе с тем необходимо уметь распознавать клинические ситуации, в которых ошибка становится настолько большой, что ориентироваться на величину РetСО2, принимая решение, нельзя. Альвеолярная.вентиляция. Для поддержания постоянного парциального давления СО2 в альвеолярном газе и артериальной крови углекислый газ, поступающий в альвеолы с периферии, удаляется из легких в составе выдыхамого газа. При этом скорость продукции СО2 в тканях должна равняться скорости эвакуации его в окружающую среду. В противном случае имеет место накопление СО2 в организме или, наоборот, избыточное вымывание двуокиси углерода из тканей. В процессе выдоха из дыхательных путей сначала выходит газ анатомического мертвого пространства, не содержащий СО2, а затем альвеолярный газ, в составе которого СО2 и покидает организм. В норме парциальное давление СО2 в альвеолах равно 40 мм рт. ст., что при нормальном атмосферном давлении (760 мм рт. ст.) соответствует концентрации СО2 5,6 %. Если скорость продукции СО2 в организме составляет 180 мл/мин, а FAСО2 - 5,6 %, то объем альвеолярного газа, в котором содержится данное количество СО2 вычисляют по формуле: (180 мл/ 5,6 %) х 100 % = 3214 мл = 3,21 л. Именно таким и должен быть минутный объем альвеолярной вентиляции в данном примере, чтобы парциальное давление углекислого газа в альвеолах, а значит, и напряжение СО2 в артериальной крови поддерживались на уровне 40 мм рт. ст. Из этой несложной формулы следует, в частности, что при повышении продукции СО; до 250 мл/мин и прежнем объеме альвеолярной вентиляции концентрация СО^ в альвеолах через некоторое время возрастет до 7,8 %, что соответствует парциальному давлению 55,6 мм рт. ст. Для предотвращения гиперкапнии альвеолярную вентиляцию в данном случае необходимо увеличить до 4,46 л/мин. В другой ситуации, когда минутная продукция СО2 остается на уровне 180 мл/мин, а объем альвеолярной вентиляции снижается до 1,5 л/мин, концентрация СО2 в альвеолярном газе повысится до 12 % (РдС02 85,6 мм рт. ст.). Вывод: в результате гиповентиляции поднимается концентрация CO-i в альвеолярном газе и соответственно увеличивается РаСО2. Вентиляция легких. Любому процессу, протекающему в организме, присущ свой коэффициент полезного действия. Применительно к вентиляции легких это означает, что далеко не весь объем вдыхаемого и выдыхаемого газа используется по назначению - для доставки в альвеолы кислорода и удаления поступающего в них с периферии углекислого газа, Часть дыхательного объема, которая по разным причинам не принимает участия в газообмене, является физиологическим (или функциональным) дыхательным мертвым пространством (ДМП), которое включает несколько компонентов. Анатомическое мертвое пространство - это совокупный объем дыхательных путей, имеющих небольшое общее поперечное сечение. Последнее обстоятельство делает невозможным эффективный внутрибронхиальный диффузионный обмен между вдыхаемым и альвеолярным газами. Таким образом, величина анатомического ДМП равна объему проксимальной части дыхательных путей, где состав вдыхаемого газа сохраняется неизменным. Величина анатомического мертвого пространства в условиях нормочастотной вентиляции довольно постоянна и в среднем у взрослого человека равняется 150 мл. Строго говоря, размер ДМП зависит от положения больного, частоты дыхания, скорости вдоха и выдоха и длительности инспираторной паузы, но эти изменения, хорошо изученные физиологами, столь невелики и непредсказуемы, что; в клинической практике их редко берут в расчет. Анатомическое ДМП существенно уменьшается при трахеотомии или при инсуфляции кислорода в трахею через катетер (метод TRIО2 - tracheal insufflation of oxygen). Аппаратное мертвое пространство является своеобразным искусственным началом анатомического ДМП и включает объемы интубационной трубки, пространства между куполом лицевой маски и поверхностью лица пациента, адаптера-пробоотборника капнографа; а при поломке клапанов в мертвое пространство может войти часть контура наркозного аппарата. Аппаратное ДМП оказывает такое же влияние на вентиляцию легких, как и анатомическое, и поэтому суммируется с ним. В целом размеры анатомического и аппаратного мертвого пространства можно рассматривать как фиксированный налог на дыхание, который вычитается из каждого дыхательного объема независимо от величины последнего. В случаях, когда пациент дышит малыми дыхательными объемами, которые близки по величине к сумме анатомического и аппаратного ДМП, диагностическая ценность капнографии резко снижается. Подробнее эта проблема будет рассмотрена при обсуждении капнограммы. Альвеолярное мертвое пространство представлено легочными регионами, в которых отсутствует кровоток и, следовательно, не происходит газообмен. Газ, заполняющий альвеолярное ДМП, близок по составу к вдыхаемому газу. На вентиляцию альвеолярного мертвого пространства тратится определенная часть дыхательного объема. В норме эта часть мала и существенного влияния на газообмен не имеет, но в условиях патологии она достигает более половины дыхательного объема, а в самых тяжелых случаях - 80 % ДО.(рис. 2.8). При обнаружении альвеолярного ДМП минутный объем легочной вентиляции необходимо увеличить, так как часть дыхательного объема, попадающая в "мертвые" альвеолы, не включается в газообмен, а оставшейся части ДО оказывается недостаточно для обеспечения нормовентиляции. Поскольку вдыхаемый газ распределяется между эффективно работающими регионами и альвеолярным мертвым пространством в определенном соотношении, повышение дыхательного объема влечет за собой увеличение вентиляции как "здоровых", так и "мертвых" альвеол. Поэтому вентиляцию альвеолярного ДМП можно рассматривать как пропорциональный налог на вентиляцию легких.  Таким образом,: альвеолярное мертвое пространство играет туже роль в вентиляции легких, что и шунтирование крови в системе легочного кровотока. При выдохе газ из альвеолярного мертвого пространства, не содержащий СО-2, выходит из легких одновременно с газом из аффективно работающих участков и разбавляет его, вследствие чего концентрация СОа в смешанном альвеолярном газе снижается. В норме альвеолярное ДМП невелико, поэтому РetСО2 с достаточной степенью приближения может быть использовано как заменитель РаСО2. В случаях, когда альвеолярное Мертвое пространство существенно возрастает, различие между двумя этими показателями увеличивается настолько, что применить капнографию для диагностики гипо- или гипервентиляции невозможно. Причины, приводящие к нарушению или прекращению альвеолярного кровотока в отдельных регионах, носят (1) морфологический или (2) функциональный характер. Первая группа причин - эмболии и тромбозы в системе легочной артерии; классические примеры - тромбоэмболия легочной артерии и респираторный дистресс-синдром, при которых на вентиляцию альвеолярного ДМП порой расходуется более половины дыхательного объема. Вторая группа причин - низкое давление в легочной артерии; классические примеры - гиповолемия, сердечно-легочная реанимация или сжатие легочных капилляров в межальвеолярных перегородках высоким альвеолярным давлением при некоторых режимах ИВЛ. Из приведенного выше далеко не полного списка следует, что ситуации, в которых полагаться на данные капнографии рискованно, встречаются в повседневной клинической практике достаточно часто и их необходимо уметь распознавать. Самый надежный способ решения проблемы - измерение напряжения СO2 в пробе артериальной крови и сравнение его с РetСО2. Если различие между РaСО2 и РetСО2 больше 5 мм рт. ст., ориентироваться на данные капнографии, когда речь идет об адекватности объема легочной вентиляции, нужно крайне осторожно. В таких случаях объективным и единственно надежным параметром остается РаСО2, однако измерение этого показателя в мониторном режиме - дело весьма сложное и дорогостоящее. Регионарная неравномерность вентиляции и перфузии легких - еще один фактор, влияющий на эффективность легочного газообмена. Состояние нормовентиляции достигается лишь тогда, когда объемной скорости альвеолярного кровотока соответствует строго определенный темп вентиляции альвеол. В норме для поддержания РаСО2 на уровне 40 мм рт. ст. на обработку каждых 1000 мл крови, протекающей по легочным капиллярам, требуется около 800 мл свежего газа, вентилирующего альвеолы, то есть нормальная величина вентиляционно-перфузионного отношения составляет приблизительно 0,8. Это справедливо как для отдельного региона, так и для легких в целом. Увеличение вентиляционно-перфузионного отношения при прочих неизменных условиях является физиологическим синонимом гипервентиляции - регионарной или общей - и приводит к гипокарбии - снижению напряжения СО2 в крови, оттекающей от региона, или в артериальной крови. Соответственно, "низкое отношение вентиляции к кровотоку" - это другое название гипо-вентиляции, по причине которой возникают гиперкапния и гиперкарбия. Легкие состоят из множества участков с различными вентиляционно-перфузионными отношениями и, следовательно, с неодинаковым составом альвеолярного газа, потому что возможность равномерного распределения вентиляции и кровотока в них исключена. Парциальное давление СО2 в альвеолах разных регионов в норме находится в пределах от 25 до 45 мм рт. ст. В связи с тем что зависимость содержания СО2 в крови от напряжения близка к линейной, гиповентиляция одних регионов эффективно компенсируется гипервентиляцией других', а парциальное давление СО2 в смешанном альвеолярном газе почти не Отличается от напряжения СО2 в смешанной артериальной крови. Для анализа капнограммы эти сведения могли бы оказаться неприменимыми, если бы не весьма серьезное обстоятельство. Вентиляция разных участков легких осуществляется не только неравномерно, но и несинхронно. В начале выдоха через датчик капнографа проходит альвеолярный газ, поступающий в основном из гипервентилируемых регионов, которые опорожняются с большей скоростью. В течение выдоха капнограф регистрирует Постепенное увеличение концентрации углекислого газа, поэтому альвеолярное плато в норме имеет незначительный подъем. В конечной же части выдоха преобладает альвеолярный газ из йотовентилируемых зон, содержащий повышенное количество СО2. Но именно эта, последняя, порция выдыхаемого газа ис-ррльзуется капнографом для определения величины РetСО2, по которой мы судим о вентиляции легких в целом. При физиологически нормальной степени неравномерности вентиляции отличие РetСО2 от РaСО2 невелико, и его, как правило, не принимают во внимание. Однако в случаях, когда отмечаются выраженные нарушения проходимости отдельных бронхов, величина РetС02 может оказаться несколько выше, чем РaСО2, но при этом не "перекроет" напряжение СО2 в венозной крови. Любопытно, что на первых этапах широкого внедрения капнографии такие случаи регулярно описывались в литературе как курьезные. Это справедливо только в отношении углекислого газа. S-образная форма кривой диссоциации оксигемоглобина и ограниченность его кислородной емкости редко снижают эффективность такого механизма компенсации для кислорода. Поэтому патологическая неравномерность вентиляции и кровотока приводит к развитию гипоксемии, которую нельзя ликвидировать простой гинервентиляцией. Более подробно данная тема изложена в гл. "Пульсоксиметрия".
Показатели нормальной капнограммы
В предыдущей главе мы рассмотрели ряд физиологических механизмов, формирующих внешний вид и параметры капнограммы в реальных клинических условиях. У большинства пациентов, которыми занимаются анестезиолог и интенсивист, капнография эффективно справляется со своей главной задачей: мониторингом вентиляции легких. И все же следует четко понимать, что капнография отражает реальное положение дел в системе дыхания лишь тогда, когда соблюдены ниже перечисленные условия: • отсутствие грубой патологии легких; • преобладание дыхательного объема над объемом анатомического мертвого пространства; • отсутствие гиповолемии; • своевременная калибровка капнографа. ', В остальных случаях один из основных показателей капнометрии - РetСО2 - непригоден для оценки вентиляции, но даже при этом монитор эффективно выявляет тахи-, брадипноэ и апноэ, а также позволяет извлекать важную диагностическую информацию из формы капнограммы. Частота дыхания (УД) должна соответствовать возрастной норме с поправкой на особенности клинической ситуации. Расхождения между показаниями монитора и частотой самостоятельного дыхания, измеренной по секундомеру, возможны, но они, как правило, не превышают 1-2 цикла в 1 мин. Эти несовпадения подчас обусловлены способом расчета ЧД монитором. В случаях, когда капнограф определяет частоту дыхания по интервалу времени между двумя соседними.волнами капнограммы, любая, даже незначительная нерегулярность дыхания приводит к колебаниям величины ЧД на дисплее. При выраженной аритмии дыхания такой монитор позволяет получить представление о ее степени, но среднюю частоту дыхания приходится находить "вручную". Если в программном обеспечении капнографа применяется принцип "скользящего окна" или оценка.среднего показателя производится за конкретный временной интервал, величина ЧД, усредненная за несколько дыхательных циклов,, обновляется на дисплее через регулярные промежутки времени. Данный способ расчета частоты дыхания сглаживает естественные колебания этого параметра и аналогичен традиционному способу измерения ЧД с помощью секундомера. При искусственной вентиляции легких капнограф должен отражать на дисплее неизменную величину частоты дыхания; которая точно соответствует частоте дыхательных циклов респиратора. Колебания показаний монитора возникают лишь при появлении спонтанной дыхательной активности пациента на фоне ИВЛ. Сужение диапазона между верхним и нижним порогами аларм-системы настраивает монитор на сигнализацию о нарушении адаптации больного к респиратору. При вспомогательных режимах вентиляции легких капнограф, устанавливающий ЧД за достаточно длительный временной интервал, демонстрирует суммарную частоту самостоятельных и аппаратных вдохов. При высокочастотной вентиляции легких с определением частоты вентиляции, как, впрочем, и остальных Показателей, сплавляются далеко не все модели. В паспорте каждого капнографа содержатся сведения о максимальной частоте вентиляции, при которой возможен правильный расчет параметров. Корректно оценить частоту вентиляции капнографом обычно невозможно, если она превышает 120-150 циклов в 1 мин. В случаях, когда ВЧ ИВЛ выполняется во вспомогательном режиме, этот показатель капнограммы абсолютно неинформативен. Форме капнограммы в норме присущи правильные очертания. Альвеолярное плато четко выделяется в виде ровного, почти горизонтального отрезка. Выраженный подъем альвеолярного плато, а также появление на нем зубцов - симптомы вполне определённых нарушений дыхания (о них речь пойдет ниже). В некоторых случаях на нисходящем колене капнограммы отмечаются зубцы, синхронные с работой сердца. Это кардиогенные осцилляции - колебания легочного объема, вызванные сокращениями сердца (рис. 2.10). Такая картина чаще всего наблюдается при увеличении ударного объема сердца или при брадипноэ. Рис. 2.10. Кардиогенные осцилляции на капнограмме Сходная картина встречается и при накоплении конденсата в клапане выдоха наркозного аппарата или респиратора. Клапан с залипшей мембраной выпускает выдыхаемый газ порциями. Обычно этот дефект сопровождается характерным звуком и возникновением нерегулярных зубцов на капнограмме. При интерпретации формы капнограммы необходимо осознавать, что она не дает - и не может дать - представления об объеме альвеолярной вентиляции за каждый дыхательный цикл. Длинные волны кривой, имеющие большую площадь, говорят лишь о значительной продолжительности фазы выдоха, что далеко не всегда соответствует большому объему выдыхаемого газа. Чтобы убедиться в этом, проделайте нехитрый эксперимент: выдохните через адаптер и задержите дыхание. На дисплее капнографа задержка дыхания на выдохе выглядит как широкая волна. Высокая концентрация СО2 будет отражаться до очередного вдоха, хотя элиминации углекислого газа во время экспираторной паузы не происходит. В клинической практике нередки ситуации, когда широкие волны капнограммы служат признаком крайне неэффективного дыхания или брадипноэ. Судить по капнограмме о количестве СО2, выдыхаемого за определенный отрезок времени, позволяет лишь ее сопоставление с синхронизированной спирограммой: произведение объема и концентрации представляет количество выдыхаемого углекислого газа. Этот принцип лежит в основе работы некоторых моделей метаболографов - мониторов, измеряющих продукцию CO2 и потребление О2. По капнограмме также визуально оценивают ритмичность дыхания. При аритмии дыхания нарушается регулярность чередования волн кривой. Если нерегулярность дыхательного ритма сочетается с изменчивостью глубины вдохов и выдохов (что характерно для неврологической патологии, наркотической депрессии дыхательного центра и периода восстановления дыхания после длительной ИВЛ), волны капнограммы неодинаковы по форме. Для наблюдения за ритмом дыхания удобнее использовать капнографы, на дисплее которых помещается большое число волн. В отдельных моделях предусмотрен выбор шкалы времени, что предоставляет возможность в одних случаях рассматривать на экране увеличенное изображение двух-трех соседних волн, а в других - определять изменения капнограммы за несколько десятков дыхательных циклов. Анализ более продолжительных периодов наблюдения производится по трендам. При визуальном контроле за аритмией дыхания следует отдать предпочтение малой скорости движения капнограммы, когда на дисплее присутствует большое число волн. Впрочем, достаточно наглядный результат получится и при обычном наблюдении за дыхательными движениями пациента. Некоторые капнографы неспособны точно воспроизводить капнографическую кривую. Это связано с конструктивными недостатками модели и характерно для дешевой техники "третьих" фирм. На экране таких мониторов очертания капнограммы сглажены, и она напоминает синусоиду. Разумеется, диагностическая ценность ее в этих случаях снижается. Форма капнограммы искажается и на дисплеях высококлассных моделей, если в них применяются нестандартные адаптеры и магистрали, засоряется фильтр или накапливается избыток конденсата. Конечно-экспираторное парциальное давление (или концентрация) СО2 (PetCO2 или FetCO2) - основной показатель капнометрии, ради которого, собственно, и был создан метод. В норме РetСО2 почти всегда на 2- 4 мм рт. ст. ниже, чем напряжение С02 в артериальной крови. Это несущественное артерио-конечно-экспираторное различие обусловлено незначительным альвеолярным мертвым пространством, которое есть у всех здоровых людей. Нормальная величина РетСО2 - 36- 43 мм рт. ст. При нормальном атмосферном давлении (760 мм рт. ст.) этому парциальному давлению углекислого газа соответствует концентрация 4,7-5,7 %. Для удобства визуальной оценки капнограммы на дисплеях отдельных моделей капнографов проведена дополнительная горизонтальная линия, соответствующая 5 % концентрации С02. Парциальное давление (или концентрация) СО2 во вдыхаемом газе (Р1С02 или F1CO2) в норме равняется нулю.
Капнография при гиповентиляции
Гиповентиляция - это состояние газообмена, при котором объем вентиляции легких недостаточен для поддержания нормального напряжения СО2 в артериальной крови. Из полного определения гиповентиляции мы намеренно выделили ту его часть, которая имеет непосредственное отношение к капнографии. Вопрос об обмене кислорода при гиповентиляции обсужден и главах "Пульсоксиметрия" и "Оксиметрия". Три первичных следствия гиповентиляции: Гиперкапния - повышение концентрации СО2 в альвеолах. Гиперкарбия - повышение концентрации СО2 в тканях и в крови. Респираторный ацидоз - снижение рН тканей и крови, вызванное увеличением концентрации угольной кислоты. К гиповентиляции могут привести четыре первичные причины: 1. Снижение минутного объема вентиляции, например при угнетении дыхательного центра, слабости дыхательной мускулатуры, резком возрастании дыхательного сопротивления, частичной разгерметизации системы "пациент-респиратор", неадекватной ИВЛ. Хроническая гиповентиляция встречается у пациентов с обструктивными заболеваниями легких и преимущественно обусловлена перенастройкой регуляции дыхания. 2. Повышение метаболической продукции СО2 на фоне прежнего объема вентиляции легких. Чаще всего такая ситуация наблюдается при ИВЛ, когда минутный объем вентиляции фиксирован и подвергается изменению только по решению врача. При самостоятельном же дыхании дыхательный центр пациента следит за соответствием объема дыхания метаболическим потребностям. Однако при угнетении дыхательного центра или слабости дыхательной мускулатуры, например после наркоза, длительной ИВЛ или при миастении, пациент не в состоянии ответить на увеличение продукции СОа возрастанием объема вентиляции. 3. Рециркуляция выдохнутого газа в контуре наркозного аппарата. 4. Увеличение дыхательного мертвого пространства при прежнем минутном объеме вентиляции. Наиболее подвержено быстрым и значительным изменениям альвеолярное мертвое пространство. Типичный пример - тромбоэмболия легочной артерии на фоне ИВЛ. Капнография пригодна для диагностики гиповентиляции, вызванной первыми тремя причинами. В этих случаях признаком гиповентиляции служит повышение РктС02 сверх 43 мм рт. ст. (или FE1-C02 - сверх 5,7 % при нормальном атмосферном давлении) и возрастание высоты волн капнограммы на дисплее. В третьем случае, помимо подъема РуеСO2, регистрируется еще и появление СО2 во вдыхаемом газе. В последнем, четвертом случае концентрация углекислого газа в эффективно работающих альвеолах увеличивается, но разбавление выдыхаемого альвеолярного газа газом мертвого пространства, не содержащим С02, приводит к снижению Рщ-С^. (Подробно о различных аспектах данной проблемы см. далее.) Уменьшение объема вентиляции альвеол сопровождается нарушением эвакуации углекислого газа из тканей в окружающую среду, накоплением С02 в организме и, соответственно, нарастанием концентрации СО2 в тканях, крови и легких. Концентрация углекислого газа в альвеолах постепенно увеличивается, и по мере ее повышения становится большим количество СО2, удаляемого из организма с каждым выдохом. Рост концентрации углекислого газа в альвеолах, крови и тканях прекращается тогда, когда скорость эвакуации СО2 увеличивается настолько, что Уравнивается со скоростью продукции СО2 в тканях. Возникает новое устойчивое состояние газообмена, при котором пониженный объем вентиляции легких обеспечивает удаление из организма прежнего количества углекислого газа за счет повышенного содержания СО2 в выдыхаемом газе. К гиповентиляции иногда приводит уменьшение дыхательного объема и/или частоты дыхания. В тех случаях, когда дыхательный объем приближается к величине анатомического мертвого пространства, капнограф может показывать нормальную или сниженную величину РetСО2 даже при выраженной гиперкапнии. Необходимо помнить, что при поверхностном дыхании РetС02 отражает концентрацию СО2 в переходной зоне между анатомическим мертвым пространством и альвеолами (фаза II капнограммы), а посему интерпретации не подлежит. Величина РetСО2 обладает диагностической значимостью только в тех случаях, когда на волнах капнограммы имеется отчетливое плато (фаза III). В условиях операционной или палаты интенсивной терапии предпочтительнее пользоваться именно капнографами, а не капнометрами, ибо первые предоставляют возможность оценивать качество данных мониторинга по форме капнограммы*. В настоящее время оснащение стационара капнометрами, а не капнографами считается организационной ошибкой. Гиповентиляция развивается внезапно или постепенно. И хотя конечный результат - повышение РetСО2 - в обоих случаях одинаков, в динамике углубления гиперкапнии имеются серьезные различия. Рассмотрим случай, когда минутный объем дыхания уменьшается быстро и существенно, например в результате центральной депрессии дыхания при фторотановом наркозе. Нарастание гиперкапнии при такой остро возникшей гиповентиляции происходит несравнимо медленнее, чем развитие гипоксии. При гиповентиляции количество углекислого газа, задерживающегося в организме за 1 мин, исчисляется десятками миллилитров, что крайне мало по сравнению с общими запасами СО2 в организме, объем которых составляет более 100л. Несмотря на то что в острой ситуации задержанный С02 накапливается преимущественно в органах с умеренным и интенсивным кровоснабжением, а основная часть периферических хранилищ СО2 не успевает полноценно включиться в дело, процентный прирост количества СО2 в организме за 1 мин оказывается весьма скромным. Поэтому РetСО2 при внезапной гиповентиляции увеличивается очень медленно, от 0,5 до 3 мм рт. ст. в 1 мин (рис. 2.11), а окончательная стабилизация этого показателя на уровне, характерном для нового объема дыхания, наступает не ранее чем через 1 ч от начала гиповентиляции. Из этого следует важный для практики вывод: Внезапная гиповентиляция выявляется капнографом не сразу, а лишь через несколько минут, а нередко и несколько десятков минут, которые требуются для заметного подъема концентрации СО, в тканях, крови и альвеолах. В первые минуты после неожиданного уменьшения вентиляции РetСО2 не позволяет составить впечатление об истинном объеме катастрофы, однако устойчивый постепенный рост данного показателя - очень серьезный симптом, побуждающий к немедленной оценке дыхания пациента другими способами: внимательным визуальным контролем, аускультацией, спирометрией, пульсоксиметрией. Единственный монитор, который обнаруживает внезапную гиповентиляцию практически сразу,- быстродействующий оксиметр. К сожалению, в нашей стране приборы, в которых используется этот метод, применяются крайне редко. Рис. 2.11. Капнограмма и тренд РetСО2 при внезапном снижении минутного объема вентиляции Необходимо помнить, что самое раннее и опасное последствие гиповентиляции - не гиперкапния, а гипоксия, которая способна возникнуть при относительно невысоком РetСО2 и которую легко предотвратить увеличением содержания кислорода во вдыхаемом газе. В неясных случаях дополнительная диагностика гиповентиляции непременно проводится на фоне оксигенотерапии. Для скорейшего привлечения внимания врача к росту РetС02, когда изменение величины этого показателя находится еще на уровне опасной тенденции, нужно устанавливать верхний порог аларма РetС02 всего на 2- 3 мм рт. ст. выше его текущего значения. Если по каким-то причинам минутный объем вентиляции своевременно не был откорректирован, можно ретроспективно оценить темп нарастания гиперкапнии по тренду РetСО2. При выраженной гиповентиляции подъем тренда РetСО2 оказывается более быстрым и существенным, чем при умеренном снижении объема дыхания. В некоторых случаях минутный объем дыхания уменьшается постепенно, в течение многих часов, дней и даже недель. Это характерно для ряда неврологических заболеваний - миастении, радикулополиневрита, постдифтеритической нейропатии и пр. В таких случаях успевает установиться соответствие между сокращающимся объемом вентиляции и возрастающим уровнем РetСО2. При постепенном снижении минутного объема дыхания текущая величина PetCO2 точно отражает глубину гиповентиляции. При длительном мониторинге скорость развития (углубления) дыхательной недостаточности можно оценить по тренду РetСО2. Наиболее информативны тренды тех моделей, которые обладают большим буфером памяти, что позволяет накапливать данные за 8-12 ч и более (рис.2.12). Рис. 2.12. Капнограмма и тренд РetСО2 при постепенно нарастающей гиповентиляции Чаще всего причинами гиповентиляции в операционной служат нарушение работы респиратора и негерметичность контура. Капнография - самый эффективный метод выявления таких проблем (результативность - 25 %). На втором месте - пульсоксиметрия, на третьем - спирометрия. В целом же мониторный контроль обнаруживает лишь менее половины случаев технических неполадок, подобных указанным выше; довольно часто они остаются нераспознанными. Причины недостаточной эффективности мониторинга: (1) увеличение альвеолярного Мертвого пространства, маскирующего капнографические признаки гиповентиляции, что весьма типично для общей анестезии, -и (2) использование во время наркоза повышенных концентраций кислорода, предотвращающих возникновение гипоксемии на фоне гиповентиляции. Вторая по частоте причина гиперкапнии у пациента во время общей анестезии - неисправность клапанной системы аппарата (негерметичная установка колпачков, залипание, деформация или отсутствие пластинки клапана, деформация проволочных ограничителей и пр.); Согласно статистическим исследованиям, при регулярном применении капнографа в операционной монитор выявляет такие неполадки в 90 % (!) случаев; в одном случае из ста (1 %) их определяют по клиническим данным, а в 9 % случаев не распознают вообще. Приведенные цифры лишний раз свидетельствуют о том, что за любым серьезным изменением мониторной картины всегда скрывается реальная причина, которая вполне поддается обнаружению. При оценке дыхания больного по капнограмме необходимо помнить о том, что в некоторых случаях альвеолярная гиповен-тиляция сочетается с нормальным и даже сниженным уровнем РetСО2; такая картина наблюдается, в частности, при нарушениях легочного газообмена, приводящих к появлению альвеолярного мертвого пространства. При малейших сомнениях на этот счет выполняют анализ газов артериальной крови и сопоставляют РаСО2 с РetС02. Если разница превышает 4- 6 мм рт. ст., об адекватности вентиляции по капнограмме судят с осторожностью. (Подробнее об этом речь пойдет далее.)
Мониторинг апноэ
Незамедлительное распознавание апноэ - одна из основных целей капнографии. Единственный капнографический критерий апноэ - отсутствие волн на капнограмме. В цифровом выражении это соответствует частоте дыхания, равной нулю (рис. 2.13). При полном отсутствии дыхательных циклов на дисплеях большинства моделей капнографов "замораживается" последнее предшествующее остановке дыхания значение РetС02. В тех случаях, когда больной совершает редкие нерегулярные вдохи (что по клиническим последствиям почти эквивалентно апноэ), величина РetСО2 может обновляться. Рис. 2.13. Капнограмма и тренд РetСО2 при апноэ При исчезновении дыхательной активности пациента монитор подает звуковой и световой сигналы; есть также модели, которые выводят на экран показания таймера, фиксирующего продолжительность апноэ. Включение аларм-системы происходит через определенный интервал времени после последнего выдоха. Обычно этот интервал составляет 15-20 с; в некоторых моделях его можно регулировать. Таким образом, в число показаний для капнографии входят клинические состояния, связанные с реальным риском остановки дыхания, а именно: • критическая патология нервной системы, затрагивающая дыхательный центр и иннервацию дыхательной мускулатуры; • критическая патология дыхательной мускулатуры; • применение препаратов, угнетающих дыхательный центр: – наркоз, глубокая седатация, эпи- и субдуральное введение наркотических анальгетиков; – передозировка наркотиков, барбитуратов, транквилизаторов; • высокий риск полной обструкции дыхательных путей: – коматозные состояния; – отек или инородное тело верхних дыхательных путей, ларингоспазм; • ИВЛ: – разгерметизация контура респиратора; – случайное отсоединение интубационной трубки от адаптера; – непреднамеренная экстубация; – перегиб интубационной трубки и другие варианты полной обструкции дыхательных путей; – отказ респиратора; • период перевода больного с ИВЛ на самостоятельное дыхание; • ранний посленаркозный период: – центральная депрессия дыхания; – рекураризация; – западение языка. Во время апноэ подъем напряжения СО2 в тканях и в оттекающей от них венозной крови происходит довольно медленно, по 3- 6 мм рт. ст. в 1 мин. Запасы же кислорода в организме в условиях апноэ истощаются с катастрофической скоростью, поэтому гипоксическая остановка сердца не исключается и на фоне вполне удовлетворительных показателей обмена СО2. Допустимая длительность апноэ значительно увеличивается, если ему предшествует дыхание или искусственная вентиляция газовой смесью с высоким содержанием кислорода. Подробнее эта проблема рассмотрена в главах "Пульсоксиметрия" и "Оксиметрия". Наиболее распространенные причины апноэ в операционной - полный отказ респиратора и полная разгерметизация контура. Более чем в половине случаев аларм капнографа служит первым сигналом, предупреждающим врача об ухудшении ситуации. Если респиратор снабжен собственным монитором давления в контуре, капнограф оказывается вторым по скорости реакции. Эти мониторы оповещают об осложнении задолго до развития гипоксемии, изменения артериального давления и возникновения аритмии.
Необходимо помнить, что аларм "апноэ" никогда не бывает случайным и обязательно должен побуждать к внимательной оценке ситуации.
Описаны случаи, когда анестезиологи в течение довольно долгого времени наблюдали.за изолинией на дисплее канпографа и в конце концов выключали аларм, так и не осознав, что произошла остановка вентиляции. Впоследствии, при "разборе полетов", данный прискорбный факт документально подтверждался трендами. И это далеко не единственный пример того, что психология отношений между врачом и монитором играет не меньшую роль в принятии решений, чем профессиональное образование специалиста.
Капнография при гипервентиляции
Гипервентиляция - это состояние газообмена, при котором объем легочной вентиляции избыточен по Отношению к текущим потребностям организма, что приводит к снижению напряжения CO2 в артериальной крови. Гипервентиляция, в первую очередь, проявляется интенсивным вымыванием углекислого газа из альвеол, в связи с чем парциальное давление СO2 в альвеолярном газе уменьшается. Это вызывает падение напряжения СO2 в артериальной крови, и диффузия двуокиси углерода из тканей в притекающую к ним кровь усиливается. В результате количество CO2 в тканях постепенно уменьшается до уровня, соответствующего новому объему вентиляции. Три первичных физиологических следствия гипервентиляции: Гипокапния - снижение концентрации CO2 в альвеолярном газе. Гипокарбия - снижение концентрации С02 в крови и тканях. Респираторный алкалоз - повышение рН крови и тканей, обусловленное уменьшением концентрации угольной кислоты. Гипокапния легко определяется при мониторинге РetСО2. Минутный объем вентиляции избыточен, если РetСО2 ниже 34 мм рт. ст., что соответствует концентрации СО2 менее 4,5 % (при нормальном атмосферном давлении). На капнограмме при гипервентиляции обнаруживается снижение волн. При внезапном начале гипервентиляции (например, после изменения режима ИВЛ) РetС02 падает довольно резко и достигает нового устойчивого значения уже через 10-15 мин, что легко обнаруживается при изучении тренда (рис. 2.14). Кратковременная гипервентиляция не успевает заметно истощить периферические запасы С02, поэтому после возврата к исходному объему дыхания РetСО2 и РаСО2 быстро нормализуются. Рис. 2.14. Капнограмма и тренд РetСО2 при гипервентиляции Но если продолжительность гипервентиляции превышает 30-40 мин, содержание СО2 в тканях уменьшается. В таких случаях последующий переход к нормовентиляции сопровождается постепенным накоплением СО2 в тканях, и нормализация показателей гомеостаза С02 совершается лишь тогда, когда восстановятся периферические запасы двуокиси углерода. Этот процесс, в зависимости от глубины и длительности предшествовавшей гипервентиляции, занимает от 30 мин до 1 ч. Подобное развитие событий часто наблюдается в операционной, где преднамеренная гипервентиляция во время наркоза традиционно используется для адаптации пациента к респиратору и для сокращения количества вводимых анестетиков и миорелаксантов. Такой подход нередко заканчивается замедленным восстановлением самостоятельного дыхания после завершения многочасовой операции. Причиной пролонгированного апноэ в данном случае служит угнетающее действие на дыхательный центр наркотических препаратов, которое резко усиливается на фоне респираторного алкалоза. Во избежание осложнения необходимо уменьшить объем вентиляции заранее, за 20-30 мин до конца операции, чтобы успеть восполнить периферические запасы СО2 в организме пациента. В клиниках Великобритании до настоя пито времени довольно широко применяется альтернативный подход - подача углекислого гада и контур респиратора в конце операции. Поэтому наркозные аппараты, используемые в Великобритании, традиционно имеют poтаметр для СО2. Однако этот способ, при всей своей эффективности в других странах распространения не получил. Сходные проблемы возникают и в периоде восстановления самостоятельного дыхания после длительной ИВЛ. Капногра-фия при этом обеспечивает точный количественный контроль вентиляции и позволяет целенаправленно отлаживать режим вентиляции. Изменения РetС02 после смены режима происходят постепенно, поэтому их динамику удобнее всего оценивать по трендам. С внедрением в широкую клиническую практику мониторинга РetС02 выбор режима ИВЛ - как в операционных, так и в палатах интенсивной терапии - стал более строгим. Например, подверглась пересмотру популярная прежде рекомендация во всех случаях выполнять ИВЛ в режиме заведомой гипервентиляции. В отсутствие мониторинга такая позиция была в определенной степени оправдана, поскольку из двух зол - гипо- и гипервентиляции - позволяла выбрать меньшее. Вместе с тем неблагоприятные эффекты гипервентиляции давно и хорошо известны. К ним, в частности, относятся: • вазоконстрикция в системах церебрального, коронарного и маточно-плацентарного кровотока, вызывающая ухудшение кровоснабжения органов; • увеличение сродства гемоглобина к кислороду, приводящее к ухудшению оксигенации тканей; • ухудшение вязкоэластических свойств легких в связи с уменьшением количества сурфактанта; • изменение фармакокинетики некоторых препаратов на фоне респираторного алкалоза. Все эти явления приобретают клиническую значимость при выраженной гипервентиляции, когда РаСО2 опускается ниже 28- 30 мм рт. ст. При умеренной гипокапнии отрицательных последствий у больных не отмечается. Нетрудно заметить, что любой из вышеперечисленных нежелательных эффектов способен в определенной ситуации ухудшить состояние пациента, однако в каждом случае прямая причинно-следственная связь между тем или иным осложнением и гипервентиляцией не столь очевидна, как связь между падением кирпича и черепно-мозговой травмой. Гипервентиляция никогда не фигурирует в историях болезни в качестве причины острой ишемии миокарда или гипоксии плода, но это свидетельствует лишь о неготовности практической медицины обнаруживать и доказывать реальную связь между этими явлениями. Искусство ведения больного заключается в том числе и в умении избегать факторов, чреватых нанесением вреда, даже если этот вред неявен и недоказуем. Мониторинг РetСО2 обеспечивает безопасность пациента во время ИВЛ, предотвращая возникновение ненужной гипокапнии. Вместе с тем капнографический контроль предоставляет возможность регулировать степень гипокапнии в тех случаях, когда она действительно необходима (например, у больных с внутричерепной гипертензией).
Мониторинг рециркуляции CO 2 в контуре
В большинстве моделей капнографов предусмотрено измерение Содержания СО2 во вдыхаемом газе (P1CO2). Появление примеси углекислого газа во вдыхаемой газовой смеси служит признаком неисправности или неграмотного использования наркозно-дыхательной аппаратуры. Существует несколько разновидностей реверсивных наркозных контуров (Mapleson D, Bain и другие), для которых незначительная рециркуляция СО2 - нормальное явление. В России эти контуры распространения не получили. Основные причины повышения P1CO2: • истощение или отсутствие сорбента в адсорбере наркозного аппарата; • неправильная сборка или поломка клапанов наркозного аппарата; • негерметичность шлангов наркозного аппарата. При рециркуляции выдохнутого газа капнограмма поднимается над изолинией. Если минутный объем вентиляции не изменяется, РetС02 возрастает на величину P1CO2 и возникает гиперкапния. Развитие данных событий во времени изучают по тренду концентрации СО2 (рис. 2.15). Рис.2.15. Капнограмма и тренд волн СО2; при рециркуляции углекислого газа в контуре Далеко не праздным является вопрос, а возможно ли обеспечить нормо- или гипокапнию при истощении или отсутствии натронной извести в адсорбере. Достичь этого помогает выполнение двух условий: (1) увеличение подачи свежей газонаркотической смеси в контур и (2) повышение минутного объема вентиляции. В результате волны капнограммы, оставаясь приподнятыми над изолинией, уплощаются. Таким "сжатием" капнограммы сверху можно добиться желаемого уровня РetСО2 и при рециркуляции углекислого газа в контуре (рис. 2.16). Рис. 2.16. Результат увеличения минутного объема вентиляции при рециркуляции выдохнутого газа
Капнография при гиповолемии
Типичное физиологическое следствие гиповолемии - снижение давления в легочных капиллярах. Признанию данного факта немало способствовало внедрение в повседневную клиническую практику катетера Свана-Ганца, с помощью которого оказалось возможным измерять давление заклинивания легочной артерии (ДЗЛА)(РАWР - pulmonary artery wedge pressure) - эквивалент легочного капиллярного давления. Уменьшение ДЗЛА принадлежит к весьма чувствительным признакам гиповолемии даже в тех случаях, когда она носит скрытый, компенсированный характер. Падение давления в легочной артерии и капиллярах сопровождается резким нарушением распределения кровотока между легочными регионами и выраженным искажением вентиляционно-перфузионных отношений в легких. Кровоснабжение верхних регионов значительно сокращается или прекращается вовсе, и они трансформируются в альвеолярное мертвое пространство. Этот факт не проходит мимо внимания капнографа, который регистрирует снижение содержания С02 в конечной пробе выдыхаемого газа. При анализе газового состава артериальной крови обнаруживается ненормально большая разница между напряжением СО2 в крови и парциальным давлением СО2 в альвеолах. Из этого следуют по крайней мере три важных практических вывода. Во- первых, в той ситуации, когда у пациента диагностирована или подозревается гиповолемия, интерпретацию данных капнографии необходимо проводить с большой осторожностью, а полагаться на значение РetСО2 при решении вопроса о достаточности минутного объема вентиляции нельзя. Во- вторых, нужно выполнить лабораторный анализ газового состава артериальной крови и по его результатам определить, чем вызвано уменьшение РetСО2 -банальной гипервентиляцией или появлением альвеолярного мертвого пространства. В первом случае артерио-конечно-экспираторная разница по СО2 будет нормальной, а во втором - увеличится. В- третьих, падение уровня РetСО2 при повышенном артерио-конечно-экспираторном градиенте -это не только следствие, но и вероятный симптом гиповолемии, в том числе скрытой. Капнография не относится к методам точной диагностики волемических расстройств, тем не менее при "необъяснимо" низком уровне РетСО2, явно не соответствующем минутному объему дыхания, у внимательного врача должна обязательно возникнуть мысль о наличии гиповолемии; в спорных ситуациях такая находка подчас становится серьезным дополнительным аргументом. При грамотном прочтении результатов капнографии, сопоставлении их с клинической картиной и данными пульсоксиметрии можно заподозрить развитие у больного гиповолемии и своевременно предпринять необходимые диагностические действия. При массивном кровотечении изменения капнограммы, описанные выше, особенно демонстративны. Быстрому и существенному уменьшению РetСО2 сопутствует прогрессирующее снижение волн капнограммы. Динамика процесса отчетливо прослеживается на тренде РетСО2 (рис. 2.17). По своему характеру изменения напоминают капнографическую картину тромбоэмболии легочной артерии, что неудивительно: оба события сопровождаются быстрым увеличением альвеолярного мертвого пространства, которое, собственно, и приводит к падению РetСО2. Рис. 2.17. Капнограмма и тренд РetСО2 при массивном кровотечении Нормализация показателей капнограммы - один из надежных признаков эффективности инфузионной терапии. Типичные изменения показателей капнограммы особенно выражены у пациентов с гиповолемией - явной или скрытой - на фоне ИВЛ. В таких случаях сказывается одновременное и однонаправленное воздействие на легочное кровообращение сразу двух факторов.
Капнография при тромбоэмболии легочной артерии
Первичная клиническая диагностика ТЭЛА до сего дня остается серьезной проблемой. Тромбоэмболия легочной артерии без труда диагностируется лишь в типичных случаях, однако отнюдь не каждый случай ТЭЛА имеет типичные клинические проявления. Это связано с разнообразием и неспецифичностью симптомов и наличием многих клинических вариантов течения - от молниеносных до бессимптомных. Особенно сложно распознавать данную патологию у больных, которым выполняется ИВЛ (ИВЛ сама по себе является серьезнейшим фактором риска возникновения: эмбологенного тромбоза вен, что обусловлено длительным неподвижным положением пациента и отсутствием "мышечного массажа" вен, а также повышенным веночным давлением). Тромбоэмболия легочной артерии сопровождается настолько характерными изменениями показателей капнограммы, что этот метод мониторинга в настоящее время включен в комплекс первичной диагностики ТЭЛА. Эмболия ветви легочной артерии приводит к прекращению кровоснабжения соответствующего региона легких, но вентиляция в нем сохраняется. В результате углекислый газ, находящийся в альвеолах пострадавшего участка, вымывается из них в течение нескольких дыхательных циклов, после чего альвеолы оказываются заполненными вдыхаемым газом с незначительной примесью С02. В функциональном плане такой регион превращается в альвеолярное мертвое пространство, объем которого определяется массивностью эмболии. Давайте уточним, каким образом это событие сказывается на легочном газообмене и проявляется при капнографии. В фазу выдоха газ из работающих зон легких смешивается с газом, поступающим из альвеолярного мертвого пространства, не содержащим СО2. В итоге концентрация СО2 в выдыхаемом газе уменьшается (рис. 2.18). Степень снижения зависит от объема альвеолярного мертвого пространства я, следовательно, от степени эмболии. Рис. 2.18. Капнограмма и тренд РetСО2 при массивной тромбоэмболии легочной артерии Первый и основной капнографический признак ТЭЛА - внезапное резкое падение РetСO2 В таких случаях необходим срочный анализ газового состава артериальной крови: наличие выраженного артерио-конечно-экспираторного различия РСО2 позволяет сузить "круг подозреваемых" до ТЭЛА и массивного кровотечения. На вентиляцию альвеолярного мертвого пространства расходуется часть минутного объема дыхания, и эта часть тем больше, чем массивнее объем поражения легких. Вентиляции функционирующих легочных зон за счет эффекта обкрадывания недостаточно для обработки всего минутного объема кровообращения, осуществляемого по "уцелевшей" части малого круга. Компенсаторная реакция при этом направлена на увеличение минутного объема дыхания и проявляется тахипноэ и возрастанием глубины дыхания - симптомами, весьма характерными для ТЭЛА. В том случае, когда массивная тромбоэмболия легочной артерии диагностируется у пациента в ходе ИВЛ, врач должен принять решение о соответствующем изменении режима вентиляции. " У пациента с тромбоэмболией легочной артерии низкий уровень РetС02 отнюдь не свидетельствует о гипервентиляции. В связи С возникновением альвеолярного мертвого пространства данный показатель полностью утрачивает свою первоначальную диагностическую роль и приобретает новую: степень падения РetСО2 дает ориентировочное представление о выраженности эмболии. Итак, перечислим типичные изменения капнограммы, обусловленные тромбоэмболией легочной артерии: • быстрое и резкое уменьшение РetСО2, не объяснимое другими причинами; • возникновение выраженного различия между РetС02 и РаСО2- признак альвеолярного мертвого пространства; • повышение частоты самостоятельного дыхания - необязательный, но частый симптом; • внезапность развития перечисленных изменений, что особенно наглядно демонстрируется на трендах РетСО2 и ЧД. По сути дела, все вышеперечисленные симптомы говорят не о ТЭЛА как таковой, а о неожиданном образовании в легких большого альвеолярного мертвого пространства. Следует, однако, помнить, что в списке вероятных причин данного нарушения диагноз ТЭЛА занимает почетное первое место. Вывод: капнография служит вспомогательным, но довольно чувствительным средством диагностики ТЭЛА. В некоторых случаях (например, у пациента, находящегося на длительной ИВЛ или у коматозных больных) изменения капнограммы подчас оказываются первыми симптомами, привлекающими внимание врача к катастрофе. В ситуациях, когда диагноз поставить сложно, капнограф применяется не в мониторном режиме, а для однократного замера показателей: обнаружение сниженного РetС02 и большой артерио-конечно-экспираторной разницы по СО2 - весомый аргумент в пользу диагноза ТЭЛА. случаях (например, у пациента, находящегося на длительной ИВЛ или у коматозных больных) изменения капнограммы подчас оказываются первыми симптомами, привлекающими внимание врача к катастрофе. В ситуациях, когда диагноз поставить сложно, капнограф применяется не в мониторном режиме, а для однократного замера показателей: обнаружение сниженного РetС02 и большой артерио-конечно-экспираторной разницы по СО2 - весомый аргумент в пользу диагноза ТЭЛА.
Капнография при прочих эмболиях малого круга
К частичной обструкции легочного кровотока приводят разнообразные причины, однако независимо от характера причин всем вариантам эмболии свойственно общее следствие: образование в легких некровоснабжаемых, но вентилируемых участков - альвеолярного мертвого пространства. В отличие от тромбоэмболии легочной артерии, когда прекращается приток крови к одному или нескольким крупным регионам, перечисленным ниже эмболиям присуще образование множественных мелкоочаговых поражений. И хотя объем каждого отдельного пораженного участка невелик, их суммарный функциональный эффект порой оказывается тяжелее, чем при массивной ТЭЛА.
Типичные для эмболии изменения капнограммы сводятся к появлению признаков альвеолярного мертвого пространства:
снижению PetCO2, возникновению аномально большой артерио-конечно-экспираторной разницы по СОа и увеличению частоты дыхания. На выраженность и скорость нарастания этих признаков влияют темп поступления эмболов в легочный кровоток и развитие вторичного поражения легочной ткани, которое обычно носит характер синдрома острых дыхательных расстройств (бывший РДСВ).
Форма капнограммы при эмболиях также изменяется: ее волны уплошаются, а в случаях, когда эмболиисопутствует бронхиолоспазм, капнограмма приобретает черты, которые имеют место при обструктивном типе (см. ниже).
Газовая эмболия в клинических условиях наблюдается, как правило, при выполнении всяческих вмешательств, манипуляций и процедур. Типичные ситуации, чреватые газовой эмболией:
• нейрохирургические операции с вскрытием синусов твердой мозговой оболочки; риск воздушной эмболии повышается в положении пациента сидя;
• ряд ситуаций в акушерской практике, сопровождающихся разгерметизацией венозной системы матки (третий период родов и ранний послеродовой период, отслойка плаценты, внутриматочные манипуляции и пр.); субклиническая форма воздушной эмболии отмечается приблизительно у половины пациенток, которым производят кесарево сечение;
• лапароскопии;
• рентгенологические исследования с газовым контрастированием;
• пункции легких и средостения, медиастиноскопия.
В перечисленных ситуациях риск развития газовой эмболии существенно повышается у пациентов с гиповолемией.
Капнография сегодня - самый дешевый, доступный и простой метод своевременного обнаружения газовой эмболии: Более чем в 50 % случаев газовой эмболии изменения капнограммы оказываются первым симптомом, привлекающим внимание врача к осложнению. При внезапном и резком падении РвтСОз часто отмечается синхронное снижение сатурации и артериальной гипотензии. Из четырех методов мониторинга, при которых показатели быстро реагируют при эмболии (капнография, пульсоксиметрия, ЭКГ, измерение артериального давления), лишь капнография предоставляет информацию для конкретного диагноза, остальные - сигнализируют о "какой-то катастрофе".
При абсорбции газового эмбола показатели капнограммы нормализуются.
Жировая эмболия сопровождается выраженным падением РетСО2. В самом начале процесса уменьшение этого показателя обусловлено в основном множественной обструкцией легочных микрососудов жировыми эмболами„а в последующем - повреждением легочной ткани свободными жирными кислотами, обра зующимся в результате липолиза. Развивается синдром острых дыхательных расстройств с присущими ему микротромбозом и деструкцией легочных микрососудов, что вызывает дальнейшее стойкое ухудшение показателей капнограммы.
Амниотической эмболии сопутствует обструкция легочного кровотока частицами сыровидной смазки, мекония и лануго, что приводит к появлению альвеолярного мертвого пространства и типичным изменениям РetС02. Затем причинами постоянного сниженного РetСО2 и значительной альвеоло-конечно-экспира-торной разницы по СО2 становятся ДВС-синдром, эмболия микросгустками вследствие массивных гемотрансфузий и синдром острых дыхательных расстройств. Массивная амниотическая эмболия с классическими клиническими симптомами диагностируется чрезвычайно редко, но субклинические или стертые формы этого синдрома встречаются гораздо чаще, чем принято считать.
Эмболия микросгустками - еще одна причина микроэмболий легких - происходит при гемотрансфузий. Количество микросгустков в донорской крови и плазме лавинообразно нарастает со сроком хранения, а применение специальных микрофильтров для внутривенных систем еще не пополнило список здоровых традиций отечественного здравоохранения. Капнография во время трансфузий позволяет в каждом случае оценить актуальность этой проблемы.
Микротромбозы малого круга - неотъемлемый компонент синдрома острых дыхательных расстройств. На самых ранних, доклинических стадиях синдрома часть легочных капилляров перекрывается агрегатами тромбоцитов и лейкоцитов (процесс тромбо-, лейкоагрегации и секвестрации); позднее возникают распространенные микротромбозы малого круга. Этот и другие процессы, нарушающие проходимость легочных микрососудов при РДС (деструкция капилляров, сжатие их высоким альвеолярным давлением при ИВЛ), вызывают образование мертвого пространства, на вентиляцию которого в тяжелых случаях расходуется до 70-80 % дыхательного объема.
У пациентов с синдромом острых дыхательных расстройств капнография абсолютно непригодна для обнаружения гипо- или гипервентиляции; у них единственным объективным ориентиром адекватности минутного объема вентиляции остается РaСО2.
Капнография при сердечно-легочной реанимации
Применение капнографии при остановке кровообращения обеспечивает врача информацией о состоянии больного и об эффективности реанимации. Капнография в этих случаях позволяет: своевременно обнаружить остановку кровообращения; контролировать действенность реанимационных мероприятий; ориентировочно оценить качество кровообращения после восстановления сердечных сокращений. Несомненные достоинства метода - его информативность, неинвазивность и возможность немедленного начала мониторинга после интубации трахеи. Немаловажен и тот факт, что на включение монитора и присоединение адаптера к интубационной трубке требуется лишь пара секунд. При остановке кровообращения прекращается поступление венозной крови в легкие. Вслед за этим в течение нескольких дыхательных циклов - самостоятельных или аппаратных - альвеолярный газ вымывается из легких и замещается атмосферным воздухом (рис. 2.19, участок В-С). Рис. 2.19. Тренд РetСО2 при остановке сердца и успешной реанимации (пояснения в тексте) Остановка кровообращения при сохраненном дыхании (самостоятельном или искусственном) сопровождается резким снижением РetСО2 почти до нуля. В случаях, когда остановке сердца предшествует остановка дыхания, капнограф регистрирует апноэ и "замораживает" на экране последнее значение РetСО2, которое может быть нормальным. Но и при этом монитор привлекает внимание персонала к катастрофе (апноэ), точный момент которой нетрудно установить по трендам. При проведении сердечно-легочной реанимации (СЛР) вентиляция кислородом или кислородно-воздушной смесью обеспечивает нормальную или близкую к нормальной оксигенацию артериальной крови. Однако минутный объем кровообращения при массаже сердца обычно в 3-5 раз меньше нормального, из-за чего оксигенация органов абсолютно недостаточна; вследствие этого быстро развивается выраженный метаболический ацидоз, который частично "гасится" бикарбонатным буфером организма с образованием значительного количества С02. Напряжение СОа в тканях и венозной крови нарастает с большой скоростью, и насыщенная углекислотой кровь при массаже сердца поступает в легкие. Во время реанимации удаление СО2 из организма в атмосферу нарушается. Малый кровоток не справляется с вымыванием С02 из тканей, а эффективность легочного газообмена резко снижается, и тому есть две причины. Во- первых, малый минутный объем кровообращения оказывается неспособным поддерживать достаточно высокое давление в легочной артерии, чтобы обеспечивать кровоснабжение всех легочных регионов, поэтому кровоток направляется преимущественно в нижние зоны легких, а верхние и средние отделы превращаются в альвеолярное мертвое пространство. Во- вторых, возросшее альвеолярное давление при ИВЛ, которая во время реанимации часто выполняется в режиме явной гипервентиляции, также способствует смещению капиллярного кровотока в нижние отделы легких. Исследования показали, что при стандартной СЛР 60-70 % дыхательного объема тратится на вентиляцию обескровленных альвеол, то есть альвеолярного мертвого пространства, а газообмен происходит лишь в 30-40 % легочной ткани. При проведении реанимационных мероприятий PetCO2 существенно уменьшается из-за нарушения доставки СО2 в легкие малым минутным объемом кровообращения и образования в легких выраженного альвеолярного мертвого пространства, резко снижающего эффективность вентиляции. Если при СЛР нет самостоятельных сердечных сокращений, непрямым массажем сердца обычно поддерживают РetС02 на уровне 0,5-2,5 % (рис. 2.19, участок C-D). Считается, что массаж сердца эффективен, если РетСО2 превышает 1 % (7- 8 мм рт. ст.). Невозможность поднять этот параметр до уровня 1 % - факт весьма показательный: он свидетельствует, как правило, о наличии дополнительных проблем, препятствующих действенной реанимации. К ним относятся: • интубация пищевода; • смещение интубационной трубки в бронх; • гиповолемия; • тампонада сердца; • напряженный пневмоторакс; • массивная ТЭЛА; • гипервентиляция; • несоблюдение методики СЛР. Подъем РетСО2 в ходе СЛР до 15 мм рт. ст. и выше - признак увеличения минутного объема кровообращения. Обычно это означает возобновление самостоятельного кровотока. При отсутствии электрокардиомонитора по данному признаку судят о восстановлении сердечной деятельности. При этом.не требуется прерывать реанимацию для пальпации пульса, да и сам метод не дает артефактов, столь свойственных ЭКГ. Если минутный объем кровообращения приближается к норме, РetС02 быстро возрастает до исходного уровня и даже может превысить его (рис. 2.19, участок E-F) на период, пока из организма не будут выведены излишки двуокиси углерода, накопившиеся за время реанимации (рис. 2.19, участок F-G). Следует помнить и о другой вероятной причине подъема PetCO2 во время реанимации - инфузии раствора гидрокарбоната натрия, который, попав в кровь и ткани, насыщенные лактатом и другими кислыми продуктами анаэробного метаболизма, нейтрализует их с образованием большого количества СО-.» и существенным усилением респираторного компонента ацидоза. Внутривенное введение раствора гидрокарбоната натрия при СЛР вызывает резчайшее увеличение содержания СО2 в венозной крови, притекающей к легким, и соответствующий подъем РetСО2 (рис. 2.19, участок D-E). После внутривенного введения раствора гидрокарбоната натрия во время реанимации напряжение С0;в венозной крови порой достигает 100- 130 мм рт. ст. (нормальный уровень - 46 мм рт. ст.). В клинической практике нередко встречаются ситуации, когда появление на ЭКГ нормальной (или напоминающей нормальную) биоэлектрической активности сердца не сопровождается восстановлением кровообращения (ЭМД - электромеханическая диссоциация)**. Если это явление не распознать в нужный момент и прекратить массаж сердца, создается реальная угроза необратимого повреждения головного мозга. Сегодня капногра-фия - пожалуй, единственный доступный в широкой практике объективный метод, который позволяет сразу оценить эффективность сердечных сокращений и принять решение о прекращении или продолжении массажа сердца. В случаях, когда возникновению сердечного ритма на ЭКГ не сопутствует быстрый и существенный подъем Рщ-СОд, необходимо продолжать массаж сердца и медикаментозную терапию до восстановления эффективных сердечных сокращений. Опасно играть в числа в медицине. Однако, с прправкой на конкретные обстоятельства, допустимо использование нескольких правил: • Внезапное, в течение 5-10 дыхательных' циклов, падение РetСО2 почти до нуля - характерный признак остановки кровообращения (рис. 2.19, участок В-С). • Сразу после начала реанимационных мероприятий наблюдается подъем РетСО2 до 0,5-2,5 % (рис. 2.19, участок C-D). • Если величина РетС02 в процессе реанимации оказывается в пределах 1-2,5 %, это свидетельствует о нормальной эффективности массажа сердца. • При РeтСО2 ниже 1 %, что говорит о недостаточной эффек-. живности непрямого массажа, необходимо решать вопрос о переходе на открытый массаж, который обычно обеспечивает больший объем кровотока. •Внутривенное введение гидрокарбоната натрия вызывает увеличение РетСО2 которое не имеет отношения к эффективности массажа сердца (рис. 2.19, участок D-E). • Быстрый подъём РetС02 до нормального уровня или выше - признак восстановления эффективных сердечных сокращений (рис. 2.19, участок E-F). • Низкий уровень РetС02 после восстановления сердечного ритма на ЭКГ - это признак электромеханической диссоциации и серьезный аргумент против отмены первичных реанимационных мероприятий.
Капнография при обструктивном синдроме
Увеличение сопротивления дыхательных путей имеет два проявления на капнограмме: пологое восходящее колено дыхательной волны и увеличение PetCO2. Первый симптом нередко связан со снижением скорости выдоха и наблюдается при серьезной обструкции. Рост РetСО2 в острых случаях свидетельствуете неспособности дыхательной мускулатуры обеспечивать нормальный объем легочной вентиляции (рис. 2.20). У пациентов с хронической обструктивной патологией отмечается стойкое повышение уровня РetСО2, обусловленное перенастройкой дыхательного центра на более выгодный в энергетическом отношении режим дыхания. При выполнении таким больным искусственной вентиляции легких не нужно стремиться к насильственной нормализации РетСО2, впоследствии это может существенно затруднить восстановление самостоятельного дыхания. Капнография у пациентов с хронической обструктивной патологией и стойкой гипоксемией позволяет определять гиповентиляцию, возникающую в ответ на ингаляцию кислорода, и таким образом контролировать оксигенотерапию. Рис. 2.20. Капнограмма при обструктивном синдроме
This file was created
with BookDesigner program
bookdesigner@the-ebook.org
21.02.2008
Страницы:
1, 2, 3, 4, 5, 6, 7, 8, 9, 10
|
|