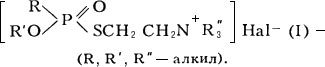(затравки) при 370 °С в течение 8
сут.Чёрный Ф. представляет собой кристаллы ромбической структуры (
а=
3,31
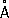
,
b= 4,38
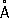
,
с=
10,50
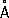
), решётка построена из волокнистых слоев с характерным для Ф. пирамидальным расположением атомов, плотность 2,69
г/см
3, t
плоколо 1000 °С под давлением 1,8Ч10
3
Мн/м
2(18Ч10
3
кгс/см
2)
.По внешнему виду чёрный Ф. похож на графит; полупроводник: ширина запрещенной зоны 0,33
эвпри 25 °С; имеет удельное электросопротивление 1,5
омЧ
см,температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость – 0,27Ч10
-6. При нагревании до 560–580 °С под давлением собственных паров превращается в красный Ф. Чёрный Ф. малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.
Атомный радиус Ф. 1,34
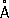
, ионные радиусы: P
5 +0,35
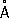
, P
3 +0,44
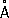
, P
3-1,86
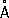
.
Атомы Ф. объединяются в двухатомные (P
2), четырёхатомные (P
4) и полимерные молекулы. Наиболее стабильны при нормальных условиях полимерные молекулы, содержащие длинные цепи связанных между собой P
4– тетраэдров. В жидком, твёрдом виде (белый Ф.) и в парах ниже 800 °С Ф. состоит из молекул P
4. При температурах выше 800 °С молекулы P
4диссоциируют на P
2
,которые, в свою очередь, распадаются на атомы при температуре свыше 2000 °С. Только белый Ф. состоит из молекул P
4, все остальные модификации – полимеры.
Химические свойства. Конфигурация внешних электронов атома Ф. 3
s
23
p
3,в соединениях наиболее характерны степени окисления + 5, + 3, и – 3. Подобно азоту, Ф. в соединениях главным образом ковалентен. Ионных соединений, подобных фосфидам Na
3P, Ca
3P
2, очень мало. В отличие от азота, Ф. обладает свободными 3
d-opбиталями с довольно низкими энергиями, что приводит к возможности увеличения координационного числа и образованию донорно-акцепторных связей.
Ф. химически активен, наибольшей активностью обладает белый Ф.; красный и чёрный Ф. в химических реакциях гораздо пассивнее. Окисление белого Ф. происходит по механизму
.Окисление Ф. обычно сопровождается хемилюминесценцией. При горении Ф. в избытке кислорода образуется пятиокись P
4O
10(или P
2O
5), при недостатке – в основном трёхокись P
4O
6(или P
2O
3). Спектроскопически доказано существование в парах P
4O
7, P
4O
8
,P
2O
6, PO и др.
.Пятиокись Ф. получают в промышленных масштабах сжиганием элементарного Ф. в избытке сухого воздуха. Последующая гидратация P
4O
10приводит к получению орто- (Н
3РО
4) и поли- (Н
n + 2
P
n
O
3
п+ 1) фосфорных кислот. Кроме того, Ф. образует
H
3PO
3,
H
4P
2O
6и
H
3PO
2, а также надкислоты: надфосфорную H
4P
2O
8и мононадфосфорную H
3PO
5Широкое применение находят соли фосфорных кислот (
)
,в меньшей степени –
и гипофосфиты.
Ф. непосредственно соединяется со всеми галогенами с выделением большого количества тепла и образованием тригалогенидов (PX
3, где Х – галоген), пентагалогенидов (PX
5) и оксигалогенидов (например, POX
3) (см.
)
.При сплавлении Ф. с серой ниже 100 °С образуются твёрдые растворы на основе Ф. и серы, а выше 100 °С происходит экзотермическая реакция образования кристаллических сульфидов P
4S
3, P
4S
5, P
4S
7, P
4S
10, из которых только P
4S
5при нагревании выше 200 °С разлагается на P
4S
3и P
4S
7, а остальные плавятся без разложения. Известны оксисульфиды фосфора: P
2O
3S
2, P
2O
3S
3, P
4O
4S
3, P
6O
10S
5и P
4O
4S
3. Ф. по сравнению с азотом менее способен к образованию соединений с водородом. Фосфористый водород фосфин PH
3и дифосфин P
2H
4могут быть получены только косвенным путём. Из соединений Ф. с азотом известны нитриды PN, P
2N
3, P
3N
5– твёрдые, химически устойчивые вещества, полученные при пропускании азота с парами Ф. через электрическую дугу; полимерные фосфонитрилгалогениды – (PNX
2)
n(например,
)
,полученные взаимодействием пентагалогенидов с аммиаком при различных условиях; амидоимидофосфаты – соединения, как правило, полимерные, содержащие наряду с Р–О–Р связями Р–NH–Р связи.
При температурах выше 2000°C Ф. реагирует с углеродом с образованием карбида PC
3– вещества, не растворяющегося в обычных растворителях и не взаимодействующего ни с кислотами, ни со щелочами. При нагревании с металлами Ф. образует
. Ф. образует многочисленные
. Получение. производство элементарного Ф. осуществляется электротермическим восстановлением его из природных фосфатов (апатитов или фосфоритов) при 1400–1600 °С коксом в присутствии кремнезёма (кварцевого песка):
2Ca
3(PO
4)
2+ 10C +
nSiO
2= P
4+ 10CO + 6CaOЧ
nSiO
2
Предварительно измельченная и обогащенная фосфорсодержащая руда смешивается в заданных соотношениях с кремнезёмом и коксом и загружается в электропечь. Кремнезём необходим для снижения температуры реакции, а также увеличения ее скорости за счет связывания выделяющейся в процессе восстановления окиси кальция в силикат кальция, который непрерывно удаляется в виде расплавленного шлака. В шлак переходят также силикаты и окислы алюминия, магния, железа и др. примеси, а также феррофосфор (Fe
2P, FeP, Fe
3P), образующийся при взаимодействии части восстановленного железа с Ф. Феррофосфор, а также растворённые в нём небольшие количества фосфидов марганца и др. металлов по мере накопления удаляются из электропечи с целью последующего использования при производстве специальных сталей.
Пары Ф. выходят из электропечи вместе с газообразными побочными продуктами и летучими примесями (CO, SiF
4, PH
3, пары воды, продукты пиролиза органических примесей шихты и др.) при температуре 250–350 °С. После очистки от пыли содержащие фосфор газы направляют в конденсационные установки, в которых при температуре не ниже 50 °С собирают под водой жидкий технический белый Ф.
Разрабатываются методы получения Ф. с применением газообразных восстановителей, плазменных реакторов с целью интенсификации производства за счёт повышения температур до 2500–3000 °С, т. е. выше температур диссоциации природных фосфатов и газов-восстановителей (например, метана), используемых в качестве транспортирующего газа в низкотемпературной плазме.
Применение. Основная масса производимого Ф. перерабатывается в
и получаемые на её основе
и технические соли (
)
. Белый Ф. используется в зажигательных и дымовых снарядах, бомбах; красный Ф. – в спичечном производстве. Ф. применяется в производстве сплавов цветных металлов как раскислитель. Введение до 1% Ф. увеличивает жаропрочность таких сплавов, как фехраль, хромаль. Ф. входит в состав некоторых бронз, т.к. повышает их жидкотекучесть и стойкость против истирания. Фосфиды металлов, а также некоторых неметаллов (В, Si, As и т.п.) используются при получении и легировании
.Частично Ф. применяется для получения хлоридов и сульфидов, которые служат исходными веществами для производства фосфорсодержащих
(например, трикрезилфосфат, трибутилфосфат и др.), медикаментов,
,а также применяются в качестве добавок в смазочные вещества и в горючее.
Техника безопасности. Белый Ф. и его соединения высокотоксичны. Работа с Ф. требует тщательной герметизации аппаратуры; хранить белый Ф. следует под водой или в герметически закрытой металлической таре. При работе с Ф. следует строго соблюдать правила техники безопасности.
Л. В. Кубасова.
Ф. в организме. Ф. – один из важнейших
,необходимый для жизнедеятельности всех организмов. Присутствует в живых клетках в виде орто- и пирофосфорной кислот и их производных, а также входит в состав
,
,фосфопротеидов,
,фосфорных эфиров углеводов, многих коферментов и др. органических соединений. Благодаря особенностям химического строения атомы Ф., подобно атомам серы, способны к образованию богатых энергией связей в
;аденозинтрифосфорной кислоте (АТФ), креатин фосфате и др. (см.
)
.В процессе биологической эволюции именно фосфорные соединения стали основными, универсальными хранителями генетической информации и переносчиками энергии во всех живых системах. Др. важная роль соединений Ф. в организме заключается в том, что ферментативное присоединение фосфорильного остатка (
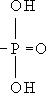
) к различным органическим соединениям (
) служит как бы «пропуском» для их участия в
,и, наоборот, отщепление фосфорильного остатка (дефосфорилирование) исключает эти соединения из активного обмена. Ферменты обмена Ф. –
,
и
.Главную роль в превращениях соединений Ф. в организме животных и человека играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D.
Содержание Ф. (в
мгна 100
гсухого вещества) в тканях растений – 230–350, морских животных – 400–1800, наземных – 1700–4400, у бактерий – около 3000; в организме человека особенно много Ф. в костной ткани (несколько более 5000), в тканях мозга (около 4000) и в мышцах (220–270). Суточная потребность человека в Ф. 1–1,2
г(у детей она выше, чем у взрослых). Из продуктов питания наиболее богаты Ф. сыр, мясо, яйца, зерно бобовых культур (горох, фасоль и др.). Баланс Ф. в организме зависит от общего состояния обмена веществ. Нарушение фосфорного обмена приводит к глубоким биохимическим изменениям, в первую очередь в энергетическом обмене. При недостатке Ф. в организме у животных и человека развиваются остеопороз и др. заболевания костей, у растений – фосфорное голодание (см.
)
.Источником Ф. в живой природе служат его неорганические соединения, содержащиеся в почве и растворённые в воде. Из почвы Ф. извлекается растениями в виде растворимых фосфатов. Животные обычно получают достаточное количество Ф. с пищей. После гибели организмов Ф. вновь поступает в почву и донные отложения, участвуя т. о. в
.Важная роль Ф. в регуляции обменных процессов обусловливает высокую чувствительность многих ферментных систем живых клеток к действию фосфорорганических соединений. Это обстоятельство используют в медицине при разработке лечебных препаратов, в сельском хозяйстве при производстве
,а также при создании эффективных
.Многие соединения Ф. чрезвычайно токсичны и некоторые из фосфорорганических соединений могут быть причислены к боевым отравляющим веществам (зарин, зоман, табун). Радиоактивный изотоп Ф.
32P широко используют в биологии и медицине как индикатор при исследовании всех видов обмена веществ и энергии в живых организмах (см.
)
.
Н. Н. Чернов.
Отравления Ф. и его соединениями наблюдаются при их термоэлектрической возгонке, работе с белым Ф., производстве и применении фосфорных соединений. Высокотоксичны
,оказывающие антихолинэстеразное действие. Ф. проникает в организм через органы дыхания, желудочно-кишечный тракт, кожу. Острые отравления проявляются жжением во рту и желудке, головной болью, слабостью, тошнотой, рвотой. Через 2–3
сутвозникают боли в подложечной области, правом подреберье, желтуха. Для хронических отравлений характерны воспаление слизистых оболочек верхних дыхательных путей, признаки токсического гепатита, нарушение кальциевого обмена (развитие
,ломкость, иногда омертвение костной ткани, чаще – на нижней челюсти), поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении через рот (наиболее частом) – промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы, хлористого кальция и др. При ожогах кожи – обработать пораженные участки растворами медного купороса или соды. Глаза промывают 2%-ным раствором питьевой соды. Профилактика: соблюдение правил техники безопасности, личная гигиена, уход за полостью рта, раз в 6
мес –медицинские осмотры работающих с Ф.
Лекарственные препараты, содержащие Ф. (аденозинтрифосфорная кислота, фитин, глицерофосфат кальция, фосфрен и др.), влияют главным образом на процессы тканевого обмена и применяются при заболеваниях мышц, нервной системы, при туберкулёзе, упадке питания, малокровии и др. Радиоактивные изотопы Ф. используют в качестве
для изучения обмена веществ, диагностики заболеваний, а также для лучевой терапии опухолей (см. также
)
.
А. А. Каспаров.
Лит.:Краткая химическая энциклопедия, т. 5, М., 1967; Коттон Ф., Уилкинсон Дж., Современная неорганическая химия, пер. с англ., ч. 2, М., 1969; Везер Ван-Дж.. Фосфор и его соединения, пер. с англ., т. 1, М., 1962; Ахметов Н. С., Неорганическая химия, 2 изд., М., 1975; Некрасов Б. В., Основы общей химии, 3 изд., т. 1–2, М., 1973; Моссэ А. Л., Печковский В. В., Применение низкотемпературной плазмы в технологии неорганических веществ, Минск, 1973; Горизонты биохимии, Сб. ст., пер. с англ., М., 1964; Рапопорт С. М., Медицинская биохимия, пер, с нем., М., 1966; Скулачев В. П., Аккумуляция энергии в клетке, М., 1969; Происхождение жизни и эволюционная биохимия, М., 1975.
Фосфора галогениды
Фо'сфора галогени'ды,соединения фосфора с галогенами, из которых важны и хорошо изучены тригалогениды PX
3(где Х – галоген): PF
3, PCl
3, PBr
3; пентагалогениды PX
5: PF
5, PCl
5, PBr
5. Известны, но менее изучены моногалогениды PX (например, PCl, PBr); дигалогениды P
2X
4(например, P
2C
4, P
2F
4); смешанные Ф. г. типа PFCl
2, PF
3Cl
2; полигалогениды, содержание галогена в которых более пяти (например, PBr
7, PCl
6I), и оксигалогениды (например, POCl
3, POF
з).
Ф. г. чрезвычайно реакционноспособны, причём химическая активность уменьшается от фторидов к иодидам; в вакууме перегоняются без разложения, водой легко гидролизуются. Ф. г. способны образовывать соединения типа PCl
3Ч5NH
3в безводных средах. Из Ф. г. наиболее изучены трихлорид и пентахлорид фосфора.
Трихлорид фосфора (трёххлористый фосфор) PCl
3, бесцветная жидкость,
t
пл.– 93,6 °С,
t
кип
76,1 °C, плотность 1,575
г/см
3при 20 °С; растворим в эфире, бензоле, хлороформе, сероуглероде, четырёххлористом углероде. Легко гидролизуется, образуя фосфористую и соляную кислоты. Получают хлорированием белого фосфора в растворе PCl
3(в лабораторных условиях белый фосфор заменяют красным). Используют для синтеза фосфорорганических соединений. PCl
3токсичен, вызывает ожоги, раздражает глаза, дыхательные пути.
Пентахлорид фосфора (пятихлористый фосфор) PCl
5, зеленовато-белые кристаллы,
t
пл167 °С (в запаянной трубке), плотность 2,11
г/см
3,легко сублимируется, растворим в четырёххлористом углероде и сероуглероде, в воде гидролизуется с образованием оксихлорида POCl
3и соляной кислоты. Получают хлорированием PCl
3. Используется в основном как хлорирующий реагент в органическом синтезе. PCl
3токсичен.
Л. В. Кубасова.
Лит.см. при ст.
.
Фосфора окислы
Фо'сфора о'кислы,соединения фосфора с кислородом. Известны: недоокись P
4O, закись P
4O
2(P
2O), перекись P
2O
6(PO
3), трёхокись, или фосфористый ангидрид P
4O
6(P
2O
3), пятиокись, или фосфорный ангидрид P
4O
10(P
2O
5), четырёхокись (PO
2)
n
. Наибольшее значение имеют фосфорный ангидрид, фосфористый ангидрид и четырёхокись фосфора.
Фосфорный ангидрид P
4O
10(P
2O
5), белый чрезвычайно гигроскопичный порошок, склонный к полиморфизму (число модификаций точно не установлено); в P
4O
10атом фосфора окружен четырьмя атомами кислорода (структура тетраэдра), причём три из них служат вершинами трёх смежных РО
4-тетраэдров, образуя Р–О–Р связи. Товарный продукт – белая, снегоподобная масса (плотность 2,28–2,31
г/см
3,температура возгонки 358–362 °С,
t
пл420 °С), содержащая в основном кристаллическую гексагональную модификацию (т. н. Н-форму) с примесью аморфной модификации. Состав Н-формы – P
4O
10; остальные две кристаллические модификации полимерного строения менее изучены. Фосфорный ангидрид обладает сильным дегидратирующим действием, позволяющим удалять из веществ не только адсорбированную воду, но и кристаллизационную и даже конституционную (структурную, химически связанную). Фосфорный ангидрид растворяется в воде с выделением тепла, образуя полимерные фосфорные кислоты (циклические и линейные), а в конечном счёте, при достаточно большом количестве воды – ортофосфорную кислоту. При взаимодействии с основными окислами образуются фосфаты, с галогенидами – оксигалогениды, с металлами – смесь фосфатов и фосфидов; легко реагирует со всеми органическими веществами основного типа. Фосфорный ангидрид реагирует с сухим и влажным аммиаком, образуя
аммония, содержащие наряду с Р–О–Р связями Р–NH–Р связи. Под действием света P
4O
10люминесцирует.
В промышленных масштабах P
4O
10получают сжиганием элементарного фосфора в избытке сухого воздуха с последующей конденсацией твёрдого продукта из паров. Очищают P
4O
10от примесей (фосфорных кислот), возгонкой. Фосфорный ангидрид в виде паров или дыма сушит слизистые оболочки, вызывает кашель, удушье, отёк лёгких, ожоги на коже, поэтому при работе с ним следует соблюдать правила техники безопасности.
Применяют фосфорный ангидрид для удаления воды из газов и жидкостей (не реагирующих с P
4O
10)
,в органических и неорганических синтезах как конденсирующий агент, иногда как компонент фосфатных стекол и катализатор.
Фосфористый ангидрид P
4O
6(P
2O
3), бесцветное хлопьевидное вещество, кристаллическая структура моноклинная, плотность 2,135
г/см
2,
t
пл23,8 °С,
t
кип175,4 °С, растворяется в сероуглероде и бензоле. При растворении P
4O
6в холодной воде образуется фосфористая кислота H
3PO
3, а в горячей воде – элементарный фосфор, фосфин, фосфорная кислота и др. соединения. При нагревании выше 210 °С трёхокись фосфора разлагается на PO
2и красный фосфор. Легко окисляется воздухом до пятиокиси. Получают трёхокись окислением фосфора при ограниченном доступе воздуха. Трёхокись фосфора широко используется в органических синтезах.
Четырёхокись фосфора (PO
2)
n
, белый хлопьевидный порошок, после возгонки которого образуются блестящие кристаллы; плотность 2,54
г/см
3при 22,6 °С; имеются данные о полимерном строении четырёхокиси. Хорошо растворима в воде, образует с ней в основном H
3PO
3и конденсированные полифосфорные кислоты, а также небольшое количество PH
3. Может быть получена, подобно трёхокиси, сжиганием фосфора при низкой температуре с ограниченным количеством воздуха или нагреванием P
4O
6в запаянной трубке при 250 °С с последующей очисткой.
Лит.см. при ст.
.
Л. В. Кубасова.
Фосфоресценция
Фосфоресце'нция,
,продолжающаяся значительное время после прекращения возбуждения (в отличие от
)
.Разделение люминесценции по длительности послесвечения на Ф. и флуоресценцию весьма условно, по существу устарело, т.к. не отражает механизма процесса преобразования энергии. Ф. продолжается иногда несколько часов и даже суток, а иногда – несколько микросекунд.
Ф.
возникает при рекомбинации электронов и дырок, разделённых во время возбуждения. Затягивание послесвечения в этом случае связано с захватом электронов и дырок ловушками (см. рис. 3 в ст.
)
,из которых они могут освободиться, лишь получив дополнительную энергию, определяемую глубиной ловушки. Ф. сложных органических молекул связана с пребыванием молекул в
,вероятность перехода из которого в основное состояние мала.
Яркость Ф. органических молекул уменьшается со временем обычно по экспоненциальному закону. Закон затухания Ф. кристаллофосфоров сложен, в ряде случаев он приближённо описывается формулой Беккереля:
В=
B
0(1 +
at)
-
a
,где
t –время,
аи a– постоянные, а
B
0
–начальная яркость. Сложность закона обусловлена наличием в кристаллофосфорах ловушек разных сортов. Повышение температуры кристаллофосфоров, как правило, ускоряет затухание.
От интенсивности возбуждения затухание Ф. зависит только в случае рекомбинационной люминесценции. Например, начальные стадии Ф. кристаллофосфоров резко ускоряются при увеличении интенсивности возбуждения. На поздних стадиях яркость Ф. мало зависит от интенсивности возбуждения (асимптотическое свойство кривых затухания). На Ф. кристаллофосфоров влияет также освещение инфракрасным светом и включение электрического поля.
Лит.см. при ст.
.
Фосфорилазы
Фосфорила'зы,ферменты класса трансфераз. Катализируют обратимые реакции переноса гликозильных групп (остатков моносахаридов) на ортофосфат (фосфоролиз). Фосфорилазная реакция может быть представлена уравнением: А – Г + Ф
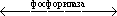
А + Г – Ф, где Г – гликозильная группа, А – акцептор гликозильной группы, Ф – ортофосфат. Известны 7 ферментов, переносящих гексозильные (от полисахаридов и дисахаридов), и 8 – переносящих пентозильные группы (от нуклеозидов). Обладают высокой степенью специфичности к переносимой гликозильной группе, в отношении акцептора такая специфичность наблюдается не всегда. Ф. имеют универсальное распространение в природе, встречаются у простейших, в животных и растительных тканях. Играют важную роль в живых организмах, катализируя ключевые реакции метаболизма, связанные с использованием запасных углеводов, а следовательно, с обеспечением клеток энергией. Изучение Ф. значительно способствовало развитию энзимологии: на примере фосфорилазных реакций была исследована модель макромолекулярного синтеза, связывание фермента с субстратом, аллостерическая регуляция активности фермента и возможность диссоциации ферментов на субъединицы, каталитическое превращение фермента из неактивной формы в активную. Наиболее хорошо изучены Ф., катализирующие расщепление запасных углеводов –
и
.
В. В. Зуевский.
Фосфорилирование
Фосфорили'рование,замещение атома водорода в молекулах химических соединений остатком кислот фосфора, чаще всего фосфорной кислоты. Наиболее легко фосфорилируются первичные и вторичные амины, спирты, меркаптаны и др. нуклеофильные соединения. Ф. могут быть подвергнуты также углеводороды (радикальный механизм) и алкилгалогениды (ионный механизм). Фосфорилирующими агентами служат кислоты фосфора и их производные, чаще всего галоген-ангидриды, ангидриды, реже эфиры, амиды и др. Например:
ROH + ClP (O)(OR')
2(ROP (O)(OR')
2+ HCl
3R
2NH + PCl
3(P (NR
2)
3+ 3HCl.
При Ф. кислоты фосфора применяют обычно вместе с конденсирующими средствами (например, карбодиимидами, сульфохлоридами). Способность к Ф. зависит от валентности фосфора в фосфорилирующсм реагенте – более реакционноспособны производные фосфора (III). Ф. широко используется при синтезе негорючих материалов, пластификаторов, экстрагентов, пестицидов, лекарственных и др. важных веществ. Ф. занимает важнейшее место в обмене веществ и энергии в клетках животных, растений, микроорганизмов. Катализируется ферментами и происходит либо в результате
,либо вследствие фосфокиназных реакций:
А–Б + В–Н
2РО
3® А–Н
2РО
3+ Б–В,
где А–Б – молекула, принимающая фосфорильную группу (акцептор), а В–H
2PO
3– молекула, отдающая фосфорильную группу (донор). Донором фосфорильной группы служат молекулы аденозинтрифосфорной кислоты (АТФ) и др. нуклеозидтрифосфатов. В процессе обмена веществ Ф. подвергаются различные низкомолекулярные соединения, а также белки. Ф. аденозиндифосфорной кислоты неорганической фосфорной кислотой служит основным механизмом образования АТФ и аккумуляции энергии, необходимой для процессов биосинтеза, механической, электрической и осмотической активностей клеток; осуществляется полиферментными системами за счёт реакций окисления низкомолекулярных органических соединений либо в анаэробных условиях (гликолитическое Ф.), либо кислородом (
)
.Ф. аденозиндифосфорной кислоты при фотосинтезе с образованием АТФ называется фотофосфорилированием.
Э. Е. Нифантьев, А. Д. Виноградов.
Фосфорилтиохолины
Фосфорилтиохоли'ны,фосфорилированные аналоги
,
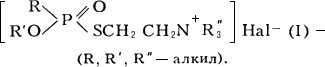
кристаллические вещества, растворимые в воде. К этому же типу веществ относятся и соединения, содержащие третичный атом азота,
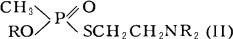
,
высококипящие жидкости, ограниченно растворимые в воде, хорошо – в некоторых органических растворителях, водой практически не омыляются; могут быть получены следующей реакцией:
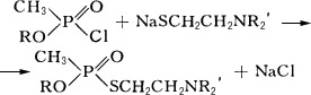
(III).
Ф. – мощные
нервно-паралитического действия; соединения типа II известны как V-газы. В отличие от соединений типа I, соединения типа II обладают очень высокой кожно-резорбтивной токсичностью (см.
):
смертельная доза для человека около 8–10
мг.Токсичность соединений I обусловлена тем, что они вследствие структурного сходства с
ацетил-холином способны вместо него взаимодействовать с активными центрами фермента
и ингибировать их; соединения II, по-видимому, превращаются в организме в I и действуют аналогично им. Защитой от V-газов служат
и защитная одежда (см.
)
,средством терапии –
.Оба типа соединений энергично взаимодействуют с хлорирующими агентами, что может быть использовано для дегазации Ф.
Р. Н. Стерлин.
Фосфорилтиохолины.
Фосфористая кислота
Фо'сфористая кислота',H
3PO
3, слабая двухосновная кислота. Безводная Ф. к. – бесцветные гигроскопичные кристаллы, плотность 1,65
г/см
3, t
пл70,1 °С. Константы диссоциации Ф. к. при 18 °С: K
1= 5,1Ч10
-2K
2= 1,8Ч10
-7. Растворимость при 20 °С около 80%. При нагревании до 250 °С безводная Ф. к. разлагается на
и
,а водные её растворы – на фосфорную кислоту и водород. Ф. к. легко окисляется галогенами, окислами азота и пр. Получают Ф. к. растворением P
4O
6(P
2O
3) в холодной воде, гидролизом PCl
3или взаимодействием
с серной кислотой. Ф. к. и её соли применяют как восстановители.
Лит.см. при ст.
.
Фосфористый ангидрид
Фо'сфористый ангидри'д,трёхокись фосфора, оксид фосфора (III), P
4O
6(P
2O
3), ангидрид фосфористых кислот (см.
)
.
Фосфоритная мука
Фосфори'тная мука',минеральное
.Серый или бурый порошок тонкого помола, нерастворим в воде, не слёживается, хорошо рассевается. Содержит 19–30% P
2O
5в виде малодоступного растениям Ca
3(PO
4)
2с примесью CaCO
3, CaF
2и др. Получают Ф. м. измельчением желваковых, зернистых и некоторых карстовых
.Применяют на кислых подзолистых, серых лесных, болотных почвах, выщелоченных чернозёмах, краснозёмах в качестве
(вносят осенью под вспашку). В кислой среде фосфор Ф. м. постепенно переходит в доступную растениям форму – Ca (H
2PO
4)
2ЧH
2O. Наиболее эффективна на суглинках и глинах при использовании под люпин, горчицу, гречиху, горох и др. культуры, корневые выделения которых подкисляют почву. На известкованных и хорошо унавоженных почвах Ф. м. не применяют. Доза Ф. м. 40–90
кг/гаP
2O
5. Удобрение используют также для приготовления
.
Производство Ф. м. в СССР (тыс.
тP
2O
5): 90 в 1940, 90 в 1950, 265 в 1960, 973 в 1970, 1059 в 1975. За рубежом Ф. м. применяют в основном в США, Канаде.
Лит.см. при ст.
.
Фосфоритный
Фосфори'тный,посёлок городского типа в Воскресенском районе Московской области РСФСР. Ж.-д. станция в 13
кмк В. от г. Воскресенска. Добыча фосфоритов.
Фосфоритовые месторождения Северной Америки
Фосфори'товые месторожде'ния Се'верной Аме'рики,группа месторождений фосфоритов, сосредоточенных преимущественно в западных штатах США (формация Фосфория), а также во Флориде, Сев. Каролине и Теннесси.
В западных штатах (Юта, Айдахо, Вайоминг, Монтана и Невада) месторождения
расположены в пределах геосинклинали Скалистых гор и западной окраины Северо-Американской платформы; приурочены к нижне-средне-пермской формации Фосфория со средней мощностью до 180
м;распространены на площади около 180 000
км
2,среди них выделяются две выдержанные пачки фосфоритов, а также пачки кремней и доломитов. Характерны пластовые Ф. пеллетового и оолитового строения с карбонатным цементом. Содержание P
2O
5колеблется от 19 до 36%. Фосфориты обогащены органическим веществом и содержат малые концентрации U, V, Se и др. металлов. В пределах бассейна расположено несколько десятков месторождений с запасами 7,7 млрд.
тпри среднем содержании P
2O
525%. Общие прогнозные запасы оцениваются в 23,4 млрд.
т(1971).
Во Флориде залежи фосфоритов в пределах платформы связаны со среднемиоценовой формацией Хауторн, залегающей на площади 17 000
км
2и сложенной песками, доломитами и глинами, в которых рассеяны зёрна фосфоритов. Запасы фосфоритов значительны, но концентрации низкие и не имеют промышленного значения. В плиоценовое время за счёт размыва и обогащения фосфоритоносных толщ Хауторн, в центральных частях штата в формации Боун-Валли сформировались линзы и прослои галечников, содержащих в среднем 15% P
2O
5при мощности до 7,5
м;запасы фосфоритов в них превышают 1 млрд.
т.На С.-З. полуострова Флорида в плиоценовой формации Алачуа залегают твёрдые фосфориты со средним содержанием P
2O
533–36%; они возникли в результате выщелачивания пород формации Хауторн и закарстования подстилающих её олигоцен-эоценовых известняков.

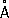 ,
b= 4,38
,
b= 4,38
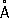 ,
с=
10,50
,
с=
10,50
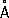 ), решётка построена из волокнистых слоев с характерным для Ф. пирамидальным расположением атомов, плотность 2,69
г/см
3, t
плоколо 1000 °С под давлением 1,8Ч10
3
Мн/м
2(18Ч10
3
кгс/см
2)
.По внешнему виду чёрный Ф. похож на графит; полупроводник: ширина запрещенной зоны 0,33
эвпри 25 °С; имеет удельное электросопротивление 1,5
омЧ
см,температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость – 0,27Ч10
-6. При нагревании до 560–580 °С под давлением собственных паров превращается в красный Ф. Чёрный Ф. малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.
), решётка построена из волокнистых слоев с характерным для Ф. пирамидальным расположением атомов, плотность 2,69
г/см
3, t
плоколо 1000 °С под давлением 1,8Ч10
3
Мн/м
2(18Ч10
3
кгс/см
2)
.По внешнему виду чёрный Ф. похож на графит; полупроводник: ширина запрещенной зоны 0,33
эвпри 25 °С; имеет удельное электросопротивление 1,5
омЧ
см,температурный коэффициент электросопротивления 0,0077, диамагнитен, удельная магнитная восприимчивость – 0,27Ч10
-6. При нагревании до 560–580 °С под давлением собственных паров превращается в красный Ф. Чёрный Ф. малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.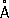 , ионные радиусы: P
5 +0,35
, ионные радиусы: P
5 +0,35
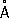 , P
3 +0,44
, P
3 +0,44
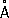 , P
3-1,86
, P
3-1,86
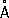 .
.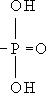 ) к различным органическим соединениям (
) служит как бы «пропуском» для их участия в
,и, наоборот, отщепление фосфорильного остатка (дефосфорилирование) исключает эти соединения из активного обмена. Ферменты обмена Ф. –
,
и
.Главную роль в превращениях соединений Ф. в организме животных и человека играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D.
) к различным органическим соединениям (
) служит как бы «пропуском» для их участия в
,и, наоборот, отщепление фосфорильного остатка (дефосфорилирование) исключает эти соединения из активного обмена. Ферменты обмена Ф. –
,
и
.Главную роль в превращениях соединений Ф. в организме животных и человека играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D.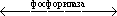 А + Г – Ф, где Г – гликозильная группа, А – акцептор гликозильной группы, Ф – ортофосфат. Известны 7 ферментов, переносящих гексозильные (от полисахаридов и дисахаридов), и 8 – переносящих пентозильные группы (от нуклеозидов). Обладают высокой степенью специфичности к переносимой гликозильной группе, в отношении акцептора такая специфичность наблюдается не всегда. Ф. имеют универсальное распространение в природе, встречаются у простейших, в животных и растительных тканях. Играют важную роль в живых организмах, катализируя ключевые реакции метаболизма, связанные с использованием запасных углеводов, а следовательно, с обеспечением клеток энергией. Изучение Ф. значительно способствовало развитию энзимологии: на примере фосфорилазных реакций была исследована модель макромолекулярного синтеза, связывание фермента с субстратом, аллостерическая регуляция активности фермента и возможность диссоциации ферментов на субъединицы, каталитическое превращение фермента из неактивной формы в активную. Наиболее хорошо изучены Ф., катализирующие расщепление запасных углеводов –
и
.
А + Г – Ф, где Г – гликозильная группа, А – акцептор гликозильной группы, Ф – ортофосфат. Известны 7 ферментов, переносящих гексозильные (от полисахаридов и дисахаридов), и 8 – переносящих пентозильные группы (от нуклеозидов). Обладают высокой степенью специфичности к переносимой гликозильной группе, в отношении акцептора такая специфичность наблюдается не всегда. Ф. имеют универсальное распространение в природе, встречаются у простейших, в животных и растительных тканях. Играют важную роль в живых организмах, катализируя ключевые реакции метаболизма, связанные с использованием запасных углеводов, а следовательно, с обеспечением клеток энергией. Изучение Ф. значительно способствовало развитию энзимологии: на примере фосфорилазных реакций была исследована модель макромолекулярного синтеза, связывание фермента с субстратом, аллостерическая регуляция активности фермента и возможность диссоциации ферментов на субъединицы, каталитическое превращение фермента из неактивной формы в активную. Наиболее хорошо изучены Ф., катализирующие расщепление запасных углеводов –
и
.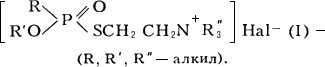
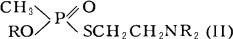 ,
,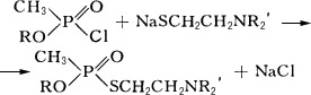 (III).
(III).