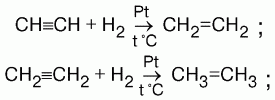Шпаргалка по органической химии
ModernLib.Net / Химия / Титаренко Алена / Шпаргалка по органической химии - Чтение
(Ознакомительный отрывок)
(Весь текст)
Алена Игоревна Титаренко
Шпаргалка по органической химии
1. Предмет органической химии
Органические веществав своем составе наряду с другими элементами всегда содержат углерод. Изучение соединений углерода – их строения, химических превращений – и составляет
предмет органической химии.
Вещества органические и неорганические.
Наряду с углеродом в состав органических веществ чаще всего входят водород, кислород и азот, сравнительно реже – сера, фосфор, галогены и другие элементы. Известно несколько миллионов органических соединений, неорганических же веществ значительно меньше. Из всех химических элементов только углерод образует такое большое число органических соединений.
С органическими веществами мы встречаемся на каждом шагу. Они содержатся во всех растительных и животных организмах, входят в состав нашей пищи, служат материалом для изготовления одежды, образуют различные виды топлива, используются нами в качестве лекарств, красителей, средств защиты урожая и т. д.
Резкой грани между органическими и неорганическими веществами не существует. Оксиды углерода, угольная кислота, ее соли и некоторые другие вещества по наличию в них углерода должны считаться органическими, но по свойствам они близки к неорганическим соединениям подобного типа и изучаются обычно в неорганической химии.
С органическими веществамичеловек знаком с давних времен. Наши далекие предки применяли природные красители для окраски тканей, использовали в качестве продуктов питания растительные масла, животные жиры, тростниковый сахар, получали уксус брожением спиртовых жидкостей.
В настоящее время синтезированы многие органические вещества, не только имеющиеся в природе, но и не встречающиеся в ней: многочисленные пластмассы, различные виды каучуков, всевозможные красители, взрывчатые вещества, лекарственные препараты.
Синтетически полученных веществ сейчас известно даже больше, чем найденных в природе, и число их быстро растет. Осуществляются синтезы самых сложных органических веществ – белков.
Название науки
«органическая химия», утратив первоначальный смысл, приобрело в связи с этим более широкое толкование.
Можно сказать, что такое название получило и новое подтверждение, так как ведущей познавательной
задачей современной органической химииявляется глубокое изучение процессов, происходящих в клетках организмов на молекулярном уровне, выяснение тех тонких механизмов, которые составляют материальную основу явлений жизни.
Изучение химии органических веществ, таким образом, расширяет наши знания о природе.
2. Предпосылки теории строения
Подобно тому как в неорганической химии при изучении элементов и их соединений необходимо постоянно руководствоваться периодическим законом и Периодической системой химических элементов Д.И. Менделеева, в
органической химиипри изучении веществ необходимо опираться на
теорию химического строения.
Основные особенности предпосылок химического строения:
1) теория химического строенияв своей основе была создана
в 60-е гг. XIX в.;
2) основная задача органической химии того времени состояла в изучении состава и свойств природных соединений;
3) также основная задача состояла в разработке способов рационального использования состава и свойств природных соединений для практических нужд;
4) в связи с развитием промышленности, торговли, ростом городов к органической химии стали предъявляться большие требования;
5) текстильная промышленность нуждалась в разнообразных красителях;
6) для развития пищевой промышленности требовались более совершенные методы переработки сельскохозяйственных продуктов;
7) необходимо было решить проблему освещения растущих городов на основе использования природных материалов;
8) нужно было также удовлетворить потребность населения в лекарственных веществах и т. д.
Дальнейшее развитие органической химии стало замедляться из-за отставания в ней теоретических представлений.
Новые теоретические воззрения:
1) открывшиеся в процессе исследования веществ новые явления требовали систематизации и объяснения их с единой точки зрения, но теория того времени оказывалась для этого недостаточной;
2) органическая химия должна была создавать новые вещества, но теоретические знания не могли указать пути их целенаправленного синтеза;
3) необходимость новых теоретических воззрений в органической химии становится более понятной, если знать некоторые известные факторы.
При изучении курса неорганической химии становится известно, что:
а) углерод образует с водородом большое число соединений, так называемых углеводородов;
б) в состав горючего природного газа, например, наряду с простейшим углеводородом метаном СН4, входят этан С2Н6, пропан С3Н8, бутан С4H10 и др.;
в) при термическом разложении каменного угля образуется бензол С6Н6, толуол С7Н8 и т. д.;
г) много различных углеводородов содержится в нефти;
4) углерод, который содержится в природном газе, является четырехвалентным элементом, но только в метане он сохраняет эту валентность;
5) в этане С2Н6 углерод должен быть трехвалентным, а в пропане С3Н8 иметь даже дробную валентность.
3. Особенности органических соединений
В отличие от неорганических веществ
органические вещества имеют ряд характерных особенностей:
1) атомы углерода способны соединяться друг с другом;
2) образуют цепи и кольца, что не так типично для неорганических соединений. Это одна из причин многообразия органических соединений;
3) одной из важных особенностей органических соединений, которая накладывает отпечаток на все их химические свойства, является характер связей между атомами в их молекулах.
Эти связи имеют ярко выраженный ковалентный характер. Органические вещества в большинстве неэлектролиты, не диссоциируют в растворах на ионы и сравнительно медленно взаимодействуют друг с другом.
Время, необходимое для завершения реакций между органическими веществами, измеряется часами, а иногда и днями.
Если
ионные(неорганические) соединения легко диссоциируют в воде на ионы и реакции между ними протекают весьма быстро, то органические вещества, содержащие
простые(одинарные) С – С и С – Н связи, взаимодействуют между собой с большим трудом.
При нагревании в пределах 400–600 °C органические соединения полностью разлагаются и обугливаются, а в присутствии кислорода сгорают. Это объясняется сравнительно небольшой прочностью связи между атомами углерода (355,6 кДж/моль);
4) важной особенностью органических соединений является и то, что среди них широко распространено явление изомерии;
5) имеется множество соединений углерода, которые обладают одинаковым качественным и количественным составом и одинаковой молекулярной массой, но совершенно различными физическими и даже химическими свойствами;
6) многие органические соединения являются непосредственными носителями, участниками или продуктами процессов, которые протекают в живых организмах, – ферменты, гормоны, витамины.
Особенности атома углерода объясняются его строением:
1) он имеет четыре валентных электрона;
2) атомы углерода образуют с другими атомами, а также друг с другом общие электронные пары. При этом на внешнем уровне каждого атома углерода будет восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам.
В органической химии обычно пользуются структурными формулами, поскольку атомы имеют пространственное расположение в молекуле.
Структурные формулы– это язык органической химии.
В структурных формулах ковалентная связь обозначается черточкой. Как и в структурных формулах неорганических веществ, каждая черточка означает общую электронную пару, связывающую атомы в молекуле. Используются также
эмпирическиеи
электронныеформулы.
4. Теория химического строения органических соединений А.М. Бутлерова
Крупнейшим событием в развитии органической химии было создание в 1961 г. великим русским ученым
А.М. Бутлеровымтеории химического строения органических соединений.
До А.М. Бутлерова считалось невозможным познать строение молекулы, т. е. порядок химической связи между атомами. Многие ученые даже отрицали реальность атомов и молекул.
А.М. Бутлеров опроверг это мнение. Он исходил из правильных
материалистическихи философских представлений о реальности существования атомов и молекул, о возможности познания химической связи атомов в молекуле. Он показал, что строение молекулы можно установить опытным путем, изучая химические превращения вещества. И наоборот, зная строение молекулы, можно вывести химические свойства соединения.
Теория химического строения объясняет многообразие органических соединений. Оно обусловлено способностью четырехвалентного углерода образовывать углеродные цепи и кольца, соединяться с атомами других элементов и наличием изомерии химического строения органических соединений. Эта теория заложила научные основы органической химии и объяснила ее важнейшие закономерности. Основные принципы своей теории А.М. Бутлеров изложил в докладе «О теории химического строения».
Основные положения теории строения сводятся к следующему:
1) в молекулах атомы соединены друг с другом в определенной последовательности в соответствии с их валентностью. Порядок связи атомов называется химическим строением;
2) свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т. е. от химического строения молекулы;
3) атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга.
В теории химического строения большое внимание уделяется взаимному влиянию атомов и групп атомов в молекуле.
Химические формулы, в которых изображен порядок соединения атомов в молекулах, называются
структурными формуламиили
формулами строения.
Значение теории химического строения А.М. Бутлерова:
1) является важнейшей частью теоретического фундамента органической химии;
2) по значимости ее можно сопоставить с Периодической системой элементов Д.И. Менделеева;
3) она дала возможность систематизировать огромный практический материал;
4) дала возможность заранее предсказать существование новых веществ, а также указать пути их получения.
Теория химического строения служит руководящей основой во всех исследованиях по органической химии.
5. Изомерия. Электронное строение атомов элементов малых периодов. Химическая связь
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
Изомеры –это вещества, которые имеют одинаковый состав и одинаковую молярную массу, но различное строение молекул, а потому обладающие разными свойствами.
Научное значение теории химического строения:
1) углубляет представления о веществе;
2) указывает путь к познанию внутреннего строения молекул;
3) дает возможность понять накопленные в химии факты; предсказать существование новых веществ и найти пути их синтеза.
Всем этим теория в огромной степени способствовала дальнейшему развитию органической химии и химической промышленности.
Немецкий ученый
А. Кекулевысказывал мысль о соединении атомов углерода друг с другом в цепи.
Учение об электронном строении атомов.
Особенности учения об электронном строении атомов:1) позволило понять природу химической связи атомов; 2) выяснить сущность взаимного влияния атомов.
Состояние электронов в атомах и строение электронных оболочек.
Электронные облака– это области наибольшей вероятности пребывания электрона, которые различаются по своей форме, размерам, направленности в пространстве.
В атоме
водородаединственный электрон при своем движении образует отрицательно заряженное облако сферической (шаровидной) формы.
S-электроны – это электроны, образующие сферическое облако.
В атоме водорода имеется один s-электрон.
В атоме
гелия– два s-электрона.
Особенности атома гелия:1) облака одинаковой сферической формы; 2) наибольшая плотность одинаково удалена от ядра; 3) электронные облака совмещаются; 4) образуют общее двухэлектронное облако.
Особенности атома лития:1) имеет два электронных слоя; 2) имеет облако сферической формы, но по размерам значительно превосходит внутреннее двухэлектронное облако; 3) электрон второго слоя слабее притягивается к ядру, чем первые два; 4) легко захватывается другими атомами в окислительно-восстановительных реакциях; 5) имеет s-электрон.
Особенности атома бериллия:1) четвертый электрон – s-электрон; 2) сферическое облако совмещается с облаком третьего электрона; 3) имеются два спаренных s-электрона во внутреннем слое и два спаренных s-электрона в наружном.
Чем больше перекрываются электронные облака при соединении атомов, тем больше выделяется энергии и тем прочнее
химическая связь.
6. Гомологические ряды органических соединений
Среди многообразия органических соединений можно выделить
группы веществ,которые сходны по химическим свойствам и отличаются друг от друга на группу СН2.
Гомологи– это соединения, сходные по химическим свойствам, состав которых отличается друг от друга на одну или несколько групп СН2.
Гомологи, расположенные в порядке возрастания их относительной молекулярной массы, образуют
гомологический ряд.
Гомологическая разность– это группы СН2.
Примером гомологического ряда может служить ряд предельных углеводородов (алканов).
Простейший его представитель – метан СН4.
Формула любого последующего гомолога может быть получена прибавлением к формуле предыдущего углеводорода гомологической разности.
Состав молекул всех членов гомологического ряда может быть выражен одной общей формулой: СnН2n + 2, где n – число атомов углерода.
Гомологические ряды могут быть построены для всех классов органических соединений. Зная свойства одного из членов гомологического ряда, можно сделать выводы о свойствах других представителей того же ряда. Это обусловливает важность понятия гомологии при изучении органической химии.
Классификация органических соединений.
Все органические соединения в зависимости от природы углеродного скелета можно разделить на ациклические и циклические.
Ациклические(нециклические, ценные) соединения называют также жирными или алифатическими.
Эти названия связаны с тем, что одними из первых хорошо изученных соединений такого типа были природные жиры.
Среди циклических соединений обычно выделяют:1)
карбоциклические –молекулы которых содержат кольца из углеродных атомов; 2)
гетероциклические –кольца которых содержат, кроме углерода, атомы других элементов (кислорода, серы, азота и др.).
Карбоциклические соединения подразделяются:1) на
алициклические(предельные и непредельные), похожие по свойствам на алифатические; 2)
ароматические –содержат бензольные кольца.
Функциональные группы –это группы атомов, которые определяют химические свойства данного класса соединений.
Наличие этих групп позволяет разделить типы органических соединений на классы и облегчить их изучение.
Классы соединений:а) спирты; б) фенолы; в) альдегиды; г) кетоны; д) карбоновые кислоты; е) нитросоединения; ж) первичные амины; з) амиды кислот.
Свойства свободных радикалов:1) обычно очень неустойчивы; 2) химически весьма активны; 3) быстро превращаются в устойчивые молекулы.
Индуктивный эффект –это смещение электронной плотности от одного атома к другому в результате их разной электроотрицательности. Происходит
поляризация связи.
7. Классификация органических соединений
В зависимости от строения углеродных цепей среди органических соединений выделяются следующие три ряда:
1) соединения
с открытой цепью атомов углерода,которые также называются ациклическими, или соединения жирного ряда (это название возникло исторически: к первым соединениям с длинными незамкнутыми углеродными цепями принадлежали кислоты).
В зависимости от характера связей между атомами углерода эти соединения подразделяются на: а) предельные (или насыщенные), которые содержат в молекулах только простые (ординарные) связи; б) непредельные (или ненасыщенные), в молекулах которых имеются кратные (двойные или тройные) связи между атомами углерода;
2) соединения
с замкнутой цепью атомов углерода,или карбоциклические.
Эти соединения, в свою очередь, подразделяются:
а) на соединения ароматического ряда.
Они характеризуются наличием в молекулах особой циклической группировки из шести атомов углерода – бензольного ароматического ряда.
Эта группировка отличается характером связей между атомами углерода и придает содержащим ее соединениям особые химические свойства, которые называются ароматическими свойствами;
б) алициклические соединения – это все остальные карбоциклические соединения.
Они различаются по числу атомов углерода в цикле и в зависимости от характера связей между этими атомами могут быть предельными и непредельными;
3)
гетероциклические соединения.
В молекулах этих соединений имеются циклы, которые включают, кроме атомов углерода, также
гетероатомы.
В рядах ациклических (жирных) и карбоциклических соединений простейшими являются углеводороды. Все остальные соединения этих рядов рассматриваются как производные углеводородов, которые образованы замещением одного, двух или нескольких атомов водорода в углеводородной молекуле другими атомами или группами атомов.
Остатки углеводородов, которые образуются при отнятии от их молекул одного, двух или нескольких атомов водорода, называются
углеводородными радикалами.
Атомы или группы атомов, которые замещают водород в углеводородной основе, образуют
функциональныеили
характеристические(этот термин разработан Международным союзом теоретической и прикладной химии) группы, обусловливающие общие химические свойства веществ, которые принадлежат к одному и тому же классу производных углеводородов.
Виды органических соединений:
1) галогенопроизводные углеводороды: а) фторпроизводные; б) хлорпроизводные; в)бромопроизводные, г) йодопроизводные;
2) кислородосодержащие соединения: а) спирты и фенолы; б) простые эфиры; в) альдегиды; г) кетоны.
8. Типы органических соединений
Органические реакции, как и неорганические, подразделяются на 3 основных типа:
1) реакция замещения: СН4 + CI2 ? СН3CI + НCI;
2) реакция отщепления: СН3СН2Br ? СН2 = СН2 + НBr;
3) реакция присоединения: СН2 = СН2 + НBr ? CН3СН2Br.
К реакциям присоединения относятся
реакции полимеризации.Особым типом органических реакций являются
реакции поликонденсации.Органические реакции можно классифицировать и
по механизму разрыва ковалентных связей в реагирующих молекулах.
В зависимости от двух способов разрыва ковалентных связей и строится данная классификация.
1. Если общая электронная пара делится между атомами, то образуются радикалы.
Радикалы– это частицы, имеющие неспаренные электроны. Такой разрыв связи называется
радикальным (гомолитическим).
Особенностьданной связи заключается в том, что радикалы, которые образуются, взаимодействуют с имеющимися в реакционной системе молекулами или друг с другом.
Образующиеся радикалы взаимодействуют с имеющимися в реакционной системе молекулами или друг с другом: CН?3 + CI2 ? СН3CI + CI.
По радикальному механизму протекают реакции, в которых разрыву подвергаются связи малой полярности (С-С, С-Н, N-N) при высокой температуре, под действием света или радиоактивного излучения.
2. Если при разрыве связи общая электронная пара остается у одного атома, то образуются
ионы – катион и анион.Такой механизм называется
ионнымили
гетеролитическим.Он приводит к образованию органических
катионов или анионов:1) хлористый метил образует метил-катион и хлорид-анион; 2) метил-литий образует литий-катион и метил-анион.
Органические ионы вступают в дальнейшие превращения. При этом катионы взаимодействуют с
нуклеофильными(«любящими ядра») частицами, а органические анионы – с
электрофильными(«любящими электроны») частицами (катионы металлов, галогены и др.).
Ионный механизм наблюдается при разрыве полярной ковалентной связи (углерод – галоген, углерод – кислород и др.).
Органические ионные частицы подобны ионам в неорганической химии – имеют соответствующие заряды. Однако они и резко отличаются: ионы неорганических соединений присутствуют в водных растворах постоянно, а органические ионные частицы возникают только в момент реакции.
Поэтому во многих случаях необходимо говорить не о свободных органических ионах, а о сильно поляризованных молекулах.
Радикальный механизм наблюдается при разрыве неполярной или малополярной ковалентной связи (углерод – углерод, углерод – водород и т. д.).
Органические ионные частицы подобны ионам в неорганической химии – они имеют соответствующие заряды.
9. Предельные углеводороды (алканы). Номенклатура алканов и их производных
Углеводороды –это простейшие органические соединения, которые состоят из двух элементов – углерода, водорода.
Предельные углеводороды, или алканы.
(международное название), – это соединения, состав которых выражается общей формулой СnН2n+2, где n – число атомов углерода.
Особенности предельных углеводородов (алканов):
1) в молекулах
предельных углеводородоватомы углерода связаны между собой простой (одинарной) связью;
2) остальные валентности насыщены атомами водорода;
3)
алканытакже называются
насыщенными углеводородами,или
парафинами;
4) первым членом гомологического ряда алканов является
метан (СН4
);
5) начиная с пятого углеводорода название образуется от греческого числительного, которое указывает число углеродных атомов в молекуле;
6) в гомологическом ряду наблюдается изменение физических свойств углеводородов: а) повышаются температуры кипения и плавления; б) возрастает плотность;
7) алканы начиная с четвертого члена ряда (бутана) имеют
изомеры.
Номенклатура алканов и их производных.
При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, которые называются
углеводородными радикалами.
Радикалы образуются не только органическими, но и неорганическими соединениями.
Если отнять от молекулы углеводорода два атома водорода, получаются двухвалентные радикалы.
Для названия изомеров применяются две номенклатуры:1) рациональная – старая; 2) заместительная (систематическая или международная) – современная. Предложена Международным союзом теоретической и прикладной химии ИЮПАК.
Особенности рациональной номенклатуры:1) по рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикалы; 2) рациональная номенклатура удобна для не очень сложных соединений.
Особенности заместительной номенклатуры:1) по заместительной номенклатуре основой для названия служит одна углеродная цепь, а все другие фрагменты молекулы рассматриваются как заместители; 2) если в формуле содержится несколько одинаковых радикалов, то перед их названием указывается число прописью, а номера радикалов разделяются запятыми.
Химия– это наука о качественных изменениях тел, происходящих под влиянием изменения количественного состава (Ф. Энгельс).
Явление изомерии в ряду углеводородов– это изомерия углеродного скелета молекул, который обусловливает возможность существования разных веществ одного и того же состава.
10. Химические свойства метана и его гомологов
Принадлежность веществ к группе предельных углеводородов определяется характером строения.
Основные свойства метана:
1) это газ без цвета и запаха (СН4);
2) в два раза легче воздуха;
3) образуется в природе в результате разложения без доступа воздуха остатков животных и растительных организмов;
4) может быть обнаружен в заболоченных водоемах, каменноугольных шахтах;
5) содержится в природном газе, который широко используется в качестве топлива в быту и на производстве;
6) в молекуле метана химические связи атомов водорода с атомом углерода имеют ковалентный характер.
Молекула метана имеет тетраэдрическую форму,а не плоскую.
Когда атом углерода вступает во взаимодействие с атомами водорода,
s-электронынаружного слоя в нем распариваются, один из них занимает вакантное место третьего
р-электронаи образует при своем движении облако в виде
объемной восьмерки, перпендикулярное по отношению к облакам двух других р-электронов.
Атом при этом переходит в
возбужденное состояние.Все четыре валентных электрона становятся
неспаренными,они могут образовывать четыре химические связи.
Противоречия:1) три р-электрона должны образовывать три химические связи с атомами водорода во взаимно перпендикулярных направлениях (под углом 90°); 2) четвертый атом водорода мог бы присоединяться в произвольном направлении.
Разрешение противоречий:1) в процессе образования химических связей облака всех валентных электронов атома углерода (одного s– и трех р-электронов) выравниваются, становятся одинаковыми; 2) облака принимают форму несимметричных, вытянутых в направлении к вершинам тэтраэдра объемных восьмерок. Несимметричное распределение электронной плотности означает, что вероятность нахождения электрона по одну сторону от ядра больше, чем по другую; 3) угол между осями гибридных электронных облаков равен 109°, что позволяет им максимально удаляться друг от друга; 4) такие облака могут значительно перекрываться электронными облаками водородных атомов, что ведет к большому выделению энергии и образованию прочных, одинаковых по свойствам
химических связей.
Гибридизация может распространяться на разное число электронных облаков.
Шаростержневая модель молекулы:
1) детали, изображающие атомы, соединяются на некотором расстоянии друг от друга посредством стерженьков, символизирующих валентные связи; 2) модель дает наглядное представление о том, какие атомы с какими соединены, но она не передает относительных размеров и внешней формы молекулы.
11. Строение и номенклатура углеводородов ряда метана
Строение углеводородов.
В природном газе и особенно в нефти содержится много углеводородов, сходных с метаном по строению и свойствам.
Предельные углеводороды (неразветвленного строения):1) метан; 2) этан; 3) пропан; 4) бутан; 5) пентан; 6) гексан; 7) гептан; 8) октан; 9) нонан; 10) декан.
Для наименования всех предельных углеводородов принят
суффикс – ан.
С увеличением молекулярной массы последовательно возрастают температуры плавления и кипения углеводородов.
Первые четыре вещества (С1 – С4) при обычных условиях –
газы.
Все предельные углеводороды
нерастворимы в воде, но могут растворяться в органических растворителях.
Общая формула углеводородов:СnH2n+2, где n – число атомов углерода в молекуле.
Пространственное и электронное строение молекул пропана и бутана.
Атомы углерода в них расположены не по прямой линии, а зигзагообразно.
Причина – в тетраэдрическом направлении валентных связей атомов углерода.
Если к одному атому углерода присоединился другой атом углерода, то у этого последнего остались три свободные валентности, все они направлены к вершинам тетраэдра. Следующий атом углерода может присоединиться только в одном из этих направлений.
Углеродная цепь неизменно принимает зигзагообразную форму.
Угол между ковалентными связями, соединяющими атомы углерода в такой цепи, как и в молекуле метана, 109° 28?.
Зигзагообразная цепь атомов углерода может принимать различные пространственные формы.
Это связано с тем, что атомы в молекуле могут относительно свободно вращаться вокруг простых сигма-связей.
Углеродная цепь получается сильно изогнутой. Если повернуть атом углерода, то молекула примет почти кольцеобразную форму.
Такое вращение существует в молекулах как проявление теплового движения (если нет препятствующих этому факторов).
Наиболее энергетически выгодной является форма с наибольшим удалением атомов друг от друга.
Все эти разновидности легко переходят одна в другую, при этом их химическое строение (последовательность связи атомов в молекулах) остается неизменным.
Свойство атомов углеродасоединяться друг с другом в длинные цепи связано с положением элемента в Периодической системе Д.И. Менделеева и строением его атомов.
При химической реакции у атома углерода трудно полностью оторвать четыре валентных электрона, а также присоединить к нему столько же элетронов от других атомов до образования полного октета.
12. Химические свойства предельных углеводородов
1.
Горение углеводородов на воздухе и выделение большого количества теплоты.
Продукты горения подтверждают наличие углерода и водорода в метане. Если поджечь газ, собранный в стеклянном цилиндре, то после прекращения горения стенки внутри цилиндра становятся влажными.
При добавлении в цилиндр известковой воды она становится мутной.
При горении метана образуются вода и оксид углерода (IV).
2.
Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается, если смешать метан с кислородом в объемном отношении 1:2. Оптимальное отношение объемов при взрыве метана с воздухом 1:10.
Взрыв меньшей силы может происходить и при некоторых других объемных отношениях газов.
Наиболее опасными являются смеси метана с воздухом в каменноугольных шахтах, заводских котельных, квартирах.
Для обеспечения безопасности работы в шахтах устанавливают автоматические приборы – анализаторы, сигнализирующие о появлении газа.
Горение углеводородов, которые имеют значительную молекулярную массу.
Парафин – это смесь твердых углеводородов.
Если поместить в фарфоровую чашечку кусочек парафина, расплавить и поджечь его, то при горении образуется много копоти.
Когда горят газообразные вещества, они хорошо смешиваются с воздухом и поэтому сгорают полностью.
При горении расплавленного парафина кислорода не хватает для сгорания всего углерода и углерод выделяется в свободном виде.
3.
При сильном нагревании углеводороды разлагаются на простые вещества – углерод и водород.
Эти реакции могут служить подтверждением молекулярной формулы вещества: при разложении метана образуется двойной, а при разложении этана – тройной объем водорода по сравнению с объемом исходного газа (объем углерода как твердого вещества в расчет не принимается).
4.
Реакция с галогенами (хлором).
Если смесь метана с хлором в закрытом стеклянном цилиндре выставить на рассеянный солнечный свет (при прямом солнечном освещении может произойти взрыв), то произойдет постепенное ослабление желто-зеленой окраски хлора при взаимодействии его с метаном.
Химическая реакция заключается в разрыве одних связей и образовании новых.
Атомы хлора имеют в наружном слое по одному неспаренному электрону, становятся свободными радикалами.
Когда атом-радикал, который обладает высокой химической активностью, сталкивается с молекулой метана, его электрон начинает взаимодействовать с электронным облаком атома водорода. Между этими атомами устанавливается
ковалентная связьи образуется молекула
хлороводорода.
13. Применение и получение предельных углеводородов
Сферы применения предельных углеводородов:
1)
метанв составе природного газа находит все более широкое применение в быту и на производстве;
2)
пропан и бутанприменяются в виде «сжиженного газа», особенно в тех местностях, где нет подвода природного газа;
3)
жидкие углеводородыиспользуются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах;
4)
метанкак доступный углеводород в большей степени используется в качестве химического сырья;
5) реакция горения и разложения
метанаиспользуется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука;
6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива;
7)
метан– основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений.
Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром.
Реакция хлорирования служит для получения хлорпроизводного метана.
Особенности хлорметана:1) это газ; 2) это вещество, которое легко переходит в жидкое состояние; 3) это вещество, которое поглощает большое количество теплоты при последующем испарении.
Особенности дихлорметана, трихлорметана и тетрахлорметана:1) это жидкости; 2) используются как растворители; 3) применяются для тушения огня (особенно когда нельзя использовать воду); 4) тяжелые негорючие газы этих веществ, которые образуются при испарении жидкости, быстро изолируют горящий предмет от кислорода воздуха.
Из гомологов метана при реакции изомеризации получаются углероводороды разветвленного строения.
Они используются в производстве каучуков и высококачественных сортов бензина.
Получение углеводородов:1) предельные углеводороды в больших количествах содержатся в природном газе и нефти; 2) из природных источников их извлекают для использования в качестве топлива и химического сырья.
Особенности синтеза метана:1) синтез метана показывает возможность перехода от простых веществ к органическим соединениям. Реакция идет при нагревании углерода с водородом в присутствии порошкообразного никеля в качестве катализатора; 2) синтез метана – реакция экзотермическая. Сильное нагревание не будет повышать выход продукта, равновесие сместится в сторону образования исходных веществ; 3) при слабом нагревании будет недостаточна скорость образования метана; 4) оптимальная температура синтеза метана примерно 500 °C; 5) для разложения метана необходима температура 1000 °C.
14. Алкины (ацетиленовые углеводороды)
Алкины– это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации и связаны друг с другом тройной связью. Общая формула: CnH2n–2, где n > 2. Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома. Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи. Первые два члена гомологического ряда –
этин и пропин –изомеров не имеют. Для
бутиноввозможен только один вид изомерии – изомерия положения тройной связи. Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен. Физические свойства алкинов: 1) С2Н2...С4Н6 – газы; 2) С5Н8...С15Н28 – жидкости; 3) С16Н30... – твердые вещества; 4) плохо растворимы в воде. Химические свойства алкинов: обладают большой реакционной способностью, характеризуются реакцией присоединения, тройная связь содержит две ?-связи.
Реакции присоединения:
1) присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы. 2) присоединение галогенов (галогенирование). HC?CH + HCl ? CH2=CHCl ? CH3-CHCl2; На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы. Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается; 3) присоединение галогеноводородов (гидрогалогенирование). На I ступени образуются моногалогеналкены, на II – дигалогеналканы; 4) присоединение воды (гидратация). Ацетилен образует
альдегид,его гомологи –
кетоны (реакция М.Г. Кучерова):
Реакция окисления:1) горение (полное окисление): 2С2Н2 + 5O2 ? 4СO2 + 2Н2О; 2) неполное окисление (под действием окислителя типа КМnO4, К2Сr2О7). При действии сильных окислителей (КМnO4 в нейтральной среде, К2Сr2О7 в кислотной среде) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена). Конечным продуктом реакции являются карбоновые кислоты: СН3-С?С-СН3 + 3[О] + Н2О ? 2СН3-СООН – этановая (уксусная) кислота. При неполном окислении ацетилена образуется двухосновная щавелевая кислота: СН?Н + 4[О] ? НООС-СООН.
15. Непредельные (ненасыщенные) углеводороды
Непредельные углеводороды– это углеводороды, в молекулах которых имеются атомы углерода, которые связаны между собой двойными или тройными связями.
Ненасыщенные углеводороды– это углеводороды, молекулы которых имеют меньшее число атомов водорода, чем насыщенные.
Особенности непредельных углеводородов:
1) первыми представителями гомологических рядов непредельных углеводородов являются этилен (с двойной связью) и ацетилен (с тройной связью);
2) двойная связь состоит из одной ?-связи и одной ?-связи;
3) по своей природе ?-связь резко отличается от ?-связи. Основные отличия ?-связи от ?-связи:
а) ?-связь менее прочная при перекрывании электронных облаков вне плоскости молекулы;
б) двойная связь изображается двумя одинаковыми черточками, но при этом учитывается их неравноценность;
4) тройная связь состоит из одной ?-связи и двух ?-связей.
Особенность тройной связи ацетилена и его гомологов: из электронного строения видно, что кратные связи (двойные и тройные) сравнительно легко (легче, чем одинарные) разрываются при химическом взаимодействии.
Гомологические ряды непредельных углеводородов и их особенности:
1) соединения гомологического ряда этилена выражаются общей формулой СnН2n;
2) названия гомологов по рациональной номенклатуре производятся от названий соответствующих предельных углеводородов путем замены окончаний (-ан на – илен);
3) по заместительной номенклатуре названия этиленовых углеводородов производятся от названий предельных углеводородов при замене окончаний – ан на – ен (-ен – двойная связь).
Общее международное название этиленовых углеводородов –
алкены.
Олефины– это непредельные углеводороды ряда этилена, которые содержат одну двойную связь;
4) гомологический ряд ацетилена выражается формулой СnН2n-2;
5) название ацетиленовых углеводородов по заместительной номенклатуре производятся от названий предельных углеводородов при замене окончаний
– анна
– ин.
Алкины– это общее название ацетиленовых углеводородов по заместительной номенклатуре.
Важным источником получения этилена и его гомологов служат газообразные и жидкие продукты крекинга углеводородов нефти.
Крекинг– это процесс расщепления углеводородов с длинными цепями на молекулы меньшей длины.
При крекинге наряду с предельными углеводородами всегда получаются и непредельные, которые образуются при крекинге, а также получаются дегидрированием предельных углеводородов, содержащихся в попутных газах нефтедобычи.
16. Этилен и его гомологи
Особенности строения этилена:1) это бесцветный газ; 2) немного легче воздуха; 3) почти не имеет запаха; 4) плотность этилена при нормальных условиях – 1,25 г/л; 5) молярная масса газа – 1,25 г/л х 22,4 л/моль = 28 г/моль; 6) относительная молекулярная масса этилена – 28 г/моль; 7) не может иметь более двух атомов водорода; 8) молекулярная формула этилена – С2Н4; 9) в его молекуле атомы углерода соединены с меньшим числом атомов водорода, чем в молекуле этана; 10) атомы соединяются в соответствии с валентностью; 11) молекула этилена симметрична, т. е. каждый атом углерода в ней связан с двумя атомами водорода. Четвертые единицы валентности атомов углерода не могут оставаться свободными, они соединяются друг с другом, образуя вторую связь между атомами углерода; 12) в молекуле этилена устанавливается двойная связь. Каждая валентность атома углерода обусловливается наличием неспаренного электрона в его наружном электронном слое; 13) в молекуле этилена сохраняется четырехвалентность углерода и правило электронного октета для его атомов.
Особенности sр2-гибридизации:
1) гибридные облака принимают одинаковую форму несимметричных, вытянутых в одну сторону объемных восьмерок;
2) при образовании химических связей они расходятся на наибольшее удаление друг от друга – это достигается тогда, когда угол между их осями будет составлять 120°;
3) у атомов углерода остается еще по одному р-электрону.
Облако этого электрона не затронуто гибридизацией, оно не изменило своей формы и также имеет вид объемной восьмерки с равномерным распределением электронной плотности по обе стороны ядра;
4) оси электронных облаков перпендикулярны плоскости атомных ядер и оказываются наиболее удаленными от электронных облаков, которые участвуют в образовании химических связей.
Сигма-связь– это первая, более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющей центры атомов.
Сигма-связь – это обычные ковалентные связи атомов углерода с атомами водорода.
Молекулы предельных углеводородов содержат только сигма-связи.
Пи-связь– это менее прочная связь, которая образуется при перекрывании электронных облаков вне плоскости атомных ядер.
Электроны ?-связи и ?-связи теряют свою принадлежность к определенному атому.
Особенности ?-связи и ?-связи:
1) вращение атомов углерода в молекуле возможно в случае, если они соединены ?-связью;
2) появление ?-связи лишает атомы углерода в молекуле свободного вращения.
17. Строение и номенклатура углеводородов ряда этилена
Строение углеводородов:1)
этилен– первый представитель гомологического ряда веществ, в молекулах которых имеется двойная связь между атомами углерода; 2) ближайшие гомологи этилена –
пропилен и бутилен;3) названия углеводородов ряда этилена образуются путем изменения суффикса
– ансоответствующего предельного углеводорода на –
илен (этилен, пропилен и т. д.).
Особенности систематической (международной) номенклатуры:а) названия этих углеводородов принимают суффикс –
ен(этен, пропен, бутен и т. д.); б) гомологи этилена должны отличаться друг от друга по составу молекул на группу атомов СН2; в) в молекуле каждого непредельного углеводорода при образовании двойной связи на два атома водорода меньше, чем в молекуле соответствующего предельного углеводорода; г) состав углеводородов ряда этилена (этена) выражается формулой СnН2n; д) непредельные углеводороды могут образовывать
радикалы.
Реакция присоединения, характерная для всех алкенов:
1. Присоединение водорода.
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия – при комнатной температуре.
Реакция гидрирования, или гидрогенизация,– это присоединение водорода к веществу.
При гидрогенизации олефины превращаются в предельные углеводороды.
2. Присоединение галогенов.
Реакция протекает при обычных условиях.
Дихлорэтан– это жидкость, которая хорошо растворяет органические вещества.
Реакция присоединения брома служит качественной реакцией на непредельные углеводороды.
3. Присоединение галогеноводородов.
Галогенопроизводные углеводороды можно получить двумя путями:
1) присоединение к этилену хлороводорода;
2) замещение водорода в этане на хлор.
4. Присоединение воды.
Реакция протекает в присутствии катализатора –
серной кислоты.
Сначала происходит присоединение серной кислоты к этилену по месту разрыва двойной связи с образованием
этилсерной кислоты.
Затем этилсерная кислота при взаимодействии с водой образует спирт и кислоту.
Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, которые содержатся в газах крекинга нефти (попутных газах), а также в коксовых газах.
Важным химическим свойством этилена и его гомологов является способность легко окисляться при обычной температуре.
Конец бесплатного ознакомительного фрагмента.
Страницы:
1, 2
|
|