Фотоплетизмограмма по форме весьма похожа на кривую артериального давления, но, в отличие от последней, характеризует колебания объема микрососудов.
Амплитуда ФПГ зависит от тонуса. микрососудов и ударного объема сердца.
Вот почему изменения фотоплетизмограммы далеко не всегда соответствуют изменениям артериального давления. При артериальной гипотензии, вызванной вазодилататорами, кривая на экране пульсоксиметра Может иметь высокую амплитуду. И наоборот, снижение волн ФПГ при вазоконстрикции иногда Наблюдается и на фоне артериальной гипертензии.
Микрососуды тканей пальца богато иннервированы волокнами симпатической системы и содержат большое количество рецепторов для "плавающих" катехоламинов. Поэтому активация симпатической системы, инфузия а1-адреномиметиков, в2-адре-ноблокаторов, ангиотензина и других сосудосуживающих препаратов сопровождается снижением амплитуды ФПГ. Необходимо помнить, что данные, получаемые при пульсоксиметрии, из-за специфики регуляции пальцевого кровотока не всегда пригодны для суждения о кровоснабжении внутренних органов. Пример такого несоответствия - холодовая вазоконстрикция.
Второй фактор, от которого зависит форма фотоплетизмографической кривой,- ударный объем сердца, определяющий наполнение пульсовой волны. Его непосредственное влияние на амплитуду отдельных волн ФПГ прекрасно видно на экране пульсоксиметра при парадоксальном или альтернирующем пульсе. Кроме того, влияние сердечного выброса на форму ФПГ может быть и опосредованным, поскольку его снижение часто сопровождается периферической вазоконстрикцией.
Снижение амплитуды ФПГ служит признаком периферической вазоконстрикции и/или уменьшения ударного объема, а повышение амплитуды свидетельствует об обратном. Тонус сосудов - основной фактор, определяющий высоту волн фотоплетизмограммы.
К сожалению, пульсоксиметрия в своем современном варианте не позволяет дифференцировать вазоконстрикцию от уменьшения ударного объема. Принципиальная возможность такой дифференцировки, основанной на математическом анализе формы пульсовой волны, существует, но в серийных мониторах еще не реализована.
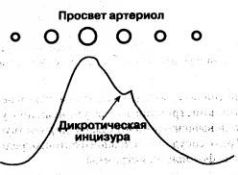
Форма ФПГ
Форма волны ФПГ индивидуальна, но полной клинической ее интерпретации пока нет. На нисходящем колене каждой волны заметна вырезки - дикротическая инцизура,- которая соответствует закрытию аортального клапана. 3а инцизурой следует дополнительный пик-дикротический зубец (рис. 1.9). Чёткость изображения инцизуры и зубца на дисплеях разных моделей пульсоксиметров неодинакова, и нередко они представлены едва заметной волной.
При выраженной артериальной гипертензии или аортальной недостаточности дикротический зубец может быть очень высоким (рис. 1.10) и пульсоксиметр интерпретирует его как самостоятельную пульсовую волну. В результате частота пульса артефактно завышается.
В каждом случае, когда данные пульсоксиметрии свидетельствуют о выраженной тахикардии, непременно обратите внимание на форму ФПГ и посчитайте пульс вручную. При работе с пульсоксиметром, не выводящим ФПГ на дисплей, коррекции тахикардии, обязательно должна предшествовать проверка частоты пульса. Наличие высокого дикротического зубца - типичная причина расхождения показаний пульсоксиметра и ЭКГ-монитора, поэтому такие артефакты нехарактерны для моделей, в которых использован принцип C-lock.
Рис. 1.9. Волна ФПГ как отражение пульсации артериол
Рис. 1.10. Высокий дикротический зубец, имитирующий волну ФПГ
Иногда в промежутках между пиками ФПГ наблюдаются дополнительные колебания - венозные волны (об их происхождении и роли см. "Артефакты и их источники", с. 22).
Пульсоксиметрия позволяет непрерывно контролировать важнейшую функцию легких - насыщение гемоглобина крови кислородом. При всей несомненной полезности этой информации нельзя забывать, что SpO2 - лишь один из многих параметров, используемых для описания кислородного гомеостаза. Надеемся, что приведенных выше фрагментарных сведений из физиологии достаточно для того, чтобы понять, насколько непростой может стать трактовка этого показателя, когда он вырван из клинико-физиологического контекста. Тем не менее пульсоксиметрия - самый распространенный, а во многих случаях и вообще единственный доступный метод определения оксигенации.
Мониторинг амплитуды фотоплетизмограммы - простой и неинвазивный метод ориентировочной оценки периферического артериального кровотока. Если причина изменения ФПГ лежит на поверхности, заключение, сделанное врачом, поможет своевременно принять правильные меры и контролировать их эффективность. Однако при наличии сложных расстройств кровообращения, когда амплитуда ФПГ формируется под влиянием сразу нескольких факторов, она теряет самостоятельное диагностическое значение и становится лишь дополнительным аргументом в дифференциальной диагностике.
В следующей главе мы расскажем, как выжимать из этих параметров максимум пользы.
Несколько практических советов
Перед началом работы постарайтесь расположить прибор так, чтобы его существованию ничто не угрожало. Шнур питания и кабель датчика не должны болтаться под ногами у персонала:
скорее рано, чем поздно, монитор окажется на полу, а на такие случаи гарантия бесплатного ремонта не распространяется. Разумнее всего найти и приспособить для него удобное постоянное место.
Отучите медицинский персонал использовать верхнюю панель монитора в качестве места для хранения ампул, флаконов, ларингоскопа или контейнеров для трахеальных катетеров. Некоторые модели снабжены специальной подставкой, позволяющей наклонять прибор, чтобы улучшить обзор дисплея. Прибегните к ее помощи еще и потому, что на наклонную плоскость никто ничего положить не сможет.
Мониторы с жидкокристаллическим дисплеем нужно размещать так, чтобы обеспечить максимальный сектор обзора на высоте глаз стоящего человека. Желательно покупать мониторы с регулируемой яркостью дисплея.
Если пульсоксиметр реагирует на наводку от электроаппаратуры (а это легко проверить самому), постарайтесь поместить кабель датчика как можно дальше от кабелей электрооборудования. Электрическая дефибрилляция безопасна для пульсоксиметра.
У больного с двигательным беспокойством или судорожным синдромом применяйте ушной или гибкий Y-образный датчик. В любом случае датчик должен быть на виду у персонала, поэтому лучше покупать пульсоксиметры, не реагирующие на окружающий свет. Обидно извлечь из-под одеяла обломки того, что когда-то называлось датчиком и стоило несколько сотен долларов.
Трудно удержаться, чтобы не привести совет, данный фирмой DATEX:
Относитесь к датчику так же бережно, как к собственным часам или очкам.
Если датчик сломался, а запасного такого же нет, не подключайте к монитору датчик другой фирмы, даже если у него такой же штекер. Это типичная ошибка, чреватая самыми разнообразными - и всегда плохими - последствиями: ожогами, поломкой оборудования, резким снижением точности измерения и пр. В мире существует большое, но все же ограниченное число типов разъемов, в связи с чем разные фирмы иногда просто вынуждены использовать одинаковые штекеры. Не полагаясь на здравомыслие врачей, фирмы приводят соответствующие предупреждения в руководствах к мониторам, наклеивают их на кабель датчика и даже публикуют в профессиональных журналах, но авантюризм порой оказывается сильнее. Некоторые крупные фирмы, например NELLCOR-PURITAN BENNET, продают свои датчики вместе с патентованной технологией их калибровки другим производителям пульсоксиметров, однако об этом всегда сообщается в документации.
У пациентов с выраженными расстройствами периферического кровообращения попробуйте переместить датчик на соседний палец или другую руку. Попытайтесь согреть руку грелкой или помассируйте ее. В некоторых случаях улучшить локальный кровоток удается с помощью нитроглицериновой мази, нанесенной тонким слоем на мочку уха или палец.
Более надежный сигнал в условиях нарушенного периферического кровотока можно получить с ушного датчика.
Нежелательно размещать датчик на той руке, которая используется для измерения артериального давления, так как это приводит к необоснованной активации аларма при каждом раздувании манжеты. У больных с атеросклеротическим или иным поражением артерий верхних конечностей датчик следует устанавливать на той руке, где амплитуда ФПГ выше. После катетеризации лучевой артерии не исключено снижение амплитуды ФПГ на этой руке.
Рекомендуется менять место установки датчика-клипсы (ушного или пальцевого) через каждые 4-5 ч, а при нарушениях периферического кровотока это необходимо делать чаще.
При охлаждении тела человека амплитуда ФПГ на периферии часто резко снижается. Такое состояние наблюдается у пациентов к концу длительных операций. Терморегуляция у них подавлена, теплопотеря повышена, а температура в операционной далека от комфортной, и пациент накрыт одной стерильной простыней. Это надо иметь в виду, выполняя пульсоксиметрию в раннем послеоперационном периоде.
Пульсоксиметрию, как любой другой метод мониторинга, следует применять лишь тогда, когда в ней есть необходимость. Пульсоксиметр редко включают без надобности, но часто забывают отключить, когда таковая отпала. Нужно помнить, что срок службы прибора (в большей степени это относится к датчикам) зависит от суммарного наработанного времени.
Настройка аларм-системы
Любой пульсоксиметр имеет, по крайней мере, четыре регулируемых аларма: два - на выход Sp02 и два - на выход частоты пульса за нижний или верхний установленный предел. Обычно звуковой сигнал (при желании его временно или насовсем отключают) дублируется световым, а в некоторых моделях - еще и мерцанием соответствующего параметра на дисплее. Тональность звуковых сигналов разных алармов не всегда одинакова.
У многофункциональных мониторов во время неинвазивного автоматического измерения артериального давления аларм пульсоксиметра отключается.
Неправильно настроенная аларм-система может или задергать персонал ложными вызовами, или не сработать при появлении опасности.
Настройка алармов частоты пульса достаточно понятна и не отличается от таковой у электрокардиоскопов. Аларм-система же Sр02 нуждается в пояснениях.
Колебания SpO2 в пределах 1-2 % являются нормальными. Такие изменения, как правило, не поддаются интерпретации и не требуют коррекций.
Поэтому слишком узкий диапазон между нижним и верхним пределами аларма может послужить причиной частых необоснованных сигналов, которые нервируют персонал. В конце концов на "беспокойный" монитор прекращают обращать внимание или вовсе отключают аларм, и начало настоящего осложнения остается незамеченным.
Установка верхнего допустимого предела Sp02 преследует две цели:
o Получение сигнала об избыточном содержании кислорода во вдыхаемой (вдуваемой) газовой смеси. (См. об этом подробно в разделе об оксигенотерапии.)
o Получение сигнала об улучшении легочного газообмена при исходной стойкой гипоксемии.
Втех случаях, когда возможности респираторной терапии исчерпаны и от легких оттекает кровь со стойко сниженным содержанием оксигемоглобина, есть смысл установить верхний предел аларм-системы SpO2 на несколько процентов выше текущего стабильного значения, тем самым поставив пульсоксиметру задачу сообщить о положительной динамике патологического процесса. В неонатологии верхний предел аларма обычно устанавливается на уровне 95 %. После появления младенца на свет его легкие частично заполнены фетальной легочной жидкостью, которая
исчезает в течение первых суток. Кроме того, в первые дни после рождения до окончательной стабилизации легочной ткани
происходит образование и расправление микро- и макроателектазов. Все это приводит к уменьшению дыхательной поверхности легких и интенсивному шунтированию в них крови. После досрочных родов РаО2 новорожденного при дыхании атмосферным воздухом постепенно увеличивается от 40- 50 мм рт. ст. в первые часы до 80 мм рт. ст. к концу первой недели внеутробной жизни. Таким образом, в первые дни после рождения верхняя граница нормы Sa02 возрастает с 90 до 95 %. Превышение этого уровня при оксигенотерапии считается не только ненужным, но и вредным, поскольку грозит развитием бронхопульмональной дисплазии и ретролентальной фиброплазии. Поэтому неонатальный режим работы пульсоксиметра (neonatal mode) включает в себя и автоматическую установку верхнего допустимого предела SpO2 на уровне 95 % с целью обнаружения избытка кислорода во вдуваемом или вдыхаемом газе.
Нижний допустимый предел SpO2 при включении пульсоксиметра обычно автоматически фиксируется на уровне 95 %, что соответствует Ра02 -= 85 мм рт. ст. Таков он и есть, когда мониторинг выполняется у пациента со здоровыми легкими. При наличии у больного дыхательной недостаточности, порождающей гипоксемию, нижний предел аларма следует установить на 3-5% меньше текущего устойчивого уровня SpO2.
В любом случае сигнал тревоги должен обращать внимание врача на такое снижение сатурации, которое говорит об опасной тенденции и побуждает к действиям.
Пульсоксиметрия в диагностике гипоксемии
Цианоз. До появления пульсоксиметрии главным признаком гипоксемии считался цианоз. Применение пульсоксиметра, прибора гораздо более чувствительного, чем глаз, не отменяет необходимости в наблюдении за цветом кожных покровов больного, поскольку монитор улавливает не всякий цианоз. Пульсоксиметр способен распознавать выраженные нарушения оксигенации артериальной крови при обычном цвете кожных покровов или показывать норму в случаях, когда цианотичность больных бросается в глаза, и при этом не ошибаться.
Окраска кожи зависит от цвета крови в сосудах сосочкового слоя дермы. Основное количество крови находится в венозной части микроциркуляторной системы; цвет именно этой крови и определяет окраску кожи или слизистой оболочки. Общий объем артериол и капилляров невелик, и кровь, содержащаяся в них, оказывает влияние не столько на цвет кожных покровов, сколько
на.оттенок этого цвета ("багровый", "пепельный", "чугунный" цианоз и др. образные уточнения).
Особенность кожного кровотока заключается в том, что он явно избыточен по отношению к метаболическим потребностям кожи, поскольку обслуживает не только обмен веществ, но и теплообмен. Кроме того, венозное русло кожного покрова человека - это основное депо крови. Из каждого миллилитра артериальной крови, притекающей к коже, ее ткани извлекают для своих нужд лишь очень небольшое количество кислорода. В результате по содержанию кислорода (и, соответственно, по насыщению им гемоглобина) венозная кровь, оттекающая от кожи, не слишком сильно отличается от артериальной. Различие становится и вовсе ничтожным при резком увеличении притока артериальной крови к коже (например, при нагревании или растирании кожи, гиперкапнии, инфузии нитропруссида натрия и других вазодилататоров, ингаляции фторотана, применении горчичников и т.д.). Нормальный розоватый цвет кожных покровов преимущественно обусловлен высокой концентрацией 0ксигемоглобина в венулах кожи.
Интенсивность цианоза зависит от количества восстановленного гемоглобина в крови и от объема сосудистого ложа (в самой емкой, венозной его части). Поэтому при выраженной анемии или вазоконстрикции оценка цианоза затруднена. Большую роль играет и качество освещения: в мерцании некоторых люминесцентных ламп порой отчетливо видится то, чего на самом деле нет.
Существуют две главные причины цианоза: (1) артериальная гипоксемия и (2) ухудшение периферического кровотока. Они могут сочетаться.
Цианоз при нарушениях оксигенации крови в легких. В условиях артериальной гипоксемии к тканям от легких притекает кровь с исходно сниженным содержанием оксигемоглобина, в связи с чем сатурация гемоглобина венозной крови также уменьшается и венозная кровь становится более темной, что воспринимается как цианоз. Такой цианоз называется центральным и часто является диффузным. Кожные покровы в этом случае обычно хорошо снабжаются кровью, поэтому остаются теплыми, что подтверждается нормальной амплитудой фотоплетизмо-граммы. Поскольку первичная причина такого цианоза состоит в нарушении сатурации артериальной крови, пульсоксиметр позволяет не только обнаружить, но и дать точную количественную оценку глубины гипоксемии даже на той стадии, когда зрение еще не улавливает изменения окраски кожи.
Считается, что когда SpO2 опускается до 90 %, увидеть цианоз удается лишь в половине случаев. Напомним, что при нормальном положении кривой диссоциации оксигемоглобина этому уровню сатурации соответствует РаО2 = 57 мм рт. ст., что значительно ниже нормы. Даже десатурация артериальной крови до 85 % (РаО2 = 50 мм рт. ст.), что расценивается как серьезная гипоксемия, требующая коррекции, не всегда сопровождается развитием цианоза. В этом можно убедиться, сопоставляя Sp02 и внешний вид больных. Широкое применение пульсоксимет-рии рассеяло иллюзии анестезиологов относительно нормальной оксигенации пациентов во время наркоза.
Мониторинг показал, что эпизоды гипоксемии в операционной возникают в 20 (!) раз чаще, чем обнаруживаются при обычном наблюдении за больным.
Описано немало случаев, когда опытные врачи не могли распознать цианоз у пациентов с глубочайшей артериальной десатурацией, замаскированной анемией или вазоконстрикцией. Не случайно с внедрением пульсоксиметров в операционных и палатах интенсивной терапии резко сократилась частота эпи-' зодов недиагностированной или несвоевременно обнаруженной гипоксемии.
Кстати, недорогой портативный пульсоксиметр, помещающийся в кармане халата, постепенно становится таким же традиционным инструментом терапевта, как фонендоскоп, тонометр и авторучка, и обычно используется не в мониторном режиме, а для разовых измерений при обходе больных. SpO2 служит объективным показателем состояния легочного газообмена - в отличие от весьма субъективной оценки цианоза "на глаз". Миниатюрный пульсоксиметр, в котором корпус прибора и датчик смонтированы в единое целое, имеет размер спичечного коробка;
выпускается фирмой NONIN.
Цианоз при нарушениях кровообращения. Ухудшение перфузии периферии сопровождается возникновением акроцианоза. При отсутствии легочной патологии пульсоксиметр в такой ситуации показывает нормальный уровень SpO2 но из уменьшенного объема хорошо оксигенированной артериальной крови, притекающей к тканям кожи, последние извлекают прежнее количество кислорода. В результате усиленной десатурации оксигемоглобина в кожных капиллярах венозная кровь приобретает более темный цвет, что визуально воспринимается как цианоз, но не сказывается - и не может сказаться - на величине Sp02. Основные причины акроцианоза: (1) снижение сердечного выброса и (2) периферическая вазоконстрикция. В обоих случаях акроцианоз - это свидетельство нарушения кровоснабжения тканей. Акроцианоз наблюдается даже при нормальной сатурации гемоглобина артериальной крови.
К пульсоксиметрическим признакам нарушения перфузии тканей относится уменьшение амплитуды фотоплетизмограм-мы. Разумеется, этот симптом становится доступным, если монитор способен отражать на дисплее реальную амплитуду ФПГ. В крайне тяжелых случаях кожа приобретает бледно-цианотичный вид, а пульсоксиметр не хочет работать и дает сообщение типа "low perfusion" (нарушенная перфузия) или "low quality signal" (сигнал низкого качества). Подобные сообщения следует расценивать не как досадную помеху для мониторинга, а как признак серьезного неблагополучия.
Нарушения перфузии, определяемые монитором, могут иметь самые разные причины: от безобидной холодовой вазокон-стрикции до опасного генерализованного артериолоспазма или уменьшения сердечного выброса. Какую полезную информацию дает пульсоксиметр у таких больных?
Во- первых, данные пульсоксиметрии -хорошее подспорье в дифференциальной диагностике цианозов, поскольку помогают исключить или подтвердить участие дыхательной системы (по SpOa) и системы кровообращения (по амплитуде ФПГ) в нарушении транспорта кислорода.
Во- вторых, благодаря пульсоксиметрии становится обоснованным отказ от оксигенотерапии -универсального стереотипа в лечении цианотичных больных, при условии что SpOz находится в пределах нормы. Тем самым у врача появляется возможность сосредоточить усилия на решении действительных проблем: "раскрытии" периферии, ликвидации гиповолемии, повышении сократимости миокарда и пр.
В- третьих, пульсоксиметр, отражающий амплитуду фотопле-тизмограммы, позволяет судить о состоянии периферического кровотока, что ранее было недоступно. Восстановление нормальных пульсаций на ФПГ свидетельствует об улучшении кровоснабжения тканей и, как правило, совпадает с уменьшением степени акроцианоза.
Таким образом, пульсоксиметрия при гипоксемии облегчает дифференциальную диагностику, выбор лечения и контроль его эффективности, помогая адаптировать терапию к особенностям конкретного случая.
Причины артериальной гипоксемии
Артериальная гипоксемия - это следствие и признак нарушения способности дыхательной системы оксигенировать притекающую к легким венозную кровь.
Исключение составляют лишь дисгемоглобинемии, при которых, кстати, пульсоксиметрический контроль Sp02 неэффективен из-за грубых артефактов.
Значение пульсоксиметрии не сводится только к распознаванию артериальной гипоксемии и наблюдению за ее динамикой. Иногда удается определить причину нарушения оксигенации крови в легких и, следовательно, выбрать оптимальный способ коррекции.
Нужно отметить, что возможности пульсоксиметрии в дифференциальной диагностике гипоксемии скромнее, чем у лабораторного или мониторного газового анализа, ибо существующая система описания расстройств газообмена традиционно ориентирована на такие параметры, как напряжение, концентрация и парциальное давление дыхательных газов. Недостаточная точность измерения Sp02 и всегда присутствующая вероятность сдвига кривой диссоциации оксигемоглобина не позволяют использовать этот параметр для расчета РаО2. Но все же пульсоксиметрия, в сравнении с газовым анализом, обладает неоспоримым достоинством: в настоящее время это единственный широкодоступный способ обеспечить сколь угодно длительное непрерывное наблюдение за степенью насыщения артериальной крови кислородом.
Непрерывный мониторинг сатурации гемоглобина артериальной крови в сочетании с пониманием типичных механизмов нарушений легочного газообмена позволяет сделать ряд ценных выводов.
Существует несколько приемов, с помощью которых можно уточнить причину гипоксемии, выявленной пульсоксиметром.
1. Необходимо учитывать, в какой клинической ситуации возникает артериальная гипоксемия, и сопоставлять SpO2 с данными лабораторного и инструментального исследования. Например, если гипоксемия диагностируется у больного со свежей невосполненной кровопотерей, то наиболее вероятная причина снижения SpO2 - нарушение регионарных вентиляционно-перфузионных отношений в легких. Такая гипоксемия легко устраняется простой ингаляцией кислорода и инфузией.
2. Амплитуда фотоплетизмограммы в некоторых случаях позволяет подтвердить предположения, основанные на наблюдениях за SрО2. В приведенном выше примере (пациент с невосполненной кровопотерей) на дисплее пульсоксиметра отмечаются снижение пиков ФПГ, а также "дыхательные волны" - колебания кривой, синхронные с дыханием,- которые характерны именно для гиповолемии.
3. Высокоинформативна реакция SpO2 на различные лечебные воздействия (оксигенотерапию, инфузию, режим ПДКВ, изменение положения тела и пр.). Так, стойко сниженная сатурация даже на фоне применения кислорода в высокой концентрации характерна для массивного шунтирования крови в легких.
4. Изучение динамики сатурации, о которой лучше всего судить по тренду SpO2, также позволяет сделать определенные заключения. Неожиданное резкое снижение SpO2 характерно для внезапных событий, таких как смещение интубационной трубки в бронх или развитие напряженного пневмоторакса. Постепенное снижение сатурации, которую не удается нормализовать оксигенотерапией и подбором режима ИВЛ, типично для комплексных расстройств газообмена, возникающих, например, при РДС или тотальной пневмонии. Лабильная гипоксемия наблюдается при накоплении в бронхах мокроты, периодически нарушающей вентиляцию некоторых регионов легких.
5. Желательно сочетать пульсоксиметрию с другими методами мониторинга дыхания (капнографией, оксиметрией, спирометрией). Данные разных мониторов взаимно дополняют друг друга и даже в сложных случаях помогают восстановить картину нарушения легочного газообмена.
Причины артериальной гипоксемии. Таковых пять (они могут встречаться по отдельности, однако часто имеет место их сочетание):
• гиповентиляция;
• уменьшение содержания кислорода во вдыхаемом газе;
• шунтирование крови в легких;
• гиповентиляция отдельных легочных зон;
• нарушение диффузии кислорода из альвеол в кровь легочных капилляров.
В каждом из вышеперечисленных случаев гипоксемия углубляется при увеличении потребности организма в кислороде.
Пульсоксиметрия при гиповентиляции и апноэ. Снижение минутного объема вентиляции легких приводит к уменьшению доставки кислорода в альвеолы и нарушению эвакуации углекислого газа из альвеолярного пространства. При этом доставка в альвеолы углекислого газа с периферии и извлечение из них кислорода кровью, протекающей по легким, не прекращаются. В результате содержание кислорода в альвеолярном газе уменьшается, а концентрация CU2 возрастает. Соответственно изменяется и газовый состав крови, оттекающей от легких.
При гиповентиляции развиваются артериальная гипоксемия, выявляемая пульсоксиметром по снижению SpO2, и гиперкапния, сопровождающаяся расширением артери-ол, увеличением амплитуды ФПГ и тахикардией (рис. 1.11).
Степень гипо- или гипервентиляции традиционно оценивают по напряжению СОа в артериальной крови, потому что величина данного показателя зависит только от соответствия минутного объема альвеолярной вентиляции скорости продукции углекислоты. Внутрилегочный обмен кислорода подчиняется значительно более сложным законам. Поэтому снижение Sp02 можно определенно связать с гиповентиляцией лишь тогда, когда для этого есть реальные клинические предпосылки и нет оснований подозревать участие других механизмов, вызывающих гипоксемию.
Диагностика гиповентиляции по снижению SpO2 в каждом случае требует обязательного соотнесения величины этого показателя с конкретной клинической ситуацией.
Несомненным преимуществом пульсоксиметрии при гиповентиляции служит своевременность распознавания этого расстройства по самому опасному последствию - гипоксемии, способной быстро привести к тяжелым осложнениям.
Пульсоксиметр реагирует на внезапное снижение объема вентиляции значительно раньше, чем капнограф.
Как быстро развивается артериальная гипоксемия при остановке дыхания? Для анестезиолога и интенсивиста ответ на этот вопрос имеет исключительное практическое значение. Ведь речь идет о времени, которым располагает специалист, чтобы успеть интубировать больного после введения миорелаксанта, или о допустимой продолжительности аспирации мокроты у пациента, которому выполняется ИВЛ, или о любой другой ситуации, когда возникает или искусственно вызывается апноэ.
В целом скорость появления и развития гипоксемии после остановки вентиляции определяется двумя факторами: (1) потребностью организма в кислороде и (2) запасами кислорода в организме, доступными для использования в физиологическом диапазоне РаО2.
Потребность взрослого человека в кислороде в покое в среднем равна 250 мл/мин. При адекватной анестезии она снижается до 200 мл/мин, а при недостаточном обезболивании может увеличиться. Повышенная потребность в кислороде отмечается при гиперметаболических состояниях, например при стрессе.
Рис. 1.11. Эпизоды апноэ на тренде SpO2 при дыхании воздухом
Условность приведенных здесь величин очевидна. Минутное потребление кислорода зависит от массы тела и состояния метаболизма, которое, в свою очередь, определяется множеством факторов.мышечной дрожи, гипертермии или септическом шоке. Лидером среди гиперметаболических состояний является синдром злокачественной гипертермии - редчайшее осложнение общей анестезии, при котором потребность в кислороде возрастает в десятки раз.
Запасы кислорода в организме невелики и у взрослого человека, дышащего воздухом, составляют в среднем 1,5 л, а при дыхании чистым кислородом возрастают до 4- 4,5 л. Поэтому предварительная вентиляция пациента кислородом (преоксиге-нация) существенно увеличивает допустимую продолжительность последующего апноэ. В этом можно убедиться, просматривая тренды SpO2, записанные, например, во время интубаций при вводных наркозах*.
Объем кислорода в легких при дыхании атмосферным воздухом - около 450 мл, а при дыхании чистым кислородом он повышается до 3 л (размер функциональной остаточной емкости, ФОЕ - объема газа, содержащегося в легких к концу спокойного выдоха).
Любая патология, приводящая к уменьшению ФОЕ или нарушающая использование этого резерва кислорода, укорачивает срок между моментом остановки дыхания и появлением артериальной гипоксемии.
Ниже перечислены основные причины уменьшения ФОЕ, знание которых позволяет выделить из общей массы больных группу особого риска в отношении форсированного развития гипоксемии при апноэ:
• ожирение;
• высокое внутрибрюшное давление (парез кишечника, асцит, беременность и пр.), особенно в положении лежа или в положении Тренделенбурга;
• релаксация диафрагмы;
• уменьшение количества работающей легочной ткани (обширные резекции легких, пневмония, ателектазы, РДС, пробки мокроты, пневмо- или гемоторакс и пр.);
• общая анестезия;
• период новорожденности.
Ряд проблем, связанных с преоксигенацией, подробнее рассмотрен в гл. "Оксиметрия".