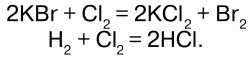Шпаргалка по неорганической химии
ModernLib.Net / Химия / Макарова Ольга / Шпаргалка по неорганической химии - Чтение
(Ознакомительный отрывок)
(стр. 1)
Ольга Владимировна Макарова
Шпаргалка по неорганической химии
1. Материя и ее движение
Материя– это объективная реальность, обладающая свойством движения. Все существующее есть различные виды движущейся материи. Материя существует независимо от сознания человека. Материя существует либо в виде вещества, либо в виде поля.
Движение материи– постоянное ее взаимодействие, а также изменения состояния объектов, вызванные этими взаимодействиями. Формы движения материи различны.
Пример формы движения материи:нагревание и охлаждение тел, излучение света, электрический ток, химические и физические превращения, жизненные процессы.
Классификация форм движения материи:
1) неживая природа;
2) живая природа;
3) общество.
Неживую природу характеризует взаимосвязь физической и химической форм движения, живую – биологическая, а общество – социальная форма движения. Одни формы движения материи способны переходить в другие.
Например: механическое движение переходит в тепловое, тепловое – в химическое, химическое – в электрическое.Возможен и обратный переход. Взаимопереход форм движения материи подтверждает единство и связь всех ее форм. В этом явлении отражен
основной закон природы– закон вечности материи и ее движения:
1) ни один вид материи и ни одна форма движения не могут быть получены из ничего и превращены в ничто;
2) материя и ее движение неуничтожимы и несотворимы – вечно изменяясь, они вечно существуют.
Материя
не может существовать вне движения,она всегда находится в состоянии движения, изменения и развития. При уничтожении движения объект прекращает свое существование, переходит в другие объекты, которым характерно движение покоя – состояния движений, обеспечивающих стабильность предмета, сохраняя его качества.
Покой относителен, а движение абсолютно– это неотъемлемое свойство материи. Структурные уровни материи:
Развитие материи– переход одного качества в другое, направленное формирование новых типов организации, рождающихся из предшествующих им типов. Две разновидности процессов развития:
1) процессы качественных превращений, в рамках соответствия вида материи, определенного уровня ее организации;
2) процессы перехода от одного уровня к другому.
Свойства и движение материи – предмет изучения естествознания. Оно изучает взаимные превращения, модификации и развитие конкретных видов материи, выявляет закономерности этих явлений и связь между ними. Изучение свойств и закономерностей материи позволяет управлять природными явлениями в нужном направлении и руководить ими в полном объеме.
2 Вещества и их изменение. Предмет неорганической химии
Вещества– виды материи, дискретные частицы которых имеют конечную массу покоя (сера, кислород, известь и т. д.). Из веществ состоят физические тела.
Каждое вещество имеет определенные физические свойства: агрегатное состояние (жидкое, твердое, газообразное), температуру плавления, кипения, замерзания, плотность, растворимость. Агрегатное состояние может переходить из одного в другое. Величины, количественно отражающие свойства веществ называются
физическими константами. Различают
чистыевещества (сера, железо, дистиллированная вода) и
смеси(природная вода, содержащая соли, сплавы). Смеси называют по веществу, преобладающему в их составе. В природе абсолютно чистых веществ не встречается. Если количество примесей ничтожно мало, то вещество считается условно чистым. Чистое вещество однородно, смеси бывают однородные и неоднородные.
Однородные смеси– смесь двух или нескольких веществ, которые не обнаруживаются при помощи аппаратуры (смеси газов, многие жидкости, например, кровь, сплавы).
Различают простые и сложные вещества. Вещества, состоящие из атомов одного вида, называются
простыми(S – сера, C – графит, O2 – кислород, H2 – водород, все металлы). Вещества, состоящие из атомов разного вида, называются
сложными(Н2О – вода, СО2 – углекислый газ, Н2SO4 – серная кислота).
Вещества подвержены различным изменениям. Явления, сопровождающиеся коренными изменениями вещества, при которых из одних веществ образуются другие, называются
химическими(Fе (железо) + S (сера) = FеS (сульфид железа)), что является предметом изучения неорганической химии.
Предметом неорганической химииявляется изучение химических элементов и образуемых ими простых и сложных веществ (кроме соединений углерода, составляющих предмет органической химии), превращений веществ, сопровождающихся изменениями его состава, свойств и (или) строения.
Неорганические вещества, или минеральные– вещества, встречающиеся в неживой природе (песок, сера, минералы, графит).
Неорганическая химия связана с другими разделами химии –
аналитической, коллоидной, кристаллохимией, физической, термодинамикой, электрохимией, радиохимией, химической физикой; на стыке неорганической и органической химии лежит химия металло-органических соединений и элементооргани-ческих соединений. Неорганическая химия соприкасается с
геолого-минералогическими науками: геохимией и минералогией, а также с техническими науками – химической технологией (ее неорганической частью), металлургией и агрохимией.
3. Закон сохранения массы. Основное содержание атомно-молекулярного учения
Атомно-молекулярное учение разработал
М.В. Ломоносовв 1741 г.
Основные положения закона: 1) все вещества состоят из «корпускул» (молекул); 2) молекулы состоят из «элементов» (атомов); 3) частицы – молекулы и атомы – находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц; 4) молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ – из различных атомов. Атомно-молекулярное учение окончательно утвердилось в
1860 г.
Молекула– это наименьшая частица вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее атомным составом и их химическим строением.
Атом– это наименьшая электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов и входящая в состав молекул простых и сложных веществ.
Закон сохранения массы веществ, позже (в 1748 г.) сформулированный М.В. Ломоносовым, подчинен закону атомно-молекулярно-го учения и объяснен с точки зрения последнего:
общее число атомов остается постоянным до и после реакций. Например: То есть из двух молекул бромида калия и одной молекулы хлора (т. е. в общем из трех молекул) образовалось 2 молекулы хлорида калия и одна молекула брома (т. е. образовалось три молекулы), 3 = 3. Из одной молекулы водорода и одной молекулы хлора – 2 молекулы хлороводорода. А масса веществ до и после реакции не претерпевает изменений, т. к. атомы имеют постоянную массу.
Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.В
1789 г.независимо от Ломоносова этот же закон изложил французский ученый и химик Лавуазье. Он также экспериментальным путем получил неопровержимое доказательство закона, проведя опыты с многими реакциями. Закон сохранения массы веществ Ломоносов связывал с сохранением энергии. Он рассматривал эти законы с точки зрения всеобщего закона природы. Закон сохранения массы веществ и закон сохранения энергии – единые законы природы – законы вечной материи и ее движения. Взаимосвязь массы и энергии выражается уравнением Энштейна: Е = mc2, где
Е– энергия,
m– масса, и
с– скорость света в вакууме.
Значение закона сохранения массы веществ.Закон сохранения массы веществ позволяет правильно составить уравнение химических реакций, является опорой для осуществления расчетов по химическим уравнениям, позволяет сформулировать представление о всеобщем равновесии материи.
4. Эквивалент. Закон эквивалентности. Важнейшие классы и номенклатура неорганических веществ
Эквивалент– такое количество вещества (элемента), которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Это величина безразмерная, непостоянная, зависит от ряда факторов: валентности, реакций, в которых участвует вещество: В окислительно-восстановительных реакциях: Эквивалент в реакциях нейтрализации зависит от того, какая соль получается в результате реакции (средняя или основная). или
Закон эквивалентовоткрыт в 1873 году Рихтером: вещества взаимодействуют друг сдругом, а также получаются в массовых количествах, пропорциональных их эквивалентам.
где m1и
m2 –массы веществ,
Э– эквиваленты. Неорганические вещества делятся на
простые(металлы и неметаллы) и
сложные(оксиды, основания, кислоты, соли).
Оксиды– сложные вещества, состоящие из двух элементов, один из которых кислород, бывают
несолеобразующие(N2O) и
солеобразующие (основные(К2О),
кислотные(SО2),
амфотерные(Al2O3).
Основания– электролиты, которые при диссоциации образуют только гидроксид-ионы, бывают
растворимые(щелочи: NаОН, Ва(ОН)2),
нерастворимые(Fe(OH)2),
амфотерные(Аl(ОН)3).
Кислоты– электролиты, которые при диссоциации образуют катионы водорода, бывают
сильные (Н2SO4, НNO3),
слабые(НBr),
одноосновные(НСl),
многоосновные(Н2СО3, Н3РО4),
кислородосодержащие(Н2SO4, НСlО),
бескислородные(НI, НСN).
Соли– электролиты, при диссоциации которых образуются катионы металлов или катион аммония NН4, анионы кислотных остатков, бывают
средние(К2SO4, Сu(NO3)2),
кислые(КНSO4, NаНСО3),
основные(СuОНСl, FeOHSO4),
двойные(КМnO4, СаZnO2),
комплексные(К4[Fe(CN)6]),
растворимые(NаСl, К2SO4)
и нерастворимые(ВаSO4, АgСl).
5. Периодическая система элементов Д.И. Менделеева
Периодический закон был открыт
в 1869 году Д.И. Менделеевым. Им же была создана классификация химических элементов, выраженная в форме периодической системы. До Менделеева были предприняты попытки классификации и систематизации элементов, но неудачные. Менделеев был уверен, что между элементами существует закономерная связь. Он доказал это, расположив элементы по возрастанию, взяв за основу атомный вес, и обнаружил, что элементы, имеющие аналогичные химические свойства, встречаются через одинаковые интервалы. Эта закономерность была выражена в периодическом законе:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
При анализе периодической системы Менделеева было обнаружено:
Свойства химических элементов по мере возрастания атомного веса не изменяются бесконечно, а имеют периодический характер.
В таблице Менделеева существуют периоды и группы:
Периоды– это ряды элементов, в которых свойства элементов меняются последовательно. В таблице Менделеева 3 малых и 4 больших периода.
Группы– это ряды элементов, обладающих сходными свойствами. В таблице Менделеева 8 групп.
Наибольшая валентность каждой группы по кислороду соответствует номеру группы, за некоторыми исключениями. Элементы первой группы образуют оксиды с общей формулой –
R2O, второй –
RO, третьей –
R2O3и т. д.
Группы делятся на подгруппы: главную и побочную.
Значение периодической системы Менделеева.
Периодическая система элементов явилась первой естественной классификацией химических элементов, показавшей, что они взаимосвязаны друг с другом, а также послужила дальнейшим исследованиям.
Когда Менделеев на основе открытого им периодического закона составлял свою таблицу, многие элементы были еще неизвестны. Как, например, три элемента 4-го периода. Предположительно элементы назывались экабор (его свойства должны напоминать бор), экаалюминий, экасилициум. В течение 15 лет предсказания Менделеева подтвердились. Французский химик
Лекок де Буабодраноткрыл галлий, обладающий всеми свойствами экаалюминия,
Л.Ф. Нильсоноткрыл скандий, и
К.А. Винклероткрыл элемент германий, имеющий свойства экасилиция.
Открытие Ga, Sc, Ge – доказательство существования периодического закона. Большое значение имела периодическая система и при установлении валентности и атомных масс некоторых элементов, исправив некоторые из них. На основе периодического закона в настоящее время созданы трансурановые элементы.
6. Теория химического строения
Теорию химического строенияразработал
А.М. Бутлеров.Она имеет
следующие положения: 1) атомы в молекулах соединены друг с другом в определенной последовательности. Изменение этой последовательности приводит к образованию нового вещества с другими свойствами; 2) соединение атомов происходит соответственно их валентностям; 3) свойства веществ зависят от их химического строения.
Вывод:свойства вещества определяются внутренней структурой – химическим строением. По теории строение молекул возможно изобразить в виде структурных формул. В них указана последовательность соединения атомов, каждая черточка обозначает единицу валентности. По этой схеме можно понять различия веществ по свойствам. Структурные формулы не отражают взаимного расположения атомов в пространстве.
Вывод:вещество допустимо изображать при помощи структурной формулы, если вещество имеет молекулярное строение. Не все вещества имеют молекулярное строение.
Виды строения веществ:молекулярное; атомное; ионное. Теория химического строения объясняет явление
изомерии.
Изомеры– соединения, обладающие одним и тем же качественным и количественным составом, но разными свойствами. Зависимость свойств изомеров и органических соединений от их химического строения объясняется передающимся «взаимным влиянием атомов», в результате чего атомы приобретают различные химические свойства.
Бутлеровпредвидел и доказал существование позиционной и скелетной изомерии. В
1863 г.ему удалось впервые получить самый простой третичный спирт –
третичный бутиловый спирт, или
триметилкарбинол. Он расшифровал его строение и доказал наличие у него изомеров. В
1864 г. Бутлеровпредсказал существование двух
бутанови трех
пентанов, позднее –
изобутилена. Теория химического строения послужила предпосылкой развития
теории химической связи. В
1916 г. Льюиспредположил, что химическая связь возникает при образовании электронной пары, принадлежащей двум атомам. Из этого предположения была разработана
теория ковалентной связи.
В. Коссельпредположил, что один атом отдает ион, а другой его принимает при взаимодействии друг с другом. Один атом становится положительно заряженным, а другой – отрицательно заряженным. Из этих идей развилась современная
теория ионной связи.
7. Общая характеристика P-, S-, D-элементов
Элементы в периодической системе Менделеева делятся на s-, p-, d-элементы. Это подразделение осуществляется на основе того, сколько уровней имеет электронная оболочка атома элемента и каким уровнем заканчивается заполнение оболочки электронами.
К
s-элементамотносят элементы
IA-группы – щелочные металлы. Электронная формула валентной оболочки атомов щелочных металлов
ns1. Устойчивая степень окисления равна +1. Элементы
IА-группыобладают сходными свойствами из-за сходного строения электронной оболочки. При увеличении радиуса в группе Li-Fr связь валентного электрона с ядром слабеет и уменьшается энергия ионизации. Атомы щелочных элементов легко отдают свой валентный электрон, что характеризуют их как сильные восстановители.
Восстановительные свойства усиливаются с возрастанием порядкового номера.
К
p-элементамотносятся 30 элементов
IIIA-VIIIA-групппериодической системы; p-элементы расположены во втором и третьем малых периодах, а также в четвертом—шестом больших периодах. Элементы
IIIА-группыимеют один электрон на p-орбитали. В
IVА-VIIIА-
группахнаблюдается заполнение p-подуровня до 6 электронов. Общая электронная формула p-элементов
ns2np6. В периодах при увеличении заряда ядра атомные радиусы и ионные радиусы p-элементов уменьшаются, энергия ионизации и сродство к электрону возрастают, электроотрицательность увеличивается, окислительная активность соединений и неметаллические свойства элементов усиливаются. В группах радиусы атомов увеличиваются. От 2p-элементов к 6p-элементам энергия ионизации уменьшается. Усиливаются металлические свойства p-элемента в группе с увеличением порядкового номера.
К
d-элементамотносятся 32 элемента периодической системы
IV–VII больших периодов. В
IIIБ-группеу атомов появляется первый электрон на d-орбитали, в последующих Б-группах d-подуровень заполняется до 10 электронов. Общая формула внешней электронной оболочки
(n-1)dansb, где a=1?10, b=1?2. С увеличением порядкового номера свойства d-элементов изменяются незначительно. У d-эле-ментов медленно происходит возрастание атомного радиуса, также они имеют переменную валентность, связанную с незавершенностью предвнешнего d-электронного подуровня. В низших степенях окисления d-элементы обнаруживают металлические свойства, при увеличении порядкового номера в группах Б они уменьшаются. В растворах d-элементы с высшей степенью окисления обнаруживают кислотные и окислительные свойства, при низших степенях окисления – наоборот. Элементы с промежуточной степенью окисления проявляют амфотерные свойства.
8. Ковалентная связь. Метод валентных связей
Химическая связь, осуществляемая общими электронными парами, возникающих в оболочках связываемых атомов, имеющих антипараллельные спины, называется
атомной, или ковалентной связью.Ковалентная связь двухэлектронная и двуцентровая (удерживает ядра). Она образуется атомами одного вида – ковалентная
неполярная– новая электронная пара, возникшая из двух неспаренных электронов, становится общей для двух атомов хлора; и атомами разного вида, сходных по химическому характеру – ковалентная
полярная.Элементы с большей электроотрицательностью (Cl) будут оттягивать общие электроны от элементов с меньшей электроотрицательностью (Н). Атомы с непарными электронами, имеющими параллельные спины, отталкиваются – химическая связь не возникает. Способ образования ковалентной связи называется
обменным механизмом.
Свойства ковалентной связи. Длина связи –межъядерное расстояние. Чем это расстояние короче, чем прочнее химическая связь.
Энергия связи –количество энергии, требующееся для разрыва связи. Величина кратности связи прямо пропорциональна энергии связи и обратно пропорциональна длине связи.
Направленность связи –определенное расположение электронных облаков в молекуле.
Насыщаемость– способность атома образовывать определенное количество ковалентных связей. Химическая связь, образованная перекрыванием электронных облаков вдоль оси, соединяющей центры атомов, называется
?-связью.Связь, образованная перекрыванием электронных облаков перпендикулярно оси, соединяющей центры атомов, называется
?-связью. Пространственная направленность ковалентной связи характеризуется углами между связями. Эти углы называются
валентными углами. Гибридизация –процесс перестройки неравноценных по форме и энергии электронных облаков, ведущих к образованию одинаковых по тем же параметрам гибридных облаков.
Валентность– число химических связей
(
ковалентных
),посредством которых атом соединен с другими. Электроны, участвующие в образовании химических связей, называются
валентными. Число связей между атомами равно числу его неспаренных электронов, участвующих в образовании общих электронных пар, поэтому валентность не учитывает полярность и не имеет знака. В соединениях, в которых отсутствует ковалентная связь, имеет место
степень окисления –условный заряд атома, исходный из предположения, что оно состоит из положительно или отрицательно заряженных ионов. К большинству неорганических соединений применимо понятие степень окисления.
9. Неполярная и полярная ковалентные связи
При помощи химической связи атомы элементов в составе веществ удерживаются друг возле друга. Тип химической связи зависит от распределения в молекуле электронной плотности.
Химическая связь– взаимное сцепление атомов в молекуле и кристаллической решетке под воздействием электрических сил притяжения между атомами. Атом на внешнем энергетическом уровне способен содержать от одного до восьми электронов.
Валентные электроны– электроны предвнешнего, внешнего электронных слоев, участвующие в химической связи.
Валентность– свойство атомов элемента образовывать химическую связь.
Ковалентная связьобразуется за счет общих электронных пар, возникающих на внешних и предвнешних подуровнях связываемых атомов.
Общая электронная пара осуществляется черезобменный или донорно-акцепторный механизм.
Обменный механизм образования ковалентной связи– спаривание двух неспа-ренных электронов, принадлежащих различным атомам.
Донорно-акцепторный механизм образования ковалетной связи– образование связи за счет пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
Есть
две основные разновидности ковалентной связи:неполярная и полярная.
Ковалентная неполярная связьвозникает между атомами неметалла одного химического элемента (O2, N2, Cl2) – электронное облако связи, образованное общей парой электронов, распределяется в пространстве симметрично по отношению к ядрам обоих атомов.
Ковалентная полярная связьвозникает между атомами различных неметаллов (HCl, CO2, N2O) – электронное облако связи смещается к атому с большей электроотрицательностью.
Чем сильнее перекрываются электронные облака, тем прочнее ковалентная связь.
Электроотрицательность– способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Свойства ковалентной связи:1) энергия; 2) длина; 3) насыщаемость; 4) направленность.
Длина связи– расстояние между ядрами атомов, образующих связь.
Энергия связи– количество энергии, необходимое для разрыва связи.
Насыщаемость– способность атомов образовывать определенное число ковалентных связей.
Направленность ковалентной связи– параметр, определяющий пространственную структуру молекул, их геометрию, форму.
Гибридизация– выравнивание орбиталей по форме и энергии. Существует несколько форм перекрывания электронных облаков с образованием ?-связей и ?-связей (?-связь намного прочнее ?-связи, ?-связь может быть только с ?-связью).
10. Многоцентровые связи
В процессе развития метода валентных связей выяснилось, что настоящие свойства молекулы оказываются промежуточными между теми, которые описывает соответствующая формула. Такие молекулы описывают набором из нескольких валентных схем
(метод наложения валентных схем). В качестве примера рассматривается молекула метана СН4. В ней отдельные молекулярные орбитали взаимодействуют друг с другом. Это явление называется
локализованной многоцентровой ковалентной связью.Эти взаимодействия слабые, поскольку степень перекрывания орбиталей невелика. Но молекулы с многократно перекрывающимися атомными орбиталями, ответственными за образование связей путем обобществления электронов тремя и более атомами, существуют (дибо-ран В2Н6). В этом соединении центральные атомы водорода соединены трехцентровыми связями, образовавшимися в результате перекрывания sp3-гибридных орбиталей двух атомов бора с 1s-атомной орбиталью атома водорода.
С точки зрения метода молекулярных орбиталей считается, что каждый электрон находится в поле всех ядер, но связь не обязательно образована парой электронов (Н2+ – 2 протона и 1 электрон).
Метод молекулярных орбиталейиспользует представление о молекулярной орбитали, описывая распределение электронной плотности в молекуле.
Молекулярные орбитали– волновые функции электрона в молекуле или другой многоатомной химической частице.
Молекулярная орбиталь (МО)занята одним или двумя электронами. В области связывания состояние электрона описывает связывающая молекулярная орбиталь, в области разрыхления – разрыхляющая молекулярная орбиталь. Распределение электронов по молекулярным орбиталям происходит так же как и распределение электронов по атомным орбиталям в изолированном атоме.
Молекулярные орбиталиформируются при комбинациях атомных орбиталей. Их число, энергия и форма выводятся исходя из числа, энергии и формы орбиталей атомов – элементов молекулы.
Волновые функции, отвечающие молекулярным орбиталям в двухатомной молекуле, представляют в виде суммы и разности волновых функций, атомных орбиталей, умноженных на постоянные коэффициенты: ?(АВ) = c1?(A)±c2?(B). Это
метод вычисления одноэлектронной волновой функции(молекулярные орбитали в приближении линейной комбинации атомных орбиталей).
Энергии связывающих орбиталейниже энергии атомных орбиталей. Электроны связывающих молекулярных орбиталей находятся в пространстве между связываемыми атомами.
Энергии разрыхляющих орбиталейвыше энергии исходных атомных орбиталей. Заселение разрыхляющих молекулярных орбиталей электронами ослабляет связь.
11. Ионная связь
Связь, возникшая между атомами с резко выраженными противоположными свойствами (типичным металлом и типичным неметаллом), между которыми возникают силы электростатического притяжения, называется
электровалентной,или
ионной связью. Соединения, образовавшиеся путем притяжения ионов, называются
гетерополярными,или
ионными. (FrF – самое типичное ионное соединение, NaCl). Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности, в результате перехода электронов от атомов одних элементов к другим. Ионные соединения возникают между элементами I и II групп с элементами главных подгрупп VI и VII групп. Типичные металлы имеют на внешнем энергетическом уровне не более 3-х электронов, которые они отдают, превращаясь в положительно заряженные катионы, а типичные неметаллы, имеющие 6–7 электронов на внешнем валентном уровне, принимают недостающие электроны, превращаясь в отрицательно заряженные катионы, т. е. электронные оболочки соединяющихся элементов превращаются в электронную оболочку (завершенный уровень) благородных газов. Вещества с ионной связью имеют кристаллическую решетку, твердые, являются электролитами, с высокими температурами кипения и плавления, при растворении в воде или плавлении проявляют свойства сильных электролитов. Ионная связь – производная ковалентной связи в результате односторонней поляризации общей электронной пары, переходящей во владение одного из соединяющихся атомов.
Одностороннюю поляризацию осуществляет атом хлора, обладающего ярко выраженными неметаллическими свойствами. Электроны переходят от атома натрия, имеющего типичные металлические свойства, к атому хлора. В результате к атому хлора смещается общее электронное облако. Ионная связь – высшая степень ковалентной неполярной связи. Ко-валентная полярная связь является промежуточной формой между ионной и ковалентной неполярной связью. Природа образования ко-валентной и ионной связи едина, принципиальных отличий не существует. Различие состоит в степени поляризации. Ионной связи характерны
ненасыщаемость– каждый ион, взаимодействуя с противоположным во всех направлениях, не компенсирует силовые поля, и
ненаправленность– любой ион в любом направлении способен притягивать к себе ион противоположного заряда. В результате этих свойств ионные соединения представляют собой твердые тела с ионной кристаллической решеткой. 100 %-ной ионной связи не существует. Существует степень или доля ионности связи – в соединении СsF ионная связь имеет долю 89 %.
12. Водородная связь
В 80-х годах XIX в. М.А. Ильинскийи
Н.Н. Бекетовустановили, что атом водорода, соединенный с атомом фтора, кислорода или азота, способен образовывать еще одну дополнительную связь – то есть некоторые водородосодер-жащие группы атомов образуют химическую связь, электроотрицательные атомы которой входят в состав молекулы. Этот вид связи получил название
водородная связь.
Водородная связь– взаимодействие между двумя электроотрицательными атомами одной или нескольких разных молекул при помощи атома водорода: А—Н...В (чертой обозначена ковалентная связь, тремя точками – водородная связь).
Для водородной связи характерноэлектростатическое притяжение водорода (несущего положительный заряд ?+) к атому электроотрицательного элемента, имеющего отрицательный заряд ?-. Чаще всего она слабее ковалентной, но сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах.
Водородная связь отличается от межмолекулярных взаимодействий тем, что обладает свойствами направленности и насыщаемости.
Страницы:
1, 2
|
|