 |
|
Популярные авторы:: Грин Александр :: Борхес Хорхе Луис :: Раззаков Федор :: Азимов Айзек :: Толстой Лев Николаевич :: Горький Максим :: Чехов Антон Павлович :: Кларк Артур Чарльз :: Желязны Роджер :: БСЭ Популярные книги:: The Boarding House :: По заданию преступного синдиката :: Невеста поневоле :: Дюна (Книги 1-3) :: Человек, который принял свою жену за шляпу :: 100 вещей, которые я сделаю, когда стану злым властелином :: «Фирма приключений» :: Созвездие Ворона :: Мертвые души :: Жизнь Чезаре Борджиа |
КристаллыModernLib.Net / Физика и астрономия / Китайгородский Александр Исаакович / Кристаллы - Чтение (стр. 2)
Кристаллические решётки очень разнообразны. Однако свойства, общие для всех кристаллов, безупречно объясняются решетчатым строением кристаллов. Прежде всего, нетрудно понять, что идеально плоские грани – это плоскости, проходящие через узлы, в которых сидят атомы. Но узловых плоскостей можно провести сколько угодно по самым различным направлениям. Какие же из этих узловых плоскостей ограничивают выросший кристалл? Обратим внимание прежде всего на следующее обстоятельство: разные узловые плоскости и линии заполнены узлами не одинаково плотно. Опыт показывает, что кристалл огранён плоскостями, которые гуще всего усеяны узлами, плоскости же пересекаются по рёбрам, в свою очередь, наиболее густо заселённым узлами. Рисунок 18 даёт вид кристаллической решётки перпендикулярно к её грани; проведены следы некоторых узловых плоскостей, перпендикулярных чертежу. Из сказанного ясно, что у кристалла могут развиться грани, параллельные узловым плоскостям I, и не будет граней, параллельных редко усеянным узлами плоскостям II. 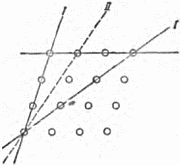
Рис. 18. Схема расположения некоторых узловых плоскостей в кристаллической решётке; плоскости I могут служить внешними гранями, II – нет. Внешняя симметрия кристалла также определяется типом его решётки. Наиболее симметричными бывают кристаллы с кубической элементарной ячейкой. К высокосимметричным относятся также кристаллы с ячейкой в виде прямой призмы, у которой в основании лежит квадрат или ромб с углом 60°. Облечём теперь скелеты-решётки плотью, перейдём к рассмотрению упаковки частиц в кристаллах. 7. Биллиардные шары как строительный материал Мы знаем, что «строительный материал» кристаллов – атомы имеют очень сложное собственное строение: на различных расстояниях от положительно заряженного ядра, состоящего в свою очередь из ряда более мелких частиц, вращаются электроны, несущие отрицательный заряд[4]. Однако в очень многих случаях – позднее мы скажем, в каких именно, – для воспроизведения расположения атомов в кристалле их можно уподобить шарам. Такое представление об атомах отнюдь не отражает всей их сложной природы, но правильно передаёт одно важное обстоятельство, а именно: рентгеновские исследования структуры кристаллов приводят нас к мысли, что кристаллы строятся по принципу наиболее плотной упаковки шаров. Для того чтобы ясно представить себе сущность этого принципа, возьмём большое количество биллиардных шаров и начнём укладывать их, стремясь создать наиболее плотную упаковку. Прежде всего составим плотный слой – он выглядит так, как биллиардные шары, собранные «треугольником» перед началом игры (рис. 19). 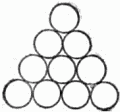
Рис. 19. Один плотный слой шаров. Отметим, что шар внутри треугольника имеет шесть соприкасающихся с ним соседей. Ясно, что нет другого способа составить плотнейший слой из шаров. Будем продолжать укладку наложением слоёв друг на друга. Если бы мы поместили шары следующего слоя непосредственно над шарами первого слоя, то такая упаковка была бы неплотной. Желая разместить в некотором объёме наибольшее число шаров, мы должны положить шары второго слоя в лунки нижележащего. Обратим внимание на то, что заполнить все лунки шарами того же самого размера нельзя: лунки заполняются через одну. Отметим на чертеже чёрным лунки первого слоя, оставшиеся пустыми (рис. 20). Плотная упаковка из двух слоёв также существует лишь одна: мы можем, конечно, заполнить шарами второго слоя все «чёрные» лунки, оставив «белые» пустыми, но от этого вид упаковки не изменится. Однако положение меняется, когда мы переходим к третьему этажу. 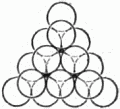
Рис. 20. Два плотных слоя шаров. Чтобы получить плотнейшую упаковку, мы должны укладывать шары третьего слоя в лунки второго. Но при этом шары третьего слоя могут быть размещены двумя способами: либо так, чтобы центры этих шаров лежали над центрами шаров первого слоя, либо так, чтобы их центры лежали над «чёрными» лунками. Наши две трёхэтажные постройки обладают одинаковой плотностью упаковки, но существенно отличаются одна от другой. При наложении 4-го слоя мы ещё более увеличим число возможных упаковок: из двух трёхслойных упаковок мы можем сделать 4 четырёхслойные. Пятислойных будет уже 8 и т.д. Ясно, что число различающихся между собой одинаково плотных шаровых упаковок может быть исключительно велико. Теперь нам надо проследить связь между кристаллической решёткой и шаровой упаковкой. Мы знаем, что основой решётки служат ячейки-кирпичи, прикладыванием которых друг к другу строится кристалл, и какое бы направление мы ни выбрали в кристалле, всегда по этому направлению структура строго повторяется через равные промежутки. А отсюда следует, что кристалл должен представлять собой такую упаковку атомов-шаров, в которой положение слоёв строго повторяется через определённое число слоёв. Если это повторение начинается, например, с 14-го слоя, то это значит, что в высоту ячейка состоит из 13 слоёв. Тогда 14-й слой находится над первым, 15-й – над вторым, 16-й – над третьим и т.д. Самая простая упаковка – двухслойная: третий слой лежит над первым, четвёртый – над вторым и т.д. Это – так называемая гексагональная плотнейшая упаковка. На рисунке 21 показана её решётка (скелет). Кружки и крестики соответствуют положениям центров атомов. Атомы, центры которых обозначены крестиками, входят в лунки как нижнего, так и верхнего слоёв. Этим способом построены, например, кристаллы магния. Исключительно большое распространение имеют трёхслойные кристаллы, в которых 4-й слой повторяет первый, пятый – второй и т.д. Рисунок 22, где по-прежнему отмечены лишь центры атомов, показывает, что в такой упаковке можно выбрать кубическую элементарную ячейку. Плотные слои расположены здесь перпендикулярно диагонали куба, соединяющей два атома, центры которых обозначены кружками. 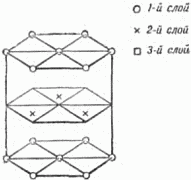
Рис. 21. Скелет плотной гексагональной упаковки. 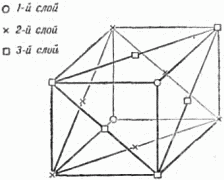
Рис. 22. Скелет гранецентрированной кубической упаковки. (Отмечены центры шаров). Попытайтесь представить себе ячейку расположенной так, чтобы эта диагональ шла вертикально. Левый задний кружок окажется при этом внизу и, единственный на нашем рисунке, будет принадлежать первому слою (центры других атомов этого слоя, принадлежащих соседним ячейкам, на рисунок не попали). На первом слое плотно лежит второй слой: центры шести его атомов, попавших на рисунок, – это крестики, расположенные по вершинам и серединам сторон треугольника. Третий плотный слой представлен шестью квадратиками, расположенными также по треугольнику. Наконец, четвёртый слой, повторяющий первый, содержит на нашем рисунке снова только один кружок. Итак, элементарная ячейка трёхслойной шаровой упаковки – это куб, у которого в вершинах и серединах граней расположены центры атомов. Такую ячейку, называемую кубической гранецентрированной, имеет ряд металлов, например: алюминий, медь, никель, при высокой температуре – железо (о влиянии температуры мы скажем ниже, на страницах 38 и 63). Мы видим теперь, что реальный кристалл представляет собой систему плотно упакованных частиц, расположение которых повторяется в пространстве. Узлы и линии, соединяющие узлы, – лишь мысленная схема, помогающая нам выделить в кристалле элементарный кирпич и наметить направления, в которых его нужно перекладывать, чтобы заполнить весь кристалл. Несколько слов о размерах «шаров»-атомов. Точные измерения, произведённые при помощи рентгеновских лучей, привели к следующим данным: радиусы атомов разных веществ колеблются в небольших пределах, примерно от 0,5 до 2 стомиллионных долей сантиметра. Мы рассматривали упаковки, составленные из одинаковых шаров. Это значит, что пока речь шла о кристаллах химических элементов, содержащих атомы только одного сорта (правда, и элементы не все построены так просто). Перейдём теперь к кристаллам, построенным из атомов нескольких сортов, то есть к кристаллам сложных веществ. 8. Упаковка атомов Опыты показывают, что кристаллы очень многих сложных веществ мы можем также изобразить, как плотные упаковки шаров. Атомам разных сортов соответствуют шары различных размеров. Строительным материалом кристаллов служат при этом, главным образом, электрически заряженные атомы – ионы[5]. Представим себе, что надо упаковать равное количество крупных и малых шаров. Как сделать упаковку наиболее плотной? Учёные нашли ответ на этот вопрос. Рассматривая упаковки шаров одинакового размера, мы видим, что не всё пространство заполнено шарами. В упаковках сохраняются пустоты; можно подсчитать, что их объём составляет около 1/4 общего объёма. Пустоты эти – двух разных сортов: одни из них окружены 4 шарами, центры которых размещены в вершинах правильного четырёхгранника – тетраэдра (см. главу 1); другие окружены 6 шарами, причём центры этих шаров образуют правильный восьмигранник – октаэдр. Первые меньше по своим размерам, и их число вдвое больше, чем вторых. Теперь нам понятно, как упаковать шары двух разных размеров: надо составить плотнейшую упаковку из более крупных шаров и в пустотах разместить меньшие (не обязательно во всех пустотах!). На рисунке 23 слева наверху показано, как располагается маленький шар в меньшей (окружённой 4 шарами) пустоте. Для наглядности окружающие пустоту крупные шары представлены не целиком, а секторами, вырезанными из них подобно тому, как вырезают клинья из арбузов. 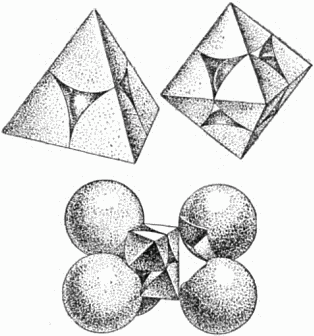
Рис. 23. Вверху: слева – малая, справа – большая пустоты в плотной упаковке шаров; внизу указано, как вырезана правая фигура. Наверху справа маленький шар расположен в большей пустоте (окружённой 6 крупными шарами), а внизу показан способ вырезания секторов из шести соседних шаров (передний шар при этом убран). Пустоты обоих сортов можно найти на рисунке 22 (гранецентрированный куб). Например, большая пустота находится в центре куба; центры окружающих её шести атомов – это три крестика и три квадрата на серединах граней. Можно подсчитать, что в любой плотной упаковке одинаковых шаров на каждый шар приходится одна большая и две меньшие пустоты. Маленькие шары размещаются в этих пустотах; если же они несколько велики для пустот и не помещаются там, то раздвигают соседние крупные шары, разрыхляя плотную упаковку. То обстоятельство, что упаковки могут быть построены из разного числа слоев и «узор» заполнения пустот маленькими шарами может быть также различен, ведёт к величайшему многообразию структур кристаллов. Кристаллы поваренной соли представляют собой плотную трёхслойную упаковку крупных ионов хлора (светлые шары на рисунке 24,а); ионы натрия (тёмные шары) заполняют все большие пустоты, поэтому каждый ион натрия окружён шестью ионами хлора. Сернистое железо (пирротин) представляет собой двухслойную упаковку крупных ионов серы; меньшие ионы железа заполняют все крупные пустоты. В кристалле окиси лития, где по химическому составу на один атом кислорода приходится два атома лития, плотную упаковку образуют крупные ионы кислорода; маленькие ионы лития заполняют все меньшие пустоты. Поэтому каждый ион лития имеет четырёх соседей – ионы кислорода. В кристалле хлористого кадмия (химический состав его – два атома хлора на один атом кадмия) плотная упаковка образована крупными ионами хлора (крупные шары на рисунке 24,б). Ионы кадмия, изображённые маленькими шарами, заполняют большие пустоты, но не все, а через два слоя ионов хлора. На рисунке 24, б для ясности посредине удалено два слоя крупных шаров, не содержащих между собой малых шаров. Линиями показана элементарная ячейка кристалла. 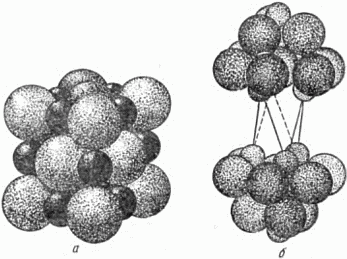
Рис. 24. Упаковки ионов в кристаллах: а – поваренной соли; б – хлористого кадмия. Мы привели лишь простейшие «узоры» заполнения пустот плотной упаковки. Большие работы по описанию кристаллических структур приведённым способом сделаны членом-корреспондентом Академии наук СССР Н.В. Беловым. Эти работы принесли значительную пользу науке, позволили найти много закономерностей, объясняющих механические, оптические и электрические свойства различных минералов. Напомним, что представление об атомах, как о шарах, правильно отражая одно важное свойство атомов – свойство укладываться в плотные кристаллические упаковки, вовсе не исчерпывает сложнейшей природы атомов и не означает, что атомы – просто твёрдые шарики. Уподобление атома шарику означает, по существу, следующее. Вокруг ядра атома, как вокруг центра, мы мысленно проводим сферу такого радиуса, что основная часть электронов данного атома попадает внутрь этой сферы. Вот и получается шар, который служит, как говорят, моделью атома. Воспроизведённая нами картина строения кристалла была бы неполной, если бы мы не сказали ещё о некоторых особенностях поведения атомов в кристалле. Дело в том, что при объединении атомов в кристалл, некоторая доля их электронов «обобществляется» – начинает принадлежать не отдельным атомам, а всему кристаллу в целом. Постоянное движение около одного атома для этих, так называемых свободных электронов прекращается, и они «бродят» по всему объёму кристалла, пристраиваясь временно к встречным ионам и вновь покидая их. При этом остовы атомов – их ядра с основной массой электронов, то есть ионы кристаллической решётки, совершают лишь малые колебания около положений равновесия в отличие от хаотически движущихся атомов жидкости или газа. Напротив, поведение свободных электронов кристалла при определённых условиях очень сходно с поведением атомов газа. Поэтому свободные электроны называют ещё «электронным газом». Доля свободных электронов в большинстве случаев очень мала. Так обстоит дело у кристаллов, построенных из разноимённых ионов, например, у кристалла поваренной соли. Здесь практически все 10 электронов положительного иона натрия движутся около ядра натрия, и все 18 электронов отрицательного иона хлора движутся около ядра хлора. (Необходимо различать свободные электроны, не имеющие постоянного «хозяина», и электроны, которые при образовании разноимённых ионов по одному на каждый атом перешли от натрия к хлору. Эти последние цепко удерживаются хлором, который не отпускает их «на свободу».) Иначе обстоит дело в металлических кристаллах, где атомы отдают, но не могут принимать лишних электронов, и все ионы, таким образом, положительны. Здесь «обобществлённой» оказывается значительная доля электронов. Каждый атом отдаёт в общее пользование 1–3 электрона из числа внешних, всего слабее притягиваемых ядром. У одновалентных металлов, таких как литий, натрий и т.д., один электрон связан со своим атомом значительно слабее, чем остальные. В кристаллах этих металлов почти каждый атом отдаёт в общее пользование один электрон. У двухвалентных металлов, таких как кальций, барий и т.д., два электрона связаны со своим атомом значительно слабее, чем остальные. Поэтому в кристаллах этих атомов в общее пользование идут примерно по два электрона с атома. Кристалл образуется из атомов благодаря притяжению между ними. Сильное притяжение имеет место между разноимённо заряженными ионами, например, между отрицательно заряженными ионами хлора и положительно заряженными ионами натрия. Каждый ион хлора притягивает к себе 6 ионов натрия, окружив себя таким образом со «всех сторон» частицами другого знака. В свою очередь, каждый ион натрия притягивает 6 окружающих его ионов хлора. Благодаря этому и возникает плотная упаковка частиц в кристалле. Притяжение ионов уравновешивается отталкиванием, возникающим при их сближении. Силы отталкивания – это силы взаимодействия электронов сблизившихся атомов. Итак, ионы располагаются в кристалле на таком расстоянии, на котором силы притяжения уравновешиваются силами отталкивания. Но ведь в металлических кристаллах все ионы положительны! Это так. Однако и здесь имеет место взаимное сцепление ионов, приводящее к образованию плотной упаковки. При достаточном сближении атомов происходит описанное выше обобществление части электронов. Эти «общие» электроны образуют своего рода «цемент», скрепляющий ионы атомов в плотно упакованную решётку. Дальнейшему сближению атомов и в этом случае мешает взаимодействие электронов, принадлежащих разным атомам. 9. Упаковка молекул Характерная особенность описанных выше кристаллов – это отсутствие молекулы в кристалле. Кристалл построен из атомов или ионов, и выделить молекулу в кристалле нельзя. Действительно, вернёмся, например к рисунку 24, а, изображающему строение кристалла каменной соли. Это вещество построено из чередующихся ионов натрия и хлора. Каждый ион натрия имеет 6 соседей – ионов хлора. Все они расположены совершенно одинаково по отношению к иону натрия, и нельзя сказать, что с натрием соединён какой-то один из них. Молекулы каменной соли, состоящей из одного атома хлора и одного атома натрия, в кристалле нет. Но далеко не всегда дело обстоит подобным образом. Рассмотрим, например, строение кристалла углекислоты, существующего лишь при низкой температуре. Это – так называемый «сухой лёд», который получают при сильном охлаждении сжиженного под давлением углекислого газа. Кристаллы «сухого льда» построены из молекул. Одна такая молекула изображена на рисунке 25, а. (Подобное представление, конечно, условно, как и изображение атомов шарами.) Рисунок 25, б поясняет, как молекулы углекислоты упакованы в кристалле: атом углерода (условно изображён меньшим) имеет только двух ближайших соседей – два атома кислорода (большие). Каждый атом кислорода имеет в качестве ближайшего соседа лишь один атом углерода. Тесные группы из трёх атомов – молекулы углекислоты отчётливо выделяются в кристалле. 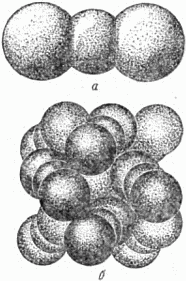
Рис. 25. а – молекула углекислого газа; б – плотная упаковка молекул. На рисунке 25 обращает на себя внимание сплющенность шаров молекулы. Дело в том, что силы притяжения между атомами «тройки», то есть между атомами углерода и кислорода одной и той же молекулы, значительно больше сил притяжения между отдельными молекулами. Электронные оболочки атомов углерода и кислорода одной молекулы в значительной степени перекрываются – проникают друг в друга. Это – результат действия химических сил. Из сказанного ясно, как следует изобразить молекулу углекислого газа: взаимное проникновение электронных оболочек можно представить себе как сплющивание шаров, соответствующих отдельным атомам. 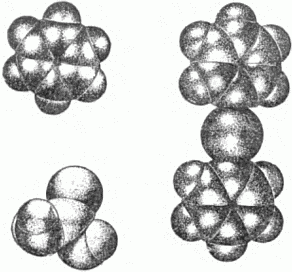
Рис. 26. Молекулы бензола (слева наверху), мочевины (внизу) и дифенилртути (справа). Несколько моделей молекул, построенных из деформированных (искажённых) шаров, дано на рисунке 26. Слева наверху вы видите молекулу бензола, состоящую из шести атомов углерода (в середине) и шести атомов водорода. «Шары» углерода превратились в «дольки»-секторы, а «шары» водорода – в сегменты-полушария. Слева внизу изображена молекула мочевины. Посредине – атом углерода. Он соединён с одним атомом кислорода (наверху) и с двумя аминогруппами (так называются группы атомов, состоящие из одного атома азота и двух атомов водорода). Справа – молекула дифенилртути. Фенил – это лишённая одного водородного атома молекула бензола; приставка «ди» указывает на наличие в молекуле двух таких групп. Атом ртути – в центре молекулы. Многочисленными исследованиями установлено, что к кристаллам, построенным из шаровых атомов или ионов, относятся металлы, сплавы, большинство неорганических соединений (солей, щелочей). Из молекул построены все органические кристаллы и небольшое количество неорганических, например сулема. Спросим себя теперь, каким образом располагаются в кристалле молекулы – тела, обладающие сложной, зачастую причудливой формой? Как в ионных кристаллах в результате притяжения ионов возникают плотные упаковки шаров, так и взаимное притяжение молекул ведёт к возникновению наиболее плотных молекулярных упаковок. Общий принцип прост: молекулы укладываются так, что «выступы» одной молекулы заходят во «впадины» другой. Это наглядно показано на рисунке 27 на примере молекул антрацена. Из рисунка ясно, какие расположения молекул осуществляются в природе, какие нет. 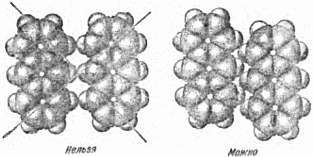
Рис. 27. Упаковка молекул антрацена. Принцип плотной упаковки для молекулярных кристаллов не позволяет такого их устройства, при котором плоскости симметрии проходили бы между молекулами – в этом случае «выступ» одной молекулы приходился бы на «выступ» другой. Таким образом, для молекулярных кристаллов возможны лишь определённые виды симметрии, всего 8–10 фёдоровских групп. На основании принципа плотной упаковки удаётся предсказать характер взаимного расположения молекул, симметрию кристалла и некоторые другие его свойства. 10. Одни и те же атомы, но разные кристаллы Чёрный матовый мягкий графит, которым мы пишем, и блестящий прозрачный твёрдый, режущий стекло алмаз построены из одних и тех же атомов, а именно, атомов углерода. Почему так резко различны свойства этих двух сходных по составу веществ? Если бы эти вещества не были кристаллическими, то нам трудно было бы объяснить наличие двух разновидностей углерода. Но эти вещества – кристаллы, а мы знаем, что каждому кристаллу свойственно своё особенное расположение атомов. Значит, заключаем мы, раз между графитом и алмазом, построенными из одних и тех же атомов углерода, есть такое резкое различие в свойствах, то и расположение атомов в кристаллах этих веществ должно быть разным. Рисунок 28 показывает решётки слоистого графита (справа), в котором каждый атом имеет трёх ближайших соседей, и алмаза, где атом имеет четырёх ближайших соседей. На этом примере с исключительной отчётливостью видно, как резко определяются свойства кристаллов взаимным расположением атомов. Из графита делают огнеупорные тигли, выдерживающие температуру до двух-трёх тысяч градусов, а алмаз горит при температуре выше 700°; удельный вес алмаза 3,5, а графита 2,1; графит проводит электрический ток, алмаз – нет и т.д. 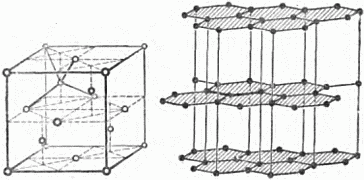
Рис. 28. Слева – решётка алмаза, справа – графита. Эта особенность давать разные кристаллы принадлежит не только одному углероду. Почти каждый химический элемент, и не только элемент, но и любое химическое вещество, существуют в нескольких разновидностях. Нам известно шесть разновидностей льда, девять разновидностей серы, четыре разновидности железа… Графит и алмаз устойчивы. Они могут неопределённо долго сохраняться в обычных земных условиях. Так обстоит далеко не со всеми разновидностями одного вещества. Есть два вида олова: белое и серое. При температуре выше +18° атомы олова располагаются в одной решётке; эта разновидность называется белым оловом; при более низкой температуре атомы начинают менять взаимное расположение: белое олово превращается в серое, которое получается при этом в виде порошка. Новые кристаллики растут из старого кристалла так же, как из жидкости (см. стр. 53). 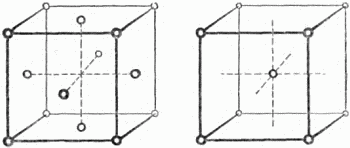
Рис. 29. Слева – элементарная ячейка гамма-железа, справа – альфа-железа. Ниже мы узнаем, насколько большое значение имеет для техники существование разновидностей у железа: при высокой температуре атомы железа образуют гранецентрированную решётку (гамма-железо, слева на рисунке 29), при нормальной температуре – объёмно-центрированную решётку (альфа-железо, справа там же). 11. Почему слюда слоистая До сих пор мы обсуждали вопросы строения кристаллов. Теперь поговорим об их свойствах. Наиболее замечательная особенность свойств кристалла – это анизотропия. Смысл этого слова, имеющего греческое происхождение, следующий: изотропный – одинаковый по всем направлениям, анизотропный – разный в разных направлениях. Возьмите кусок стекла (стекло – не кристаллическое тело; см. стр. 61) и попробуйте его сломать, сжимая прессом в каком-либо направлении. Установите величину давления, разрушающего стекло, а затем проделайте над другим таким же куском стекла новое измерение, установив теперь образец под прессом по-иному. Вторая цифра практически совпадает с первой. Хрупкость стекла не зависит от направления, в котором происходит сдавливание. (Конечно, при подобном опыте образцы должны быть одинаковой формы – например, кубики, вырезанные в разных положениях из одного и того же большого литого куска.) Известно, что тела при нагревании расширяются. Нагреем шар из стекла. Тщательно измерим образец после нагревания. Он сохранил свою шаровидную форму. Во всех направлениях кусок стекла расширился одинаково. Какие бы свойства куска стекла мы ни изучали, всегда окажется, что во всех направлениях стекло обладает одинаковыми свойствами. Стекло – изотропный материал. Примеры анизотропных материалов также встречались каждому. Кто не знает, что совсем разные силы надо прилагать, раскалывая полено дров вдоль или поперёк. И другие свойства дерева зависят от направления. Дерево – анизотропный материал. Причины анизотропии дерева видны невооружённым глазом. Дерево имеет волокнистое строение, волокна вытянуты вдоль его ствола. Разрубить полено вдоль волокон легче, так как требуется лишь отделить одни волокна от других. Разрубить полено поперёк волокон трудно, так как надо перерубить множество волокон. Так же, как и анизотропия дерева, анизотропия кристаллов объясняется их строением. Анизотропия кристаллов очень отчётливо выражается в их спайности – так называется способность кристаллов раскалываться по определённым плоскостям. Не все кристаллы обладают одинаково хорошей спайностью. Легче всего наблюдать это свойство на каменной соли, кальците, слюде. Кристаллы каменной соли раскалываются на маленькие кубы и прямоугольные параллелепипеды, кристаллы кальцита – на маленькие ромбоэдры; слюда при самом малом усилии расщепляется на листочки. В перечисленных и других подобных случаях бросается в глаза основная внешняя особенность кристалла – быть огранённым плоскостями. При разрушении кристаллов менее совершенной спайности может показаться, что образцы разрушаются бесформенно. Однако наблюдение под микроскопом покажет, что это не так. Менее совершенная спайность препятствует разделению кристалла большими плоскостями, но всё равно поверхность осколков имеет «ступенчатый» характер – только величина этих плоских ступенек меньше. Спайность кристалла показывает как нельзя лучше, что прочность кристалла резко различна в разных направлениях. Следует полагать, что силы сцепления между атомами, из которых построен кристалл, очень слабы в направлении, перпендикулярном плоскостям спайности. Лучше всего это иллюстрируется примером графита. Расстояние между центрами ближайших атомов внутри слоев, из которых построен кристалл графита (см. выше рис. 28), в 21/2 раза меньше расстояния между слоями. Немудрено, что кристаллы графита встречаются чаще всего в виде тонких чешуек. Наличие столь ярко выраженной плоскости спайности позволяет твёрдому графиту служить смазочным материалом в тех случаях, когда невозможно применение смазочных масел, – например, если скорость движения трущихся частей очень мала, а также при высокой температуре. Графит – твёрдый смазочный материал! Трение между двумя телами сводится, грубо говоря, к тому, что микроскопические выступы одного тела западают в неровности другого. Усилие, достаточное для того, чтобы расщепить микроскопический графитовый кристаллик, много меньше сил трения, поэтому наличие графитовой смазки значительно облегчает скольжение одного тела по другому. Мы не приводим схемы строения кристалла слюды – это довольно сложное химическое соединение. Но причина совершенной спайности слюды та же, что и у графита – расположение атомов слоями. Однако кристалл с совершенной спайностью может и не иметь подобной слоистой структуры. На рисунке 30, а показана ещё раз упаковка ионов в кристалле каменной (поваренной) соли. Изображён один элементарный куб; его грани состоят из чередующихся ионов хлора и натрия. Попытаемся разобраться, какие плоскости выделяются здесь среди других, по каким плоскостям легче всего разломать кристалл. Снимем один вершинный шар – обнажилась плоскость, перпендикулярная телесной диагонали. Эта плоскость состоит из одних ионов натрия (рис. 30, б). Удалим тройку натриевых ионов – следующая параллельная атомная плоскость состоит из одних ионов хлора (рис. 30, в), и так далее.
Рис. 30. Все эти слои попеременно заряжены с разным знаком: слой хлора – отрицательно, слой натрия – положительно. Поэтому они очень сильно притягиваются друг к другу, и раскалываться по таким плоскостям кристалл не будет. Напротив, раскалывание легко происходит параллельно грани куба. Как нетрудно сообразить, каждый из разделяемых при этом слоев содержит поровну и положительных и отрицательных ионов. Притяжение между такими в целом не заряженными слоями мало. По этим-то направлениям и проходят в кристалле каменной соли плоскости спайности. 1, 2, 3, 4 |
|||||||


