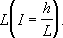|
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Азимов Айзек :: Раззаков Федор :: Чехов Антон Павлович :: Грин Александр :: Горький Максим :: Борхес Хорхе Луис :: Сименон Жорж :: Андреев Леонид Николаевич Популярные книги:: Ожерелье Иомалы :: Магия луны (Том 1) :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: Ночной орёл :: О «Двух душах» М. Горького :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер |
Большая Советская Энциклопедия (ВО)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ВО) - Чтение (стр. 8)
п. В зависимости от глубин осушаемых выработок и фильтрационных свойств горных пород В. осуществляется различными средствами. В. с использованием буровых скважин, оборудованных штанговыми или центробежными глубинными насосами, позволяет вести понижение уровня воды на глубине до 300
м. Лёгкими иглофильтровыми установками обеспечивается В. на глубине 4-5
мпри длине рабочего органа
иглофильтра
до 8
м. При В. на глубине свыше5
миглофильтры устанавливают в несколько ярусов. Наилучшие результаты применения лёгких иглофильтров достигаются в водоносных песках, однородных по составу, с коэффициентами фильтрации от 1 до 5
м/сут. В. эжекторными установками осуществляется на глубине до 22
м. Установка состоит из эжекторных иглофильтров, центробежных насосов, распределительного и сборного трубопроводов. Каждый иглофильтр оборудован водоструйным подъёмником -
эжектором
, расположенным внизу устройства. Эжекторные иглофильтры рекомендуется применять в однородных по составу и строению водоносных песках с коэффициентом фильтрации до 0,1
м/сут. Для сложных условий осушения водоносных пород, переслаивающихся с водоупорными, в 1967 в СССР разработано водопонижающее устройство - вакуум-концентрическая скважина, представляющая собой эжекторный иглофильтр с фильтровой оболочкой на всю высоту водоносного горизонта. С помощью этого устройства осушаются все вскрытые скважиной водоносные прослойки и успешно производится вакуумирование с помощью эжектора, что ускоряет процесс осушения. Насосные установки открытого водоотлива применяются для откачки подземной воды, поступающей в строительный котлован.
При полном пересечении водоносного пласта горной выработкой дополнительно к В. необходим водоотлив . Лит.:Водопонижение в строительстве, М.,1971. В. А. Полуянов. Водопотребление Водопотребле'ние,расходование воды, подаваемой для удовлетворения различных нужд населения, промышленности и т.д. Различают две основные категории В.: 1) хозяйственно-питьевое и коммунальное В. - потребление воды, связанное с бытовыми нуждами населения (питьё, приготовление пищи, содержание в чистоте жилищ и т.п.) и обеспечением благоустройства населённых мест (поливка улиц, зелёных насаждений и т.п.); 2) производственное или техническое В. - потребление воды для технологических целей промышленности, энергетики, транспорта (парообразование, охлаждение, промывка продукции, гидравлический транспорт и т.п.), на противопожарные нужды и пр. Количество воды, расходуемое для нужд населения, зависит в основном от степени санитарно-технического оборудования жилищ (наличия канализации, ванн, душей, систем газоснабжения и горячего водоснабжения). Показателем размеров В. по этой категории служит удельный расход воды, т. е. количество воды, расходуемое в среднем в сутки на одного жителя. Измерения и анализ фактических удельных расходов в населённых местах дают основания для установления норм водопотребления - величин удельных расходов, которые рекомендуется принимать при проектировании новых или реконструкции существующих водопроводов. Лит.:Абрамов Н. Н., Водоснабжение, М., 1967; Строительные нормы и правила, ч. 2, раздел Г, гл. 3. Водоснабжение. Нормы проектирования, М., 1963. Водоприёмник Водоприёмник,водоток, водоём или лощина, принимающие и отводящие воду, собираемую осушительной системой с прилегающей территории (см. Осушение ). В. должен пропускать расчётные расходы воды, не вызывая подпора почвенных вод и подтопления осушаемой площади. Для соблюдения этого условия на реках увеличивают их пропускную способность, осуществляя регулирование русла и проводя выправительные работы , в некоторых случаях (сравнительно редко) применяют механический водоподъём (перекачку). Термин «В.» употребляют также для обозначения гидротехнических водозаборных сооружений . Водопроводная сеть Водопрово'дная сеть,совокупность водопроводных линий (трубопроводов) для подачи воды к местам потребления; один из основных элементов системы водоснабжения . К линиям В. с. (обычно прокладываемым вдоль улиц и проездов) присоединяются так называемые домовые ответвления (трубы), по которым вода подаётся в отдельные здания. Внутри зданий устраиваются внутренние (внутридомовые) В. с., подводящие воду к водоразборным кранам. В отличие от них, основная В. с. (прокладываемая вне зданий) называется наружной (уличной, дворовой). Для устройства В. с. применяют водопроводные трубы. Выбор типа труб зависит от величины требуемого напора в В. с., характера грунтов, способа прокладки, а также от экономических факторов. При подземных прокладках наиболее распространены чугунные, асбестоцементные и стальные трубы, используются также железобетонные и пластмассовые. Глубина заложения труб зависит от уровня промерзания почвы, температуры подаваемой по трубам воды и режима работы В. с. (для средней полосы СССР глубина заложения около 2,5 м). Минимальная глубина заложения обусловлена необходимостью предохранения труб от разрушения динамическими (транспортными) нагрузками. В. с. оборудуются запорной арматурой-задвижками и вентилями (для выключения отдельных участков сети) и водоразборными устройствами - пожарными гидрантами , иногда - уличными водоразборными колонками (в районах, ещё не полностью обеспеченных домовыми вводами). Гидранты и задвижки обычно устанавливаются в специальных колодцах (сборных железобетонных или кирпичных), перекрываемых металлическими съёмными люками. По техническим условиям давление воды в В. с. населённых мест не должно превышать 6 ат. Для подачи воды в отдельные многоэтажные здания устраивают местные насосные станции подкачки. В. с. должны обеспечивать надёжное и бесперебойное снабжение водой потребителей. Этому условию отвечает устройство кольцевых В. с., состоящих из смежных замкнутых контуров-колец ( рис. 1 ), расположение которых зависит от планировки города. При аварии поврежденный участок водовода может быть выключен (задвижками аи б) без прекращения подачи воды ко всем остальным линиям В. с. В разветвлённых (тупиковых) В. с. ( рис. 2 ) при аварии на любом участке (например, в точке x) прекращается подача воды во все участки сети, лежащие за поврежденным; поэтому разветвлённые сети могут устраиваться лишь в тех случаях, когда допустимы перерывы в снабжении водой. Все В. с., в которых предусматривается подача воды для тушения пожаров, как правило, устраивают кольцевыми. В В. с. различают магистральные линии, транспортирующие воду транзитом в удалённые районы снабжаемой территории, и распределительную сеть, подающую воду к отдельным домовым ответвлениям. Расчёт В. с. (особенно кольцевых и получающих воду от нескольких насосных станций) - весьма сложная и трудоёмкая работа. Для её проведения целесообразно использовать вычислительные машины. Лит.:Мошнин Л. Ф., Методы технико-экономического расчёта водопроводных сетей, М., 1950; Абрамов Н. Н., Поспелова М. М., Расчет водопроводных сетей, 2 изд., М., 1962; Андрияшев М. М., Гидравлические расчеты водоводов и водопроводных сетей, М., 1964; Абрамов Н. Н., Водоснабжение, М., 1967. 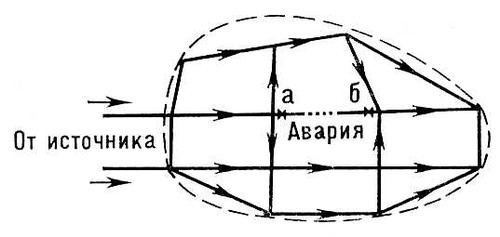
Рис. 1. Схема кольцевой водопроводной сети. 
Рис. 2. Схема разветвленной (тупиковой) водопроводной сети. Водопроницаемость горных пород Водопроница'емость го'рных поро'д,способность горных пород пропускать воду. Степень водопроницаемости зависит от размера и количества сообщающихся между собой пор и трещин, а также от отсортированности зёрен горных пород. К хорошо проницаемым горным породам относятся галечники, гравий, крупнозернистые пески, интенсивно закарстованные и трещиноватые породы. Практически непроницаемыми (водоупорными) породами являются глины, плотные суглинки, нетрещиноватые кристаллические, метаморфические и плотные осадочные породы. В. г. п. может определяться по скорости фильтрации, равной количеству воды, протекающей через единицу площади поперечного сечения фильтрующей породы. Эта зависимость выражается формулой Дарси: v= kI, где v -скорость фильтрации, k -коэффициент фильтрации, I- напорный градиент, равный отношению падения напора hк длине пути фильтрации
Коэффициент фильтрации имеет размерность скорости ( см/сек, м/сут). Таким образом, скорость фильтрации при напорном градиенте, равном единице, тождественна коэффициенту фильтрации. В связи с тем, что вода в породах может передвигаться под влиянием различных причин (гидравлического напора, силы тяжести, капиллярных, адсорбционных, капиллярно-осмотических сил, температурного градиента и др.), количественная характеристика В. г. п. может выражаться, помимо коэффициента фильтрации, также коэффициентами водопроводимости и пьезопроводности. При гидрогеологических исследованиях и расчётах коэффициента водопроводимости (произведение коэффициента фильтрации на мощность водоносного горизонта) является показателем фильтрационной способности горной породы. В зависимости от геологического строения водоносные породы в фильтрационном отношении могут быть изотропными, когда водопроводимость одинакова в любом направлении, и анизотропными, характеризующимися закономерным изменением водопроницаемости в разных направлениях. Изучение В. г. п. необходимо при поисках и разведке подземных вод для целей водоснабжения, при устройстве гидротехнических сооружений, эксплуатации различных типов подземных вод, при расчётах допустимых понижений уровня вод и радиусов влияния водозаборных скважин, при проектировании и осуществлении осушительных и оросительных мероприятий. А. М. Овчинников. Водопьянов Михаил Васильевич Водопья'новМихаил Васильевич [р. 6(18).11.1899, с. Студёнка, ныне часть г. Липецка], советский лётчик, один из первых Героев Советского Союза (20.4.1934), генерал-майор авиации (1943). Член КПСС с 1934. Родился в семье крестьянина. В феврале 1918 добровольно вступил в Красную Армию, служил шофёром-мотористом, затем бортмехаником и пилотом в авиации. После Гражданской войны летал на самолётах по трассам Москва - Иркутск, Москва - Ленинград, первым открыл воздушную линию на о. Сахалин. Окончил военно-авиационную школу лётчиков (1929). В марте - апреле 1934 участвовал в спасении экипажа ледокола «Челюскин» , за что был удостоен звания Героя Советского Союза. В 1937 участвовал в воздушной экспедиции на Северный полюс. Во время Великой Отечественной войны командовал авиадивизией. С 1946 в отставке. Автор романа «Киреевы» (1956), повестей, рассказов, автобиографической книги «Полярный лётчик» (1952) и книги «Валерий Чкалов» (1954). Награждён 4 орденами Ленина, 4 орденами Красного Знамени, орденом Отечественной войны 1-й степени и медалями. 
М. В. Водопьянов. Водораздел Водоразде'л,линия, разделяющая сток атмосферных вод по двум склонам, направленным в разные стороны. На равнинах В. нередко превращается в плоское водораздельное пространство, на котором направление стока может иметь переменный характер. Линию, разграничивающую бассейн тихоокеанского (рек, впадающих в Тихий и Индийский океаны) и атлантического (рек, впадающих в Атлантический и Северный Ледовитый океаны) склонов, называют главным В. Земли. Водорезы Водоре'зы(Rhynchopidae), семейство птиц отряда ржанкообразных. Один род (Rhynchops), включающий три вида. Длина тела до 45 см. Окраска чёрная с белым. Крылья очень длинные и острые, хвост с выемкой. Клюв большой, сжатый с боков, нижняя челюсть (подклювье) длиннее верхней, снабжена осязательными тельцами. Кормятся В. мелкими рыбами и водными насекомыми, летая в сумерках или ночью низко над водой и погрузив конец подклювья в воду (отсюда название). Обитают на морских побережьях, в устьях крупных рек субтропических и тропических зон Африки, Азии и Америки. Гнездятся небольшими группами на песчаных отмелях и островах после наступления сухого сезона и спада воды в реках. Яйца (2-4) откладывают в ямку в песке. Птенцы сразу после вылупления могут бегать и плавать, но их ещё долго кормят родители. 
Водорез Rhynchops albicollis. Водород Водоро'д(лат. Hydrogenium), Н, химический элемент, первый по порядковому номеру в периодической системе Менделеева; атомная масса 1,00797. При обычных условиях В. - газ; не имеет цвета, запаха и вкуса. Историческая справка. В трудах химиков 16 и 17 вв. неоднократно упоминалось о выделении горючего газа при действии кислот на металлы. В 1766 Г. Кавендиш собрал и исследовал выделяющийся газ, назвав его «горючий воздух». Будучи сторонником теории флогистона , Кавендиш полагал, что этот газ и есть чистый флогистон. В 1783 А. Лавуазье путём анализа и синтеза воды доказал сложность её состава, а в 1787 определил «горючий воздух» как новый химический элемент (В.) и дал ему современное название hydrogиne (от греч. hэdMr - вода и gennбM - рождаю), что означает «рождающий воду»; этот корень употребляется в названиях соединений В. и процессов с его участием (например, гидриды, гидрогенизация). Современное русское наименование «В.» было предложено М. Ф. Соловьёвым в 1824. Распространённость в природе. В. широко распространён в природе, его содержание в земной коре (литосфера и гидросфера) составляет по массе 1%, а по числу атомов 16%. В. входит в состав самого распространённого вещества на Земле - воды (11,19% В. по массе), в состав соединений, слагающих угли, нефть, природные газы, глины, а также организмы животных и растений (т. е. в состав белков, нуклеиновых кислот, жиров, углеводов и др.). В свободном состоянии В. встречается крайне редко, в небольших количествах он содержится в вулканических и других природных газах. Ничтожные количества свободного В. (0,0001% по числу атомов) присутствуют в атмосфере. В околоземном пространстве В. в виде потока протонов образует внутренний («протонный») радиационный пояс Земли . В космосе В. является самым распространённым элементом. В виде плазмы он составляет около половины массы Солнца и большинства звёзд, основную часть газов межзвёздной среды и газовых туманностей. В. присутствует в атмосфере ряда планет и в кометах в виде свободного H 2, метана CH 4, аммиака NH 3, воды H 2O, радикалов типа CH, NH, OH, SiH, PH и т.д. В виде потока протонов В. входит в состав корпускулярного излучения Солнца и космических лучей. Изотопы, атом и молекула. Обыкновенный В. состоит из смеси 2 устойчивых изотопов: лёгкого В., или протия ( 1H), и тяжёлого В., или дейтерия ( 2H, или D). В природных соединениях В. на 1 атом 2H приходится в среднем 6800 атомов 1H. Искусственно получен радиоактивный изотоп - сверхтяжёлый В., или тритий ( 3H, или Т), с мягким І-излучением и периодом полураспада T 1/2 = 12,262 года. В природе тритий образуется, например, из атмосферного азота под действием нейтронов космических лучей; в атмосфере его ничтожно мало (4·10 -15% от общего числа атомов В.). Получен крайне неустойчивый изотоп 4H. Массовые числа изотопов 1H, 2H, 3H и 4H, соответственно 1,2, 3 и 4, указывают на то, что ядро атома протия содержит только 1 протон, дейтерия - 1 протон и 1 нейтрон, трития - 1 протон и 2 нейтрона, 4H -1 протон и 3 нейтрона. Большое различие масс изотопов В. обусловливает более заметное различие их физических и химических свойств, чем в случае изотопов других элементов. Атом В. имеет наиболее простое строение среди атомов всех других элементов: он состоит из ядра и одного электрона. Энергия связи электрона с ядром (потенциал ионизации) составляет 13,595 эв. Нейтральный атом В. может присоединять и второй электрон, образуя отрицательный ион Н -; при этом энергия связи второго электрона с нейтральным атомом (сродство к электрону) составляет 0,78 эв. Квантовая механика позволяет рассчитать все возможные энергетические уровни атома В., а следовательно, дать полную интерпретацию его атомного спектра . Атом В. используется как модельный в квантовомеханических расчётах энергетических уровней других, более сложных атомов. Молекула В. H 2состоит из двух атомов, соединённых ковалентной химической связью. Энергия диссоциации (т. е. распада на атомы) составляет 4,776 эв(1 эв= 1,60210·10 -19 дж). Межатомное расстояние при равновесном положении ядер равно 0,7414·Е. При высоких температурах молекулярный В. диссоциирует на атомы (степень диссоциации при 2000°С 0,0013, при 5000°С 0,95). Атомарный В. образуется также в различных химических реакциях (например, действием Zn на соляную кислоту). Однако существование В. в атомарном состоянии длится лишь короткое время, атомы рекомбинируют в молекулы H 2. Физические и химические свойства. В. - легчайшее из всех известных веществ (в 14,4 раза легче воздуха), плотность 0,0899 г/лпри 0°С и 1 атм. В. кипит (сжижается) и плавится (затвердевает) соответственно при -252,6°С и -259,1°С (только гелий имеет более низкие температуры плавления и кипения). Критическая температура В. очень низка (-240°С), поэтому его сжижение сопряжено с большими трудностями; критическое давление 12,8 кгс/см 2(12,8 атм), критическая плотность 0,0312 г/см 3. Из всех газов В. обладает наибольшей теплопроводностью, равной при 0°С и 1 атм0,174 вт/( м· К), т. е. 4,16·0 -4 кал/( с· см· °С). Удельная теплоёмкость В. при 0°С и 1 атм С р14,208·10 3 дж/( кг· К), т. е. 3,394 кал/( г· °С). В. мало растворим в воде (0,0182 мл/гпри 20°С и 1 атм), но хорошо - во многих металлах (Ni, Pt, Pd и др.), особенно в палладии (850 объёмов на 1 объём Pd). С растворимостью В. в металлах связана его способность диффундировать через них; диффузия через углеродистый сплав (например, сталь) иногда сопровождается разрушением сплава вследствие взаимодействия В. с углеродом (так называемая декарбонизация). Жидкий В. очень лёгок (плотность при -253°С 0,0708 г/см 3) и текуч (вязкость при - 253°С 13,8 спуаз). В большинстве соединений В. проявляет валентность (точнее, степень окисления) +1, подобно натрию и другим щелочным металлам; обычно он и рассматривается как аналог этих металлов, возглавляющий 1 гр. системы Менделеева. Однако в гидридах металлов ион В. заряжен отрицательно (степень окисления -1), т. е. гидрид Na +H -построен подобно хлориду Na +Cl -. Этот и некоторые другие факты (близость физических свойств В. и галогенов, способность галогенов замещать В. в органических соединениях) дают основание относить В. также и к VII группе периодической системы (подробнее см. Периодическая система элементов ). При обычных условиях молекулярный В. сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами. Атомарный В. обладает повышенной химической активностью по сравнению с молекулярным. С кислородом В. образует воду: H 2+ 1/ 2O 2= H 2O с выделением 285,937·10 3 дж/моль, т. е. 68,3174 ккал/мольтепла (при 25°С и 1 атм). При обычных температурах реакция протекает крайне медленно, выше 550°С - со взрывом. Пределы взрывоопасности водородо-кислородной смеси составляют (по объёму) от 4 до 94% H 2, а водородо-воздушной смеси - от 4 до 74% H 2(смесь 2 объёмов H 2и 1 объёма О 2называется гремучим газом ). В. используется для восстановления многих металлов, так как отнимает кислород у их окислов: CuO +Н 2= Cu + H 2O, Fe 3O 4+ 4H 2= 3Fe + 4H 2O, и т.д. С галогенами В. образует галогеноводороды, например: H 2+ Cl 2= 2HCl. При этом с фтором В. взрывается (даже в темноте и при -252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а с иодом только при нагревании. С азотом В. взаимодействует с образованием аммиака: 3H 2+ N 2= 2NH 3лишь на катализаторе и при повышенных температурах и давлениях. При нагревании В. энергично реагирует с серой: H 2+ S = H 2S (сероводород), значительно труднее с селеном и теллуром. С чистым углеродом В. может реагировать без катализатора только при высоких температурах: 2H 2+ С (аморфный) = CH 4(метан). В. непосредственно реагирует с некоторыми металлами (щелочными, щёлочноземельными и др.), образуя гидриды: H 2+ 2Li = 2LiH. Важное практическое значение имеют реакции В. с окисью углерода, при которых образуются в зависимости от температуры, давления и катализатора различные органические соединения, например HCHO, CH 3OH и др. (см. Углерода окись ). Ненасыщенные углеводороды реагируют с В., переходя в насыщенные, например: C nH 2 n+ H 2= C nH 2 n +2(см. Гидрогенизация ). Роль В. и его соединений в химии исключительно велика. В. обусловливает кислотные свойства так называемых протонных кислот (см. Кислоты и основания ). В. склонен образовывать с некоторыми элементами так называемую водородную связь , оказывающую определяющее влияние на свойства многих органических и неорганических соединений. Получение. Основные виды сырья для промышленного получения В. - газы природные горючие , коксовый газ (см. Коксохимия ) и газы нефтепереработки , а также продукты газификации твёрдых и жидких топлив (главным образом угля). В. получают также из воды электролизом (в местах с дешёвой электроэнергией). Важнейшими способами производства В. из природного газа являются каталитическое взаимодействие углеводородов, главным образом метана, с водяным паром (конверсия): CH 4+ H 2O = CO + 3H 2, и неполное окисление углеводородов кислородом: CH 4+ 1/ 2O 2= CO + 2H 2. Образующаяся окись углерода также подвергается конверсии: CO + H 2O = CO 2+ H 2. В., добываемый из природного газа, самый дешёвый. Очень распространён способ производства В. из водяного и паровоздушного газов, получаемых газификацией угля. Процесс основан на конверсии окиси углерода. Водяной газ содержит до 50% H 2и 40% CO; в паровоздушном газе, кроме H 2и CO, имеется значительное количество N 2, который используется вместе с получаемым В. для синтеза NH 3. Из коксового газа и газов нефтепереработки В. выделяют путём удаления остальных компонентов газовой смеси, сжижаемых более легко, чем В., при глубоком охлаждении. Электролиз воды ведут постоянным током, пропуская его через раствор KOH или NaOH (кислоты не используются во избежание коррозии стальной аппаратуры). В лабораториях В. получают электролизом воды, а также по реакции между цинком и соляной кислотой. Однако чаще используют готовый заводской В. в баллонах. Применение. В промышленном масштабе В. стали получать в конце 18 в. для наполнения воздушных шаров. В настоящее время В. широко применяют в химической промышленности, главным образом для производства аммиака . Крупным потребителем В. является также производство метилового и других спиртов, синтетического бензина (синтина) и других продуктов, получаемых синтезом из В. и окиси углерода. В. применяют для гидрогенизации твёрдого и тяжёлого жидкого топлив, жиров и др., для синтеза HCl, для гидроочистки нефтепродуктов, в сварке и резке металлов кислородо-водородным пламенем (температура до 2800°С) и в атомно-водородной сварке (до 4000°С). Очень важное применение в атомной энергетике нашли изотопы В. - дейтерий и тритий. Лит.:Некрасов Б. В., Курс общей химии, 14 изд., М., 1962; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963; Егоров А. П., Шерешевский Д. И., Шманенков И. В., Общая химическая технология неорганических веществ, 4 изд., М., 1964; Общая химическая технология. Под ред. С. И. Вольфковича, т. 1, М., 1952; Лебедев В. В., Водород, его получение и использование, М., 1958; Налбандян А. Б., Воеводский В. В., Механизм окисления и горения водорода, М. - Л., 1949; Краткая химическая энциклопедия, т. 1, М., 1961, с. 619-24. С. Э. Вайсберг. Водорода перекись Водоро'да пе'рекись,см. Перекись водорода . Водородная бомба Водоро'дная бо'мба,бомба взрывного действия большой разрушительной силы. Действие В. б. основано на термоядерной реакции. См. Ядерное оружие . Водородная связь Водоро'дная связь,вид химического взаимодействия атомов в молекулах, отличающийся тем, что существенное участие в нём принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом (А). Группа А - Н выступает донором протона (акцептором электрона), а другая группа (или атом) В - донором электрона (акцептором протона). Иначе говоря, группа А - Н проявляет функцию кислоты, а группа В - основания. Для обозначения В. с. употребляют, в отличие от обычной валентной чёрточки, пунктир, т. е. А - Н···В [в предельном случае симметричной В. с., например, в бифториде калия, K + (F···Н···F) -, различие двух связей исчезает]. К образованию В. с. способны группы А - Н, где А - атомы О, N, F, Cl, Вr и в меньшей мере С и S. В качестве второго, электродонорного центра В могут выступать те же атомы О, N, S разнообразных функциональных групп, анионы F -, С1 -и др., в меньшей мере ароматические кольца и кратные связи. Если А - Н и В принадлежат отдельным (разнородным или идентичным) молекулам, то В. с. называют межмолекулярной, а если они находятся в разных частях одной молекулы, - внутримолекулярной. От общих для всех веществ ван-дер-ваальсовых сил взаимного притяжения молекул В. с. отличается направленностью и насыщаемостью, т. е. качествами обычных (валентных) химических связей. В. с. не сводится, как ранее считали, к электростатическому притяжению полярных групп А - Н и В, а рассматривается как донорно-акцепторная химическая связь. По своим энергиям, обычно 3-8 ккал/моль, В. с. занимает промежуточное положение между ван-дер-ваальсовыми взаимодействиями (доли ккал/моль) и типичными химическими связями (десятки ккал/моль) (1 ккал =4,19·10 3· дж). Наиболее распространены межмолекулярные В. с. Они приводят к ассоциации одинаковых или разнородных молекул в разнообразные агрегаты-комплексы с В. с., или Н-комплексы, которые при обычных условиях находятся в быстро устанавливающемся равновесии. При этом возникают как бинарные комплексы (кислота - основание и циклические димеры), так и большие образования (цепи, кольца, спирали, плоские и пространственные сетки связанных молекул). Наличием таких В. с. обусловлены свойства различных растворов и жидкостей (в первую очередь, воды и водных растворов, ряда технических полимеров - капрона, нейлона и т.д.), а также кристаллическая структура многих молекулярных кристаллов и кристаллогидратов неорганических соединений, в том числе, разумеется, и льда . Точно так же В. с. существенно определяет структуру белков , нуклеиновых кислот и других биологически важных соединений и поэтому играет важнейшую роль в химии всех жизненных процессов. Вследствие всеобщей распространённости В. с. её роль существенна и во многих других областях химии и технологии (процессы перегонки, экстракции, адсорбции, хроматографии, кислотно-основные равновесия, катализ и т.д.). Образование В. с., специфически изменяя свойства групп А - Н и В, отражается и на молекулярных свойствах; это обнаруживается, в частности, по колебательным спектрам и спектрам протонного магнитного резонанса. Поэтому спектроскопия, особенно инфракрасная, является важнейшим методом изучения В. с. и зависящих от неё процессов. Лит.:Пиментел Дж., Мак-Клеллан О., Водородная связь, пер. с англ., М., 1964; Водородная связь. Сб. ст., М., 1964; Pauling L., The chemical bond, N. Y., 1967. А. В. Иогансен. Водородные бактерии Водоро'дные бакте'рии, бактерии , окисляющие водород и использующие образующуюся при этом энергию для усвоения углерода (см. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77 |
|||||||