 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Азимов Айзек :: Раззаков Федор :: Чехов Антон Павлович :: Грин Александр :: Горький Максим :: Борхес Хорхе Луис :: Сименон Жорж :: Андреев Леонид Николаевич Популярные книги:: Ожерелье Иомалы :: Магия луны (Том 1) :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: Ночной орёл :: О «Двух душах» М. Горького :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер |
Большая Советская Энциклопедия (ВО)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ВО) - Чтение (стр. 2)
Указанные 4 полюса зарядов располагаются в вершинах тетраэдра (
рис. 1
, г). Благодаря этой полярности В. имеет высокий
дипольный момент
(1,86
D), а четыре полюса зарядов позволяют каждой молекуле В. образовать четыре
водородные связи
с соседними (такими же) молекулами (например, в кристаллах льда).
Кристаллическая структура обычного льда гексагональная ( рис. 2 ), она «рыхлая», в ней много «пустот». (При плотной «упаковке» молекул В. в кристаллах льда его плотность составляла бы около 1,6 г/см 3.) В жидкой В. присущая льду связь каждой молекулы H 2O с четырьмя соседними («ближний порядок») в значительной степени сохраняется; однако «рыхлость» структуры при плавлении льда уменьшается, молекулы «дальнего порядка» попадают в «пустоты», что ведёт к росту плотности В. При дальнейшем нагревании В. возрастает тепловое движение молекул, расстояние между ними увеличивается, т. е. происходит расширение В., которое начиная с +3,98°С уже преобладает, и поэтому далее с ростом температуры плотность В. уменьшается. Водородные связи примерно в 10 раз прочнее, чем связи, обусловленные межмолекулярными взаимодействиями, характерными для большинства других жидкостей; поэтому для плавления, испарения, нагревания В. необходима гораздо большая энергия, чем в случае других жидкостей, что объясняет отмеченные аномально высокие значения теплот плавления и испарения и удельной теплоёмкости. С повышением температуры водородные связи разрываются, однако определённое их число сохраняется даже при 100°С. Растворённая в органических растворителях В. состоит из образовавшихся за счёт водородных связей ассоциатов (H 2O) 2. Вода как растворитель. В. - наиболее универсальный растворитель. Газы достаточно хорошо растворяются в В., если способны вступать с ней в химическое взаимодействие (аммиак, сероводород, сернистый газ, двуокись углерода). Прочие газы мало растворимы в В. При понижении давления и повышении температуры растворимость газов в В. уменьшается. Многие газы при низких температурах и повышенном давлении не только растворяются в В., но и образуют кристаллогидраты (аргон, криптон, ксенон, хлор, сероводород, углеводороды и др.). В частности, пропан при 10°С и 0,3 мн/м 2(3 кгс/см 2) даёт кристаллогидрат C 3H 8·17H 2O. При уменьшении давления такие гидраты распадаются. Кристаллогидраты многих газообразных веществ, образующиеся при низких температурах, содержат В. в «пустотах» своих кристаллов (так называемые клатраты, см. Соединения включения ). В. - слабый электролит , диссоциирующий по уравнению:
причём количественной характеристикой электролитической диссоциации В. служит ионное произведение В.: К в= [Н +] [ОН -], где [Н +] и [ОН -] - концентрация соответствующих ионов в г-ион/л; Квсоставляет 10 -14(22°С) и 72·10 -14(100°С), что соответствует усилению диссоциации В. с ростом температуры (см. также Водородный показатель ). Будучи электролитом, В. растворяет многие кислоты, основания, минеральные соли. Такие растворы проводят электрический ток благодаря диссоциации растворённых веществ с образованием гидратированных ионов (см. Гидратация ). Многие вещества при растворении в В. вступают с ней в реакцию обменного разложения, называемую гидролизом . Из органических веществ в В. растворяются те, которые содержат полярные группы (-ОН, -NH 2, - СООН и др.) и имеют не слишком большую молекулярную массу. Сама В. хорошо растворима (или смешивается во всех отношениях) лишь в ограниченном числе органических растворителей. Однако в виде ничтожной примеси к органическим веществам В. присутствует практически всегда и способна резко изменять физические константы последних. В. любого природного водоёма содержит в растворённом состоянии различные вещества, преимущественно соли (см., например, Жёсткость воды ). Благодаря высокой растворяющей способности В., получить её в чистом виде весьма трудно. Обычно мерой чистоты В. служит её электропроводность. Дистиллированная В., полученная перегонкой обычной В., и даже повторно перегнанный дистиллят имеют электропроводность примерно в 100 раз более высокую, чем у абсолютно чистой В. Наиболее чистую В. получают синтезом из тщательно очищенного кислорода и водорода в спец. аппаратуре. В последние годы появились многочисленные сообщения о существенном изменении свойств технической и дистиллированной В. после её протекания с определённой скоростью в магнитных полях оптимальной (весьма невысокой) напряжённости. Эти изменения носят временный характер и через 10-25 часов постепенно и самопроизвольно исчезают. Отмечается, что после такой «магнитной обработки» ускоряются процессы кристаллизации растворённых в В. веществ, адсорбции, изменяется смачивающая способность В. и др. Хотя теоретическое объяснение этих явлений пока отсутствует, они уже находят широкое практическое применение - для предотвращения образования накипи в паровых котлах, для улучшения процессов флотации , очистки В. от взвесей и др. Образование и диссоциация В. Образование В. при взаимодействии водорода с кислородом сопровождается выделением теплоты 286 кдж/моль(58,3 ккал/моль) при 25°С (для жидкой В.). Реакция 2H 2+ O 2 =2H 2O до температуры 300°С идёт крайне медленно, при 550°С - со взрывом. Присутствие катализатора (например, платины) позволяет реакции идти при обычной температуре. Спокойное горение водорода в кислороде, как и взрывное взаимодействие, - это цепные реакции , идущие с участием радикалов свободных . Химические свойства В. В обычных условиях В. - достаточно устойчивое соединение. Распад молекул H 2O (термическая диссоциация) становится заметным лишь выше 1500°С. Разложение В. происходит также под действием ультрафиолетового (фотодиссоциация) или радиоактивного излучения ( радиолиз ). В последнем случае, кроме H 2и O 2, образуется также перекись водорода и ряд свободных радикалов. Характерным химическим свойством В. является способность её вступать в реакции присоединения, а также гидролитические разложения взаимодействующих веществ. Восстановители действуют на В. преимущественно при высокой температуре. Только наиболее активные из них, как щелочные и щелочноземельные металлы, реагируют с В. уже при комнатной температуре с выделением водорода и образованием гидроокисей: 2Na + 2H 2O = 2NaOH + Н 2; Ca + 2H 2O = Ca (OH) 2+ H 2. Магний и цинк взаимодействуют с В. при кипячении, алюминий - после удаления с его поверхности окисной плёнки. Менее активные металлы вступают в реакцию с В. при красном калении: 3Fe + 4H 2O = Fe 3O 4+ 4H 2. Медленное взаимодействие многих металлов и их сплавов с В. происходит при обычной температуре. Используя В., содержащую изотоп кислорода 18O, удалось показать, что при коррозии железа во влажной атмосфере «ржавчина» получает кислород именно из В., а не из воздуха (см. Коррозия металлов). Благородные металлы - золото, серебро, платина, палладий, рутений, родий, а также ртуть с В. не взаимодействуют. Атомарный кислород превращает В. в перекись водорода: H 2O + O = H 2O 2. Фтор уже при обычной температуре разлагает В.: F 2+ H 2O 2HF + О. Одновременно образуются также H 2O 2, озон, окись фтора F 2O и молекулярный кислород O 2. Хлор при комнатной температуре даёт с В. хлористоводородную и хлорноватистую кислоты: Cl 2+ H 2O = HCl + HClO. Бром и иод в этих условиях реагируют с В. аналогичным образом. При высоких температурах (100°С для хлора, 550°С для брома) взаимодействие идёт с выделением кислорода: 2Cl 2+ 2H 2O = 4HCl + O 2. Фосфор восстанавливает В. и образует метафосфорную кислоту (только в присутствии катализатора под давлением при высокой температуре): 2P + 6H 2O =2HPO 3+ 5H 2. С азотом и водородом В. не взаимодействует, а с углеродом при высокой температуре даёт водяной газ: С + H 2O = CO + H 2. Эта реакция может служить для промышленного получения водорода, как и конверсия метана: CH 4+ H 2O = CO + 3H 2(1200-1400°С). В. взаимодействует со многими основными и кислотными окислами, образуя соответственно основания и кислоты . Присоединение В. к молекулам непредельных углеводородов лежит в основе промышленного способа получения спиртов , альдегидов , кетонов (см. также Гидратация ). В. участвует во многих химических процессах как катализатор. Так, взаимодействие щелочных металлов или водорода с галогенами, многие окислительные реакции не идут в отсутствие хотя бы ничтожных количеств В. В., химически связанную с веществом, в которое она входит (неразличимую в виде «готовых» молекул H 2O), называют конституционной; молекулы H 2O образуются лишь в момент разложения вещества, например при сильном нагревании: Ca (OH) 2= CaO + H 2O. В., входящая в состав ряда кристаллических веществ (например, алюминиевых квасцов K 2SO 4·Al 2(SO 4) 3·24H 2O) и различимая в этих кристаллах рентгенографически, называется кристаллизационной или кристаллогидратной. В., поглощённую твёрдыми веществами, имеющими большое число пор и развитую поверхность (например, активным углём ), называют адсорбционной. Свободную В., заполняющую тонкие канальцы (например, в почве), называют гигроскопической (капиллярной) В. Различают также структурно-свободную В., располагающуюся в пустотах некоторых структур, например в минералах . Качественно можно обнаружить В. в виде конденсата, образующегося при нагревании исследуемого образца; проводя нагревание при непрерывном взвешивании, получают количественные результаты (термогравиметрический анализ). В органических растворителях В. можно обнаружить по окрашиванию бесцветной сернокислой меди CuSO 4, образующей с В. синий кристаллогидрат CuSO 4·5H 2O. Отделить и количественно определить В. часто удаётся азеотропной отгонкой её с бензолом, толуолом или другой жидкостью в виде азеотропной смеси , после расслоения которой при охлаждении измеряют объём отделившейся В. Применение В. в промышленности. Невозможно указать другое вещество, которое бы находило столь разнообразное и широкое применение, как В. В. - химический реагент, участвующий в производстве кислорода, водорода, щелочей, азотной кислоты, спиртов, альдегидов, гашёной извести и многих других важнейших химических продуктов. В. - необходимый компонент при схватывании и твердении вяжущих материалов - цемента, гипса, извести и т.п. Как технологический компонент для варки, растворения, разбавления, выщелачивания, кристаллизации В. применяется в многочисленных производственных процессах. В технике В. служит энергоносителем (см. Гидроэнергетика ), теплоносителем (паровое отопление, водяное охлаждение), рабочим телом в паровых машинах (см. Пар водяной ), используется для передачи давления (в частности, в гидравлических передачах и прессах, а также при нефтедобыче) или для передачи мощности (см. Гидропривод машин ). В., подаваемая под значительным давлением через сопло, размывает грунт или породу (см. Гидромеханизация ). Требования, предъявляемые к В. в промышленности, весьма разнообразны. В. особой чистоты необходима для развития новейших отраслей промышленности (производство полупроводников, люминофоров, атомная техника и др.). Поэтому особое внимание уделяется в настоящее время вопросам водоподготовки и водоочистки . По некоторым оценкам, общий объём ежегодно перерабатываемых материалов (руды, уголь, нефть, минералы и т.д.) составляет во всём мире около 4 млрд. м 3(4 км 3); в то же время потребление свежей В. (т. е. В. из источников водоснабжения) только промышленностью СССР составило в 1965 37 млрд. м 3. Стремительный рост потребления В. ставит перед человечеством новую важную проблему - борьбы с истощением и загрязнением водных ресурсов планеты (см. Водные ресурсы ). Лит.:Вернадский В. И., История природных вод, Избр. соч., т. 4, М., 1960; Горизонты биохимии, пер. с англ., М., 1964; Некрасов Б. В., Основы общей химии, т. 1, М., 1965; Фюрон Р., Проблемы воды на земном шаре, пер. с франц., М., 1966; Круговорот воды, М., 1966; Паундер Э., Физика льда, пер. с англ., М., 1967; Виноградов А. П., Введение в геохимию океана, М., 1967; Самойлов О. Я., Структура водных растворов электролитов и гидратация ионов, М., 1957; Изотопный анализ воды, 2 изд., М., 1957; Термодинамика и строение растворов, М., 1959; Краткая химическая энциклопедия, т. 1, М., 1961, с. 605-14. В. Л. Василевский. Вода в организме - основная среда (внутриклеточная и внеклеточная), в которой протекает обмен веществ у всех растений, животных и микроорганизмов, а также субстрат ряда химических ферментативных реакций. В процессе фотосинтеза В. вместе с углекислым газом вовлекается в образование органических веществ и, таким образом, служит материалом для создания живой материи на Земле. Табл. 2. - Содержание воды в различных организмах, их органах и тканях
В. обеспечивает тургор тканей, перенос питательных веществ и продуктов обмена (кровь, лимфа, сок растений), физическую терморегуляцию (см. Транспирация , Потоотделение ) и другие процессы жизнедеятельности. Жизнь , вероятно, возникла в водной среде. В ходе эволюции различные водные животные и водные растения вышли на сушу и приспособились к наземному образу жизни; тем не менее и для них В. - важнейший компонент внешней среды. Жизнь без В. невозможна. При недостатке В. жизнедеятельность организмов нарушается. Лишь покоящиеся формы жизни - споры, семена - хорошо переносят длительное обезвоживание. Растения при отсутствии В. увядают и могут погибнуть, но чувствительность различных растений к недостатку В. неодинакова ( см. Засухоустойчивость, Ксерофиты , Мезофиты ). Животные, если лишить их В., быстро погибают: упитанная собака может прожить без пищи до 100 дней, а без В. - менее 10. Содержание В. в организмах велико (см. табл. 2). В жидкостях организма - межклеточных пространствах, лимфе, крови, пищеварительных соках, соке растений и др. - содержится свободная В. В тканях животных и растений В. находится в связанном состоянии - она не вытекает при рассечении органа. В. способна вызывать набухание коллоидов, связываться с белком и другими органическими соединениями, а также с ионами, входящими в состав клеток и тканей (гидратационная В.). Молекулы В., находящиеся внутри клеток, но не входящие в состав гидратационных оболочек ионов и молекул, представляют иммобильную В., легче гидратационной вовлекаемую в общий круговорот В. в организме (см. Водно-солевой обмен , Всасывание , Выделение ). Лит.:Зюков А. М., Обмен воды в организме. Физиология и патология, Хар., [1929]; Данилов Н. В., Физиологические основы питьевого режима, М., 1956; Кравчинский Б. Д., Физиология водно-солевого обмена жидкостей тела, Л., 1963. В. В. Парин. Гигиеническое значение В. Вода входит в состав всех жидкостей и тканей человеческого тела, составляя около 65% всей его массы. Потеря В. опаснее для организма, чем голодание: без пищи человек может прожить больше месяца, без В. - всего лишь несколько дней. В В. растворяются важные для жизнедеятельности организма органические и неорганические вещества; она способствует электролитической диссоциации содержащихся в ней солей, кислот и щелочей, выполняет роль катализатора разнообразных процессов обмена веществ в организме. Физиологическая потребность человека в В., которая вводится в организм с питьём и с пищей, в зависимости от климатических условий составляет 3-6 лв сутки. Значительно большее количество В. необходимо для санитарных и хозяйственно-бытовых нужд. Лишь при достаточном уровне водопотребления, которое обеспечивается централизованными системами водоснабжения, оказывается возможным удаление отбросов и нечистот при помощи сплавной канализации. Уровень водопотребления (в лна 1 жителя в сутки) в известной мере определяет и уровень санитарной. культуры в населённых местах (см. табл. 3). Табл. 3. - Нормативы хозяйственно-питьевого водопотребления
Для предупреждения опасности прямого или косвенного отрицательного влияния В. на здоровье и санитарные условия жизни населения большое значение имеют научно-обоснованные гигиенические нормативы предельно допустимого содержания в В. химических веществ. Эти нормативы являются основой государственных стандартов качества питьевой В. (ГОСТ - 2874) и обязательны при проектировании и эксплуатации хозяйственно-питьевых (коммунальных) водопроводов. В интересах здравоохранения в 60-х гг. 20 в. во всех социалистических странах, в США, Франции были пересмотрены стандарты качества питьевой В. Международные стандарты питьевой В. были опубликованы Всемирной организацией здравоохранения (ВОЗ) в 1963; в 1968 закончена разработка проекта нового стандарта качества питьевой В. в СССР. Потребление В. населением должно быть безопасно в эпидемиологическом отношении; В. не должна содержать болезнетворных бактерий и вирусов. Водный путь распространения характерен для возбудителей холеры, брюшного тифа, паратифов и лептоспирозов, в известной мере также для возбудителей дизентерии, туляремии, эпидемического гепатита, бруцеллёза. С В. в организм человека могут попадать цисты дизентерийной амёбы, яйца аскарид и др. Эпидемиологическая безопасность В. обеспечивается очисткой сточных вод и их обеззараживанием, мерами санитарной охраны водоёмов , очисткой и обеззараживанием водопроводной В. Показателями безопасности В. в эпидемиологическом отношении являются: 1) общее количество бактерий (выращиваемых на питательной среде - агаре при t37°С) - не более 100 в 1 мл; 2) количество кишечных палочек (выращиваемых на плотной питательной среде с концентрацией на мембранных фильтрах) - не более 3 в 1 л. При использовании жидких сред накопления титр кишечной палочки должен быть не менее 300. По проекту ГОСТа (1968) к бактериям группы кишечной палочки относятся грамотрицательные неспороносные палочки, факультативные анаэробы, способные сбраживать глюкозу с образованием кислоты и газа при t35-37°С в течение 24 часов. Природный состав В. издавна привлекал к себе внимание как возможная причина массовых заболеваний неинфекционной природы. Содержание в В. хлоридов, сульфатов и продуктов разложения органических веществ (аммиак, нитриты и нитраты) рассматривалось лишь как косвенный показатель опасного для здоровья населения загрязнения В. бытовыми стоками. Благодаря применению новых методов исследования были обнаружены районы с недостатком или избытком в В. тех или иных микроэлементов. В этих районах наблюдаются своеобразные изменения флоры и фауны. В связи с недостаточным или избыточным поступлением в организм микроэлементов с В. и с пищей, среди населения отмечаются характерные заболевания. Так, развитие эндемического флюороза вызывается недостаточным содержанием фтора в питьевой В., причём выявлена прямая связь между концентрацией фтора в В. и частотой и тяжестью поражения зубов. Фтор питьевой В. оказывает также влияние на фосфорно-кальциевый обмен и на процесс кальцификации костей. Для фтора питьевой В. характерен малый диапазон концентраций от токсических до физиологически полезных. В связи с этим установлено, что содержание фтора в питьевой В. не должно превышать 0,7-1,0 мг/л(до 1,2 при фторировании В.) в зависимости от климатических условий. Долгое время существовало представление о содержащихся в В. нитратах как о косвенных показателях бытового загрязнения В. Однако наличие повышенных концентраций нитратов обнаруживается и в природных подземных В. и даже в В. артезианских водоносных горизонтов (Молдавская ССР, Татарская АССР, район Владивостока). Использование в молочных смесях для детского питания В., содержащей повышенные концентрации нитратов, вызывает у детей метгемоглобинемию разной тяжести. Водонитратная метгемоглобинемия встречается и у детей старших возрастов, поэтому она приобретает черты эндемического заболевания. (См. табл. 4). Табл. 4. - Показатели безвредности химических веществ (природных и добавляемых в процессе обработки) в питьевой воде
Первые водные интоксикации были отмечены во 2-й половине 19 в. в Западной Европе (свинцовые «эпидемии») вследствие применения свинцовых труб в водопроводной технике (применение таких труб в СССР запрещено). Свинец обнаруживается и в В. подземных источников, в концентрациях, которые не безразличны для организма из-за возможности длительного действия. Среди химических веществ, обнаруживаемых в питьевых В., могут встречаться также вещества, которые в небольших концентрациях изменяют органолептические свойства В. (запах, вкус, прозрачность и пр.). Наиболее часто органолептические свойства В. изменяют содержащиеся химические вещества, в природных В. (соли общей минерализации, железо, марганец, медь, цинк и др.), остаточные количества соединений, используемые как реагенты при обработке В., а также промышленные загрязнения водоёмов. Показатели, обеспечивающие благоприятные органолептические свойства В., приведены в табл. 5. Табл. 5.-Показатели благоприятных органолептических свойств воды при содержании в ней природных или добавляемых в процессе очистки веществ
В случае применения В. для обработки серебра остаточная концентрация его не должна быть больше 0,05 мг/л. Для органолептических свойств В. также существуют нормативы: запах и привкус на уровне 2 баллов, цветность по шкале -20°, жёсткость -7,0 мг/экви pH в пределах 6,5-9,0. При содержании в В. одновременно хлоридов, сульфатов, марганца, меди, цинка сумма их концентраций, выраженная в долях от максимально допустимых концентраций каждого вещества, не должна превышать 1. Лит.:Руководство по коммунальной гигиене, т. 2, М., 1962; Вернадский В. И., Биогеохимические очерки. 1922-1932 гг., М. - Л., 1940; Международные стандарты питьевой воды, 2 изд., пер., М., 1964. С. Н. Черкинский. 
Рис. 2. Кристаллическая структура льда. 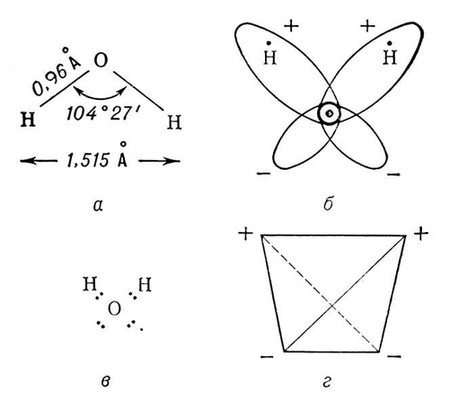
Рис. 1. Структура молекулы воды: а - геометрия молекулы H 2O (в парообразном состоянии); б - электронные орбиты в молекуле H 2O; в - электронная формула молекулы H 2O (видны необобществленные электронные пары); г - четыре полюса зарядов в молекуле H 2O расположены в вершинах тетраэдра. Водан Во'дан,Вотан, в мифологии древних германцев верховное божество, соответствующее скандинавскому Одину . ВОДГЕО ВОДГЕО,Всесоюзный научно-исследовательский институт водоснабжения, канализации, гидротехнических сооружений и инженерной гидрогеологии. В ведении Госстроя СССР. Организован в Москве в 1934. С 1965 имеет филиал в Баку и отделы в Харькове, Ташкенте и Челябинске. Институт проводит исследования по водоподготовке для промышленного водоснабжения, опреснению воды, водопроводным сетям, системам оборотного водоснабжения; разрабатывает методы механической, биохимической и физико-химической очистки промышленных сточных вод, конструкции очистных сооружений, а также вопросы автоматизации систем водоснабжения и канализации. Ведутся работы по прогнозированию качества воды в водохранилищах, по использованию подземных вод, охране их от загрязнения и др.; разрабатываются гидротехнические сооружения систем водного хозяйства промышленности и городов. Водевиль Водеви'ль(франц. vaudeville), лёгкая комедийная пьеса с песенками-куплетами и танцами. Родина В. - Франция. Название происходит от долины р. Вир (Vau de Vire), где жил в 15 в. народный песенник О. Баслен. Вначале В. называли песенки в ярмарочных комедиях 1-й половины 18 в. Как самостоятельны театральный жанр В. сложился в годы Великой французской революции и вскоре получил общеевропейское распространение. Классики французского В. - Э. Скриб , Э. Лабиш - сохранили многие черты В. как «народного произведения французов» (А. И. Герцен): задорное веселье, злободневные намёки. В России В. появился в начале 19 в., унаследовав от комической оперы 18 в. интерес к отечественным сюжетам. Раннее развитие В. связано с именами А. И. Писарева, Н. И. Хмельницкого, А. С. Грибоедова, А. А. Шаховского. В конце 30-40-х гг. в русском В. заметны демократические тенденции, сближение с реалистической комедией нравов под влиянием натуральной школы («Лев Гурыч Синичкин» Д. Т. Ленского, водевили Ф. А. Кони, В. А. Соллогуба, П. А. Каратыгина, Н. А. Некрасова). В конце 19 в. одноактные пьесы А. П. Чехова продолжили традицию В. (но без куплетов). В советское время шли на сцене водевили В. П. Катаева, В. В. Шкваркина и др. С В. в значительной степени связаны развитие комедийного актёрского искусства 19 в., борьба против обветшавших традиций классицизма. Игра актёров в лучших образцах В. отличалась естественностью, непосредственностью, импровизационной лёгкостью диалога, чувством юмора; она требовала от исполнителя музыкальности, умения петь и танцевать. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
