 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Азимов Айзек :: Раззаков Федор :: Чехов Антон Павлович :: Грин Александр :: Горький Максим :: Борхес Хорхе Луис :: Сименон Жорж :: Андреев Леонид Николаевич Популярные книги:: Ожерелье Иомалы :: Магия луны (Том 1) :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: Ночной орёл :: О «Двух душах» М. Горького :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер |
Большая Советская Энциклопедия (УГ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (УГ) - Чтение (стр. 4)
тCO
2). На Земле существует и эволюционно более древний способ усвоения CO
2путём
;в этом случае микроорганизмы-хемосинтетики используют не лучистую энергию Солнца, а энергию окисления неорганических соединений. Большинство животных потребляют У. с пищей в виде уже готовых органических соединений. В зависимости от способа усвоения органических соединений принято различать
и
.Применение для биосинтеза белка и др. питательных веществ микроорганизмов, использующих в качестве единственного источника У.
нефти,- одна из важных современных научно-технических проблем.
Содержание У. в живых организмах в расчёте на сухое вещество составляет: 34,5-40% у водных растений и животных, 45,4-46,5% у наземных растений и животных и 54% у бактерий. В процессе жизнедеятельности организмов, в основном за счёт ,происходит окислительный распад органических соединений с выделением во внешнюю среду CO 2. У. выделяется также в составе более сложных конечных продуктов обмена веществ. После гибели животных и растений часть У. вновь превращается в CO 2в результате осуществляемых микроорганизмами процессов гниения. Таким образом происходит круговорот У. в природе (см. ) .Значительная часть У. минерализуется и образует залежи ископаемого У.: каменные угли, нефть, известняки и др. Помимо основные функции - источника У.- CO 2, растворённая в природных водах и в биологических жидкостях, участвует в поддержании оптимальной для жизненных процессов кислотности среды. В составе CaCO 3У. образует наружный скелет многих беспозвоночных (например, раковины моллюсков), а также содержится в кораллах, яичной скорлупе птиц и др. Такие соединения У., как HCN, CO, CCl 4, преобладавшие в первичной атмосфере Земли в добиологический период, в дальнейшем, в процессе биологической эволюции, превратились в сильные обмена веществ. Помимо стабильных изотопов У., в природе распространён радиоактивный 14C (в организме человека его содержится около 0,1 мккюри) .С использованием изотопов У. в биологических и медицинских исследованиях связаны многие крупные достижения в изучении обмена веществ и круговорота У. в природе (см. ) .Так, с помощью радиоуглеродной метки была доказана возможность фиксации H 14CO - 3растениями и тканями животных, установлена последовательность реакций фотосинтеза, изучен обмен аминокислот, прослежены пути биосинтеза многих биологически активных соединений и т.д. Применение 14C способствовало успехам молекулярной биологии в изучении механизмов биосинтеза белка и передачи наследственной информации. Определение удельной активности 14C в углеродсодержащих органических остатках позволяет судить об их возрасте, что используется в палеонтологии и археологии. Н. Н. Чернов. Лит.:Шафрановский И. И., Алмазы, М. - Л., 1964; Уббелоде А. Р., Льюис Ф. А., Графит и его кристаллические соединения, пер. с англ., М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1972; Перельман А. И., Геохимия элементов в зоне гипергенеза, М., 1972; Некрасов Б. В., Основы общей химии, 3 изд., М., 1973; Ахметов Н. С., Неорганическая химия, 2 изд., М., 1975; Вернадский В. И., Очерки геохимии, 6 изд., М., 1954; Рогинский С. З., Шноль С. Э., Изотопы в биохимии, М., 1963; Горизонты биохимии, пер. с англ., М., 1964; Проблемы эволюционной и технической биохимии, М., 1964; Кальвин М., Химическая эволюция, пер. с англ., М., 1971; Лёви А., Сикевиц Ф., Структура и функции клетки, пер. с англ., 1971, гл. 7; Биосфера, пер. с англ., М., 1972. Углерода галогениды Углеро'да галогени'ды,соединения углерода с галогенами. У. г. обычно рассматривают как производные углеводородов, в которых водород полностью замещен на галоген. Простейшими У. г. являются тетрагалогениды общей формулы CX 4, молекулы которых имеют тетраэдрическое строение с расстояниями С-F, С-Сl, С-Вr и С-I, соответственно: (Е) 1,36; 1,76; 1,94; 2,12, и энергиями связи ( кдж/моль) :487; 340: 285; 214 или в ккал/моль116; 81; 68; 51. При обычных условиях CF 4- газ (t kип-128 °С), CCl 4- жидкость (t пл-22,9 °С, t kип76,8 °C), CBr 4и Cl 4- твёрдые тела ( t пл93,7 и 171 °С). Все тетрагалогениды практически нерастворимы в воде и растворимы в органических растворителях. В соответствии с уменьшением энергии связи устойчивость CX 4падает, а химическая активность возрастает при переходе от фтора к иоду. CF 4и CCl 4устойчивы к нагреванию и действию воздуха, света, кислот. Cl 4легко разлагается при нагревании. Только CF 4может быть получен непосредственно взаимодействием элементов. Один из способов синтеза CCl 4и CBr 4- реакция CS 2с галогенами. Cl 4получают при взаимодействии CCl 4с иодидами алюминия, висмута и др. металлов. Из тетрагалогенидов углерода наибольшее значение имеет .Известны также смешанные У. г., например CClF 3, CCBr 2Cl 2, С 2Вг 2F 4. Многие У. г. широко применяют в различных отраслях техники, например дифтордихлорметан CCl 2F 2и трихлорфторметан CCl 3F как хладоагенты в холодильных установках ( ) , C 2F 4и C 2ClF 3- мономеры в производстве , C 2Cl 6- заменитель камфоры, некоторые фторхлор-содержащие У. г.- компоненты .
Лит.:Ахметов Н. С., Неорганическая химия, 2 изд., М., 1975. Б. А. Поповкин. Углерода двуокись Углеро'да двуо'кись,ангидрид угольной кислоты, углекислый газ, CO 2, оксид С (IV), высший окисел углерода. В 1756 Дж. показал, что при разложении карбоната магния выделяется газ - «связанный воздух» (его состав установил в 1789 А. ) .У. д. бесцветный газ, имеющий слегка кисловатые запах и вкус; плотность 0,0019 г/см 3(0 °С. 0,1 Мн/м 2) , t пл-56,6 °С. t kип-78,5 °С, критическая температура 31 °С, критич. давление 7,62 Мн/м 2(75,2 кгс/см 2) .При атмосферном давлении и -78,5 °С, минуя жидкое состояние, затвердевает в белую снегообразную массу («сухой лёд»). Жидкая У. д. существует при комнатной температуре лишь при давлении больше 5,85 Мн/м 2(58,5 кгс/см 2) .Плотность жидкой CO 20,771 г/см 2(20 °С), твёрдой 1,512 г/см 3.Молекула газообразной У. д. имеет симметричную форму О=С=О с расстоянием С-О 1,162 Е. Твёрдая CO 2кристаллизуется в кубической гранецентрированной решётке, а=5,62 Е. У. д. термически устойчива, диссоциирует на окись углерода и кислород только при температурах выше 2000 °С. Заметно растворима в воде (по массе %): 0,335 (0 °С); 0,169 (20 °С) и частично взаимодействует с ней с образованием H 2CO 3. Растворяется в органических растворителях: ацетоне, бензоле, хлороформе, спиртах. Энергично соединяется с основаниями, давая .CO 2не горит и не поддерживает горения. Только очень активные металлы восстанавливают её при высоких температурах (например, магний - при 600 °С, кальций - при 700 °С). CO 2взаимодействует с раскалённым углём: CO 2+ С =2СО (реакция имеет большое значение в металлургии); с аммиаком при 160- 200 °С и давлении 10-40 Мн/м 2(100- 400 кгс/см 2) :CO 2+ 2NH 3= CO (NH 2) 2+ + H 2O; в присутствии окиси меди с водородом, образуя метан. У. д. входит в состав воздуха: 0,03 объёмных %, общее содержание 2,3Ч10 12 т,в гидросфере, находящейся в равновесии с атмосферой, 1,4Ч10 14 т. CO 2образуется и поступает в атмосферу при горении топлив, гниении органических остатков, брожении, дыхании животных и человека. В результате индустриальных загрязнений содержание У. д, в атмосфере промышленных городов намного превышает предельно допустимые нормы. Поэтому в ряде технически развитых стран (в том числе и в СССР) осуществляются мероприятия по снижению содержания У. д. в атмосферном воздухе (см. ) .У. д. необходима для развития растений, поглощающих её из атмосферы в процессе .Атмосферы планет Марса и Венеры содержат У. д. в качестве основного компонента. Получают У. д. в промышленности главным образом при обжиге известняка (900-1300 °С) с одновременным получением извести; очистку 002 осуществляют поглощением её растворами соды, поташа или этаноламина. Хранят и перевозят У. д. в сжиженном состоянии под давлением 6 Мн/м 2(60 кгс/см 2) в стальных баллонах. В лаборатории CO 2обычно получают взаимодействием соляной кислоты с мрамором. Применяется У. д. в производстве газированных вод, пива и сахара. CO 2идёт на изготовление «сухого льда», который служит для хранения и перевозки скоропортящихся пищевых продуктов. В химической промышленности CO 2расходуется на получение соды, мочевины, оксикарбоновых кислот, применяется также как теплоноситель в графитовых реакторах. У. д. используется для тушения пожаров и при перевозке огнеопасных веществ. Б. А. Поповкин. В сельском хозяйстве У. д. используют как удобрение. Недостаток её в воздухе, что часто наблюдается в условиях защищенного грунта, особенно при гидропонной культуре (см. ) ,снижает интенсивность фотосинтеза и урожай. Для улучшения углеродного питания растений в теплицах и парниках проводят газацию, то есть в дневное время подают в них газообразную У. д. (из баллонов) или очищенные продукты каталитического горения природного горючего газа и твёрдого топлива (содержат до 15% CO 2). Источником газообразной У. д. может быть твёрдая У. д. («сухой лед»), куски которой раскладывают в помещении, а также органические и минеральные удобрения, выделяющие её при разложении. Эффективность удобрения У. д. зависит от условий минерального питания растений, освещённости, температуры почвы и воздуха. В организме человека и животных У. д. вместе с бикарбонатами образует важную крови. Повышение уровня парциального давления У. д. в крови увеличивает прочность связи кислорода с гемоглобином. Бездействуя (в том числе непосредственно) на центры продолговатого мозга, У. д. участвует в регуляции дыхания и кровообращения. Смесь кислорода (95%) и У. д. (5%) - так называемый карбоген - используют для лечения отравлений наркотиками, окисью углерода и др. В больших концентрациях У. д. токсична, вызывает .Длительное (до нескольких сут) вдыхание У. д. даже при концентрации 1,5-3% вызывает головную боль, головокружение, тошноту. При концентрации выше 6% (так называемый критический уровень) теряется работоспособность, появляются сонливость, ослабление дыхания и сердечной деятельности, возникает опасность для жизни. Накопление У. д. в воздухе с одновременным снижением содержания кислорода может наблюдаться в замкнутых, плохо вентилируемых пространствах (например, в шахтах, сточных колодцах), в помещениях, где осуществляются процессы брожения (например, на пивоваренных заводах). Первая помощь: вынести пострадавшего на свежий воздух, провести искусственное дыхание. В воздухе жилых и общественных зданий накопление У. д. не достигает критических величин; её концентрация - один из санитарно-гигиенических показателей степени чистоты воздушной среды. В. Ф. Кириллов.
Лит.:Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1972; Некрасов Б. В., Основы общей химии, 3 изд., т. 1- 2, М., 1973: Ахметов Н. С., Неорганическая химия, 2 изд., М., 1975. Углерода окись
Углеро'да о'кись,угарный газ CO, оксид С (II), соединение углерода с кислородом; газ без цвета и запаха. У. о. впервые выделил французский врач Ж. де Лассон в 1776 при нагревании древесного угля с окисью цинка. Плотность У. о. 0,00125 г/см
3при 0 °С и давлении 0,1
Мн/м
2(1 кгс/см
2),
t
пл-205 °С,
t
kип-191,5 °С, критическая температура - 140°C, критическое давление 3,46
Мн/м
2(34,6
кгс/см
2)
.Формально углерод в У. о. имеет степень окисления +2, однако повышенная прочность молекулы CO [энергия диссоциации 1036
кдж/моль(247
ккал/моль)]
и малое межъядерное расстояние (1,128Е) заставляют предположить, что атомы кислорода и углерода связаны дополнительно донорно-акцепторной связью
У. о. - несолеобразующий окисел, не взаимодействующий при обычных условиях с водой, кислотами и щелочами. У. о. характеризуется восстановительными свойствами и склонностью к реакциям присоединения. Так, при облучении светом и в присутствии катализаторов CO соединяется с хлором (см. ) ;а при нагревании - с кислородом, давая двуокись CO 2; с серой образует сероокись COS, с некоторыми металлами - ,например Ni (CO) 4, Fe (CO) 5. У. о. при повышенных температурах восстанавливает окислы металлов до свободных металлов (Fe; Pb; Ni; Cu и др.) и взаимодействует с водородом, давая, в зависимости от условий реакции, метан, смесь высших спиртов, альдегиды, кетоны. В атмосфере У. о. содержится в незначительных количествах. Встречается в виде небольших включений в пластах каменного угля. Всегда образуется в результате сгорания углерода или его соединений при недостатке воздуха и в значительных количествах присутствует в топочных газах, выхлопных газах автомобилей (2-10 объёмных %), табачном дыме (0,5-1 объёмных %), являясь таким образом источником загрязнения атмосферы. Поэтому во многих странах принимаются меры по снижению концентрации У. г. в атмосферном воздухе промышленных городов (см. ) . Получают У. о. в промышленности при взаимодействии раскалённого угля с углекислым газом: С + CO 2= 2CO или водяным паром: С + H 2O = CO + H 2. Таким образом производят генераторный и водяной газы, использующиеся как газообразное горючее (см. ) .В лаборатории CO получают нагреванием при 100 °С муравьиной кислоты с серной кислотой; при этом происходит реакция: HCOOH = H 2O + CO. Применяют У. о. в химической промышленности для синтеза спиртов, углеводородов, альдегидов и органических кислот, а также для получения .См. ; . Отравления У. о. возможны на производстве и в быту: в доменных, мартеновских, литейных цехах; при испытании двигателей, использовании топливных газов для сушки и подогрева; в химической промышленности; в гаражах; при дровяном отоплении и т.п. Поступая в организм через органы дыхания, У. о. взаимодействует с гемоглобином и образует ,не обладающий способностью переносить кислород к тканям. Наряду с этим уменьшается коэффициент утилизации кислорода тканями. Возникают гипокапния, затруднение диссоциации оксигемоглобина, ферментные нарушения тканевого дыхания и т.д. Защитную роль играет железо плазмы крови: его соединение с У. о. препятствует образованию карбоксигемоглобина и способствует извлечению У. о. из тканей. При острых отравлениях наблюдается головная боль, головокружение, тошнота, рвота, слабость, одышка, учащённый пульс; возможны быстрая потеря сознания, судороги, кома (с последующим двигательным возбуждением), нарушения кровообращения и дыхания, поражение зрительного нерва и т.д.; на 2-3-й сутможет развиться токсическая пневмония. Первая помощь: вынести пострадавшего на свежий воздух, растереть грудь; вдыхание паров нашатырного спирта, горячее питье. При хронических отравлениях появляются головная боль, головокружение, бессонница, возникает эмоциональная неустойчивость, ухудшаются память, внимание. Возможны органические поражения центральной нервной системы, сосудистые спазмы, повышение количества эритроцитов в крови. Профилактика: контроль за герметичностью газопроводов, состоянием местной вентиляции, удалением выхлопных газов, содержанием У. о. в воздухе рабочей зоны; аэрация зданий; соблюдение техники безопасности при взрывных работах; использование противогазов; медицинское наблюдение за рабочими соответствующих производств; в быту - правильное пользование газовыми горелками и печным отоплением. А. А. Каспаров. Лит.:Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1972; Ахметов Н. С., Неорганическая химия, 2 изд., М., 1975; Тиунов Л. А., Кустов В. В., Токсикология окиси углерода, Л., 1969. Углеродистая сталь Углеро'дистая сталь, ,не содержащая легирующих компонентов. В зависимости от содержания углерода У. с. подразделяют на низкоуглеродистую (до 0,25% С), среднеуглеродистую (0,25-0,6% С) и высокоуглеродистую (более 0,6% С). Различают У. с. обыкновенного качества и качественную конструкционную. К 1-й группе относится горячекатаная (сортовая, фасонная, толстолистовая, тонколистовая, широкополосная) и холоднокатаная (тонколистовая) сталь; во 2-ю входят горячекатаные и кованые заготовки диаметром (или толщиной) до 250 мм,калиброванная сталь и . У. с. выплавляют в мартеновских, двухванных, дуговых печах и кислородных конвертерах. Для раскисления У. с. используют ферромарганец, ферросилиций, феррованадий, алюминий, титан и др.; по степени раскисления различают кипящую, полуспокойную и спокойную У. с. Для улучшения физико-химических и технологических свойств применяют микролегирование У. с. титаном, цирконием, бором, редкоземельными элементами. В результате микролегирования сталь приобретает мелкозернистую структуру, уменьшается степень зональной ,снижаются загрязнённость стали и склонность к образованию трещин при горячей пластической деформации, повышается при отрицательных температурах, что даёт возможность применять У. с. в различных климатических зонах (от - 40 до 60 °С). У. с. разливают на слитки (сверху, сифоном) и заготовки (на машинах непрерывного литья); масса слитков достигает 35 т.Кроме того, У. с. используется для получения стальных отливок. Литая У. с. отличается от деформируемой стали подобного состава несколько меньшими пластичностью и ударной вязкостью. У. с. - наиболее распространённый вид ;на её долю приходится (середина 70-х гг.) свыше 75% всей стальной продукции чёрной металлургии СССР. Лит.:Смоляренко Д. А., Качество углеродистой стали, 2 изд., М., 1969; Качество слитка спокойной стали, М., 1973. Д. А. Смоляренко. Углеродистые огнеупоры Углеро'дистые огнеупо'ры,состоят почти целиком из углерода либо содержат 5-70% С вместе с др. огнеупорными компонентами. Углеродистые изделия изготовляют из кокса, термоантрацита и каменноугольной смолы обжигом в восстановительной среде при 1100-1450 °С (неграфитированные) или около 2500 °С (графитированные). Графитовые изделия получают из природного или искусственного графита. Углеродсодержащие (графитсодержащие) огнеупоры формуют различными способами из смесей графита с глиной, шамотом, др. огнеупорными порошками и обжигают при 800-1350 °С или делают безобжиговыми. У. о. имеют кажущуюся плотность 1500-2000 кг/м 3,пористость преимущественно 15-30%, высокую .В окислительной среде У. о. сравнительно быстро окисляются, форма изделий - блоки различных размеров и фасонные изделия (пробки, стаканы, трубы, тигли и др.). Углеродистые изделия применяются в кладке горна и лещади доменных печей, подин печей цветной металлургии, печей по производству карбида кальция; графитированные и графитовые - в печах для производства специальных сплавов, в ракетных двигателях; графито-алюмосиликатные - при разливке стали, плавке цветных металлов и т.д. Находят применение также смеси - пасты из углеродистых или графитовых порошков со смоляным связующим. Лит.:Химическая технология керамики и огнеупоров, М., 1972. А. К. Карклит. Углеродная единица Углеро'дная едини'ца,унифицированная ,составляющая массы атома изотопа углерода 12C. У. е. была предложена в 1959 (IUPAC), принята в 1960 (IUPAP) и утверждена на конгрессе IUPAC в 1961. У. е. равна (1,66043 ± 0,00031)Ч10 -24 г. Углеродные волокна Углеро'дные воло'кна,волокна, состоящие в основном из углерода. У. в. обычно получают термической обработкой химических или природных органических волокон, при которой в материале волокна остаются главным образом атомы углерода. Температура обработки может составлять менее 900 °С (такие У. в. содержат 85-90% углерода), 900-1500 °С (95-99%) или 1500-3000 °С (более 99%). Помимо обычных органических волокон (чаще всего вискозных и полиакрилонитрильных), для получения У. в. могут быть использованы специальные волокна из фенольных смол, лигнина, каменноугольных и нефтяных пеков. У. в. могут иметь разнообразную текстильную форму, определяемую чаще всего формой исходного сырья (непрерывные или штапельные нити, жгуты, ленты, войлок, ткани и др.). Возможна также переработка У. в. в тканые и нетканые материалы с использованием обычного текстильного оборудования. У. в. имеют исключительно высокую теплостойкость: при тепловом воздействии вплоть до 1600-2000 °С в отсутствии кислорода механические показатели волокна не изменяются. Это предопределяет возможность применения У. в. в качестве тепловых экранов и теплоизоляционного материала в высокотемпературной технике. На основе У. в. изготавливают армированные пластики, которые отличаются высокой абляционной стойкостью (см. ). У. в. устойчивы к агрессивным химическим средам, однако окисляются при нагревании в присутствии кислорода. Их предельная температура эксплуатации в воздушной среде составляет 300-350 °С. Нанесение на У. в. тонкого слоя карбидов, в частности SiC, или нитрида бора позволяет в значительной мере устранить этот недостаток. Благодаря высокой химической стойкости У. в. применяют для фильтрации агрессивных сред, очистки газов, изготовления защитных костюмов и др. Изменяя условия термообработки, можно получить У. в. с различными электрофизическими свойствами (удельное объёмное электрическое сопротивление от 2Ч10 -3до 10 6 омЧ см) и использовать их в качестве разнообразных по назначению электронагревательных элементов, для изготовления термопар и др. Активацией У. в. получают материалы с большой активной поверхностью (300-1000 м 2/г) ,являющиеся прекрасными сорбентами. Нанесение на волокно катализаторов позволяет создавать каталитические системы с развитой поверхностью. Обычно У. в. имеют прочность порядка 0,5-1 Гн/м 2(50-100 кгс/мм 2) и модуль 20-70 Гн/м 2(2000-7000 кгс/мм 2) ,а подвергнутые ориентационной вытяжке - прочность 2,5-3,5 Гн/м 2(250-350 кгс/мм 2) и модуль 200-450 Гн/м 2(20Ч10 3-45Ч10 3 кгс/мм 2) .Благодаря низкой плотности (1,7-1,9 г/м 3) по удельному значению (отношение прочности и модуля к плотности) механических свойств У. в. превосходят все известные жаростойкие волокнистые материалы. На основе высокопрочных и высокомодульных У. в. с использованием полимерных связующих получают конструкционные углеродопласты. Разработаны композиционные материалы на основе У. в. и керамических связующих, У. в. и углеродной матрицы, а также У. в. и металлов, способные выдерживать более жёсткие температурные воздействия, чем обычные пластики. Лит.:Конкин А. А., Углеродные и другие жаростойкие волокнистые материалы, М., 1974. А. А. Конкин. Углеродовский Углеро'довский,посёлок городского типа в Ростовской области РСФСР, подчинён Гуковскому горсовету. Расположен в 2 кмот железнодорожного узла Замчалово. Добыча угля. Углеродопласты Углеро'допла'сты,карбопласты, углепластики, пластмассы, содержащие в качестве наполнителя (в виде непрерывного жгута, ленты, мата или короткого рубленого волокна). Связующими для таких материалов служат синтетические полимеры, например эпоксидные, полиэфирные, феноло-формальдегидные смолы, полиимиды, кремнийорганические полимеры (полимерные У.), синтетические полимеры, подвергнутые пиролизу (коксованные У.), и так называемый «пиролитический углерод» (пироуглеродные У.). Изделия из У. можно формовать всеми способами, применяемыми при переработке слоистых .Наиболее распространён следующий метод: углеродный наполнитель пропитывают расплавом или раствором связующего (например, в спирте, в углеводородах), подсушивают, получая полуфабрикат (препрег), из которого выкраивают заготовки, собирают из них по форме изделия пакет и прессуют, как правило, на гидравлических прессах, в автоклавах или пресс-камерах (удельное давление не должно превышать 2,0- 2,5 Мн/м 2,или 20-25 кгс/см 2,из-за высокой хрупкости углеродного волокна). Препрег в виде пропитанной ленты или жгута используют также при получении изделий намоткой. Коксованные У. получают пиролизом полимерных У. при 300-1500 °С или 2500-3000 °С. При изготовлении пироуглеродных У. наполнитель, не пропитанный связующим, выкладывают по форме изделия, помещают в печь, в которую пропускают обычно метан. При 1100 °С и остаточном давлении 2,6 кн/м 2(20 мм рт. см.) он разлагается, и образующийся «пиролитический углерод» осаждается на углеродных волокнах, связывая их. У. характеризуются сочетанием высокой прочности и жёсткости с малой плотностью, низкими температурным коэффициентом линейного расширения (благодаря чему при повышенных температурах У. имеют хорошую стабильность размеров) и коэффициент трения, высокими тепло- и электропроводностью, износостойкостью, устойчивостью к термическому, химическому и радиационному воздействию. У. превосходят др. слоистые пластики (например, , ) и металлы по статической и динамической выносливости, имеют высокую вибропрочность (например, усталостная прочность при изгибе У. на основе эпоксидного связующего более 400 Мн/м 2,или 40 кгс/мм 2,вибропрочность 480 Мн/м 2,или 48 кгс/мм 2) .У. обладают высокой анизотропией свойств. Пироуглеродные и коксованные У. отличаются также хорошими абляционными свойствами (см. ) .Однако ударная прочность У. меньше, чем, например, у стеклопластиков. У. - важные ,используемые в авиастроении (обеспечивают снижение массы деталей фюзеляжа, крыла, оперения самолёта на 15-50%). Из У. изготавливают детали самолётов скоростной авиации и космических летательных аппаратов, спортинвентарь (например, лыжи), химическое оборудование; У. используют в судо- и автомобилестроении. Коксованные и пироуглеродные У. применяют для внешней теплозащиты возвращаемых космических аппаратов, для внутренней теплозащиты элементов ракетных двигателей (сопла, камеры сгорания). И. П. Хорошилова. Углеуральский Углеура'льский,посёлок городского типа в Пермской области РСФСР, подчинён Губахинскому горсовету. Расположен на западном склоне Среднего Урала, на автодороге Соликамск - Кунгур, в 3 кмот железнодорожная станции Половинка (на линии Соликамск - Чусовская) и в 4 кмот железнодорожной станции Углеуральская (на линии Лёвшино - Соликамск). 17,2 тыс. жителей (1976). Добыча угля. Филиал швейной фабрики. Угли ископаемые У'гли ископа'емые- твёрдые горючие полезные ископаемые осадочного происхождения. В состав У. и. входят: органическое вещество - продукт преобразования высших и низших растений с участием микроорганизмов планктона, минеральные примеси (условно не более 50%) и влага. У. и. залегают в земной коре в виде пластов, пластообразных и линзовидных залежей, имеют землистую, массивную, слоистую или зернистую текстуру; цвет от коричневого до чёрного. I. Общие сведения У. и. - один из основных видов энергетического сырья; доля их участия в мировом топливно-энергетическом балансе 30-35%. С 1950 по 1974 мировая добыча У. и. увеличилась в 1,7 раза, превысив 3 млрд, т. У. и. составляют основную часть (87,5%) прогнозных ресурсов ископаемого топлива Земли, оцениваемых величиной 12,8 триллиона т ( тут) .СССР обладает крупнейшими ресурсами У. и.; разведанные и прогнозные геологические запасы У. и., отвечающие современным требованиям по качеству и мощности разрабатываемых пластов, составляют 5,7 триллиона т(1968), или 4,6 триллиона тут. 1, 2, 3, 4, 5, 6, 7, 8 |
|||||||
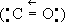 .
.