 |
|
���������� ������:: ������ ����� ���� :: ������ ����� :: ���� ��������� :: ����� ����� �������� :: �������� ����� :: ������� ������ :: ������� ��� ���������� :: ������� ���� :: ������� ������ ���������� :: ������ ���� ���������� �����:: ������� :: ���� (����� 1-3) :: ����������� ���� :: ������ �� ������ ����� (������� ���������) :: The Boarding House :: �������� :: �������� :: ���������� �� ������� Windows XP :: On Basilisk Station :: ������� �������� |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 18)
Цепочечные С. Простейшие и наиболее распространённые из них представлены непрерывными цепочками кремнекислородных тетраэдров, соединённых вершинами, типа [SiO 3] 2-или сдвоенными цепочками-лентами типа [Si 4O 11] 6-( рис. , 4 и 5). К ним принадлежат группы пироксенов , амфиболов , рамзаита Na 2[Ti 2Si 2O 6] O 3и др. Слоистые С. характеризуются непрерывными в двух направлениях слоями кремнекислородных тетраэдров, образующими бесконечные двухмерные радикалы, которые в зависимости от пространственного положения кремнекислородных тетраэдров в слое имеют различную формулу; для слоя, состоящего из шестерных колец, характерен радикал типа [Si 4O 10] 4-( рис. , 6); при этом в шестерном кольце тетраэдров слоя каждый из шести атомов кремния принадлежит трём таким кольцам, т. е. по два кремния на каждое кольцо. К этому подклассу относятся слюды группы мусковита и биотита K (Mg, Fe 2- 3)[AlSi 3O 10]Ч(OH, F) 2, группы пирофиллита Al 2[Si 4O 10](OH) 2и талька Mg 3[Si 4O 10]Ч(OH) 2, каолинита Al 4[Si 4O 10](OH) 8и серпентина Mg 6[Si 4O 10](OH) 8, галлуазита Al 4(H 2O) 4[Si 4O 10](OH) 8, хлоритов ; к слоистым относится гадолинит FeY 2Ч[Be 2Si 2O 10]; к титаносиликатам - астрофиллит (К, Na) 3(Mn, Fe) 7[Ti 2(Si 4O 12) 2ЧO 2(OH) 5; к ураносиликатам - склодовскит (H 3O) 2Mg [UO 2(SiO 4)] 2Ч3H 2O и др. Каркасные С. характеризуются трёхмерным бесконечным каркасом кремнекислородных тетраэдров типа [SiO 4] 4-, соединённых всеми четырьмя вершинами друг с другом так, что каждый атом кислорода одновременно принадлежит только двум таким тетраэдрам; общая формула [Al mSi n-mO 2n] m-. К ним относятся минералы группы полевых шпатов Na [AISi 3O 8] - K [AISi 3O 8] - Ca [Al 2Si 2O 8], нефелина KNa 3[AISiO 4], петалита Li [AISi 4O 10], данбурита Ca [B 2Si 2O 8l, цеолитов , содалита Na 4[AISiO 4] 3Cl, гельвина Mn 4[BeSiO 4] 3S (см. Содалита группа ) и др. В структурах С. установлено значительное число различных типов цепочек, лент, сеток и каркасов из тетраэдров. По составу тетраэдрических радикалов различаются простые С. с кремнекислородным радикалом [SiO 4] 4-и сложные С., в которых вместе с [SiO 4] 4-присутствуют тетраэдрические группы алюминия ( алюмосиликаты ), бериллия (бериллосиликаты), бора (боросиликаты), титана (титаносиликаты), циркония (цирконосиликаты), урана (ураносиликаты). Наряду с этим выделяются силикаты Al, Be, Ti, Zr, в которых эти элементы играют роль таких же катионов, как Mg, Fe и др., соединяясь с кремнекислородными тетраэдрами не вершинами, а ребрами или через вершины, поделенные между двумя тетраэдрами. Катионы, входящие в состав С., разделяются прежде всего на 2 группы: малые катионы - Mg 2+, Al 3+, Fe 2+, Mn 2+и др., частично Ca 2+, имеющие обычно октаэдрическую координацию (содержащие их соединения составляют первую главу кристаллохимии С., по Н. В. Белову, 1961), и крупные катионы - К +, Na +, Ca 2+, Ba 2+, Sr 2+, редкоземельных элементов, образующие соответственно более крупные координационные полиэдры: 8-, 9-, 12-вершинники, ребра которых соизмеримы уже с размерами не одиночных [SiO 4] 4-тетраэдров, а групп [Si 2O 7] 6-(с этими соединениями связана вторая глава кристаллохимии С.). Для С. характерен изоморфизм , проявляющийся особенно широко среди катионов; вследствие этого в С. распространены ряды твёрдых растворов (непрерывные или со значительными пределами замещений), а также изоморфные примеси. Поэтому даже развёрнутые формулы С., учитывающие основные изоморфные замещения, всё же являются неполными вследствие большой сложности состава реальных С. Распределение изоморфных катионов в структуре С. зависит от температуры и устанавливается рентгенографически или по мёссбауэровским и инфракрасным спектрам. Это свойство позволяет использовать С. в качестве геотермометра. В составе С. отмечается разнообразие форм вхождения в их структуру водорода - в виде гидроксильных групп, кристаллизационной и цеолитной воды, межслоевой адсорбированной воды и др., изучаемых с помощью ядерного магнитного резонанса (ЯМР), термического анализа, инфракрасной спектроскопии. Во всех подклассах С. выделяются группы с добавочными анионами (O 2-, F -, CI -, OH -, S 2-) и радикалами (SO 4 2-, CO 3 2-и др.). Дальнейшие усложнения в строении С. связаны с явлениями упорядочения (особенно Al - Si в алюмосиликатах и Mg - Fe в оливинах, пироксенах, амфиболах), политипии и смешаннослойных прорастаний (в слоистых С.), полиморфных превращений (например, андалузит - дистен - силлиманит), распада твёрдых растворов, образования электронно-дырочных центров (см. Дефекты в кристаллах ). Большинство С. в связи с их сложным строением имеет низкую симметрию: около 45% кристаллизуется в моноклинной, 20% имеют ромбическую симметрию, 9% - триклинную, 7% - тетрагональную, 10% - тригональную и гексагональную и 9% - кубическую. Весьма характерно двойникование (двойники роста, механических и фазовых превращений). Свойства С.определяются прежде всего типом кремнекислородного тетраэдра: спайность (несовершенная в островных и кольцевых С., совершенная и зависящая от ориентировки кремнекислородных группировок в цепочечных, слоистых, каркасных С.); твёрдость обычно 5,5-7, кроме слоистых С., в которых она понижается до 2-1; плотность около 2500-3500 кг/м 3. Цвет большинства С. определяется ионами железа (Fe 2+- зелёный, Fe 3+- бурый, красный, жёлтый, Fe 2+и Fe 3+- синий и др.), в отдельных группах - ионами Ti 3+, V 4+, Cr 3+, Mn 2+, Co 2+, Ni 2+, Cu 2+и их сочетаниями с ионами железа и др.; в некоторых минералах - электронно-дырочными центрами. В ряде случаев окраска связана с микровключениями окрашенных минералов. Большое значение для точной диагностики С. имеют их оптические свойства - преломление, оптическая ориентировка и др., измеряемые с помощью Федорова столика , иммерсионного метода и др. Происхождение С.весьма разнообразно: они возникают при кристаллизации магмы, метаморфических и метасоматических процессах; реже С. образуются в гидротермальных жилах. Крупные кристаллы С. возникают в пегматитах. Физико-химические особенности образования С. в природных условиях определяются с помощью парагенетического анализа минеральных ассоциаций (см. Парагенезис минералов ) с учётом данных детально изученных диаграмм состоянии силикатных систем. При выветривании происходит разрушение большинства С. с образованием осадочных горных пород, с выщелачиванием основных соединений, освобождением кремнезёма, возникновением за счёт алюмосиликатов водных силикатов алюминия, образованием глинистых минералов, нонтронита, гарниерита и др., а также окислов железа, карбонатов и др. С. (плагиоклазы, оливин, пироксены и др.) являются также главными минералами лунных пород, входят в состав метеоритов . Полагают, что оливин и плотная модификация со шпинели составляют почти полностью мантию Земли. Применение С.определяется тем, что многие из них являются важнейшими среди полезных ископаемых. Существенное значение имеют силикатные минералы, составляющие литиевые, бериллиевые руды, руды рассеянных элементов, силикатные никелевые руды. Месторождения нефелина поставляют комплексное сырьё для получения алюминия, поташа, соды. Большую долю составляют С. в нерудных полезных ископаемых (полевые шпаты, слюды, асбест, тальк, цеолиты, гранаты, бентонитовые и огнеупорные глины), в драгоценных и поделочных камнях (изумруд, аквамарин, топаз, хризолит, турмалин и др.). Исследование С. как главнейших минералов Земли и Луны, содержащих многие ценные элементы в качестве основных компонентов или примесей, составляет важное направление современной минералогии, тесно связанное с геохимией, литологией, геофизикой и исследованием вещественного состава месторождений полезных ископаемых. Лит.:Соболев B. С., Введение в минералогию силикатов, Львов, 1949; Белов Н. В., Кристаллохимия силикатов с крупными катионами, М., 1961; Эйтель В., Физическая химия силикатов, пер. с англ., М., 1962; Дир У.-А., Хауи Р.-А., 3усман Дж., Породообразующие минералы, пер. с англ., т. 1-4, М., 1965 - 66; Поваренных А. С., Кристаллохимическая классификация минеральных видов, К., 1966; Минералы. Справочник, т. 3, в. 1, М., 1972; Коржинский Д. С., Теоретические основы анализа парагенезисов минералов, М., 1973; Марфунин А. С., Введение в физику минералов, М., 1974. А. С. Марфунин. 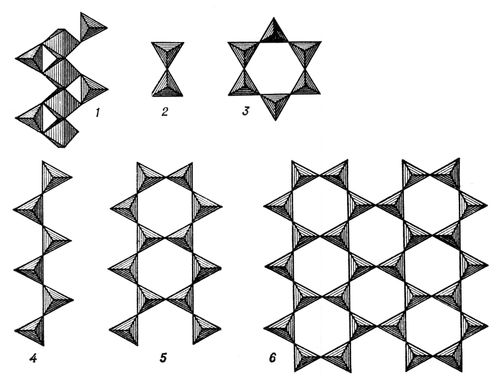
Основные типы связи кремнекислородных радикалов: 1 - изолированные тетраэдры [SiO 4] 4-с октаэдрами Mg, Fe, Ca; 2 - группы [Si 2O 7] 6-из двух тетраэдов; 3 - шестерные кольца [Si 3O 9] 6-; 4 - цепочки [SiO 3] 2-; 5 - ленты [Si 4O 11] 6-; 6 - слои из шестерных колец [Si 4O 10] 4-. Силикаты натрия Силика'ты на'трия,натриевые соли кремниевых кислот. Известны следующие безводные С. н.: Na 2OЧSiO 2(или Na 2SiO 3) - метасиликат натрия, 2Na 2OЧSiO 2(Na 4SiO 4) - ортосиликат натрия, 3Na 2OЧ2SiO 2(Na 6Si 2O 7) - пиросиликат натрия, Na 2OЧ2SiO 2(Na 2Si 2O 5) - бисиликат натрия, Na 2OЧ3SiO 2(Na 2Si 3O 7) - трисиликат натрия. См. также Силикаты природные и Стекло . Силикаты синтетические Силика'ты синтети'ческие,простые или сложные соли кремниевых или алюмокремниевых кислот. С. с. - составная часть цементов, огнеупоров, шлаков, красного и силикатного кирпича, фарфора и фаянса, стекол, глазурей, эмалей, адсорбентов, катализаторов и пр. С. с., образующиеся в процессе нагревания сырьевой смеси, содержащей в своём составе SiO 2, AI 2O 3, CaO, MgO, K 2O и др., во многом определяют свойства получаемого технического продукта. С. с. могут образоваться и в результате нежелательных процессов, например коррозии огнеупоров расплавленными металлургическими шлаками. В отличие от силикатов природных, С. с. могут быть получены в виде однофазных продуктов, свободных от посторонних примесей. Синтезированы почти все аналоги природных силикатов, а также большое число силикатов, не встречающихся в природе. С. с. щелочных металлов относительно легкоплавки и хорошо растворяются в воде; силикаты Na и К в виде т. н. жидкого, или растворимого, стекла используют для изготовления клея, красок, различных замазок и в мыловарении. С. с. двухвалентных и особенно трёхвалентных металлов обладают большой тугоплавкостью и химической устойчивостью. Силикаты кальция 3CaO·SiO 2и 2CaO·SiO 2являются основными компонентами портландцемента . Гидросиликаты кальция, образующиеся при гидратации цемента, а также при гидротермической обработке в автоклавах силикатного кирпича и силикатобетонных изделий , обусловливают прочность твердеющих материалов. Метасиликат кальция CaO·SiO 2- наполнитель при изготовлении бумаги. Ортосиликат магния 2MgO·SiO 2- основной компонент форстеритовых огнеупоров (встречается также в составе магнезитевых огнеупоров и шлаков). Метасиликат магния MgO·SiO 2- кристаллическая фаза электроизоляционной стеатитовой керамики. Силикат алюминия 3A1 2O 3·2SiO 2- муллит обеспечивает прочность при высоких температурах и коррозионную стойкость шамотных и муллитовых огнеупоров, широко используемых в металлургии и стекловарении. Этот же силикат в виде тончайших иголочек кристаллизуется при обжиге фарфоровых изделий; он служит своеобразной арматурой фарфора (о цеолитах и пермутитах см. в ст. Алюмосиликаты ). Алюмосиликаты лития и магния, обладающие низким коэффициентом термического расширения, - основные кристаллические фазы стойких к термическому удару керамических материалов. Способность силикатных расплавов застывать в виде стекла, не кристаллизуясь, позволяет получать стекла различного назначения. Однако в технике иногда специально создаются условия для кристаллизации стекла. При этом получают стеклокристаллические материалы - ситаллы (см. также Строительных материалов промышленность ). Лит.:Химическая технология керамики и огнеупоров, под ред. Будникова П. П. и Полубояринова Д. Н., М., 1972; Диаграммы состояния силикатных систем, Л., 1972. А. А. Майер. Силиква Си'ликва(лат. siliqua), 1) древнеримская учетная и монетная единица равная 1/ 728римского весового фунта (327,45 г) или 1/ 6в скрупула (0,19 г). 2) Римская и византийская серебряная монета. Впервые выпущена в 323 н. э. Равнялась 1/ 24золотого солида . В 5-6 вв. применялась как основа денежного счёта в Византийской империи С падением Византийской империи С. исчезла из обращения. Силико..., силик... Силико..., силик...(от лат. silex, родительный падеж silicis - кремень), в химических, геологических, технических и других терминах составная часть, означающая отношение к кремнию ; см., например, Силикаты , Силикотермия , Силикоз . Силикоз Силико'з(от лат. silex - кремень), заболевание человека, вызываемое длительным вдыханием пыли, содержащей свободную двуокись кремния, относится к профессиональным болезням . Встречается у рабочих горнорудной, фарфорофаянсовой, металлургической, машиностроительной промышленности. С. - наиболее неблагоприятно протекающее заболевание из группы пневмокониозов ; чаще, чем при других заболеваниях, отмечаются присоединение туберкулёзного процесса (т. н. силикотуберкулёз) и другие осложнения. Силикокальций Силикока'льций, ферросплав , содержащий 23-32% Ca, 2-4% Fe (остальное Si); выплавляется в рудно-термических печах углевосстановительным процессом (см. Карботермия ) из извести и кварцита. При введении в шихту железной стружки углевосстановительным или силикотермическим (см. Силикотермия ) процессом получают ферросиликокальций, содержащий 10-20% Ca и до 25% Fe (стоимость кальция в нём ниже, чем в С.). Оба сплава используются при выплавке стали как раскислители (см. Раскисление металлов ). Силикомарганец Силикома'рганец ферросплав основные компоненты которого - кремний и марганец; выплавляется в рудно-термических печах углевосстановительным процессом (см. Карботермия ). С. с 10-26% Si (остальное Mn, Fe и примеси), получаемый из марганцевой руды, марганцевого шлака и кварцита, используется при выплавке стали как раскислитель (см. Раскисление металлов ) и легирующая присадка (см. Легирование ), а также для выплавки ферромарганца с пониженным содержанием углерода силикотермическим процессом (см. Силикотермия ). С. с 28-30% Si (сырьём для которого служит специально получаемый высокомарганцевый низкофосфористый шлак) применяется в производстве металлического марганца. Силиконы Силико'ны,то же что кремнийорганические полимеры . Силикотермия Силикотерми'я,силикотермический процесс, получение металлов и сплавов восстановлением окислов металлов (руд, концентратов) кремнием. С. основана на том, что сродство кремния к кислороду (изменение изобарного потенциала образования окисла) выше, чем у восстанавливаемого металла. Силикотермические процессы осуществляют в дуговых печах , т. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82 |
|||||||