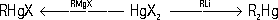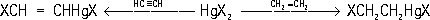Большая Советская Энциклопедия (РТ)
Ртищев Фёдор Михайлович
Рти'щевФёдор Михайлович [6(16).4.1626, с. Покровское Лихвинского уезда, — 21.6(1.7).1673, Москва], русский государственный и культурный деятель. Сын окольничего. С 1645 занимал дворцовые должности стряпчего, постельничего, дворецкого. В 1656 получил чин окольничего. Во время войн России с Польшей и Швецией (1654—56) выполнял дипломатические поручения. Был близким советником царя Алексея Михайловича, входил в
. Возглавлял ряд приказов: Приказ Большого дворца, Приказ тайных дел и др. Р. способствовал укреплению русско-украинских политических и культурных связей. Пригласив из Киева учёных монахов (Епифания Славинецкого и др.), организовал в Москве школу при Андреевском монастыре (так называемое Ртищевское братство), ставшую предшественницей Славяно-греко-латинской академии. Для ознакомления москвичей с полифонической музыкой выписал хор из Киева. Р. содействовал расширению системы медицинских и благотворительных учреждений в России (больницы, госпитали, богадельни, странноприимные дома). За нравственные качества и благотворительную деятельность получил от современников прозвище «милостивого мужа».
Лит.:Козловский И. П., Ф. М. Ртищев, К., 1906; Кашкин Н. Н., Родословные разведки, СПБ, 1912, с. 402—49.
Ртищево
Рти'щево,город областного подчинения, центр Ртищевского района Саратовской области РСФСР. Ж.-д. узел на пересечении линий Москва — Саратов и Пенза — Харьков. 41 тыс. жителей (1974), Предприятия ж.-д. транспорта; мясокомбинат, маслозавод, швейная и гигроскопической ваты фабрики, комбинат стройматериалов. Техникум ж.-д. транспорта. Народный театр. Р. возникло в 70-х гг. 19 в., город с 1920.
РТО
РТО,см.
Ртути хлориды
Рту'ти хлори'ды,соединения ртути с хлором: хлористая ртуть Hg
2CI
2(
) и хлорная ртуть HgCl
2(
).
Ртутная лампа
Рту'тная ла'мпа,
, в котором при электрическом разряде в парах ртути возникает оптическое излучение в ультрафиолетовой, видимой и близкой инфракрасной областях спектра. В зависимости от рабочего давления паров ртути, которое определяется температурой наиболее холодного участка колбы и количеством введённой в лампу ртути, Р. л. подразделяются на лампы низкого, высокого и сверхвысокого давления.
Р. л. низкого давления (~ 0,7
н/м
2)
—эффективные источники резонансного излучения ртути с длинами волн 185 и 254
нм.Среди них наиболее распространены
и
.
Р. л. высокого давления (10
4—10
6
н/м
2)
—эффективные источники света с преобладающим излучением в ультрафиолетовой и видимой областях оптического диапазона, имеющие линейчатый спектр излучения со спектральными линиями в интервале длин волн от 248 до 1014
нм.Колбы Р. л. высокого давления, имеющие диаметр 8—60
мми длину 30—1500
мм,изготовляются преимущественно из тугоплавкого прозрачного кварцевого стекла и наполняются инертным газом и дозированным количеством ртути, которая при работе лампы полностью испаряется в объёме колбы, создавая в ней требуемое давление. Разряд имеет форму яркого шнура, расположенного между электродами по оси трубки. При давлениях свыше
10
5
н/м
2появляется непрерывный фон излучения, интенсивность которого возрастает с увеличением плотности тока и давления. Мощность Р. л. высокого давления от
50
втдо 50
квт,световая отдача 40—60
лм/вт.Р. л. высокого давления во внешних колбах, покрытых изнутри люминофором, применяются для
, лампы без люминофора используются в медицине (при
), фотохимии, а также в
.
Р. л. сверхвысокого давления (свыше 10
6
н/м
2)
—источники излучения высокой яркости в ультрафиолетовой и видимой областях. Спектр излучения линейчатый; наиболее интенсивные линии соответствуют длинам волн от 312 до 579
нм.Как в ультрафиолетовой области, так и в видимой на линейчатый спектр накладывается непрерывный фон излучения, интенсивность которого возрастает с ростом плотности тока и давления. Различают Р. л. сверхвысокого давления с естественным и водяным охлаждением; кварцевые колбы этих ламп соответственно имеют шаровую или капиллярную форму. Мощность Р. л. сверхвысокого давления от 100
втдо 10
квт,световая отдача 30—70
лм/вт.Применяются в различных светооптических установках.
Среди Р. л. высокого и сверхвысокого давления выделяются так называемые металлогалогенные лампы, в колбы которых добавляют галогениды некоторых металлов, что позволяет значительно поднять их кпд и в широких пределах варьировать спектральный состав излучения. Все Р. л. включаются в сеть с помощью специальных пускорегулирующих устройств.
Лит.:Рохлин Г. Н. Газоразрядные источники света, М. — Л., 1966; Ртутные лампы высокого давления, пер. с англ., М., 1971.
Г. Н. Рохлин.
Ртутная турбина
Рту'тная турби'на,
, в которой рабочим телом является ртутный пар. В 40-х гг. 20 в. считалось, что некоторые свойства ртути (например, высокая температура насыщения пара при относительно низких давлениях) позволяют эффективно использовать Р. т. в ртутно-водяных энергетических установках. Р. т. не получили распространения из-за сравнительно дорогого рабочего тела и его токсичности.
Ртутно-кварцевая лампа
Рту'тно-ква'рцевая ла'мпа,газоразрядный источник интенсивного ультрафиолетового излучения, используемый при
, то же, что
Ртутно-цинковый элемент
Рту'тно-ци'нковый элеме'нт,
, относящийся к классу первичных гальванических элементов, у которого отрицательный электрод (анод) изготовляется из Zn, а активным материалом положительного электрода (катода) служит окись ртути; современная разновидность
. Термин «Р.-ц. э.» вошёл в употребление с начала 60-х гг. 20 в.
Ртутные руды
Рту'тные ру'ды,природные минеральные образования, содержащие
в таких концентрациях, при которых их промышленное использование технически возможно и экономически целесообразно. Главный рудный минерал Р. р. —
HgS с содержанием Hg 86,2%; второстепенные рудные минералы — метациннабарит (b-сульфид Hg), самородная ртуть Hg, ливингстонит (HgSb
4S
7), кордероит (Hg
3S
2Cl
2), ртутьсодержащие сульфосоли Си, Sb, As и др. Р. р. делятся на богатые (около 1% Hg), рядовые (0,2—0,3% Hg), бедные (0,06—0,12% Hg), убогие (0,02—0,06% Hg). Комплексные Р. р. содержат Sb, Cu — Pb — Zn, W, Au — Ag; вредная примесь — As. Рудные тела представлены пластообразными и контактовыми залежами, жилами, гнёздами и штокверками объёмом от нескольких
м
2до сотен тыс.
м
2.Р. р. образуются обычно низкотемпературными (250—100 °С) слабо концентрированными (3—5
г/л) гидротермальными растворами; в более редких случаях — перегретыми газово-жидкими эманациями, насыщенными парами Hg. В связи с этим выделяются собственно гидротермальные, телетермальные и вулканогенные Р. р. Основное промышленное значение имеют телетермальные месторождения, включающие согласные залежи в окварцованных песчаниках, доломитах и известняках под сланцевыми породами (в СССР — районы Донбасса, Северного Кавказа, Якутии, Чукотки; в Испании — Альмаден), а также рудные столбы в зонах
(в СССР — Средняя Азия, Алтай, Закавказье; в США — Нью-Альмаден) на контакте серпентинитов со сланцами, и вулканогенные месторождения, представленные плащеобразными залежами в эффузивных и осадочных горных породах (в СССР — Камчатка, в США — Сульфур-Банк). Последние разрабатываются открытым способом, остальные — преимущественно подземным. Ртуть возгоняется во вращающихся печах и печах кипящего слоя без предварительного обогащения руд.
Общие запасы Р. р. оцениваются в 500 тыс.
т.Годовая добыча в капиталистических и развивающихся странах 7—8 тыс.
т(1968—73), в том числе в Альмадене (Испания) и Монте-Амиата (Италия) по 1,5—2 тыс.
т;от 500 до 1000
тв год дают месторождения США, Канады, Мексики; по 100—300
т —Турции, Алжира, Японии; по 10—100
т —Перу, Чили, Туниса.
Лит.Сауков А. А. Геохимия ртути, М., 1946; Вопросы металлогении ртути, М., 1968; Мельников С. М., Металлургия ртути, М., 1971; Сауков А. А., Айдинян Н. Х., Озерова Н. А., Очерки геохимии ртути, М., 1972; Металлогения ртути, М., 1975.
В. П. Федорчук.
Ртутный вентиль
Рту'тный ве'нтиль,обобщённое название
самостоятельного дугового разряда, с жидким ртутным катодом. Р. в. используют главным образом в качестве
в мощных промышленных выпрямительных и инверторных установках (см.
,
) или в качестве управляемых
в импульсных устройствах. Р. в. состоит из герметичной (обычно металлической) оболочки и находящихся внутри неё ртутного катода, основного (графитового или стального) анода и дополнительных электродов, таких как управляющая сетка, деионизационный фильтр, анод возбуждения, зажигатель. Давление остаточного газа внутри оболочки Р. в. составляет 10
-2—10
-3
н/м
2.Источником электронов в нём служит небольшая часть поверхности катода —
так называемое катодное пятно. В ту часть периода переменного напряжения, когда Р. в. обладает высокой проводимостью, между катодом и основным анодом горит самостоятельный
в ртутных парах, образующихся в результате испарения ртути катода. По методу управления моментом зажигания дугового разряда Р. в. делят на
и
, по величине рабочего напряжения на основном аноде — на низковольтные (как правило, до 5—10
кв) и высоковольтные (обычно свыше 50
кв).
Лит.:Каганов И. Л., Ионные приборы, М., 1972.
Л. Ю. Абрамович.
Ртутный горизонт
Рту'тный горизо'нт,прибор, состоящий из сосуда с ртутью, горизонтальная поверхность которой используется в качестве зеркала при некоторых астрономических и геодезических наблюдениях. См.
Ртуть
Рту'ть(лат. Hydrargyrum), Hg, химический элемент II группы периодической системы Менделеева, атомный номер 80, атомная масса 200,59; серебристо-белый тяжёлый металл, жидкий при комнатной температуре. В природе Р. представлена семью стабильными изотопами с массовыми числами: 196 (0,2%), 198 (10,0%), 199 (16,8%), 200 (23,1%), 201 (13,2%), 202 (29,8%), 204 (6,9%).
Историческая справка. Самородная Р. была известна за 2000 лет до н. э. народам Древней Индии и Древнего Китая. Ими же, а также греками и римлянами применялась
(природная HgS) как краска, лекарственное и косметическое средство. Греческий врач Диоскорид (1 в. н. э.), нагревая киноварь в железном сосуде с крышкой, получил Р. в виде паров, которые конденсировались на холодной внутренней поверхности крышки. Продукт реакции был назван hydrбrgyros (от греч. hэdor — вода и бrgyros — серебро), т. е. жидким серебром, откуда произошли латинские названия hydrargyrum, а также argentum vivum — живое серебро. Последнее сохранилось в названиях P. quicksilver (англ.) и Quecksilber (нем.). Происхождение русского названия Р. не установлено. Алхимики считали Р. главной составной частью всех металлов. «Фиксация» Р. (переход в твёрдое состояние) признавалась первым условием её превращения в золото. Твёрдую Р. впервые получили в декабре 1759 петербургские академик И. А. Браун и М. В. Ломоносов. Учёным удалось заморозить Р. в смеси из снега и концентрированной азотной кислоты. В опытах Ломоносова отвердевшая Р. оказалась ковкой, как свинец. Известие о «фиксации» Р. произвело сенсацию в учёном мире того времени; оно явилось одним из наиболее убедительных доказательств того, что Р. — такой же металл, как и все прочие.
Распространение Р. в природе. Р. принадлежит к числу весьма редких элементов, её среднее содержание в земной коре (кларк) близко к 4,5Ч10
-6% по массе. Приблизительно в таких количествах она содержится в изверженных горных породах. Важную роль в геохимии Р. играет её миграция в газообразном состоянии и в водных растворах. В земной коре Р. преимущественно рассеяна; осаждается из горячих подземных вод, образуя
(содержание Р. в них составляет несколько процентов). Известно 35 ртутных минералов; главнейший из них — киноварь HgS.
В биосфере Р. в основном рассеивается и лишь в незначительных количествах сорбируется глинами и илами (в глинах и сланцах в среднем 4Ч10
-5%). В морской воде содержится 3Ч10
-9% Р.
Самородная Р., встречающаяся в природе, образуется при окислении киновари в сульфат и разложении последнего, при вулканических извержениях (редко), гидротермальным путём (выделяется из водных растворов).
Физические и химические свойства Р. — единственный металл, жидкий при комнатной температуре. Твёрдая Р. кристаллизуется в ромбические сингонии,
а= 3,463
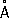
, с = 6,706
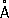
; плотность твёрдой Р. 14,193
г/см
3(—38,9 °С), жидкой 13,52
г/см
3(20 °С), атомный радиус 1,57
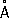
, ионный радиус Hg
2+1,10
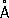
;
t
пл— 38,89 °С;
t
kип357,25 °С; удельная теплоемкость при 0 °С 0,139
кдж/(
кгЧК) [0,03336
кал/(
гЧ°С)]; при 200 °С 0,133
кдж/(
кгЧК)[0,0319
кал/(гЧ°С)]; температурный коэффициент линейного расширения 1,826Ч10
-4(0—100 °С); теплопроводность 8,247
вт/(
мЧК) [0,0197
кал/(
смЧ
секЧ°C) (при 20°C); удельное электросопротивление при 0°С 94,07Ч10
-8
омЧ
м(94,07Ч10
-6
омЧ
см)
.При 4,155 К Р. становится сверхпроводником (см.
). Р. диамагнитна, её атомная магнитная восприимчивость равна —0,19Ч10
-6(при 18 °С).
Конфигурация внешних электронов атома Hg 5d
106s
2
,в соответствии с чем при химических реакциях образуются катионы Hg
2+и Hg
2
2+. Химическая активность Р. невелика. В сухом воздухе (или кислороде) она при комнатной температуре сохраняет свой блеск неограниченно долго. С кислородом даёт 2 соединения: чёрную закись Hg
2O и красную окись HgO. Hg
2O появляется в виде чёрной плёнки на поверхности Р. при действии озона. HgO образуется при нагревании Hg на воздухе (300—350 °С), а также при осторожном нагревании нитратов Hg (NO
3)
2или Hg
2(NO
3)
2. Гидроокись Р. практически не образуется. При взаимодействии с металлами, которые Р. смачивает, образуются
. Из сернистых соединений важнейшим является HgS, которую получают растиранием Hg с серным цветом при комнатной температуре, а также осаждением растворов солей Hg
2+сероводородом или сульфидом щелочного металла. С галогенами (хлором, иодом) Р. соединяется при нагревании, образуя почти недиссоциирующие, в большинстве ядовитые соединения типа HgX
2. В соляной и разбавленной серной кислотах Р. не растворяется но растворима в царской водке, азотной и горячей концентрированной серной кислотах.
Почти все соли Hg
2+плохо растворимы в воде. К хорошо растворимым относится нитрат Hg (NO
3)
2.
Большое значение имеют хлориды Р.: Hg
2Cl
2(
) и HgCl
2(
) Известны соли окисной Р. цианистой и роданистой кислот, а также ртутная соль гремучей кислоты Hg (ONC)
2, т. н.
. При действии аммиака на соли образуются многочисленные
, например HgCIЧ2NH
3(плавкий белый преципитат) и HgNH
2CI (неплавкий белый преципитат). Применение находят
.
Получение Р. Ртутные руды (или рудные концентраты), содержащие Р. в виде киновари, подвергают окислительному обжигу
HgS + O
2= Hg + SO
2.
Обжиговые газы, пройдя пылеуловительную камеру, поступают в трубчатый холодильник из нержавеющей стали или монель-металла. Жидкая Р. стекает в железные приёмники. Для очистки сырую Р. пропускают тонкой струйкой через высокий (1—1,5
м) сосуд с 10%-ной HNO
3, промывают водой, высушивают и перегоняют в вакууме.
Возможно также гидрометаллургическое извлечение Р. из руд и концентратов растворением HgS в сернистом натрии с последующим вытеснением Р. алюминием. Разработаны способы извлечения Р. электролизом сульфидных растворов.
Применение. Р. широко применяется при изготовлении научных приборов (барометры, термометры, манометры, вакуумные насосы,
, полярографы, капиллярные электрометры и др.), в
, переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и хлора электролизом, в качестве катализатора при синтезе уксусной кислоты, в металлургии для
золота и серебра, при изготовлении взрывчатых веществ (см.
); в медицине (каломель, сулема, ртутьорганические и другие соединения), в качестве пигмента (киноварь), в сельском хозяйстве (органические соединения Р.) в качестве протравителя семян и гербицида, а также как компонент краски морских судов (для борьбы с обрастанием их организмами). Р. и ее соединения токсичны, поэтому работа с ними требует принятия необходимых мер предосторожности.
С. А. Погодин.
Р. в организме. Содержание Р. в организмах составляет около 10
-6% В среднем в организм человека с пищей ежесуточно поступает 0,02—0,05
мгР. Концентрация Р. в крови человека составляет в среднем 0,023
мкг/мл,в моче — 0,1—0,2
мкг/мл.В связи с загрязнением воды промышленными отходами в теле многих ракообразных и рыб концентрация Р. (главным образом в виде её органических соединений) может значительно превышать допустимый санитарно-гигиенический уровень. Ионы Р. и её соединения, связываясь с
ферментов, могут инактивировать их. Попадая в организм, Р. влияет на поглощение и обмен микроэлементов — Cu, Zn, Cd, Se. В целом биологическая роль Р. в организме изучена недостаточно.
Ю. И. Раецкая.
Отравления Р. и её соединениями возможны на ртутных рудниках и заводах, при производстве некоторых измерительных приборов, ламп, фармацевтических препаратов, инсектофунгицидов и др.
Основную опасность представляют пары металлической Р., выделение которых с открытых поверхностей возрастает при повышении температуры воздуха. При вдыхании Р. попадает в кровь. В организме Р. циркулирует в крови, соединяясь с белками; частично откладывается в печени, в почках, селезёнке, ткани мозга и др. Токсическое действие связано с блокированием сульфгидрильных групп тканевых белков, нарушением деятельности головного мозга (в первую очередь, гипоталамуса). Из организма Р. выводится через почки, кишечник, потовые железы и др.
Острые отравления Р. и её парами встречаются редко. При хронических отравлениях наблюдаются эмоциональная неустойчивость, раздражительность, снижение работоспособности, нарушение сна, дрожание пальцев рук, снижение обоняния, головные боли. Характерный признак отравления — появление по краю дёсен каймы сине-чёрного цвета; поражение дёсен (разрыхлённость, кровоточивость) может привести к гингивиту и стоматиту. При отравлениях органическими соединениями Р. (диэтилмеркурфосфатом, диэтил-ртутью, этилмеркурхлоридом) преобладают признаки одновременного поражения центральной нервной (энцефало-полиневрит) и сердечно-сосудистой систем, желудка, печени, почек.
Лечение: внутривенное введение 20%-ного раствора гипосульфита (12—15 вливаний на курс), унитиол, фармакологические и физиотерапевтические средства, нормализующие высшую нервную деятельность, курортолечение (Пятигорск, Мацеста и т. п.) и др. Профилактика: замена Р. менее вредными веществами, правильные способы хранения, соблюдение мер безопасности при использовании (герметичность оборудования, рациональная отделка помещений, рабочих поверхностей, эффективная вентиляция), индивидуальная защита; предварительные и периодические медицинские осмотры.
Препараты Р. находят применение в медицинской практике, главным образом благодаря их антисептическим и мочегонным свойствам. Как мочегонные применяют меркузал, промеран и др. В качестве антисептиков используют сулему (дезинфекция кожи, одежды, предметов ухода за больными и т. п.), диоцид (стерилизация хирургических инструментов и т. п.), цианид и оксицианид Р. (для промываний и спринцеваний при некоторых воспалительных процессах), амидохлорид Р. (в виде мази при заболеваниях кожи), окись Р. жёлтую (в виде мази при заболеваниях глаз и кожи). Применявшиеся ранее для лечения сифилиса препараты Р. в современной практике не используются.
А. А. Каспаров.
Лит.:Мельников С. М., Ртуть, в кн.: Краткая химическая энциклопедия, т. 4, М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 2, М., 1966; Рипан Р., Четяну И., Неорганическая химия, пер. с рум., М., 1972; Некрасов Б. В., Основы общей химии, 2 изд., т. 2, М., 1969; Вредные вещества в промышленности, под общ. ред. Н. В. Лазарева, 6 изд., [ч. 2], Л., 1971; Трахтенберг И. М., Хроническое воздействие ртути на организм, К., 1969; Профессиональные болезни, 3 изд., М., 1973.
Ртуть гремучая
Ртуть грему'чая,Hg (ONC)
2, см.
.
Ртутьорганические соединения
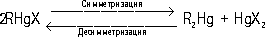
Ртутьоргани'ческие соедине'ния,соединения, содержащие в молекуле связь углерод — ртуть (С—Hg). Известны два основных типа Р. с.: R—Hg—R' и R—HgX (R, R' — органические радикалы, X — кислотный остаток). Эти типы Р. с. взаимопревращаемы:
Симметризующие агенты — NH
з, Kl, амальгамы, Na
2S
2O
3и др. Низшие гомологи Р. с. типа R
2Hg — летучие тяжёлые жидкости, высшие гомологи и RHgX — кристаллические вещества; нерастворимы в воде, растворимы в органических растворителях. Основные методы получения Р. с.: 1) взаимодействие солей ртути с магний- или литийорганическими соединениями:
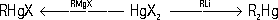
2) замещение в органическом соединении водорода на ртуть (меркурирование):

3) присоединение солей ртути к ненасыщенным соединениям:
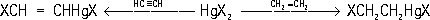
4) разложение солей диазония в присутствии солей ртути (
).
Связь С—Hg в Р. с. расщепляется галогенами, кислотами, солями некоторых металлов, окислителями (например, кислородом, озоном и др.); при облучении Р. с. распадаются с выделением металлической Hg и
, претерпевающих дальнейшие превращения.
Р. с. применяются в органическом синтезе, находят ограниченное использование в качестве
. Р. с. — промежуточные продукты в некоторых промышленно важных процессах, катализируемых солями ртути, например в синтезе ацетальдегида гидратацией ацетилена (
). См. также
.
Б. Л. Дяткин.

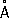 , с = 6,706
, с = 6,706
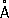 ; плотность твёрдой Р. 14,193
г/см
3(—38,9 °С), жидкой 13,52
г/см
3(20 °С), атомный радиус 1,57
; плотность твёрдой Р. 14,193
г/см
3(—38,9 °С), жидкой 13,52
г/см
3(20 °С), атомный радиус 1,57
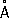 , ионный радиус Hg
2+1,10
, ионный радиус Hg
2+1,10
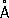 ;
t
пл— 38,89 °С;
t
kип357,25 °С; удельная теплоемкость при 0 °С 0,139
кдж/(
кгЧК) [0,03336
кал/(
гЧ°С)]; при 200 °С 0,133
кдж/(
кгЧК)[0,0319
кал/(гЧ°С)]; температурный коэффициент линейного расширения 1,826Ч10
-4(0—100 °С); теплопроводность 8,247
вт/(
мЧК) [0,0197
кал/(
смЧ
секЧ°C) (при 20°C); удельное электросопротивление при 0°С 94,07Ч10
-8
омЧ
м(94,07Ч10
-6
омЧ
см)
.При 4,155 К Р. становится сверхпроводником (см.
). Р. диамагнитна, её атомная магнитная восприимчивость равна —0,19Ч10
-6(при 18 °С).
;
t
пл— 38,89 °С;
t
kип357,25 °С; удельная теплоемкость при 0 °С 0,139
кдж/(
кгЧК) [0,03336
кал/(
гЧ°С)]; при 200 °С 0,133
кдж/(
кгЧК)[0,0319
кал/(гЧ°С)]; температурный коэффициент линейного расширения 1,826Ч10
-4(0—100 °С); теплопроводность 8,247
вт/(
мЧК) [0,0197
кал/(
смЧ
секЧ°C) (при 20°C); удельное электросопротивление при 0°С 94,07Ч10
-8
омЧ
м(94,07Ч10
-6
омЧ
см)
.При 4,155 К Р. становится сверхпроводником (см.
). Р. диамагнитна, её атомная магнитная восприимчивость равна —0,19Ч10
-6(при 18 °С).