 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Раззаков Федор :: Азимов Айзек :: Чехов Антон Павлович :: Грин Александр :: Борхес Хорхе Луис :: Горький Максим :: Андреев Леонид Николаевич :: Сименон Жорж Популярные книги:: Ожерелье Иомалы :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: О «Двух душах» М. Горького :: Магия луны (Том 1) :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер :: Вторая книга Царств |
Большая Советская Энциклопедия (ПЛ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ПЛ) - Чтение (стр. 17)
П. б. социалистических стран, где внешнеэкономические отношения осуществляются на основе государственной монополии внешней торговли и валютной монополии, формируются на плановой основе как составная часть общего народно-хозяйственного, внешнеторгового и валютного плана. П. б. стран - членов СЭВ взаимно уравновешиваются на основе долгосрочного планирования торговли и платежей между этими странами (в частности, при помощи расчётов в ) .В условиях валютной монополии в социалистических странах П. б. не оказывают влияния на положение их денежных единиц. В отношениях с капиталистическими государствами Советский Союз и др. социалистические страны обеспечивают равновесие своих П. б., исходя из использования в плановом порядке ресурсов иностранной валюты и золота, а также ожидаемых валютных поступлений. Лит.:Комиссаров В. П., Попов А. Н., Международные валютные и кредитные отношения, М., 1965; Фрей Л. И., Валютные и финансовые расчеты капиталистических стран, М., 1969. А. Б. Фрумкин. Платёжный оборот Платёжный оборо'т, денежный оборот, в котором деньги функционируют как средство платежа. По характеру платежей П. о. подразделяется на наличноденежный и безналичный. В 1973 весь платёжный безналичный оборот, проходящий через систему Госбанка СССР, составил 1800 млрд. руб. (см. ) .П. о. в СССР и др. социалистических странах осуществляется планомерно. Социалистическое общество сознательно определяет денежные потоки, внедряет прогрессивные формы платежей (расчёты ,чеками, плановыми платежами), ограничивающих внеплановое перераспределение средств в хозяйстве. Планирование основных показателей хозяйственно-финансовой деятельности создаёт возможность определить объём поставок, а следовательно, и платежей, их важнейшие потоки на основе договоров, заключаемых хозяйственными организациями. П. о. находится в прямой зависимости от движения товаров, от конкретной хозяйственной сделки. Платежи между предприятиями возникают поэтому не на базе авансирования расходов (коммерческое кредитование в СССР и в большинстве др. социалистических стран запрещено), а вслед за совершением фактических расходов. Подобный принцип способствует более быстрой реализации готовой продукции, своевременному получению поставщиком денежных средств за отгруженный товар. По своему экономическому содержанию, роли в социалистическом воспроизводстве и механизму организации платежа П. о. предприятий и организаций охватывает две группы: 1) платежи, связанные непосредственно с производственной и хозяйственной деятельностью (за приобретённые средства производства и товары, выполненные работы и оказанные услуги), - на их долю приходится более 2/ 3всего П. о., проходящего через Госбанк; 2) платежи, связанные с финансовыми обязательствами и др. нетоварными операциями (перечисление налога с оборота, платежи из прибыли, взносов амортизации и др.). Обслуживая разнообразные стороны хозяйственно-финансовой деятельности внутри предприятия, П. о. непосредственно связан с кругооборотом оборотных фондов (сфера производства и обращения товаров) и основных фондов (сфера капитальных вложений). Все платежи, относящиеся к основной производственной деятельности и капитальным затратам, совершаются с разных счетов, отдельно они отражаются в бухгалтерских балансах (баланс по основной деятельности и баланс по капитальным вложениям). Между этими двумя сферами П. о. существует органическое единство: средства предприятий, предназначенные на капитальные вложения, формируются в значительной части за счёт соответствующих перечислений со счетов основной производственной деятельности. Возможно и обратное движение средств с особых счетов по капитальным затратам на счета по основной деятельности. Такое переплетение разнообразных платежей выражает единство воспроизводственного процесса социалистических предприятий. Лит.см. при ст. . О. И. Лаврушин. Платеи Платеи, Платея (Plataiбi, Plбtaia), древнегреческий город в Южной Беотии, около которого во время 26 сент. 479 до н. э. произошло сражение между войсками 24 греч. городов-государств во главе с Афинами и Спартой под командованием спартанского полководца Павсания и персидской армией под командованием Мардония. Греки занимали выгодные оборонительные позиции, и персы не решались их атаковать. В ночь на 26 сентября греки начали отход к П. Утром персы, считая, что противник обратился в бегство, атаковали арьергард, состоявший из спартанцев. Спартанцы отбросили атаковавших, а затем с помощью подошедших афинян и др. союзников опрокинули плохо организованную массу персов, которые, после того как Мардоний был смертельно ранен, в беспорядке бежали к Геллеспонту, преследуемые греками. При П. греческая фаланга снова подтвердила своё превосходство над более многочисленной, но иррегулярной персидской пехотой и конницей. Победа при П. и одновременно разгром персидского флота при привели к освобождению Греции и греческих городов Малой Азии от персов. Платеозавр Платеоза'вр(Plateosaurus), род ящеротазовых динозавров подотряда .Жили в позднем триасе. Длиной до 6 м.Имели относительно маленький лёгкий череп. Зубы ланцетовидные (в верхней челюсти свыше 30, в нижней - менее 30). Передвигались на двух ногах. Питались растениями, возможно и мелкими животными. Скелеты П. известны из отложений Западной Европы. Платереско Платере'ско(исп. plateresco, от platero - ювелир), архитектурный стиль испанского Возрождения. Основой стиля П., возникшего в конце 15 в., является тончайшее архитектурное узорочье, крайне детализированное по формам и имеющее плоскостный, ковровый характер. Не затрагивая конструкции зданий в целом, декор П. первоначально накладывался на позднеготические, а позднее - и на ренессансные формы. В раннем П. (архитекторы Х. Гуас, Х. де Колония, Э. де Эгас) сплавлены воедино мотивы готики и ;в поздний П. (с 1530-х гг., архитекторы А. де Коваррубиас, Д. де Рианьо и др.) проникает всё больше орнаментальных мотивов итальянского ренессанса (гирлянды, медальоны и т. д.), а также ордерных элементов, вносящих известную упорядоченность, но не нарушающих общего впечатления нарядной живописности. Во 2-й половине 16 в. в большинстве районов П. вытесняется аскетически-суровым стилем «десорнаментадо» (или «эрререско»). Лит.:Camуn Aznar J., La arquitectura plateresca, v. 1-2, Madrid, 1945. 
Университет в Саламанке. Фасад. 1529. Платибазальный череп Платибаза'льный че'реп(от греч. Platэs - широкий и bбsis - основание), тип осевого ,присущий ряду групп позвоночных (круглоротые, многие рыбы, земноводные); характеризуется широким основанием и широко раздвинутыми глазницами, между которыми продолжается мозговая полость. У млекопитающих в связи с сильным развитием переднего мозга ,свойственный их предкам, стал вторично П. ч. Платибелодон Платибелодо'н(Platybelodon), род вымерших млекопитающих отряда хоботных. Внешне П. были похожи на бегемотов. Передняя часть нижней челюсти и бивни (резцы) у П. были сильно вытянуты в виде лопаты и приспособлены для добывания растений из грунта. П. жили по берегам рек, озёр. Остатки известны из миоценовых отложений Северного Кавказа (впервые описан А. А. Борисяком) и Центральной Азии (Китай, Монголия). 
Рис. к ст. Платибелодон. Платина Пла'тина(лат. Platinum), Pt, химический элемент VIII группы периодической системы Менделеева, атомный номер 78, атомная масса 195,09; тяжёлый тугоплавкий металл. О П., а также о рутении, родии, палладии, осмии и иридии, сопутствующих П. в земной коре и сходных с нею по свойствам, см. в статьях , , . Платина самородная Пла'тина саморо'дная,группа платиновых минералов, являющихся неупорядоченными природными твёрдыми растворами Fe, Cu, Ni, lr, Rh, Pd, Sn, Os, Ru, Au, Ag, Bi, Pb в платине. Обычно содержат 2-3 основных (минералообразующих) металла и различное количество металлов-примесей. Их главный элемент - платина; в кристаллической структуре П. с. она является металлом-растворителем, её структура наследуется минералами П. с. Атомы второстепенных минералообразующих и примесных элементов статистически распределяются в унаследованной структуре платины, как бы растворяясь в ней. Подобными кристаллическими структурами обладают следующие минералы П. с.: твёрдые растворы Fe в Pt - поликсен (2,5-11,9 весового % Fe) и ферроплатина (12,0-28,1% Fe); lr в Pt - иридистая платина (10,4- 37,5% lr); Pd в Pt - палладистая платина (19,4-40,0% Pd); Sn и Pd в Pt - палладистая станноплатина (16-23% Sn и 17,2-20,9% Pd). Содержание примесей в минералах П. с. достигает: в поликсене - 8,8% lr, 6,8% Rh, 6% Pd, 3,3% Cu и 2,3% Ru; в ферроплатине - до 14,3% Ni, 14% Cu, 12,9% Pd, 7,5% lr, 5,8% Rh и 3% Bi; в иридистой платине - до 11% Os, 4% Pd и 2,5% Ru; в палладистой платине - до 3% Au; в палладистой станноплатине - до 2,5% Bi. Поликсен и ферроплатина с содержанием Rh свыше 4% называется родистой платиной, ферроплатина с содержанием свыше 7% Cu - медистой ферроплатиной или купроплатиной; ферроплатина, в которой более 3% Ni, называют иногда никелистой платиной. Ферроплатина и поликсен являются наиболее распространёнными минералами П. с. Кристаллизуются минералы П. с. в кубической системе, кристаллическая структура типа ,решётка гранецентрированная кубическая. Минералы П. с. непрозрачные, серо-стального и серебряно-белого цвета, с жёлтым оттенком у палладистой платины и бронзовым - у купроплатины; металлический блеск особенно сильный у иридистой платины. Выделения этих минералов (зёрна, сростки, кристаллы) часто покрыты с поверхности чёрной оксидной плёнкой, тонкой и хрупкой. Преобладающая часть выделений ферроплатины и поликсена и некоторые из выделений купроплатины обладают магнитными свойствами. Почти все минералы П. с. ковкие, исключая слабохрупкую иридистую платину. Твёрдость по минералогической шкале в пределах 3,5-5,5; минимальная у Cu- и Ni-содержащих минералов и максимальная у lr-содержащих минералов. Плотность от 13100 до 21500 кг/м 3,наименьшая - у ферроплатины (13100-16000 кг/м 3) и палладистой станноплатины, самая большая - у чистой природной платины. Минералы П. с. - хорошие проводники электричества. Обычны выделения минералов П. с. в виде зёрен неправильной формы, редких мелких кристаллов - прямоугольников, кубов, октаэдров, кубооктаэдров; изредка встречаются двойниковые сростки кристаллов и чрезвычайно редко - скатанные и угловатые (зернистые агрегаты). Размеры зёрен и кристаллов - от десятых долей и единиц микрона до нескольких мм,очень редко - единицы см,а самородков - до первых десятков смпри массе от нескольких гдо нескольких кг.Наиболее крупные в СССР самородки найдены в дунитах Нижнетагильского массива на Среднем Урале (самый большой из них 427,5 г) и в аллювиальных платиновых россыпях там же (9439 г). Самородки состоят не только из минералов П. с. - ферроплатины, поликсена, иридистой платины; они содержат также включения минералов иридия и осмия (см. ) .Крупные платиновые самородки (в сотни и тыс. г) охраняются государством. Минералы П. с. - эндогенные: их образование связано с позднемагматическими и метаморфическими стадиями формирования магматических месторождений и гидротермальной стадией образования постмагматических месторождений (в пегматитах, скарнах, гидротермальных жилах). В максимальной степени эти минералы концентрируются в месторождениях .Один из наиболее редких минералов П. с. - металлическая платина установлена среди продуктов распада природных твёрдых растворов Pt в lr в платиновых рудах, генетически связанных с форстеритовыми дунитами. Минералы П. с. - один из главных природных источников получения . Л. В. Разин. Платинель Платине'ль,общее название сплавов благородных металлов для электродов высокочувствительной (~39 мкв/°С) термопары. Состав сплава для положительного электрода 55% Pd, 31% Pt, 14% Au, для отрицательного - 65% Au, 35% Pd. Термопарой из сплавов П. можно длительно (в течение сотен и тысяч часов) измерять температуру до 1300 °С в окислительных и инертных средах, а также в сухом водороде. Градуировочная характеристика термопары при температурах 600-1300 °С практически совпадает с градуировочной характеристикой термопары ,поэтому термопара из сплавов П. обычно используется в комплекте с удлиняющими (компенсационными) проводами из хромеля и алюмеля, причём температура холодного спая термопары поддерживается на уровне 600-800 °С: это позволяет изготовлять электроды термопары очень небольшой длины. Термопара из сплавов П. предназначена главным образом для измерения и регулирования температур газовых потоков в газотурбинных двигателях. Платинирование Платини'рование,1) нанесение на поверхность металлических изделий тонкого слоя платины (толщиной 1-5 мкм) для повышения их коррозионной стойкости, отражательной способности, износостойкости, а также для обеспечения постоянства контактной электропроводности. Покрытия наносятся гальваническим способом (см. ) из фосфатных или (реже) диаминодинитритных электролитов, содержащих соли платины. Анодами служат тонкие платиновые листы, которые в процессе П. практически не растворяются. П. применяется при изготовлении специальной лабораторной и химической аппаратуры, платинированных анодов из титана (используемых, например, в производстве перекиси водорода), деталей (или узлов) электротехнических приборов (контактов из меди и её сплавов), молибденовой проволоки для электронных разрядных трубок, в ювелирной и часовой промышленности. 2) Пропитка гранул глинозёма платинохлористоводородной кислотой с последующим восстановлением платины; платинированный глинозём применяется в качестве катализатора при гидрировании непредельных углеводородов, изомеризации и переработке нефтяных продуктов ( ) .
Лит.:Лайнер В. И., Современная гальванотехника, М., 1967; Бондарев В. В., Новое в нанесении гальванопокрытий благородных металлов, М., 1970. В. В. Бондарев. Платинит Платини'т,биметаллическая проволока, состоящая из железо-никелевого сердечника (58% Fe, 42% Ni), покрытого тонким слоем меди (около 30% от общей массы проволоки). П. имеет коэффициент теплового расширения, близкий к коэффициенту теплового расширения платины (около 9Ч10 -6 град --1) ,и применяется взамен её в качестве токовводов в осветительные лампы и различные электровакуумные приборы для обеспечения герметичного соединения со стеклом. П. иногда называют также железо-никелевый сплав (54% Fe, 46% Ni), используемый в электровакуумной промышленности для соединения с керамикой (в СССР сплав марки 46H). Лит.:Любимов М. Л., Спаи металла со стеклом, 2 изд., М., 1968; Прецизионные сплавы с особыми свойствами теплового расширения и упругости, М., 1972. Платиновые металлы Пла'тиновые мета'ллы,платиноиды, химические элементы второй и третьей триад VIII группы периодической системы Менделеева. К ним принадлежат: рутений (Ruthenium) Ru, родий (Rhodium) Rh, палладий (Palladium) Pd (лёгкие П. м., плотность ~12 г/см 3) ;осмий (Osmium) Os, иридий (Iridium) lr, платина (Platinum) Pt (тяжёлые П. м., плотность ~22 г/см 3) .Серебристо-белые тугоплавкие металлы; благодаря красивому внешнему виду и высокой химической стойкости П. м. наряду с Ag и Au называют . Историческая справка. Имеются указания, что самородная платина в древности была известна в Египте, Эфиопии, Греции и Южной Америке. В 16 в. исп. обнаружили в Южной Америке вместе с самородным золотом очень тяжёлый белый тусклый металл, который не удавалось расплавить. Испанцы назвали его платиной - уменьшительным от исп. plata - серебро. В 1744 исп. морские офицер Антонио де Ульоа привёз образцы Pt в Лондон. Они вызвали живой интерес учёных Европы. Самостоятельным металлом Pt, которую первоначально считали белым золотом, была признана в середине 18 в. В 1803 английский учёный У. Х. Волластон обнаружил в самородной платине палладий, получивший это название от малой планеты Паллады (открытой в 1802), и родий, названный так по розовато-красному цвету его солей (от греч. rhуdon - роза). В 1804 английский химик Смитсон Теннант в остатке после растворения самородной Pt в царской водке открыл ещё 2 металла. Один из них получил название иридий вследствие разнообразия окраски его солей (от греч. нris, род. падеж нridos - радуга), другой был назван осмием по резкому запаху его четырёхокиси (от греч. osmб - запах). В 1844 К. К. при исследовании остатков от аффинажа (очистки) уральской самородной Pt в Петербургском монетном дворе открыл ещё один П. м. - рутений (от позднелат. Ruthenia - Россия). С. А. Погодин. Распространение в природе. П. м. принадлежат к наиболее редким элементам, их среднее содержание в земной коре (кларки) точно не установлено, ориентировочные значения приведены в таблице. Самые редкие в земной коре - Rh и lr (1Ч10 -7% по массе), наиболее распространён Os (5Ч10 -6%). Содержание П. м. повышено в ультраосновных и основных изверженных породах, происхождение которых связано с глубинными магматическими процессами. К этим породам приурочены месторождения П. м. Ещё выше среднее содержание П. м. в каменных метеоритах, которые считаются аналогами средней мантии Земли (кларки П. м. в каменных метеоритах составляют nЧ10 -4 - nЧ10 -5% по массе). Для земной коры характерно самородное состояние П. м., а у Rh, Pd, Os и Pt известны также немногочисленные соединения с серой, мышьяком и сурьмой. Установлено около 30 минералов П. м., больше всего их у Pd (13) и Pt (9). Все минералы образовались на больших глубинах при высоких температурах и давлениях (см. , ) .Платина и другие П. м. встречаются в виде примеси во многих сульфидах и силикатах ультраосновных и основных пород. Геохимия П. м. в биосфере почти не изучена, их содержание в гидросфере и живом веществе не установлено. Некоторые осадочные марганцевые руды обогащены Pt (до 1Ч10 -3%) ,в углях наблюдалась концентрация Pt и Pd (1Ч10 -6%); повышенное содержание П. м. отмечалось в фосфоритах (вятских), в золе деревьев, растущих на месторождениях Pt. А. И. Перельман. Физические и химические свойства. Физические и механические свойства П. м. сопоставлены в таблице. В дополнение необходимо указать, что Ru и Os очень тверды и хрупки (возможно вследствие присутствия примесей). Rh и lr обладают меньшими твёрдостью и хрупкостью, а Pd и Pt ковки, поддаются прокатке, волочению, штамповке при комнатной температуре. Интересна способность некоторых П. м. (Ru, Pd, Pt) поглощать водород. Особенно это свойственно Pd, объём которого поглощает до 900 объёмов H 2. При этом Pd сохраняет металлический вид, но растрескивается и становится хрупким. Все П. м. парамагнитны. Магнитная восприимчивость c sЧ10 -6электро-магнитных единиц при 18 °С равна 0,05 у Os; 0,50 у Ru; 5,4 у Pd; у Rh, lr и Pt она несколько более 1,0. Согласно давно установившейся традиции, П. м. принято помещать в VIII группу .В соответствии с этим следовало ожидать, что все П. м. должны иметь высшую степень окисления +8. Однако это наблюдается только у Ru и Os, прочие же П. м. проявляют валентность не выше +6. Объясняется это тем, что у атомов Ru и Os остаются незаполненными соответственно внутренние подуровни 4fи 5f. Поэтому для атомов Ru и Os возможно возбуждение не только с подуровней 5sи 6s на подуровни 5pи 6p,но и с подуровней 4dи 5dна подуровни 4fи 5f. Вследствие этого в атомах Ru и Os появляется по 8 непарных электронов и валентность +8. Электронные конфигурации атомов Rh, lr, Pd, Pt такой возможности не допускают. Поэтому в некоторых вариантах таблицы Менделеева эти элементы (а также Со и Ni) выносят за пределы VIII группы. Все П. м. легко образуют ,в которых имеют различные степени окисления и различные координационные числа. Комплексные соединения П. м., как правило, окрашены и очень прочны. Химические свойства П. м. имеют много общего. Все они в компактном виде (кроме Os) малоактивны. Однако в виде т. н. черни (мелкодисперсного порошка) П. м. легко адсорбируют S, галогены и др. неметаллы. (Чернь обычно получают восстановлением П. м. из водных растворов их соединений.) Компактные Ru, Rh, Os, lr, будучи сплавлены с Pt, Zn, Pb, Bi, переходят в раствор при действии царской водки, хотя она не действует на эти П. м., взятые отдельно. Семейство П. м. можно разделить на 3 диады (двойки), образованные двумя стоящими один под другим лёгким и тяжёлым П. м., а именно: Ru, Os; Rh, lr; Pd, Pt. При нагревании с O 2и сильными окислителями Ru и Os образуют легкоплавкие кристаллы - четырёхокиси (тетроксиды) - оранжевую RuO 4и желтоватую OsO 4. Оба соединения летучи, пары их имеют неприятный запах и весьма ядовиты. При действии восстановителей превращаются в низшие окислы RuO 2и OsO 2 или в металлы. Со щелочами RuO 4образует рутенаты, например рутенат калия K 2RuO по реакции: RuO 4+ 2KOH = K 2RuO 4+ 1/ 2O 2+ H 2O. При действии хлора K 2RuO 4превращается в перрутенат калия: K 2RuO 4+ 1/ 2Cl 2= KRuO 4+ KCI. Четырёхокись OsO 4даёт с KOH комплексное соединение K 2[OsO 4(OH) 2]. С фтором и др. галогенами Ru и Os легко реагируют при нагревании, образуя соединения типа RuF 3, RuF 4, RuF 5, RuF 6. Осмий даёт подобные же соединения, кроме OsF 3; существование OsF 8не подтверждено. Весьма интересны комплексные соединения Ru с Xe [RuF 6] (канадский химик Н. Бартлетт, 1962), а также с молекулярным азотом - [(NO)(NH 3) 4N 2Ru (NH 3) 4NO] CI (советский химик Н. М. Синицын, 1962) и [Ru (NH 3) 5N 2] Cl 2(канадский химик А. Аллен, 1965). На компактные Rh и lr царская водка не действует. При прокаливании в O 2 образуются окислы Rh 2O 3и Ir 2O 3, разлагающиеся при высоких температурах. Pd легко растворяется при нагревании в HNO 3и концентрированной H 2SO 4с образованием нитрата Pd (NO 3) 2и сульфата PdSO 4. На Pt эти кислоты не действуют. Царская водка растворяет Pd и Pt, причём образуются комплексные кислоты - тетрахлоропалладиевая кислота H 2[PdCl 4] и гексахлороплатиновая - коричнево-красные кристаллы состава H 2[PtCl 6]Ч6H 2O Из её солей наибольшее значение для технологии П. м. имеет хлороплатинат аммония (NH 4) 2[PtCl 6] - светло-жёлтые кристаллы, малорастворимые в воде и почти не растворимые в концентрированных растворах NH 4CI. При прокаливании они разлагаются по реакции:
При этом Pt получается в мелкораздробленном виде (т. н. платиновая губка, или губчатая платина). Получение. Разделение П. м. и получение их в чистом виде очень сложно вследствие большого сходства их химических свойств; это требует большой затраты труда, времени, дорогих реактивов. Для получения чистой Pt исходные материалы - самородную платину, платиновые шлихи (тяжёлые остатки от промывки платиноносных песков), лом (негодные для употребления изделия из Pt и её сплавов) обрабатывают царской водкой при подогревании. В раствор переходят: Pt, Pd, частично Rh, lr в виде комплексных соединений H 2[PtCl 6], H 2[PdCl 4], Н з[RhCl 6] и H 2[IrCl 6], а также Fe и Cu в виде FeCl зи CuCl 2. Нерастворимый в царской водке остаток состоит из осмистого иридия, хромистого железняка (FeCrO 2), кварца и др. минералов. Из раствора осаждают Pt в виде (NH 4) 2[PtCl 6] хлористым аммонием. Но чтобы в осадок вместе с Pt не выпал lr в виде аналогичного нерастворимого соединения (NH 4) 2[lrCl 6] (остальные П. м. NH 4Cl не осаждает), предварительно восстанавливают Ir (+4) до Ir (+3) (например, прибавлением сахара C 12H 22O 11по способу И. И. ) .Соединение (NH 4) 3[IrCl 6] растворимо и не загрязняет осадка. Хлороплатинат аммония отфильтровывают, промывают концентрированным раствором NH 4CI (в котором осадок практически не растворим), высушивают и прокаливают. Полученную губчатую платину спрессовывают, а затем оплавляют в кислородно-водородном пламени или в электрической печи высокой частоты. Из фильтрата, оставшегося после осаждения (NH 4) 2[PtCl 6], и из осмистого иридия извлекают прочие П. м. путём сложных химических операций. В частности, для перевода в растворимое состояние нерастворимых в царской водке П. м. и осмистого иридия используют спекание с перекисями BaO 2или Na 2O 2. Применяют также хлорирование - нагревание смеси Pt-концентратов с NaCl и NaOH в струе хлора. В результате аффинажа получают труднорастворимые комплексные соединения: гексахлорорутенат аммония (NH 4) 3[RuCl 6], дихлорид тетрамминдиоксоосмия [OsO 2(NH 3) 4] Cl 2, хлорпентамминдихлорид родия [Rh (NH 3) 5CI] Cl 2, гексахлороиридат аммония (NH 4) 2[lrCl 6] и дихлордиаммин палладия [Pd (NH 3) 2] Cl 2. Прокаливанием перечисленных соединений в атмосфере H 2получают П. м. в виде губки, например [OsO 2(NH 3) 4] Cl 2+ 3H 2= Os + 2H 2O + 4NH 3+ 2HCI [Pd (NH 3) 2] Cl 2+ H 2= Pd + 2NH 3+ 2HCI. Губчатые П. м. сплавляют в вакуумной электрической печи высокой частоты. Применяют и др. способы аффинажа, в частности основанные на использовании . Основным источником получения П. м. служат сульфидные медно-никелевые руды, месторождения которых находятся в СССР (Норильск, Красноярский край), Канаде (округ Садбери, провинция Онтарио), ЮАР и др. странах. В результате сложной металлургической переработки этих руд благородные металлы переходят в т. н. черновые металлы - нечистые и .П. м. собираются почти полностью в черновом Ni, a Ag и Au - в черновой Cu. При последующем электролитическом рафинировании Ag, Au и П. м. осаждаются на дне электролитической ванны в виде шлама, который отправляют на аффинаж. Свойства платиновых металлов
|
||||||||||||||||||||||||||||||||||||||||||||||||||
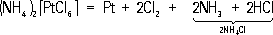
 (при 20 °С)
(при 20 °С)