 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Азимов Айзек :: Раззаков Федор :: Чехов Антон Павлович :: Грин Александр :: Горький Максим :: Борхес Хорхе Луис :: Сименон Жорж :: Андреев Леонид Николаевич Популярные книги:: Ожерелье Иомалы :: Магия луны (Том 1) :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: Ночной орёл :: О «Двух душах» М. Горького :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер |
Большая Советская Энциклопедия (ОК)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ОК) - Чтение (стр. 7)
Классификация организмов по источнику энергии и восстанавливающих эквивалентов
Основной путь использования энергии, освобождающейся при О. б., - накопление её в молекулах аденозинтрифосфорной кислоты (АТФ) и др. . О. б., сопровождающееся синтезом АТФ из аденозиндифосфорной кислоты (АДФ) и неорганического фосфата, происходит при , окислении a-кетоглутаровой кислоты и при переносе ВЭ в цепи окислительных (дыхательных) ферментов, обычно называют (см. схему ). В процессе дыхания углеводы, жиры и белки подвергаются многоступенчатому окислению, которое приводит к восстановлению основных поставщиков ВЭ для дыхательных флавинов, (НАД), (НАДФ) и . Восстановление этих соединений в значительной мере осуществляется в , которым завершаются основные пути окислительного расщепления углеводов (оно начинается с гликолиза), жиров и аминокислот. Помимо цикла трикарбоновых кислот, некоторое количество восстановленных - ФАД ( ) и НАД - образуется при окислении жирных кислот, а также при окислительном дезаминировании глутаминовой кислоты (НАД) и в (восстановленный НАДФ). Соотношение и локализация различных механизмов О. б.В расчёте на 1 молекулу глюкозы гликолиз даёт 2 молекулы АТФ, а фосфорилирование в дыхательной цепи - 34 молекулы АТФ. Гликолиз, цикл трикарбоновых кислот и дыхательная цепь функционируют, по-видимому, в клетках всех . Окисление жирных кислот у позвоночных поставляет половину энергии, потребляемой печенью, почками, мышцей сердца и покоящимися скелетными мышцами; в клетках мозга оно практически не происходит. Окисление по пентозофосфатному пути активно в печени и лактирующих молочных железах, но незначительно в сердечной и скелетных мышцах. В жидкой фазе цитоплазмы растворены все ферменты гликолиза. Внутренние мембраны , мембраны (тилакоидов) и клеточные мембраны бактерий содержат фосфорилирующие цепи переноса электронов. В матриксе митохондрий локализовано окисление жирных кислот, ферменты цикла трикарбоновых кислот и глутаматдегидрогеназа. Во внутренней мембране митохондрий находятся ферменты, окисляющие янтарную и b-оксимасляную кислоты, во внешней - ферменты, участвующие в обмене аминокислот: и кинуренингидроксилаза. В особых органоидах клетки, т. н. пероксисомах, или микротельцах, вклад которых в суммарное поглощение О 2может достигать в печени 20%, находится флавиновая оксидаза, окисляющая аминокислоты, гликолевую кислоту и др. субстраты с образованием перекиси водорода, которая затем разлагается или используется в реакциях окисления. В мембранах эндоплазматической сети клетки локализованы гидроксилазы и оксигеназы, организованные в короткие нефосфорилирующие цепи переноса электронов. Окислительные реакции не всегда сопровождаются накоплением энергии; в ряде случаев они несут функции превращения веществ (например, окисление при образовании жёлчных кислот, стероидных гормонов, на путях превращения аминокислот и др.). При окислении происходит обезвреживание чужеродных и ядовитых для организма веществ (ароматических соединений, недоокисленных продуктов дыхания и др.). О. б., не сопряжённое с накоплением энергии, называется свободным окислением. Его энергетический эффект - образование тепла. По-видимому, система переноса электронов, осуществляющая окислительное фосфорилирование, способна переключаться на свободное окисление при увеличении потребности организма в тепле (у ). Механизм использования энергии окисления. Долгое время оставался неясным вопрос о механизме преобразования энергии, освобождающейся при переносе ВЭ по цепи окислительных ферментов. Согласно т. н. хемиосмотической теории, развитой в 60-х гг. 20 в. (английский биохимик П. Митчелл и др.), энергия сначала используется для создания электрического поля («+» с одной стороны мембраны и «–» с другой) и разности концентраций ионов Н +по разные стороны мембраны. Оба фактора (электрическое поле и разность концентраций) могут служить движущей силой для действия фермента АТФ-синтетазы, осуществляющей синтез АТФ. Часть энергии поля может быть прямо использована клеткой для переноса ионов через мембрану, восстановление переносчиков электронов, образования тепла без промежуточного участия АТФ. Эволюция энергообеспечения в живой природе. Древнейшие организмы, как полагают, существовали в первичной бескислородной атмосфере Земли и были и . Обеспечение клеток энергией шло за счёт процессов типа гликолиза. Возможно, существовал механизм окисления, известный у некоторых современных микроорганизмов: ВЭ передаются через дыхательную цепь на нитрат (NO – 3) или на сульфат (SO – – 4). Принципиально важным этапом оказалось возникновение у древних одноклеточных организмов механизма фотосинтеза, с которым связывают появление кислорода в атмосфере Земли. В результате стало возможным использование O 2, обладающего высоким окислительно-восстановительным потенциалом, в качестве конечного акцептора электронов в дыхательной цепи. Реализация этой возможности произошла при появлении специального фермента - , восстанавливающей О 2, и привела к возникновению биохимического дыхательного аппарата современного типа. Обеспечение энергией у всех аэробов (их клетки содержат митохондрии) основано на таком дыхании. Вместе с тем клетки сохранили ферментный аппарат гликолиза. Образуемая в ходе последнего пировиноградная кислота окисляется далее в цикле трикарбоновых кислот, который, в свою очередь, питает дыхательную цепь электронами. Т. о., эволюция энергетического обмена шла, по-видимому, по пути использования и надстройки уже имевшихся ранее механизмов энергообеспечения. Наличие в клетках ныне существующих организмов биохимических систем гликолиза (в цитоплазме), дыхания (в митохондриях), фотосинтеза (в хлоропластах), а также поразительное сходство механизмов превращения энергии в этих органеллах и в микроорганизмах нередко рассматривают как свидетельство возможного происхождения хлоропластов и митохондрий от древних микроорганизмов-симбионтов. См. также , , , , , и лит. при этих статьях. Лит.:Ленингер А., Превращение энергии в клетке, в кн.: Живая клетка, пер. с англ., М., 1962; Скулачев В. П., Аккумуляция энергии в клетке, М., 1969; его же, Трансформация энергии в биомембранах, М., 1972; Малер Г. и Кордес Ю., Основы биологической химии, пер. с англ., М., 1970, гл. 15; Леви А., Сикевиц Ф., Структура и функции клетки, пер. с англ., М., 1971, гл. 12; Ясайтис А. А., Превращение энергии в митохондриях, М., 1973; Ленинджер А., Биохимия, пер. с англ., М., 1974. С. А. Остроумов. 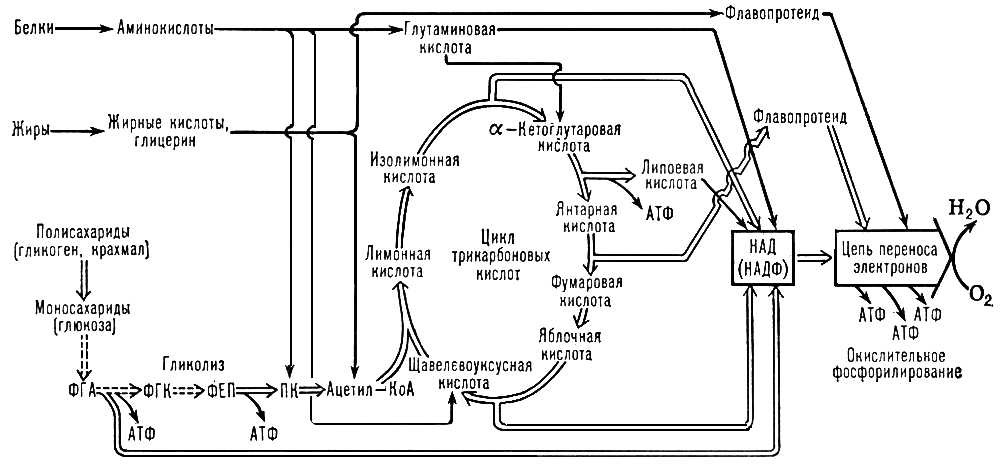
Пути образования АТФ при хемоорганотрофном типе энергетического обмена. ФГА - 3-фосфоглицериновый альдегид; ФГК - 3-фосфоглицериновая кислота; ФЕП - фосфоенолпировиноградная кислота; ПК - пировиноградная кислота; Ацетил-КоА - ацетил-кофермент А. Количественные соотношения отдельных путей биологического окисления показаны одинарными и двойными стрелками. Окисление металлов Окисле'ние мета'ллов, реакция соединения металла с кислородом, сопровождающаяся образованием окислов (оксидов). В более широком смысле О. м. - реакции, в которых атомы теряют электроны и образуются различные соединения, например хлориды, сульфиды и т.п. В природе металлы находятся почти исключительно в окисленном состоянии (в виде руд), поэтому их производство основано на процессах восстановления различных соединений. Металлы и сплавы, используемые на практике, вследствие воздействия окружающей среды подвергаются постепенному окислению - . Направление процессов О. м. определяется как термодинамическим фактором - изменением свободной энергии при реакции, так и кинетическим - скоростью её протекания, которая в значительной степени зависит от природы продуктов окисления и характера их взаимодействия с металлом. При производстве металлургической продукции О. м. может привести к образованию , потере ценных легирующих элементов и железа. В ряде же случаев проводят преднамеренное О. м. в защитных или декоративных целях (см. ). Окисления степень Окисле'ния сте'пень, то же, что . Окислительно-восстановительные реакции Окисли'тельно-восстанови'тельные реа'кциив организме, биохимические процессы, при которых происходит перенос электрона или атома водорода (иногда с сопровождающими его атомами или группами) от одной молекулы (окисляемой) к другой (восстанавливаемой). О.-в. р. катализируются ферментами . Энергия, выделяющаяся при некоторых О.-в. р., запасается в химических связях молекул аденозинтрифосфорной кислоты (АТФ) и др. . К О.-в. р. относятся реакции , реакции переноса электронов при , , и , реакции окисления и синтеза жирных кислот и многие др. процессы, протекающие в любой живой клетке. См. . Окислительно-восстановительный потенциал Окисли'тельно-восстанови'тельный потенциа'л, равновесный , характеризующий данную электролитическую среду. О.-в. п. при постоянной температуре зависит только от состава среды и может быть сообщен ею погруженному в неё электронному проводнику (электроду), если между средой и электродом не нарушен электронный обмен. О.-в. п. устойчив, если среда содержит заметные количества окислителя и восстановителя (см. ), причём первый есть продукт окисления второго. Простейший пример - ионы окисного и закисного железа: Fe 3 +- ионы могут захватывать из металла электроны, превращаясь в Fe 2 +- ионы, способные к обратной реакции; потенциал, при котором эти реакции динамически уравновешивают друг друга, и есть О.-в. п. Чем сильнее окислительная способность среды, тем он выше. Величины О.-в. п. используются при решении ряда задач в электро-, био- и аналитической химии. Как и величины , они отсчитываются от условного нуля (потенциала нормального ). Окислительное фосфорилирование Окисли'тельное фосфорили'рование, осуществляющийся в живых клетках синтез молекул аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной (АДФ) и фосфорной кислот за счёт энергии окисления молекул органических веществ (субстратов). В результате О. ф. в клетках накапливается АТФ - важнейшее , расходуемое затем на обеспечение энергией различных процессов жизнедеятельности. Основные субстраты О. ф. - органические кислоты, образующиеся в . О. ф. было открыто в 1930 советским биохимиком В. А. Энгельгардтом. В 1939 В. А. Белицер и Е. Т. Цыбакова показали, что О. ф. сопряжено с переносом электронов по цепи дыхательных ферментов, встроенных (как было установлено позднее) во внутреннюю мембрану . Электроны поступают в дыхательную цепь от восстановленного (НАД · Н) или (НАДФ · Н) и через кофермент Q (см. схему ) последовательно передаются от соединений с более отрицательным окислительно-восстановительным потенциалом к соединениям с более положительным потенциалом. Перенос электронов по цепи завершается восстановлением О 2с помощью сложного ферментного комплекса - цитохромоксидазы. Т. о., процесс окисления субстрата кислородом опосредован серией окислительно-восстановительных реакций; в результате каждой из этих реакций энергия, запасённая в молекуле окисляемого субстрата, освобождается небольшими порциями, что позволяет клетке использовать её более полно. Утилизация высвобождаемой энергии происходит в т. н. пунктах энергетического сопряжения. Синтез АТФ из АДФ и фосфата осуществляется ферментным комплексом АТФ-синтетазой (который может катализировать и обратную реакцию - расщепление АТФ). Эффективность О. ф. оценивают с помощью отношения Р/О, т. е. количества фосфата, связанного при фосфорилировании АДФ, отнесённого к поглощённому О 2. Одна молекула АТФ образуется при переносе 2 электронов через пункт энергетического сопряжения. Р/О при окислении НАД · Н равно 3, янтарной кислоты - 2. См. также , , и лит. при этих статьях. С. А. Остроумов. 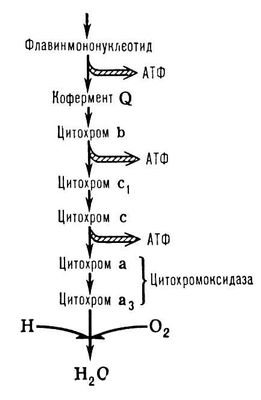
Упрощённая схема цепи дыхательных ферментов, локализованных в митохондриях. Перенос электронов по цепи на трёх этапах (т. н. пунктах сопряжения) сопровождается запасанием выделяющейся энергии, т. е. синтезом АТФ из АДФ и фосфата (показано толстыми стрелками). Окислительное число Окисли'тельное число', степень окисления, численная величина электростатического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. О. ч. атома водорода в соединениях с неметаллами условно принято равным +1. Правила расчёта О. ч. даны в статьях , . В химии понятие «О. ч.» используется при составлении уравнений окислительно-восстановительных реакций, при классификации неорганических соединений, в особенности координационных (см. ), где применение обычных классических определений валентности вызывает затруднения. О. ч. в ряде случаев не совпадает ни с валентностью (например, в органических соединениях углерод всегда четырёхвалентен, а О. ч. атома С в соединениях CH 4, CH 3OH, HCOOH соответственно равно –4, –2 и +2), ни с фактическим числом электронов, которые участвуют в образовании связей. В случае атомов, близких по , возникает неопределённость, к какому из них сдвигается электронная пара. Например, в молекуле CS 2электроотрицательность атомов углерода и серы практически одинакова и О. ч. атомов С и S может быть +4 и –2 или –4 и + 2 соответственно (значения электроотрицательностей см. в табл. к ст. ). Окислы О'кислы, оксиды, соединения химических элементов с кислородом. По химическим свойствам все О. делятся на солеобразующие (например, Na 2O, MgO, Al 2O 3, SiO 2, P 2O 5, SO 3, Cl 2O 7) и несолеобразующие (например, СО, N 2O, NO, H 2O). Солеобразующие О. подразделяются на основные, кислотные и амфотерные (их гидроокиси являются соответственно , или проявляют ). Химическая функция О. определяется положением окисленных элементов в Д.И. Менделеева. (О названиях О. см. .) Многие О. встречаются в природе: вода H 2O, углекислый газ СО 2, кремнезём SiO 2(главная составная часть горных пород) и др. Некоторые природные О. ( , и др.) служат главным сырьём для получения соответствующих металлов. О. широко применяют в технике, например негашёную CaO - в строительном деле, NO 2, SO 2- в производстве азотной и серной кислот. Окислы природные
О'кислы приро'дные, группа минералов, представляющих собой природные химические соединения элементов с кислородом, с гидроксильной группой (т. и. гидроокислы или гидроксиды), а также с О и OH вместе (т. н. оксигидраты). В качестве катионов в составе О. п. участвует до 40 элементов; главные из них относятся к
(Si, Ti, Nb, Ta, Mn, Al, Mg, Sn, Zr и др.), однако известны многие минералы О. п.
и
, Среди О. п. выделяют простые окислы (например,
,
CuO
2,
AlO
3,
Fe
2O
3,
SnO
2); сложные окислы, смешанные окислы изодесмического типа, кристаллические структуры которых состоят из одного или двух атомов металла с различной степенью окисления и кислорода (например,
Лит.:Минералы т 2 в 2-3, М., 1965-1967; Поваренных А. С., Кристаллохимическая классификация минеральных видов, К., 1966. Г. П. Барсанов. Окиснортутный элемент Окиснорту'тный элеме'нт, гальванический элемент, у которого активная масса отрицательного электрода представляет собой Zn, In или Cd, активная масса положительного электрода приготавливается из красной окиси ртути и графита, а электролитом служит раствор едкого кали (в некоторых конструкциях используется пастообразный электролит). О. э. с жидким электролитом были известны ещё в 80-х гг. 19 в., но их массовое изготовление и широкое использование стали возможны лишь с 40-х гг. 20 в. благодаря усовершенствованию конструкции и технологии производства. Наиболее распространены О. э. типа ХРЦ (ртутно-цинковый, активная масса отрицательного электрода - цинк высокой чистоты); начальное напряжение 1,25-1,35 в, конечное напряжение ~1,0 в; ёмкость 0,01-14,0 а·ч; масса 0,2-170 г). О. э. отличаются стабильностью напряжения, высокой сохраняемостьо, механической прочностью, сравнительно малыми размерами. Их применяют в качестве источников опорного напряжения в измерительных приборах, источников питания малогабаритной радиоаппаратуры, слуховых аппаратов, медицинских приборов, в кинофотоаппаратуре, электрочасах и т.д. (см. ). Лит.:Рогинский В. Ю..Современные источники питания, Л., 1969; Орлов В. А., Малогабаритные источники тока, 2 изд., М., 1970. Окичоби Окичо'би(Okeechobee), озеро на полуострове Флорида, в США. Площадь около 2,6 тыс. км 2, глубина до 6 м. Берега заболочены и частично обвалованы. Годовые колебания уровня до 1 м. В озеро впадает р. Киссимми; сток - по каналам, сооруженным для регулирования стока и осушения, которые соединяют О. с Атлантическим океаном и с р. Калусахатчи, впадающей в Мексиканский залив. Рыболовство; туризм. На южном берегу О. - г. Клуистон и резервация индейцев-семинолов. Окказионализм Окказионали'зм(от лат. occasio, род. падеж occasionis - случай, повод), направление в западно-европейской философии 17 в., идеалистически решавшее поставленный дуалистической философией Р. вопрос о взаимоотношении души и тела. Представителями О. являлись И. Клауберг, А. , Н. и др. Неспособность картезианского дуализма (см. ) объяснить факты воздействия души на тело и на оборот (см. ) послужила исходным пунктом О., утверждавшего принципиальную невозможность взаимодействия души и тела. То, что представляется телесной причиной какой-либо мысли или волевого акта, в действительности, по учению О., есть не более чем «повод» для истинной «действующей» причины, какой может быть только бог. Взаимодействие тела и духа О. объявлял результатом непрерывного «чуда» - прямого вмешательства божества в каждом отдельном случае. Идеалистическую переработку картезианства завершил Мальбранш, который выступил с утверждением невозможности влияния не только тела на душу, но и тела на тело. В философии Г. О. был переработан в учение о предустановленной гармонии. Лит.:Введенский А. И. Декарт и окказионализм, Берлин - П. - М., 1922; Быховский Б. Э., Философия Декарта, М. - Л., 1940, с. 138-48; Lenoble R., Mersenne ou la naissance du mecanisme, P., 1943 (отрывки из соч. окказионалистов и лит.); Balz A., Cartesion studies, N. Y., 1951; Callot E., Problйemes du cartesianisme, Cardet-Annecy, 1956. В. В. Соколов. Оккам Уильям О'ккам(Ockham, Occam) Уильям (около 1285, Оккам, графство Суррей, - 1349, Мюнхен), английский философ, логик и церковно-политический писатель, представитель поздней . Монах-францисканец. Учился и преподавал в Оксфорде. В 1323 в связи с обвинением в ереси был вызван папой Иоанном XXII в Авиньон, где находился в течение 4 лет. Активно поддерживал главу францисканского ордена Михаила из Цезены в его споре с папой. С 1328 жил в Мюнхене при дворе противника папы императора Людвига Баварского, которому О., по преданию, сказал: «Защищай меня мечом, а я буду защищать тебя пером». Как политический писатель О. выступал против претензий папы на светскую власть, против абсолютизма церковной и светской власти; отстаивал принцип «евангелической бедности», предвосхитив во многом идеи Реформации. О. был главным представителем 14 в. Считая, что реальным существованием обладают только единичные субстанции и их абсолютные свойства, О. полагал, что вне мышления т. н. универсалии суть только имена, термины, обозначающие классы имён: термины первой и второй . Терминам первой интенции соответствуют науки «реальные» (о реальных предметах), терминам второй интенции - «рациональные» (логика, грамматика и т.п.). О. был одним из крупнейших логиков средневековья (см. , раздел История логики). В частности, ему принадлежит идея о том, что значение термина всецело определяется его функцией в высказывании; в разработанной им теории консеквенции он фактически различал материальную и формальную импликацию, сформулировал для конъюнкции и дизъюнкции. Первичным познанием, по О., является интуитивное, которое включает внешние восприятия и интроспекцию. Понятия, не сводимые к интуитивному знанию и не поддающиеся проверке в опыте, должны быть удалены из науки: «сущности не следует умножать без необходимости». Этот принцип, получивший название «бритвы О.», сыграл важную роль в борьбе против средне-векового , теории «скрытых качеств» и т.п. Считая, что между единичными субстанциями не может существовать необходимой связи, О. ограничивал применение понятия причинности сферой эмпирических констатаций. О. выступал за разделение сфер философии и теологии (см. ), догматы религии - сверхразумные предписания, относящиеся не к разуму, а к вере и воле. Причём воле О., как и , отдавал приоритет перед разумом. О. оказал значительное влияние на последующее развитие логики и философии, особенно на Ж. , Николая из Отрекура и Т. . Соч.: Opera philosophica et theologica, ed. S. Brown, v. 1-2, St. Bonaventura (N. Y.), 1967-70; Opera politica. Accuraverunt J. G. Sнkes, R. F. Bennett, H. S. Offler, v. 1-3, Manchester, 1940-63. Лит.:Abbagnano N., Guglieimo di Ockham, Lanciano, [1931];, Hochstetteг E., Studien zur Metaphysik und Erkenntnislehre W. von Ockham, B. - Lpz., 1927; Martin G., W. v. Ockham, B., 1949; Baudry L., Guillaume d’Occam. Sa vie, ses oeuvres, ses idйes sociales et politiques, v. 1, P., 1949 (имеется лит.); Moody E. A., The logic of William of Ockham, N. Y., 1965. Г. Г. Майоров. Окклюзия Окклю'зия(позднелат. occlusio - запирание, скрывание, от лат. occludo - запираю, закрываю), поглощение вещества из газовой среды твёрдыми телами или расплавами. При О. газы поглощаются не поверхностным слоем, а всем объёмом поглотителя. В этом смысле О. подобна - растворению газов в жидкостях. Наиболее характерна О. газов металлами, например водорода металлами VIII группы периодической системы элементов. Так, при комнатной температуре 1 объём иридия поглощает более 800, а палладия - более 700 объёмов водорода. Окклюдированный газ даёт с металлами твёрдый раствор; иногда часть поглощённого газа образует с ними химические соединения (гидриды, нитриды и др.). Оккультизм Оккульти'зм(от лат. occultus - тайный, сокровенный), общее название учений, признающих существование скрытых сил в человеке и космосе, недоступных для обычного человеческого опыта, но доступных для «посвященных», прошедших через особую и специальную психическую тренировку. При этом цель ритуала посвящения, нередко связанного с психическими потрясениями, переживанием смерти и «нового рождения», усматривается в достижении «высшей ступени» сознания и нового видения мира, открывающего доступ к т. н. «тайным знаниям» - воздействию или контролю над скрытыми силами природы и человека. В философском плане О. ближе всего к и , рассматривающим мир как некий одухотворённый организм, все силы которого находятся в непрестанном динамическом взаимодействии. Объём и содержание понятия О., как и его роль, изменялись на протяжении истории; на разных этапах развития культуры он вступал в сложные взаимоотношения с наукой, философией, религией, искусством. Ряд явлений, прежде считавшихся чисто оккультными (например, магнетизм в эпоху Возрождения, гравитация в астрологии, гипнотизм в 18 в.), позднее отошли в сферу науки. О. представляет интерес для исторической психологии и психопатологии, часто отражая такие стороны древнего мировоззрения, которые не находят отражения в каких-либо др. источниках. Собрания гороскопов оказались ценным источником для исследования экономической и политической истории. Особый интерес изучение О. имеет для ранней истории естественных наук и медицины; оккультные учения о всеобщих скрытых связях явлений и о человеке как микрокосме сыграли в 14-16 вв. видную роль в развитии наблюдательных и экспериментальных методов. Однако большая часть т. н. оккультных явлений отвергается наукой, как не находящая себе места в современной научной картине мира. Антагонизм О. и науки связан и с тем, что О. основан на нерасчленённом и иррациональном типе мышления, восходящем к древнему и , не допускающем разделения объективной и субъективной сферы. О. представляет собой, т. о., антипод, противоположность научному мышлению. В религиях Древнего Востока, античных мистериях и тайных культах О. совпадал с эсотеризмом - сферой тайных знаний, доступных лишь посвященным. С этим связано древнее деление наук на изучающие внешнюю (экзотерическую) и внутреннюю сторону вещей; начатки научных знаний получали при этом сакральный характер (как «тайны природы»). Впервые в самостоятельную сферу, не связанную какой-либо религиозной системой, О. выделяется в эпоху поздней античности на базе эллинистического религиозного синкретизма. В 1-4 вв. в Александрии создаётся обширная оккультная литература, называющаяся герметической (по имени легендарного основателя О. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 |
|||||||||||||||
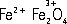 ,
Fe
2+Ti
4+O
3и др.); своеобразную группу представляют соединения с Nb, Ta, Ti [напр.,
(Fe, Mn)
2+(Ta, Nb)
2
5++O
6, браннерит
,
Fe
2+Ti
4+O
3и др.); своеобразную группу представляют соединения с Nb, Ta, Ti [напр.,
(Fe, Mn)
2+(Ta, Nb)
2
5++O
6, браннерит
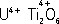 ,
CaTiO
3]; гидроокислы [например,
Mg (OH)
2, гиббсит Al (OH)
3]; оксигидраты - более сложные соединения с гидроксильной группой и кислородом (например,
AlO (OH); иногда в их кристаллической структуре водород образует протон Н
+с координационным числом 2, располагающийся обычно между двумя кислородами (например, в
FeOOH,
AlOOH). В некоторых О.п. в виде твёрдого раствора присутствует молекулярная вода (например, гидрогётит FeOOH·nH
2O). Кристаллические структуры многих О. п. являются координационными (типа корунда, NaCI,
и др.), цепочечными (типа
и др.), каркасными (типа
,
и др.). Условия образования О. п. главным образом связаны с процессами гипергенеза и
на поверхности суши и в прибрежных мелководных зонах. Характерная геохимическая обстановка - богатая водой и кислородом среда с высоким окислительным потенциалом. В результате
гидроокислы переходят в простые или сложные окислы (например, бурые железняки в гематит и магнетит, диаспор - бёмит в корунд). При застывании магмы и кристаллизации минералов из остаточных расплавов и растворов в
, гидротермальных жилах и др. также образуется ряд простых или сложных О. п. (например, хромиты, магнетиты, ильмениты, касситерит, уранинит, колумбит). Многие О. п. являются ценными рудными и нерудными полезными ископаемыми (например, окисные руды Mn, Fe, Al и др.). См. также
.
,
CaTiO
3]; гидроокислы [например,
Mg (OH)
2, гиббсит Al (OH)
3]; оксигидраты - более сложные соединения с гидроксильной группой и кислородом (например,
AlO (OH); иногда в их кристаллической структуре водород образует протон Н
+с координационным числом 2, располагающийся обычно между двумя кислородами (например, в
FeOOH,
AlOOH). В некоторых О.п. в виде твёрдого раствора присутствует молекулярная вода (например, гидрогётит FeOOH·nH
2O). Кристаллические структуры многих О. п. являются координационными (типа корунда, NaCI,
и др.), цепочечными (типа
и др.), каркасными (типа
,
и др.). Условия образования О. п. главным образом связаны с процессами гипергенеза и
на поверхности суши и в прибрежных мелководных зонах. Характерная геохимическая обстановка - богатая водой и кислородом среда с высоким окислительным потенциалом. В результате
гидроокислы переходят в простые или сложные окислы (например, бурые железняки в гематит и магнетит, диаспор - бёмит в корунд). При застывании магмы и кристаллизации минералов из остаточных расплавов и растворов в
, гидротермальных жилах и др. также образуется ряд простых или сложных О. п. (например, хромиты, магнетиты, ильмениты, касситерит, уранинит, колумбит). Многие О. п. являются ценными рудными и нерудными полезными ископаемыми (например, окисные руды Mn, Fe, Al и др.). См. также
.