 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Азимов Айзек :: Раззаков Федор :: Чехов Антон Павлович :: Грин Александр :: Горький Максим :: Борхес Хорхе Луис :: Сименон Жорж :: Андреев Леонид Николаевич Популярные книги:: Ожерелье Иомалы :: Магия луны (Том 1) :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: Ночной орёл :: О «Двух душах» М. Горького :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер |
Большая Советская Энциклопедия (ОК)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ОК) - Чтение (стр. 6)
Геология океанавключает все разделы геологии, геофизики и геохимии в применении к земной коре в области Мирового океана. Непосредственно изучаются рельеф океанского дна; состав и процессы образования современных осадков; стратиграфия, литология, минералогия и геохимия осадочной толщи (с использованием колонок донных отложений, получаемых грунтовыми трубками, и кернов океанского бурения), петрография магматических пород дна; структура слоев земной коры (методами сейсмического зондирования и непрерывного сейсмопрофилирования); тепловой поток через дно, гравитационные и магнитные аномалии и др. геофизические характеристики. Крупнейшие проблемы - исследование полезных ископаемых поверхности и недр океанского дна (нефти, газа, минеральных россыпей, железо-марганцево-полиметаллических конкреций, металлоносных осадков, фосфоритов и др.) и закономерностей формирования их месторождений; геологическая история океанов и глобальная тектоника Земли (формирование срединно-океанических хребтов, океанских плит и глубоководных желобов; раздвижение дна океана, дрейф континентов). Биология океаназанимается изучением его живого населения - планктона, нектона, бентоса и микроорганизмов. Изучается их систематика, физиология, биология развития, биохимия, экология, биогеография, эволюционная история, пищевые взаимоотношения, структура и функционирование биологических сообществ, динамика популяций промысловых организмов. Промысловая океанография исследует влияние океанических факторов на урожайность, численность и поведение морских промысловых организмов, имеет целью разработку океанологических основ промысловых прогнозов. Крупнейшие проблемы биологии океана - бонитировка его акваторий, т. е. оценка биомассы и годовой продукции важнейших видов организмов; управление биологической продуктивностью океана, т. е. искусственное создание повышенной продукции ценных организмов (аквакультура). Об истории О. см. ст. . А. С. Монин. Основные международные организации:Межправительственная океанографическая комиссия при ЮНЕСКО (МОК), Международный совет по изучению моря (МСИМ), Международное гидрографическое бюро (МГБ), Международная ассоциация физических наук об океане, Специальный комитет по изучению моря, Организация объединённых наций по продовольствию и сельскому хозяйству (ФАО) и др. Важнейшие национальные научные учреждения:СССР - институт океанологии им. П. П. Ширшова АН СССР (ИОАН), Государственный океанографический (ГОИН), Арктический и Антарктический, институты Главного управления Гидрометеорологической службы СССР, Морской гидрофизический институт АН УССР, Всесоюзный научно-исследовательский институт рыбного хозяйства и океанографии (ВНИРО) министерства рыбной промышленности СССР, институт биологии южных морей АН УССР, Главное управление навигации и океанографии министерства обороны СССР и др.; США - Вудсхолский (штат Массачусетс) и Скриппсовский (штат Калифорния) океанографические институты; Канада - институты океанографии в Ванкувере и Галифаксе; Великобритания - Национальный океанографический институт в графстве Суррей; Франция - Океанографический институт в Бресте; ФРГ - институт мореведения в Кельне; Монако - Океанографический музей; Япония - институт океанских исследований. Периодические издания:«Океанология» (с 1961), «Известия АН СССР. Физика атмосферы и океана» (с 1965), «Тр. Государственного Океанографического института» (с 1947), «Метеорология и гидрология» (с 1950), «Тр. Морского гидрофизического института» (с 1948), «Journal of Marine Research» (New Haven, с 1937), «Deep-sea Research» (L., с 1953), «Marine Observer» (L., с 1924), «International hydrographic bureau. International hydrographic bulletin» (Monaco, с 1928), «Bulletin hydrographique. Conseil permanent international pour l'exploration de la mer» (Cph., с 1908), «Australian Journal of Marine and Freshwater Research» (Melbourne, с 1950), «Annual Report of the Fisheries Research Board of Canada» (Ottawa, с 1937), «Bulletin of the Scripps Institution of Oceanography» (La Jolla, с 1925), «Contributions from the Woods Hole Oceanographic Institution» (Woods Hole, с 1933), «Collected Reprints. National Institute of Oceanography» (Wormley, с 1953), «New Zeeland Oceanographical Institute Collected Reprints» (Wellington, с 1952), «Deutsche hydrographische Zeichschrift» (Hamb., с 1948), «Beitrage zur Meereskunde» (В., с 1961), «Kieler Meeresforschungen» (Kiel, с 1937), «Journal of Oceanographical Society of Japan» (Tokyo, с 1942), «Japanese Journal of Geophysics» (Tokyo, с 1954), «Journal of the Marine Biological Association of the United Kingdom» (Plymouth, с 1887). Лит. см. при ст. . «Океанология» «Океаноло'гия», научный журнал Океанографической комиссии АН СССР. Основан в 1961 в Москве по инициативе советского биолога и океанолога Л. А. Зенкевича. Выходит 6 раз в год. Освещает вопросы физики, химии, геологии и биологии океана, морской метеорологии, методики наблюдений. В «О.» публикуется также важнейшая информация о наиболее интересных событиях в области океанологии (симпозиумы, экспедиции и пр.), новой аппаратуре. Тираж (1974) 1,4 тыс. экземпляров. Окегем Йоханнес О'кеге'м(Ockeghem, Ockenheim, Okeghem и др.) Йоханнес (Жан) де (около 1425, Дендермонде, Восточная Фландрия, - 1495, Тур), нидерландский композитор. Крупнейший представитель . Обучался в метризе собора Нотр-Дам в Антверпене, где служил певчим (1433-44). В 1446-48 певчий капеллы принца Карла I Бурбона в Мулене. С 1452 первый капеллан французского королевского двора, при котором служил 43 года. С 1456 королевский советник и казначей аббатства Сен-Мартен в Type. Посетил Испанию (1470), Фландрию (1484). Пользовался признанием и почётом (в числе авторов эпитафий на смерть О. - Эразм Роттердамский). Создал высокие образцы хоровой - , и др. сочинения, в том числе изысканные светские песни-миниатюры для 3 голосов. Искуснейший контрапунктист (современники называли О. главным мастером контрапункта), он значительно обогатил технику сквозной , утвердил 4-голосное полнозвучие в хоровом стиле а капелла, достиг совершенства в технике свободного развития мелодических линий. Математик (астролог) и философ-неоплатоник, О. строил свои композиции на математических рассчётах, внося в них скрытую философскую и религиозную символику. Славились его «загадочные» (в них исполнителям задаются задачи вычисления интервалов и моменты вступления невыписанных голосов) и сложные, виртуозно построенные хоровые сочинения - 36-голосный канон (сочетание четырёх 9-голосных канонов), «Месса разных тонов» (допускающая исполнение от любого тона) и др. Музыка О. пользовалась исключительным успехом в Германии после Реформации. Лит.:Грубер Р., История музыкальной культуры, т. 1, ч. 2, М. - Л., 1941, с. 395-401; KYenek Е., Johannes Ockeghem, N. Y., 1953; Henze М., Studien zu den Messenkorn positionen J. Ockeghems, B., 1968. Л. Г. Бергер. О'Кейси Шон О’Ке'йси(O’Casey) Шон (30.3.1880, Дублин, - 18.9.1964, Торки, Девоншир), ирландский писатель. Коммунист. Родился в бедной протестантской семье. Принимал участие в дублинской стачке (август 1913 - январь 1914), был секретарём «Ирландской гражданской армии». О национально-освободительном движении 10-20-х гг. 20 в. рассказал в драматической трилогии «Тень стрелка» (1925), «Юнона и павлин» (1925), «Плуг и звёзды» (1926). С конца 30-х гг. для творчества О’К. становится характерным сочетание поэтического видения мира с революционным мировоззрением. В героической драме «Звезда становится красной» (1940), «причудливой комедии» «Пурпурный прах» (1940), поэтически приподнятой трагедии «Красные розы для меня» (1942), фантастической комедии «Петух-денди» (1949), лирической пьесе «Костёр епископа» (1955) и «весёлой комедии» «Барабаны отца Неда» (1958) О’К. обличал буржуазную мораль, провозглашал революционный идеал. В 1939-54 О’К. создал 6-томную автобиографическую эпопею под общим названием «Зеркало в моем доме», в которой нарисовал широкую картину общественной жизни Ирландии и Англии. В сборниках статей «Летящая оса» (1937), «Зелёная ворона» (1956), «Под цветной шапочкой » (1963), «Проклятия и благословения» (1967) О’К. выступил как убеждённый сторонник реализма, против натуралистического жизнеподобия и модернизма. Публицистика О’К. сыграла значительную роль в борьбе за мир. Соч.: Collected plays, v. 1-4, L., 1949-1951; Mirror in my house, v. 1-2, N. Y., 1956; Feathers from the Green Crow. 1905-1925, [N. Y.], 1962; в рус. пер. - Я стучусь в дверь. На пороге, М., 1957; Пять одноактных пьес, М., 1960; Пьесы, М., 1961; За театральным занавесом. Сб. статей, [предисловие Г. Злобина], М., 1971. Лит.:Друзина М., Шон О’Кейси - драматург, М., 1963; Саруханян А., Творчество Шона О’Кейси, М., 1965; Шон О’Кейси. Биобиблиографический указатель, М., 1964; Krause D., Sean O’Casey. The man and his work, L., 1960; Hogan R., The experiments of Sean O’Casey, N. Y., 1960; Sean O’Casey. The modern judgements, L., 1969; Benstock B., Sean O’Casey, Lewisburg, 1970. А. П. Саруханян. 
Ш. О'Кейси. О'Келли Шон Томас О’Ке'лли(O’Ceallaigh, O’Kelly) Шон Томас (25.8.1882, Дублин, - 23.11.1966, там же), ирландский государственный деятель. Примкнул к движению , участвовал в . В 1920-22 посланник Свободного Ирландского государства (Эйре) в Италии, в 1924-26 - в США. В 1932-45 занимал ряд министерских постов. В 1945-59 президент. Во время его президентства Ирландия в апреле 1949 была провозглашена республикой. В 1958 при участии О’К. была разработана и принята программа экономического развития страны с ориентацией на привлечение иностранного капитала. Окен Лоренц О'кен(Oken) Лоренц (настоящая фамилия - Оккенфус, OckenfuЯ) (1.8.1779, Больсбах, Баден, - 11.8.1851, Цюрих), немецкий естествоиспытатель и натурфилософ, ученик и последователь Ф. В. . Профессор в Йене (1807-19), Мюнхене (1828-32), Цюрихе, где был первым ректором основанного в 1833 университета. Издавал журнал «Isis oder Encyclopдdische Zeitung» (т. 1-41, 1817-48). В 1822 основал общество немецких естествоиспытателей и врачей. Исходя из Шеллинга, О. рассматривал многообразие живых организмов как результат развития и превращения некоторого идеального творческого первоначала; каждая ступень развития органических форм реализует предустановленную идеальную первичную форму. В сочинениях О. наряду с фантастическими представлениями содержатся и проницательные догадки, предвосхитившие научные открытия последующего времени, - идея дискретности живого (вылившаяся в дальнейшем в клеточную теорию), взгляд на углерод как на основу живой материи и др. Развивавшееся О. учение о соответствии частей черепа позвонкам (эту «позвоночную теорию» черепа отстаивал и И. В. Гёте) возродилось впоследствии в учении о головы позвоночных (см. сб. Анналы биологии, т. 1, М., 1959, с. 155-264). О. оказал значительное влияние на русское шеллингианство начала 19 в. (см. П. Сакулин, Из истории русского идеализма..., т. 1, ч.1, М., 1913, гл.2). Соч.: Gesammelte Schriften, В., 1939; в рус. пер. - Обозрение главных содержаний философского естествознания..., СПБ, 1815; О свете и теплоте, как известных состояниях всемирного элемента, СПБ, 1816; Всеобщая естественная история для всех состояний, т. 5, [СПБ, 1836]. Лит.:Райков Б. Е., Германские биологи-эволюционисты до Дарвина, Л., 1969, с. 9-159; Ecker A., L. Oken, Stuttg., 1880; Schuster J., Oken. Der Mann und sein Werk, B., 1922; Pfannenstiel M., L. Oken. Sein Leben und Wirken, Freiburg im Breisgau, 1953; Brдuning-Oktavio H., Oken und Goetne im Lichte neuer Quellen, Weimar, 1959. Л. Я. Бляхер. Оки О'ки, группа островов в южной части Японского моря, принадлежит Японии. Общая площадь 323 км 2, основной о. Дого (около 250 км 2). Берега сильно изрезаны, много удобных гаваней. В рельефе преобладают холмы и низкогорья (высота до 608 м). На склонах - смешанные леса. Рыболовство, рисосеяние, ловля каракатиц. Основной порт - Сайго. Окинава (остров) Окина'ва, наиболее крупный остров архипелага Рюкю, в Японии. Длина с С.-В. на Ю.-З. 110 км, площадь 1254 км 2. Омывается Тихим океаном и Восточно-Китайским морем. Берега сильно изрезаны, на значительном протяжении окаймлены коралловыми рифами. На С.-В. и в центральной части О. - низкогорья высотой до 498 м, сложенные преимущественно сланцами, известняками и песчаниками, остальная территория - низменная равнина. Климат тропический, муссонный, осадков от 1,3 до 2 тыс. ммв год, летом и осенью часты тайфуны. Влажные тропические леса на больших пространствах сведены и замещены зарослями кустарников, бамбуковыми рощами, рисовыми полями, плантациями ананасов, батата и сахарного тростника. Основной центр - порт Наха. Лит.:Меклер Г. К., Окинава, М., 1969. Окинава (префектура в Японии) Окина'ва, префектура в Японии. Расположена на ряде островов , самый крупный из них - о. занимает свыше 50% территории префектуры. Площадь префектуры 2,4 тыс. км 2Население 970 тыс. чел. (1970), в том числе городского 59%. Б. ч. населения сконцентрирована в центральных и южных районах о. Окинава. Административный и экономический центр - г. Наха. О. - наименее развитая в экономическом отношении префектура Японии. Площадь обрабатываемых земель (1970) 53 тыс. га, главным образом под рисом (сбор 10 тыс. т, около 90 тыс. тввозится), овощными культурами (сбор 50-60 тыс. т), сахарным тростником (сбор около 2 млн. т), ананасами (сбор 70 тыс. т). Культивируются также табак и чай. Животноводство (28 тыс. голов крупного рогатого скота). Рыболовство (улов тунца 36 тыс. т). Пищевкусовая (сахарная, плодоконсервная и др.), деревообрабатывающая, текстильная, цементная промышленность. Кустарное производство швейных, лакированных и др. художественных изделий. Строится (1974) нефтехимический комбинат. Добыча угля, строительных материалов. Рыболовство, выращивание искусственного жемчуга. Национальный парк Иримотэ. Туризм. До конца 2-й мировой войны 1939-45 острова Рюкю были частью Японии и составляли префектуру О. В июне 1945 острова Рюкю были оккупированы США. По Сан-Францисскому мирному договору с Японией 1951 США получили право осуществлять всю административную, законодательную и судебную власть на островах Рюкю. Здесь были размещены военно-воздушные, военно-морские и ракетные базы США. В 60-х гг. движение в Японии за возвращение островов Рюкю приобрело всенародный характер. В результате американско-японских переговоров, которые начались в декабре 1969, подписано 17 июня 1971 соглашение, по которому Японии были переданы все административные, законодательные и судебные права на острова Рюкю; официально оно вошло в силу 15 мая 1972. С этого времени острова Рюкю - снова японская префектура О. После заключения соглашения в пользовании США на островах Рюкю остались 54 военные базы и большая часть военных установок на 34 др. военных объектах, которые переданы Японии. H. А. Смирнов, В. В. Родионов. Окинлек Клод Джон Эйр Окинле'к(Auchinlek) Клод Джон Эйр (р. 21.6.1884, Олдершот, Хэмпшир, Англия), британский фельдмаршал (1946). Родился в семье офицера. Окончил военное училище в Сандхерсте (1903), служил в колониальных войсках в Индии, во время 1-й мировой войны 1914-18 - в Египте и Месопотамии, до 1940 - снова в Индии. В мае-июне 1940 командовал англо-французскими войсками в Северной Норвегии, затем войсками военного округа в Южной Англии. В июле 1941 - августе 1942 командовал британскими войсками на Ближнем Востоке. За отступление в 1942 был снят с должности. Его руководство действиями британских войск вследствие неудач в 1942 подвергалось серьёзной критике. В 1943 назначен главнокомандующим британскими войсками в Индии (до 1947), в 1943-45 руководил военными действиями против японских войск в Бирме. Окинский хребет Оки'нский хребе'т, горный хребет Восточного Саяна, на границе Бурятской АССР и Иркутской области РСФСР. Образует водораздел рр. Ия и Хойто-Ока (бассейн Ангары). Высота около 2500 м. Длина около 100 км. Сложен гнейсами, кристаллическими сланцами, гранитами. На склонах горная тайга, до высоты 1000-2000 м- преимущественно кедровая, выше - горная тундра. Окип Оки'п(Okiep), горнопромышленный пункт на западе ЮАР, в Капской провинции. Около 5,7 тыс. жителей. К О. прилегает др. горнопромышленный пункт Набабип (около 8,3 тыс. жителей). Автодорогой связан с портом Порт-Ноллот. Центр добычи медных руд, месторождения которых эксплуатируются американской компанией «Окип коппер компани». Обогатительная фабрика. Медеплавильный завод. Окисление Окисле'ние, окислительный процесс, в узком смысле слова - реакция соединения какого-либо вещества с кислородом. В более широком смысле - всякая химическая реакция, сущность которой состоит в отнятии электронов от атомов или ионов (см. ). Из обычных окислителей к числу важнейших относятся: кислород О 2, озон О 3, перекись водорода H 2O 2,хлор Cl 2, фтор F 2, перманганат калия KMnO 4, хлорная кислота HClO 24, азотная кислота HNO 3и др. См. также . Окисление - восстановление
Окисле'ние-восстановле'ние,
окислительно-восстановительные реакции, химические реакции, сопровождающиеся изменением
атомов. Первоначально (со времени введения в химию кислородной теории горения А.
,
конец 18 в.) окислением назывались только реакции соединения с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений (1920-30) оказалось возможным широко обобщить понятие О.-в. и распространить его на реакции, в которых кислород не участвует. Согласно электронной теории, окислением называется отдача электронов атомом, молекулой или ионом: Zn – 2
Восстановлением называется присоединение электронов атомом, молекулой или ионом: Cl
2+ 2
Окислителями называется нейтральный атом, молекула или ион, принимающие электроны (во втором примере молекула хлора Cl 2), восстановителями - нейтральный атом, молекула или ион, отдающие электроны (в первом примере - атом Zn). Окисление и восстановление - взаимосвязанные процессы, которые всегда протекают одновременно. Когда одно вещество окисляется, то другое восстанавливается, и наоборот. Так, приведённые выше частные реакции окисления и восстановления составляют единый процесс О.-в.: Zn + Cl 2= ZnCl 2. Здесь Zn окисляется до Zn 2+, а Cl 2восстанавливается до 2Cl –. В химии окислительно-восстановительные реакции принадлежат к числу наиболее распространённых. Например, на них, как правило, основано получение простых веществ (металлов и неметаллов) CuO + H 2=Cu + H 2O, 2КВг + Cl 2= Br 2+ 2KCl. В основе технического производства таких важнейших химических продуктов, как
,
,
, процессов сжигания топлива и горения также лежат реакции О.-в. В гальванических элементах (см.
) возникновение электродвижущей силы обусловлено протеканием реакции О.-в. При проведении
на аноде происходит электрохимическое окисление, на катоде - электрохимическое восстановление. Например, при производстве хлора электролизом раствора NaCl на аноде идёт реакция Cl
–– 1
Дыхание, усвоение растениями углекислого газа с выделением кислорода (см. ), обмен веществ и др. биологически важные явления представляют собой реакции О.-в. (см. ). При составлении уравнений реакций О.-в. основная трудность заключается в подборе коэффициентов, особенно для реакций с участием соединений, в которых химическая связь носит не ионный, а ковалентный характер. В этом случае полезны понятия электроотрицательности и окислительного числа (степени окисления). Электроотрицательность - способность атома в молекуле притягивать и удерживать около себя электроны. Степень окисления - такой заряд, который возник бы на атоме в молекуле, если бы каждая пара электронов, связывающая его с др. атомами, была полностью смещена к более электроотрицательному атому (см. ). Нахождение степени окисления атома в молекуле основано на том, что молекула в целом должна быть электрически нейтральной. При этом учитывается, что степень окисления атомов некоторых элементов в соединениях всегда постоянна (щелочные металлы +1, щёлочноземельные металлы и цинк +2, алюминий +3, кислород, кроме перекисей, –2 и т.д.). Степень окисления атома в простых веществах равна нулю, а одноатомного иона в ионном соединении равна заряду этого иона. Например, рассчитаем степень окисления атома Cr в соединении K 2Cr 2O 7. Пользуясь постоянными значениями степеней окисления для К и О, имеем 2·(+1) + 7·(–2) = –12. Следовательно, степень окисления одного атома Cr (чтобы сохранить электронейтральность молекулы) равна +6. На основе введённых понятий можно дать другое определение О.-в.: окислением называется увеличение степени окисления, восстановлением называется понижение степени окисления. Восстановителями являются почти все металлы в свободном состоянии, отрицательно заряженные ионы неметаллов (S
2–
– 2
ZnO + С = Zn + СО, FeO +СО = Fe + СО 2. сульфит натрия Na 2SO 3и гидросульфит натрия NaHSO 3- в фотографии и красильном деле, металлический натрий и свободный водород - для получения чистых металлов TiCl 4+ 4Na = Ti + 4NaCI, GeO 2+2Н 2= Ge + 2H 2O. Окислителями могут быть нейтральные атомы неметаллов (в особенности галогенов и кислорода), положительно заряженные ионы металлов в высшей степени окисления (Sn
4++ 2
Для подбора коэффициентов в уравнениях реакций О.-в. служит общее правило: число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. Применяют обычно два метода подбора коэффициентов: метод электронного баланса и электронно-ионный метод. В методе электронного баланса подсчёт числа принятых и отданных электронов производят на основании значений степеней окисления элементов до и после реакции. Например,
Таким образом,
В соответствии с приведённым выше правилом числа отданных и принятых электронов уравнивают. Полученные величины подставляют в исходное уравнение: 2KClO 3= 2KCl + 3O 2. В электронно-ионном методе схему реакции записывают в соответствии с общими правилами составления ионных реакций, т. е. сильные электролиты записывают в виде ионов, а неэлектролиты, слабые электролиты, газы и осадки - в виде молекул. Не изменяющиеся в результате реакции ионы в такую схему не входят. Например, KMnO 4+ KI + H 2SO 4® K 2SO 4+ I 2+ MnSO 4+ H 2O, в ионном виде:
Рассчитав степени окисления, определяют окислитель и восстановитель и составляют частные реакции окисления и восстановления: 2I
–– 2
Во втором уравнении, перед тем как записать переход электронов, необходимо составить «материальный» баланс, т.к. в левой части уравнения есть атомы О, а в правой их нет. Избыточные атомы О связываются в молекулы воды ионами Н +, присутствующими в сфере реакции (кислая среда):
Далее, как и в первом методе, находят коэффициенты-множители к частным уравнениям для достижения электронного баланса (в приведённом примере 5 и 2 соответственно). Окончательное уравнение имеет вид:
Полученные коэффициенты подставляют в исходное уравнение: 2KMnO 4+ 10KI + 8H 2SO 4= 6K 2SO 4+ 5I 2+ 2MnSO 4+ 8H 2O. Аналогично составляют и уравнения реакций О.-в. в щелочной среде (вместо ионов Н
+в частных уравнениях фигурируют ионы OH
–). Т. о., в уравнивании реакций по второму методу учитывают характер реакционной среды (кислая или щелочная либо нейтральная), которая сильно влияет и на направление реакции О.-в. и на продукты, получаемые в результате реакции. Например, равновесие окислительно-восстановительной реакции
Лит.:Кудрявцев А. А., Составление химических уравнений, М., 1968; Химия. Курс для средней школы, пер. с англ., 2 изд., М., 1972, гл. 12; Химия. Пособие для преподавателей средней школы, пер. с англ., ч. 1, М., 1973, гл. 12. В. К. Бельский. Окисление биологическое Окисле'ние биологи'ческое, совокупность реакций окисления, протекающих во всех живых клетках. Основная функция О. б. - обеспечение организма энергией в доступной для использования форме. Реакции О. б. в клетках катализируют ферменты, объединяемые в класс . Изучение окисления в организме было начато в 18 в. А. ; в дальнейшем значительный вклад в исследование О. б. (его локализация в живых клетках, связь с др. процессами обмена веществ, механизмы ферментативных окислительно-восстановительных реакций, аккумуляция и превращение энергии и др.) внесли О. , Г. (Германия), Д. , Х. , П. Митчелл (Великобритания), Д. , А. , Б. Чанс, Э. Рэкер (США), а в СССР - А. Н. , В. И. , В. А. , С. Е. , В. А. , В. П. Скулачев и др. О. б. в клетках связано с передачей т. н. восстанавливающих эквивалентов (ВЭ) - атомов водорода или электронов - от одного соединения - донора, к другому - акцептору. У - большинства животных, растений и многих микроорганизмов - конечным акцептором ВЭ служит кислород. Поставщиками ВЭ могут быть как органические, так и неорганические вещества (см. таблицу). 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 |
|||||||
 = Zn
2+.
= Zn
2+. = 2Cl
–.
= 2Cl
–. = 1/2Cl
2(окисление аниона Cl
–), на катоде Н
++ 1
= 1/2Cl
2(окисление аниона Cl
–), на катоде Н
++ 1
 =
1/
2Н
2(восстановление катиона Н
+).
металлов также связана с реакциями О.-в. и заключается в окислении металлов.
=
1/
2Н
2(восстановление катиона Н
+).
металлов также связана с реакциями О.-в. и заключается в окислении металлов. = S°), положительно заряженные ионы металлов в низшей степени окисления (
= S°), положительно заряженные ионы металлов в низшей степени окисления (
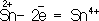 ), сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления (
), сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления (
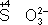 ,
,
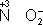 ). В промышленности и технике широко используются такие восстановители, как углерод и окись углерода (восстановление металлов из окислов)
). В промышленности и технике широко используются такие восстановители, как углерод и окись углерода (восстановление металлов из окислов) = Sn
2+), сложные ионы и молекулы, содержащие атомы элементов в более высокой степени окисления (
= Sn
2+), сложные ионы и молекулы, содержащие атомы элементов в более высокой степени окисления (
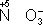 ,
,
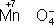 ,
,
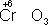 ). Промышленное значение как окислители имеют: кислород (особенно в металлургии), озон, хромовая и двухромовая кислоты и их соли, азотная кислота, перекись водорода, перманганат калия, хлорная известь и др. Самый сильный окислитель - электрический ток (окисление происходит на аноде).
). Промышленное значение как окислители имеют: кислород (особенно в металлургии), озон, хромовая и двухромовая кислоты и их соли, азотная кислота, перекись водорода, перманганат калия, хлорная известь и др. Самый сильный окислитель - электрический ток (окисление происходит на аноде).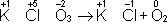
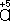 является окислителем, а
является окислителем, а
 - восстановителем. Составляют частные реакции окисления и восстановления:
- восстановителем. Составляют частные реакции окисления и восстановления: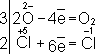
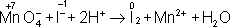
 = I
2,
= I
2,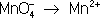
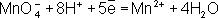
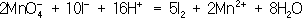 .
.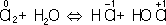 в кислой среде смещено влево, а в щелочной - вправо. Сильный окислитель ион
в кислой среде смещено влево, а в щелочной - вправо. Сильный окислитель ион
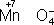 в кислой среде восстанавливается до иона Mn
2+, в щелочной среде - до иона
в кислой среде восстанавливается до иона Mn
2+, в щелочной среде - до иона
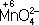 , в нейтральной - до молекулы
, в нейтральной - до молекулы
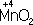 . См. также
,
.
. См. также
,
.