 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Раззаков Федор :: Азимов Айзек :: Чехов Антон Павлович :: Грин Александр :: Горький Максим :: Борхес Хорхе Луис :: Андреев Леонид Николаевич :: Сименон Жорж Популярные книги:: Ожерелье Иомалы :: Магия луны (Том 1) :: Огненная река :: Русь (Часть 2) :: Лет за триста до братьев Люмьер :: Вторая книга Царств :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: О «Двух душах» М. Горького :: Роковые кости :: Звезды в их руках |
Большая Советская Энциклопедия (НИ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (НИ) - Чтение (стр. 28)
Реакцию можно остановить на стадии образования амида карбоновой кислоты (I). Обратная реакция, т. е. отщепление воды от амида или аммониевой соли карбоновой кислоты - один из основных способов получения Н.; другой способ - взаимодействие галогеналкилов с цианидом калия KCN. Нитриты Нитри'тыметаллов, соли азотистой кислоты HNO 2. Бесцветные кристаллические вещества; термически менее устойчивы, чем .Характер разложения зависит от катиона [например, 2Ba (NO 2) 2= BaO + Ba (NO 3) 2+ NO 2+ 1/ 2N 2; 2Ag NO 2= AgNO 3+ Ag + NO]. Почти все Н. хорошо растворимы в воде (исключение - AgNO 2). Н. могут проявлять как окислительные, так и восстановительные свойства. Получают Н. действием смеси NO и NO 2на окислы и гидроокиси, восстановлением нитратов и по реакциям обмена. Применяют главным образом в производстве азокрасителей. Важнейшие Н. описаны в соответствующих статьях ( и др.). Нитрификация Нитрифика'ция(от и лат. facio - делаю), процесс микробиологического превращения аммонийных солей в нитраты - основную форму азотного питания растений. Протекает в почве и воде водоёмов. Н. завершает минерализацию органических соединений азота, начатую , и является показателем плодородия почвы. Вызывается хемосинтезирующими . Протекает в 2 стадии. Сначала ион аммония окисляется бактериями первой стадии Н. в нитрит-ион, а затем нитрит-ион окисляется бактериями второй стадии Н. в нитрат-ион. Н. идёт при рН почвы 5-9. Нитрификаторы - аэробные организмы, и при недостатке в почве воздуха Н. приостанавливается. Хорошая обработка почвы, улучшая её аэрацию, усиливает Н. В результате возросшего сжигания топлива (заводы, двигатели внутреннего сгорания) в атмосфере образуются окислы азота, которые попадают в почву и воду водоёмов с дождём в большом количестве и превращаются там с помощью нитрифицирующих бактерий в нитраты. Чрезмерное обогащение ими воды делает её непригодной для питья. Чтобы предупредить усиленное образование нитратов в воде, иногда применяют химические препараты, тормозящие Н. в почве. Г. А. Заварзин. Нитрифицирующие бактерии
Нитрифици'рующие бакте'рии,
бактерии, превращающие аммиак и аммонийные соли в нитраты; аэробны, грамотрицательны, подвижны (имеют жгутики); обитают в почве и водоёмах. Выделены и описаны в 1890 рус. микробиологом С. Н.
(их открытие позволило ему создать учение о
). Превращение NH
3в нитраты -
- осуществляется в две стадии. Сначала нитритные бактерии (Nitrosomonas) окисляют NH
3до нитрита:
Во второй стадии нитратные бактерии (Nitrobacter) окисляют нитрит до нитрата:
Таким образом, между этими двумя группами Н. б. существуют метабиотические отношения: бактерии, окисляющие NH 3, обеспечивают субстратом бактерий, окисляющих нитрит. Подобно др. хемоавтотрофам, Н. б. за счёт энергии окисления могут усваивать углерод CO 2атмосферы или карбонатов и использовать его для синтеза веществ, входящих в состав клетки (Н. б. не усваивают органические вещества, содержащиеся в почве, воде водоёмов или в искусственных питательных средах). А. А. Имшенецкий. Нитроаммофоска Нитроаммофо'ска, сложное минеральное азотно-фосфорно-калийное удобрение. Содержит 50-54% N, P 2O 5и K 2O, выпускается в гранулах. Состоит из аммиачной селитры, аммофоса, диаммофоса, хлористого аммония, сульфата аммония и калийной селитры, получаемых в едином технологическом процессе при взаимодействии аммиака, азотной и фосфорной кислот, с добавлением хлористого калия и сульфата калия. Н. применяют как основное и припосевное удобрение под все культуры. См. . Нитроанилины Нитроанили'ны, продукты замещения атомов водорода в ядре анилина C 6H 5NH 2нитрогруппами - NO 2. Н. могут содержать от 1 до 5 нитрогрупп. Техническое значение имеют мононитроанилины ( изомеры) - кристалллические вещества жёлтого цвета [ t пл(°С) 71,0 ( о-Н.), 114,0 ( м-Н.), 147,0 ( n-Н.)], плохо растворимые в воде, в органических растворителях - хорошо. о-Н. и n-Н. - слабые основания, хуже растворимые в кислотах, чем мета-изомер (более сильное основание). При нагревании с водными растворами щелочей группа NH 2у о-Н. и n-Н. замещается на ОН-группу с образованием . Н., содержащие более одной нитрогруппы, взрывчаты. о-Н. и n-Н. в промышленности получают нагреванием соответствующих нитрохлорбензолов с аммиаком, м-Н. - частичным восстановлением м-динитробензола сернистым натрием. Н. - кровяные яды; особенно опасно совместное воздействие Н. и спирта. Н. - промежуточные продукты в производстве и некоторых лекарственных веществ. Лит.:Воронцов И. И., Полупродукты анилинокрасочной промышленности, М., 1955. Нитробензол Нитробензо'л, С бН 5NO 2, простейшее ароматическое нитросоединение; бледно-жёлтая маслянистая жидкость; t пл 5,7 °С, t кип210,9 °С, плотность 1,987 г/см 3(25 °С); в воде растворяется плохо. Хорошо смешивается с органическими растворителями. При восстановлении в зависимости от условий Н. превращается в или в гидразобензол (см. ). Последний под действием кислот изомеризуется в . Нитрование, сульфирование и хлорирование Н. происходят главным образом в -положение к нитрогруппе, например:
Получают Н. нитрованием бензола . Н. ядовит; предельно допустимая концентрация в воздухе рабочих помещений 3 мг/м 3, в воздухе населённых мест 0,008 мг/м 3. Основное назначение Н. - получение анилина; в небольших количествах Н. используют также в производстве промежуточных продуктов для красителей (метаниловой кислоты, бензидина и др.) и некоторых красителей (например, индулина). Лит.:Орлова Е. Ю., Химия и технология бризантных взрывчатых веществ, Л., 1973. Нитрование Нитрова'ние,введение нитрогрупп - NO 2в молекулы органических соединений при действии различных нитрующих агентов. В зависимости от строения нитруемого соединения и условий реакции Н. может сопровождаться введением в молекулу др. функциональных групп, например - F (нитрофторирование), - ОН (окислительное нитрование) и др. Н. - один из наиболее изученных в теоретических и практических отношениях процессов. Н. ароматических соединений осуществляется азотной кислотой, или неорганическими солями нитрония NO; вначале образуется комплекс (I) между катионом нитрония и бензолом:
Затем отщепляется протон с образованием (II). Реакция осуществляется при комнатной или пониженной температуре. Для введения последующих нитрогрупп требуются более жёсткие условия. При прямом нитровании в ароматическое ядро можно ввести максимально три нитрогруппы. Наличие функциональных групп, обогащающих кольцо электронами, например амино-, сульфо-, оксигрупп, облегчает Н., причём в некоторых случаях эти группировки могут замещаться на нитрогруппы. Так, при Н. фенолсульфокислот сульфогруппа замещается нитрогруппой. Характер заместителей существенно влияет на ориентацию вступающей нитрогруппы (см. ). Н. ароматических соединений ускоряется в присутствии нитратов ртути, причём процесс может сопровождаться окислением (образуются как нитросоединения, так и нитрофенолы). О промышленном получении некоторых ароматических нитросоединений см., например, , , , . Н. алифатических соединений ненасыщенного ряда, например, смесью уксусного ангидрида и азотной кислоты, начинается с атаки двойной связи катионом нитрония; образующийся катион (III) стабилизируется отщеплением протона с образованием нитроолефина (IV) или присоединением аниона (X), находящегося в реакционной смеси:
(X=CH 3COO -, Cl -, OH -и др.). Продукты реакции - обычно смеси нитросоединений. Н. ненасыщенных соединений двуокисью азота в инертных растворителях происходит по радикальному механизму, например:
Процесс также осложняется образованием смесей различных продуктов. Н. углеводородов парафинового ряда разбавленной азотной кислотой впервые осуществил русский химик М. И. в 1888 (см. ). Н. алканов окислами азота или крепкой азотной кислотой происходит преимущественно по радикальному механизму: N 2O 4Ы 2O 2N
Обычно Н. алифатических соединений сопровождается окислительно-деструктивными процессами, приводящими к образованию смесей нитро- и кислородсодержащих соединений. В промышленности высшие разветвленные парафины нитруют при температуре около 100 °С (выход низших нитропарафинов до 75%); парафины (C 1-C 5) - в газовой фазе при 250-500 °С (иногда под давлением), выход нитропарафинов не превышает 40%. Реакция Н. взрывоопасна. Промышленное Н. проводят в специальных антикоррозионных нитраторах в тщательно контролируемых условиях; процессы полностью автоматизированы. Лит. см. при ст. . М. М. Краюшкин. Нитрогликоль Нитроглико'ль, гликольдинитрат, O 2NOCH 2-CH 2ONO 2, полный эфир и азотной кислоты; бесцветная вязкая жидкость; t пл- 20 °С, плотность ~ 1,5 г/см 3(15 °С); плохо растворима в воде, смешивается с органическими растворителями. Н. получают нитрованием этиленгликоля . Н. - вторичное (теплота взрыва 6,9 Мдж/кг, или 1650 ккал/кг); используется в смеси с и для изготовления и , а также как пластификатор в твёрдых ракетных топливах. Н. токсичен. Нитроглицерин Нитроглицери'н, глицеринтринитрат, CH 2ONO 2-CHONO 2-CH 2ONO 2, полный эфир и азотной кислоты; мощное . Н. - маслянистая бесцветная жидкость; кристаллизуется в двух модификациях: лабильной ( t пл2,8 °С) и стабильной ( t пл13,5 °С), плотность 1,591 г/см 3(25 °С); в воде практически не растворима, хорошо растворяется в ацетоне, эфире, бензоле. Н. взрывается уже при очень слабом ударе; теплота взрыва 6,3 Мдж/кг, или 1500 ккал/кг; скорость детонации 7,7 км/сек, объём газообразных продуктов взрыва 713 л/кг, температура вспышки ~200°С. Н. получают нитрованием глицерина . Как вторичное взрывчатое вещество Н. используется в значительных количествах в производстве и различных . Н. вызывает расширение сосудов сердца. В медицинской практике применяют в виде спиртового раствора (в каплях) и в таблетках для снятия приступов стенокардии. Нитрозирование Нитрози'рование, замещение атома водорода в органическом соединении на нитрозогруппу - N=O. В результате Н. образуются R-N=O, нитрозоамины RR'N-N=O, оксимы и др., например: RR'CHNO 2-RR'C (NO 2) NO. Нитрозирующими агентами служат азотистая кислота HNO 2, её эфиры RONO и хлорангидрид NOCl (хлористый нитрозил), окислы азота. Активный агент Н. - нитрозоний-катион NO +, образующийся, например, при действии сильных кислот на нитрозирующие агенты. Н. используется в промышленности, например, для синтеза циклогексаноноксима - полупродукта в производстве , а также (±-дикетонов, ±-аминокислот. Впервые Н. осуществил В. . Нитрозокрасители Нитрозокраси'тели, группа , ароматического соединения, содержащие нитрозогруппу NO в орто-положении к ОН-группе. Наибольшее промышленное значение имеют Н. - производные 1-нитрозо-2-нафтола.
Н. получают действием NaNO 2на ароматические оксисоединения в кислой среде (см. ). Краситель протравной зелёный марки БС является продуктом присоединения бисульфита натрия NaHSO 3к 1-нитрозо-2-нафтолу. Комплексное соединение этого красителя с двухвалентным железом - пигмент зелёный. Он прочен к действию света, нагреванию; находит широкое применение для окраски резины, в производстве обоев и карандашей, в лакокрасочной и др. отраслях промышленности. Пигмент зелёный, полученный непосредственно на хлопчатобумажном волокне из протравного зелёного марки БС, образует недостаточно устойчивые окраски. Кислотный зелёный марки 4Ж, являющийся комплексным соединением железа и 1-нитрозо-2-нафтол-6-сульфокислоты, используют для крашения шерсти и шёлка, обоев, окраски мыла и ряда др. продуктов. Лит.:Чекалин М. А., Пассет Б. В., Иоффе Б. А., Технология органических красителей и промежуточных продуктов, Л., 1972. М. А. Чекалин. Нитрозосоединения Нитрозосоедине'ния, органические соединения, содержащие нитрозогруппу -N=O, непосредственно связанную с атомом углерода, например нитрозо-трет-бутан (СН 3) 3С-N=O, нитрозобензол C 6H 5-N=O, трифторнитрозометан CF 3N=O, n-нитрозодиметиланилин (СН 3) 2N-СбН4-N=O. Многие Н. существуют в димерной форме, легко переходящей при плавлении, растворении или перегонке в мономерную: (R 3CNO) 2Ы 2R 3CNO. Мономерные Н. - окрашенные (синие, зеленоватые) жидкости или газы, димерные - бесцветные твёрдые вещества. Н. весьма реакционноспособны: они могут быть окислены в соответствующие , восстановлены в амины (или гидроксиламины), сравнительно легко конденсируются (подобно альдегидам и кетонам) с аминами. Н. получают различными способами из олефинов, аминов, нитросоединений, оксимов (см. также ). Н. ароматического ряда применяются в качестве красителей (см. ), полупродуктов в органическом синтезе, аналитических реагентов; фторсодержащие Н. (например, CF 3NO) используются для получения термостойких каучуков. Иногда к Н. относят все вещества, содержащие нитрозогруппу, например нитрозоамины R 2N-NO. Нитроклетчатка Нитроклетча'тка, сложный эфир целлюлозы и азотной кислоты; см. . Нитрокрасители Нитрокраси'тели, группа , ароматического соединения, цветность которых обусловлена наличием в их составе нитрогрупп NO 2, окси- и иминогрупп, ОН и NHR (R - алкил или арил); могут включать атомы и группы Cl, SO 3Н, СООН и др. Н., содержащие иминогруппы, более прочны. Из Н. практическое значение (для окраски некоторых волокон) имеет краситель дисперсный жёлтый прочный марки 2K; его строение (I):
I Его получают взаимодействием 2,4-динитрохлорбензола с п-аминофенолом. Нафтоловый жёлтый (II) используется в ряде стран для подкраски пищевых продуктов.
II Его получают ±-нафтола и последующим образующегося продукта. Бариевая соль нафтолового жёлтого применяется для окраски бумажной массы и при изготовлении цветных карандашей. Н. (пикриновая кислота) были одними из первых пром. красителей. Вследствие низкой устойчивости красок потеряли практическое значение. Лит.:Коган И. М., Химия красителей, 3 изд. М., 1956; Чекалин М. А., Пассет Б. В., Иоффе Б. А., Технология органических красителей и промежуточных продуктов, Л., 1972. М. А. Чекалин. Нитрокраски Нитрокра'ски, нитроэмали, суспензии . Н. получают различными способами, выбор которых зависит от смачиваемости пигмента связующим: например, перемешиванием пигмента с лаком в шаровой мельнице или дезагрегированием пигмента в среде пластификатора на краскотёрочной машине и последующим перемешиванием пигментной пасты с лаком (см. также ). При нанесении на поверхность (обычно пневматическим распылением - см. ) Н. высыхают при комнатной температуре через 15-30 минс образованием укрывистых плёнок (см. ). Для улучшения и повышения водонепроницаемости покрытий Н. наносят по слою алкидной или фенольно-масляной ; для выравнивания защищаемой поверхности применяют алкидные или нитроцеллюлозные . Н. могут образовывать покрытия с разнообразными декоративными свойствами - трескающиеся, молотковые, с зеркальным блеском, матовые и др. (см. ). Применяют Н. для окраски металла (автомобили, приборы, станки), дерева (кухонная и медицинская мебель, игрушки и др.), а также тканей и кожи. Лит. см. при ст. . М. М. Гольдберг. Нитролаки Нитрола'ки, лаки на основе , главным образом коллоксилина. Растворителями в Н. служат кетоны, сложные эфиры (ацетаты), спирты, а также их смеси с ароматическими углеводородами - толуолом, ксилолом; последние применяют для удешевления Н. и при необходимости введения в их состав др. , улучшающих , а также декоративные и некоторые др. свойства плёнок. Н. образуют покрытия в течение 15-30 минпри комнатной температуре в результате улетучивания растворителя. Покрытия растворимы (обратимы), бесцветны (окрашенные плёнки получают из Н., содержащих растворимые органические ), горючи, устойчивы к бензину и минеральным маслам, ограниченно водостойки, нестойки к щелочам, концентрированной серной кислоте, нагреванию, ультрафиолетовому свету. При совмещении коллоксилина с высыхающими и некоторыми др. плёнкообразующими можно получить за 1,5-3 чпри комнатной температуре нерастворимые (необратимые) плёнки, превосходящие обратимые по защитным свойствам. Н. наносят чаще всего пневматическим или аэрозольным распылением (см. ), а также с помощью . Используют Н. для получения прозрачных покрытий (по дереву, металлу) или нижних и покровных слоев при нанесении нитроэмалей (см. ), а также как полуфабрикат в производстве последних. При работе с Н. необходимо строго соблюдать правила противопожарной безопасности. Н. постепенно вытесняются , и др. материалами на основе синтетических плёнкообразующих. Лит. см. при ст. . М. М. Гольдберг. Нитрометан Нитромета'н, СН 3NO 2, простейшее алифатического ряда; бесцветная жидкость с запахом горького миндаля; t kип101,2 °С, плотность 1,138 г/см 3(20 °С); растворим в воде, смешивается с обычными органическими растворителями (кроме парафинов), образует азеотропную смесь с водой ( t kип83,6 °С, 76,4% Н.). Н. легко конденсируется с альдегидами, кетонами, окисью этилена и др. соединениями; например с формальдегидом: СН 3NO 2+ CH 2O ® HOCH 2CH 2NO 2. В промышленности Н. обычно получают деструктивным нитрованием пропана; применяют главным образом в качестве растворителя (например, эфироцеллюлозных лаков, виниловых полимеров), для экстракции ароматических углеводородов, в производстве хлорпикрина, некоторых взрывчатых веществ и др. Н. - ядовит (предельно допустимая концентрация в воздухе рабочих помещений 0,01%). Нитрон Нитро'н, торговое название , выпускаемого в СССР. В др. странах аналогичное волокно выпускается под названиями: орлон, акрилан (США), кашмилон (Япония), куртель (Великобритания), дралон (ФРГ), вольпрюла (ГДР), анилана (ПНР). Нитронафталины Нитронафтали'ны, производные общей формулы C 10H 8-n(NO 2) n, где n= 1, 2, 3 или 4. Техническое значение имеют a-нитронафталин (a-Н.), 1,5- и 1,8-динитронафталины (1,5-Д. и 1,8-Д.) - кристаллические вещества светло-жёлтого цвета ( t пл57,8 °С, 219 °С и 172 °С соответственно). a-Н. хорошо растворим в большинстве органических растворителей, оба динитронафталина - плохо. Получают Н. нитрованием нафталина ; смесь 1,5- и 1,8-Д. образуется также при нитровании a-Н. Н. применяют в производстве и . См. также .
Лит.:Доналдсон Н., Химия и технология соединений нафталинового ряда, пер. с англ., М., 1963; Орлова Е. Ю., Химия и технология бризантных взрывчатых веществ, 2 изд., Л., 1973. Нитропарафины Нитропарафи'ны, см. в ст. . Нитросоединения Нитросоедине'ния, органические соединения, содержащие одну или несколько нитрогрупп - NO 2в молекуле, связанных с атомами углерода. Различают моно-, ди-, три- и полинитросоединения (поли-Н.). Н. могут быть алифатическими (нитропарафины и нитроолефины); ароматическими, содержащими нитрогруппы в ароматическом ядре, например , , , и др.; жирноароматическими - Н. с нитрогруппами только в боковой алифатической цепи, например фенилнитрометан С 6Н 5СН 2NO 2, нитростирол C 6H 5CH = CHNO 2и др., а также Н. с нитрогруппами в боковой цепи и ароматическом кольце, например n-нитрофенилнитрометан O 2NC 6H 4CH 2NO 2. Ароматические Н. - желтоватые жидкости или кристаллические вещества, хорошо растворимые в органических растворителях, плохо - в воде; их синтезируют в промышленности и лабораторных условиях нитрованием ароматических соединений . Ароматические поли-Н. применяются в качестве [ , аммониевая соль тринитрофенола (см. ), тринитрофенилметилнитрамин и др.]. Восстановление нитрогрупп приводит к ароматическим аминам - полупродуктам в производстве различных красителей. Алифатические Н. получают в промышленности главным образом нитрованием парафинов азотной кислотой или окислами азота. Простейшие мононитропарафины - бесцветные жидкости со своеобразным запахом. Нитро-парафины легко восстанавливаются до гидроксиламинов и аминов. При действии оснований первичные и вторичные Н. образуют соли аци-формы нитросоединений, т. н. изонитросоединений (I), легко превращающиеся в альдегиды или кетоны (II):
(R - алкил, R' - H или алкил). При обработке солей Н. (III), а в некоторых случаях самих Н. или их аци-форм алкилирующими агентами может происходить О-алкилирование с образованием нитроновых эфиров (IV):
или С-алкилирование:
(X - атом галогена). Направление реакции зависит как от структуры соли, так и от природы алкилирующего агента. При действии на Н. концентрированных кислот получаются карбоновые кислоты. Алифатические Н. легко конденсируются с альдегидами и кетонами с образованием нитроспиртов, дегидратация которых приводит к нитроолефинам. Эти реакции широко используют в лабораторной практике. Нитропарафины хорошо растворяют различные органические соединения. См. также , , . Некоторые Н. обладают токсическим действием, могут вызывать поражение печени, иногда глаз (катаракта). Лит.:Химия нитро- и нитрозогрупп, под ред. Г. Фойера, пер. с англ., М., 1972; Топчиев А. В., Нитрование углеводородов и других органических соединений, 2 изд., М., 1956; Орлова Е. Ю., Химия и технология бризантных взрывчатых веществ, 2 изд., Л., 1973. М. М. Краюшкин. Нитротолуолы Нитротолуо'лы, продукты замещения атомов водорода в ядре С бН 5СН 3нитрогруппами -NO 2. Техническое значение имеют Н., приведённые в таблице.
Мононитротолуолы в виде смеси изомеров (56% орто, 38% метаи 4% пара) получают нитрованием толуола ; о-Н. и м- Н. -светло-жёлтые жидкости, пара-изомер -бесцветное кристаллическое вещество; применяют для получения -полупродуктов в производстве и . Динитротолуол получают нитрованием главным образом технической смеси мононитротолуолов; полученный продукт - кристаллическое вещество жёлтого цвета, температура затвердевания 50-54 °C - содержит в основном 2,4-изомер; обладает взрывчатыми свойствами, применяют для получения диизоцианатов - исходных веществ для синтеза . 2,4,6 - (тротил) - мощное взрывчатое вещество. Н. ядовиты; предельно допустимая концентрация, например, 2,4-динитротолуола, в воздухе рабочих помещений 1 мг/м 3.
Лит.:Орлова Е. Ю., Химия и технология бризантных взрывчатых веществ, 2 изд., Л., 1973; Ворожцов Н. Н., Основы синтеза промежуточных продуктов и красителей, 4 изд., М. 1955. Нитрофенолы Нитрофено'лы, продукты замещения атомов водорода в ядре С бН 5ОН нитрогруппами - NO 2. Техническое значение имеют Н., приведённые в таблице.
Н. - кристаллические вещества. Мононитрофенолы ( о-Н. и n-Н.) в промышленности получают нагреванием соответствующих нитрохлорбензолов с водным раствором NaOH, 2,4-динитрофенол (2,4-Д.) - аналогично из 2,4-динитрохлорбензола. Эти Н. - кровяные яды, действуют также на нервную систему, раздражают слизистые оболочки, кожу, вызывая дерматиты и хронические экземы. Предельно допустимая концентрация, например, 2,4-Д. в воздухе рабочих помещений 0,05 мг/м 3. о-Н. и n-Н. применяют главным образом для получения о- и n- . Из 2,4-динитрофенола получают пикриновую кислоту, краситель сернистый чёрный, 2,4-диаминофенол (проявитель ); его используют также в качестве гербицида. 2,4,6-Тринитрофенол (2,4,6-Т.), или пикриновая кислота, использовался как жёлтый краситель для шёлка (первый искусственный органический краситель) и как взрывчатое вещество (мелинит, лиддит); ядовит, предельно допустимая концентрация в воздухе рабочих помещений 1 мг/м 3. С металлами 2,4,6-Т. образует взрывоопасные легковоспламеняющиеся соли - . 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 |
|||||||||||||||||||||

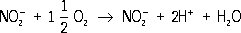 .
. .
.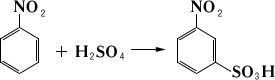





 .
.





