 |
|
���������� ������:: ��� :: ������� ��� ���������� :: �������� ����� :: ������ ����� :: ����� ����� �������� :: ���� ��������� :: ������ ����� ���� :: ������� ������ :: ������� ������ ���������� :: ������� ���� ���������� �����:: �������� ������ :: ������ � ������ ��� ����� (��������� ��. ����������� � �������� ������ ������) :: �������� ���� :: � ����� ������ �. �������� :: ����� ���� (��� 1) :: ���� (����� 2) :: ������� ����� :: ������ � �� ����� :: ��� �� ������ �� ������� ������ :: ������ ����� ������ |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 63)Калибро'вочная сельскохозя'йственная маши'на,машина для разделения по размерам семян с.-х. культур, плодов (яблок, цитрусовых), виноградных черенков, картофеля и др. В СССР выпускаются К. с. м. для калибровки семян кукурузы, сахарной свёклы, плодов и виноградных черенков. К. с. м. для разделения семян кукурузы и сахарной свёклы имеет следующие основные рабочие органы ( рис. 1 ) - решётные станы, в которых закрепляют решёта с круглыми или продолговатыми отверстиями разных размеров. Решёта с круглыми отверстиями калибруют семена по ширине, с продолговатыми - по толщине на несколько фракций (см. Калибровка семян ). Чтобы использовать эти К. с. м. для калибрования семян подсолнечника, клещевины, сои, фасоли, бобов, гороха и др. культур, в машину вставляют решёта с отверстиями требуемых размеров. К. с. м. для сортирования и калибровки плодов округлой формы по размерам или массе состоит из питателя для опорожнения ящиков с неотсортированными плодами, роликового сортировочного транспортёра, на котором сортировщицы вручную отбирают нестандартные плоды, калибрующих секций или устройств и лотков-накопителей. У К. с. м. для калибровки плодов по размерам применены калибрующие секции в виде ленточных транспортёров, в лентах которых высечены отверстия различных диаметров. У К. с. м. для разделения плодов по массе использовано калибрующее устройство в виде транспортёра с чашками, в которые ячеистый транспортёр по одному укладывает плоды, и оборудования для взвешивания чашек с плодами. Откалиброванные плоды поступают в лотки-накопители, из которых их укладывают или ссыпают в ящики. К. с. м. для обрезки по длине и калибровки по диаметру виноградных черенков ( рис. 2 ) снабжена двумя обрезающими фрезами, двумя калибровочными линейками и двумя лотками, расположенными на противоположных стенках машины. Кроме того, она имеет отсеки для отбора черенков с одинаковыми диаметрами; предельные диаметры калибруемых черенков 7-12 мм. Для калибровки клубней картофеля используют картофелесортировальный пункт и картофелесортировку . 
Рис. 1. Схема калибровочной машины для разделения семян сахарной свёклы: А, Б, В, Г, Д, Е - решёта: № 1, № 2 - номера фракций семян. 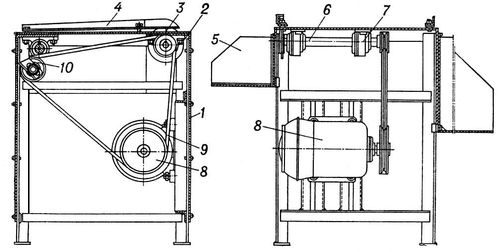
Рис. 2. Калибровочная виноградниковая машина: 1 - рама; 2 - стол; 3 - фреза; 4 - калибровочный клин; 5 - бункер; 6 - вал фрезы; 7 - подшипник; 8 - электродвигатель; 9 - клиновидный ремень; 10 - натяжной ролик. Калигула Гай Юлий Цезарь Кали'гулаГай Юлий Цезарь (Gaius Julius Caesar Caligula; лат. caligula, буквально - сапожок; получил это прозвище за сапожки солдатского образца, которые носил в детстве) (12, Анциум, - 41, Рим), римский император (с 37) из династии Юлиев-Клавдиев , сын Германика , преемник Тиберия . Стремился сделать свою власть неограниченной и требовал оказания себе божеских почестей. Чрезмерная трата К. государственных средств (на устройство триумфов, игр и зрелищ, награды преторианцам) привела к непомерному повышению налогов и конфискации богатств (особенно у сенаторов). Болезненная подозрительность, жестокость и сумасбродство К. вызвали недовольство сената и командного состава преторианцев; был убит во дворце преторианским военным трибуном Кассием Хереей. Калидаса Калида'са(гг. рождения и смерти неизвестны), древнеиндийский поэт и драматург приблизительно 5 в.; индийская традиция относит жизнь К. к 1 в. до н. э. Народные легенды изображают его пастухом, поднявшимся силой таланта до положения придворного поэта. Творчество К. тесно связано с предшествовавшим фольклорно-эпическим и литературным развитием, но главным источником вдохновения для него были природа и народная жизнь. В поэме «Род Рагху» наряду с хроникой легендарного рода, воспетого в «Рамаяне» , К. рисует картины жизни разных народностей страны, осуждает правителя, пренебрегающего интересами подданных. Эпическая поэма «Рождение Кумары» и лирическая «Времена года» воспевают торжество простых человеческих чувств, всепобеждающую силу любви. Драматургия К. - свидетельство высокого развития театрального искусства Древней Индии - открывает радостный мир гармонии и разума, стирает грань между всемогущим божеством и якобы бессильным человеком. Основанные на сюжетах из вед и «Махабхараты» , драмы К. откликаются на современные события: сцена с рыбаками и стражниками («Узнанная по кольцу Шакунтала»), осуждение Агнимитры в сатирической концовке драмы «Малавика и Агнимитра», новая, чисто земная трактовка сюжета о любви царя Пурувараса к небесной деве («Мужеством обретённая Урваши»). Драмы К., утверждающие ценность человеческой личности, переведены на многие восточные и почти на все европейские языки; они продолжают ставиться на мировой сцене. Соч. в рус. пер.: Сцены из Саконталы, индийской драмы. [Предисл. и пер. Н. М. Карамзина], «Московский журнал», 1792, ч. 6, кн. 2-3; Санскритские поэмы, Вологда, 1890; Драмы, пер. К. Бальмонта, вступ. ст. С. Ф. Ольденбурга, М., 1916; Потомки Рагху, «Ленинград», 1940, № 15-16; Сакунтала, М., 1955; Избранное, М., 1956. Лит.: Кальянов В. И., Эрман В. Г., Калидаса. Очерк творчества, М., 1958; Пыжова О. В., Об эстетическом идеале Калидасы, в сборнике: Из истории эстетической мысли древности и средневековья, М,, 1961; Серебряков И. Д., Очерки древнеиндийской литературы, М., 1971; Иванова Н. М., Калидаса. Библиогр. указатель, М., 1957; Upadhuaya Bhagwat SaramIndia in Kalidasa, with foreword by E. Thomas, Allahabad, 1947; Ruben W., Kalidasa. Die menschliche Bedeutung seiner Werke, B., 1956. И. Д. Серебряков, В. Г. Эрман. Калий Ка'лий(Kalium), К, химический элемент 1 группы периодической системы Менделеева; атомный номер 19, атомная масса 39,098; серебряно-белый, очень лёгкий, мягкий и легкоплавкий металл. Элемент состоит из двух стабильных изотопов - 39K (93,08%), 41K (6,91%) и одного слабо радиоактивного 40K (0,01%) с периодом полураспада 1,32Ч10 9лет. Историческая справка. Некоторые соединения К. (например, поташ, добывавшийся из древесной золы) были известны уже в древности; однако их не отличали от соединений натрия . Только в 18 в. было показано различие между «растительной щёлочью» (поташем K 2CO 3) и «минеральной щёлочью» (содой Na 2CO 3). В 1807 Г. Дэви электролизом слегка увлажнённых твёрдых едких кали и натра (KOH и NaOH) выделил К. и натрий и назвал их потассием и содием. В 1809 Л. В. Гильберт предложил название «калий» (от араб. аль-кали - поташ) и «натроний» (от араб. натрун - природная сода); последнее И. Я. Берцелиус в 1811 изменил на «натрий». Название «потассий» и «содий» сохранились в Великобритании, США, Франции и некоторых др. странах. В России эти названия в 1840-х гг. были заменены на «калий» и «натрий», принятые в Германии, Австрии и Скандинавских странах. Распространение в природе. К. - распространённый элемент: содержание в литосфере 2,50% по массе. В магматических процессах К., как и натрий, накапливается в кислых магмах, из которых кристаллизуются граниты и др. породы (среднее содержание К. 3,34%). К. входит в состав полевых шпатов и слюд . В основных и ультраосновных породах, богатых железом и магнием, К. мало. На земной поверхности К., в отличие от натрия, мигрирует слабо. При выветривании горных пород К. частично переходит в воды, но оттуда его быстро захватывают организмы и поглощают глины, поэтому воды рек бедны К. и в океан его поступает много меньше, чем натрия. В океане К. поглощается организмами и донными илами (например, входит в состав глауконита); поэтому океанические воды содержат лишь 0,038% К. - в 25 раз меньше, чем натрия. В прошлые геологические эпохи, особенно в пермском периоде (около 200 млн. лет назад) на поздних стадиях испарения морской воды в лагунах, после осаждения NaCl, кристаллизовались соли К. и магния - карналлит KCIЧMgCI 2Ч6H 2O и др. (Соликамское месторождение в СССР, Штасфуртское в ГДР и т.д.; см. Калийные соли ). В большинстве почв растворимых соединений К. мало, и культурные растения нуждаются в калийных удобрениях. Радиоактивный изотоп 40K - важный источник глубинного тепла, особенно в прошлые эпохи, когда этого изотопа было больше. При распаде 40K образуются 40Ca и аргон 40Ar, уходящий в атмосферу. Некоторые минералы К. не теряют аргона, и по его содержанию можно определить абсолютный возраст горных пород (т. н. калий-аргоновый метод). Физические и химические. свойства. К. - серебряно-белый, очень лёгкий и мягкий металл (без труда режется ножом). Кристаллическая решётка К. объёмно-центрированная кубическая, а= 5,33 Е. Ат. радиус 2,36 Е, ионный радиус К +1,33 Е. Плотность 0,862 г/см 3(20 °С), t пл63,55 °С, t kип760 °С; коэффициент термического расширения 8,33Ч10 -5(0-50 °С); теплопроводность при 21 °С 97,13 вт/( мЧК) [0,232 кал/( смЧ секЧ °С)]; удельная теплоёмкость (при 20 °С) 741,2 дж/( кгЧК), т. е. 0,177 кал/( гЧ°С), удельное электросопротивление (при 20 °С) 7,118Ч10 -8 омЧ м; температурный коэффициент электросопротивления 5,8Ч10 -5(20 °С). Твёрдость по Бринеллю 400 кн/м 2(0,04 кгс/мм 2). Конфигурация внешней электронной оболочки атома К. 4s 1в соответствии с чем его валентность в соединениях постоянно равна 1. Единственный валентный электрон атома К. более удалён от его ядра, чем валентные электроны лития и натрия, поэтому химическая активность К. выше, чем этих двух металлов. На воздухе, особенно влажном, К. быстро окисляется, вследствие чего его хранят в бензине, керосине или минеральном масле. При комнатной температуре К. реагирует с галогенами; при слабом нагревании соединяется с серой, при более сильном - с селеном и теллуром. При нагревании выше 200 °С в атмосфере водорода К. образует гидрид KH, самовоспламеняющийся на воздухе. Азот и К. не взаимодействуют даже при нагревании под давлением, но под влиянием электрического разряда эти элементы образуют азид К. KN 3и нитрид К. K 3N. При нагревании К. с графитом получаются карбиды KC 8(при 300 °С) и KC 16(при 360 °С). В сухом воздухе (или кислороде) К. образует желтовато-белую окись K 2O и оранжевую перекись KO 2(известны также перекиси K 2O 2и K 2O 3, получаемые действием кислорода на раствор К. в жидком аммиаке). К. весьма энергично, иногда со взрывом реагирует с водой, выделяя водород (2K + 2H 2O = 2KOH + H 2), а также с водными растворами кислот, образуя соли. В аммиаке К. медленно растворяется; полученный синий раствор - сильный восстановитель. При нагревании К. отнимает кислород от окислов и солей кислородных кислот с образованием K 2O и свободных металлов (или их окислов). К. со спиртами даёт алкоголяты, ускоряет полимеризацию олефинов и диолефинов, с галогеналкилами и галогенарилами образует калийалкилы и калийарилы. Присутствие К. легко определить по фиолетовому окрашиванию пламени. Получение и применение. В промышленности К. получают по обменным реакциям между металлическим натрием и KOH или же KCl, соответственно: KOH + Na = NaOH + K и KCl + Na = NaCI + К. В первом случае реакция идёт между расплавленной гидроокисью KOH и жидким Na - противотоком в тарельчатой реакционной колонке из никеля при 380-440 °С. Во втором - через расплавленную соль KCl пропускают пары Na при 760-800 °С: выделяющиеся пары К. конденсируют. Возможно также получение К. нагреванием выше 200 °С смесей хлорида К. с алюминием (или кремнием) и известью. Получение К. электролизом расплавленных KOH или KCl мало распространено вследствие низких выходов К. по току и трудности обеспечения безопасности процесса. Основное применение металлического К. - приготовление перекиси К., служащей для регенерации кислорода (в подводных лодках и др.). Сплавы натрия с 40-90% К., сохраняющие жидкое состояние при комнатной температуре, используются в ядерных реакторах как теплоносители, как восстановители в производстве титана и как поглотители кислорода. Сельское хозяйство - главный потребитель солей К. (см. Калийные удобрения;о применении соединений К. см. в соответствующих статьях). Лит.:Калий, в кн.: Краткая химическая энциклопедия, т. 2, М., 1963; Некрасов Б. В., Основы общей химии, т. 3, М., 1970; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963. С. А. Погодин. Калий в организме. К. - один из биогенных элементов , постоянная составная часть растений и животных. Суточная потребность в К. у взрослого человека (2-3 г) покрывается за счёт мяса и растительных продуктов; у грудных детей потребность в К. (30 мг/кг) полностью покрывается грудным молоком, в котором 60-70 мг% К. Многие морские организмы извлекают К. из воды. Растения получают К. из почвы. У животных содержание К. составляет в среднем 2,4 г/кг. В отличие от натрия , К. сосредоточен главным образом в клетках, во внеклеточной среде его много меньше. В клетке К. распределён неравномерно. Ионы К. участвуют в генерации и проведении биоэлектрических потенциалов в нервах и мышцах, в регуляции сокращений сердца и др. мышц, поддерживают осмотического давление и гидратацию коллоидов в клетках, активируют некоторые ферменты. Метаболизм К. тесно связан с углеводным обменом; ионы К. влияют на синтез белков. К +в большинстве случаев нельзя заменить на Na +. Клетки избирательно концентрируют К +. Угнетение гликолиза, дыхания, фотосинтеза, нарушение проницаемости наружной клеточной мембраны приводят к выходу К +из клеток, часто в обмен на Na +. Выделяется К. из организма главным образом с мочой. Содержание К. в крови и тканях позвоночных регулируется гормонами надпочечников - кортикостероидами. В растениях К. распределяется неравномерно: в вегетативных органах растения его больше, чем в корнях и семенах. Много К. в бобовых, свёкле, картофеле, листьях табака и кормовых злаковых травах (20-30 г/кгсухого вещества). При недостатке К. в почвах замедляется рост растений, повышается заболеваемость. Норма калийных удобрений зависит от типа с.-х. культуры и почвы. В биосфере микроэлементы Rb и Cs сопутствуют К. Ионы Li +и Na +- антагонисты К +, поэтому важны не только абсолютные концентрации К +и Na +, но и оптимальные соотношения K +/Na +в клетках и среде. Естественная радиоактивность организмов (гамма-излучение) почти на 90% обусловлена присутствием в тканях естественного радиоизотопа 40K. Лит.: Капланский С. Я., Минеральный обмен, М. - Л., 1938; Вишняков С. И., Обмен макроэлементов у сельскохозяйственных животных, М., 1967; Сатклифф Дж.-Ф., Поглощение минеральных солей растениями, пер. с англ., М., 1964. И. А. Скульский. В медицине с лечебными целями применяют ацетат CH 3COOK как мочегонное (чаще против отёков, вызванных сердечной недостаточностью) и хлорид KCl в случае недостаточности К. в организме (развивается при лечении некоторыми гормональными препаратами, наперстянкой, при большой потере жидкости с рвотой и поносом, при применении некоторых мочегонных средств и др.). Перхлорат KClO 4тормозит продукцию тироксина (гормона щитовидной железы) и применяется при тиреотоксикозе. Перманганат калия KMnO 4(марганцовокислый калий) используют как антисептическое средство. Калий цианистый Ка'лий циа'нистый,то же, что цианид калия , KCN. Калийная селитра Кали'йная сели'тра,калиевая селитра, калия нитрат, калий азотнокислый, KMO 3, соль; бесцветные кристаллы, плотность 2,11 г/см 3, t пл339 °С. В воде хорошо растворима (31 гв 100 гH 2O при 20 °С, 246 г при 100 °С). Смеси К. с. с органическими веществами легко воспламеняются и интенсивно сгорают. К. с. получают действием HNO 3(или нитрозных газов) на K 2CO 3или KCl и др. способами. Применяют как удобрение, в стекольном производстве, для приготовления чёрного пороха и т.д. В сельском хозяйстве К. с. (содержит 44% K 2O и 13% азота) используют как основное удобрение (вносят весной) и в подкормку под чувствительные к хлору культуры (лён, картофель, табак, виноград и др.). Калийные соли Кали'йные со'ли,калиевые соли, осадочные хемогенные горные породы, образованные легко растворимыми в воде калиевыми и калиево-магниевыми минералами. Важнейшие минералы - сильвин (KCl; 52,44% К), карналлит (KCIЧMgCl 2Ч6H 2O; 35,8% К), каинит (KMg [SO 4] CIЧ3H 2O; 14,07% K), полигалит ( K2MgCa2[SO 4] 4Ч2H 2O; 12,97% K), лангбейнит (K 2Mg 2[SO 4] 3; 18,84% К); второстепенные - леонит (K 2Mg [SO 4] 2Ч4H 2O; 21,32% K), шенит (K 2Mg [SO 4] 2Ч6H 2O; 19,41% К); сннгенит (K 2Ca [SO 4]2ЧH 2O; 23,81% К). Основные калийные породы: карналлитовая - 45-85% карналлита и 18-50% галита с невысоким содержанием 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241 |