Иммуните'т(историческое), в средневековой Европе привилегии крупных земельных собственников, заключавшиеся в обладании правами политической власти над населением вотчины. Оформлялся И. королевскими пожалованиями, которые передавали магнатам права на производство суда (как правило, в объёме низшей юрисдикции), взимание налогов и др. поборов, отправление полицейских и военно-административных функций в пределах их владений (а иногда и на более обширной территории), запрещая доступ на иммунитетную территорию государственным должностным лицам. И. получил широкое распространение уже во Франкском государстве (первые дошедшие до нас иммунитетные грамоты относятся к середине 7 в.). В процессе политической централизации институт И. приходит в упадок.
Специфика феодальных отношений в разных странах влияла на характер И. Так, в Германии, где расцвет И. приходится на время правления Саксонской династии (10—11 вв.), развитие И. приводило в ряде случаев к образованию компактных иммунитетных владений, что имело большое значение в оформлении территориальных княжеств. В Англии, где в англосаксонский период получил развитие преимущественно судебный И. (см.
),
в целом И. был слабо выражен. В Византии
, близкая к франкскому И., носила характер податных изъятий.
И. сыграл большую роль в развитии феодальной собственности. Реализуя предоставленные им права, вотчинники-иммунисты подчиняли своей власти крестьян, сохранявших ещё свободу. Присваивая налоги и другие поборы (собиравшиеся ранее в пользу государства), феодалы — обладатели иммунитетных прав — увеличивали объём феодальной эксплуатации. И., атрибут крупной феодальной земельной собственности, являлся важнейшим фактором в процессе формирования системы
.
Лит.:Данилов А. И., Основные черты иммунитета и фогтства на церковных землях в Германии Х—XII вв., в сборнике: Доклады и сообщения исторического факультета МГУ, в. 7, М., 1948: Гутнова Е. В., К вопросу об иммунитете в Англии XIII в., в сборнике: Средние века, в. 3, М., 1951; Граменицкий Д. С., К вопросу о происхождении и содержании франкского иммунитета, там же, в. 2, М., 1946.
Я. Д. Серовайский.
Иммунитет консульский
Иммуните'т ко'нсульский,льготы и преимущества консульского учреждения и сотрудников консульства для беспрепятственного и нормального выполнения ими консульских функций. Вопросы И. к. регулируются внутренним законодательством каждого государства, международными конвенциями и обычаями. Кодификацией норм, относящихся к И. к., является Венская конвенция о консульских сношениях 1963. В СССР вопросы И. к. регулируются Положением о дипломатических и консульских представительствах иностранных государств на территории СССР от 23 мая 1966 и консульскими конвенциями, заключёнными СССР с другими странами.
В отличие от
, некоторые И. к. по советскому законодательству предоставляются только на основе взаимности. Например, в соответствии со ст. 21 Положения помещения консульства и резиденция главы консульства пользуются неприкосновенностью: доступ в эти помещения может быть разрешён главой консульства, равно как и принудительные действия в них могут производиться по его просьбе или по просьбе посла этого государства. Неприкосновенность помещений не даёт, однако, права использования их в целях, несовместимых с функциями консульства. Неприкосновенны архивы и документы. Консульства имеют право вывешивать флаг и устанавливать эмблему представляемого государства. И. к. включает также право сношения со своим правительством, с консульскими и дипломатическими представительствами своей страны, используя обычные средства связи, шифрованные телеграммы, а также дипломатическую почту.
Консульские представители пользуются личной неприкосновенностью и могут быть арестованы или задержаны только в случае преследования за совершение тяжкого преступления или исполнения вступившего в законную силу приговора суда. Они обладают иммунитетом от уголовной, административной и гражданской юрисдикции в их служебной деятельности (это положение не распространяется, как правило, на иски о возмещении вреда, причинённого дорожно-транспортным происшествием), Сотрудники консульства не могут отказываться от дачи свидетельских показаний, кроме показаний по вопросам, связанным с выполнением ими служебных обязанностей. В случае отказа дать свидетельские показания к ним не могут применяться меры принуждения. На основе взаимности им предоставляется фискальный иммунитет (освобождение от налогов и пошлин).
Консульские конвенции, заключённые СССР с другими государствами, в некоторых отношениях приравнивают И. к. к иммунитетам, которыми пользуются дипломатические представители (например, консульские конвенции, заключённые СССР с Болгарией, ГДР, Чехословакией, Великобританией, Японией и др.).
И. К. Городецкая.
Иммунитет растений
Иммуните'т расте'ний,невосприимчивость растений к возбудителям болезней и вредителям, а также к продуктам их жизнедеятельности. Частные проявления И. р. — устойчивость (резистентность) и выносливость. Устойчивость заключается в том, что растения какого-либо сорта (иногда вида) не поражаются болезнью или вредителями либо поражаются менее интенсивно, чем другие сорта (или виды). Выносливостью называется способность больных или поврежденных растений сохранять свою продуктивность (количество и качество урожая). Применение устойчивых сортов — наиболее надёжный метод борьбы со многими болезнями растений (ржавчиной хлебных злаков, головнёй и ржавчиной кукурузы и др.). Возделывание сортов подсолнечника, устойчивых против заразихи и моли, привело к почти полной ликвидации поражения его этими вредителями.
Основатель учения об И. р. — советский биолог Н. И.
, положивший начало изучению его генетической природы. Он считал, что устойчивость против паразитов выработалась в процессе эволюции растений в центрах их происхождения на фоне длительного (в течение тысячелетий) естественного заражения возбудителями болезней. Если в результате эволюции растения приобретали гены устойчивости к патогенам — возбудителям болезней, то последние приобретали свойство поражать устойчивые сорта вследствие появления новых физиологических рас. Так, у возбудителя стеблевой ржавчины — гриба Puccinia graminis tritici выявлено свыше 250 рас. Каждый сорт пшеницы может быть восприимчивым к одним расам и иммунным к другим. Новые расы фитопатогенных микроорганизмов возникают в результате гибридизации, мутаций или гетерокариозиса (разноядерности) и других процессов. Возможны также сдвиги численности рас внутри популяции микроорганизма в связи с изменением сортового состава растений в том или ином районе. Появление новых рас возбудителя может быть связано с потерей устойчивости сортом, невосприимчивым к данному возбудителю болезни.
И. р. к заболеваниям контролируется сравнительно небольшим числом
, поддающихся учёту при гибридологическом анализе. Например, у разных видов пшеницы обнаружено около 20 генов устойчивости к стеблевой ржавчине, которые локализованы на 9 хромосомах, находящихся в разных хромосомных наборах (
).
Устойчивость или восприимчивость растений — результат взаимодействия двух геномов (растения и паразита), что и объясняет многообразие как генов устойчивости растений к одному и тому же виду возбудителя, так и физиологических рас паразита, способных преодолевать действие этих генов. Такое многообразие — следствие параллельной эволюции паразита и растения-хозяина (Н. И. Вавилов, П. М. Жуковский). Американский генетик и фитопатолог Х. Г. Флор выдвинул гипотезу «ген на ген». По этой теории, все гены резистентного растения (R-гены) рано или поздно должны быть преодолены генами вирулентности паразита, так как темп его размножения намного выше, чем у растения. Тем не менее в природе всегда можно найти растения, устойчивые ко всем известным расам паразитов. Одна из важнейших причин этой стойкости растений — наличие у них так называемой полевой устойчивости (типы устойчивости, при которых паразит может развиваться, но вследствие недостатка пищи в растении, из-за наличия механических преград, неблагоприятного строения устьиц и т. п. развивается медленно, и потери урожая в связи с этим невелики). Полевая устойчивость контролируется полимерными генами, каждый из которых не даёт видимого эффекта устойчивости, но их различные сочетания определяют ту или иную её степень.
Единой теории И. р. нет вследствие большого разнообразия типов возбудителей болезней и защитных реакций растений. Н. И. Вавилов подразделял И. р. на структурный (механический) и химический. Механический И. р. обусловлен морфологическими особенностями растения-хозяина, в частности наличием защитных приспособлений (например, густое опушение побегов и т. д.), которые препятствуют проникновению патогенов в тело растений. Химический И. р. обусловлен многими химическими особенностями растений. Иногда И. р. зависит от недостатка в растении какого-либо необходимого для паразита вещества, в других случаях растение вырабатывает вещества, вредные для паразита (фитоалексины немецкого биолога К. Мюллера; фитонциды советского биолога Б. П. Токина). Советский микробиолог Т. Д. Страхов наблюдал, что в тканях устойчивых к болезням растений происходят регрессивные изменения патогенных микроорганизмов, связанные с действием ферментов растения, его обменными реакциями. Советский биохимики Б. А. Рубин и другие связывают реакции растений, направленные на инактивацию возбудителя болезни и его токсинов, с деятельностью окислительных систем и энергетическим обменом клетки. Различные ферменты растений, регулирующие энергообмен, характеризуются разной степенью устойчивости к продуктам жизнедеятельности патогенных микроорганизмов. У иммунных форм растений доля участия ферментов, устойчивых к метаболитам патогенов, более значительна, чем у неиммунных. Наиболее устойчивы к влиянию метаболитов окислительные системы (пероксидазы и полифенолоксидазы), а также ряд флавиновых ферментов. В инфицированных клетках иммунных растений активность этих ферментов не только не падает, но даже возрастает. Это активирование обусловлено биосинтезом ферментных белков, как идентичных присутствующим в незаражённых тканях, так и отличающихся от них по ряду свойств (так называемых
). У растений, как и у беспозвоночных животных, не доказана способность вырабатывать антитела в ответ на антигены. Только у позвоночных имеются специальные органы, клетки которых вырабатывают антитела (см.
,
). В инфицированных тканях у иммунных растений образуются полноценные в функциональном отношении органоиды протоплазмы — митохондрии, пластиды, рибосомы, которые обусловливают присущую иммунным формам растений способность не только сохранять, но и повышать при инфекции энергетическую эффективность дыхания. Вызываемые болезнетворными агентами нарушения дыхания сопровождаются образованием различных соединений, выполняющих, в частности, роль своеобразных химических барьеров, препятствующих распространению инфекции. Следовательно, И. р. — выражение особенностей протопласта, клетки, ткани, органа и организма в целом, представляющего сложную, разнокачественную и в то же время функционально единую биологическую систему. Характер ответных реакций растений на повреждения вредителями, паразитами — образование химических, механических и ростовых барьеров, способность к регенерации поврежденных тканей, замена утраченных органов — всё это играет важную роль в И. р. к вредителям и паразитам. Вместе с тем в ряде случаев существенное значение для проявления И. р. имеют содержание в тканях некоторых химических соединений, анатомические особенности растений и т. д. В большой степени это относится к явлениям И. р. к вредителям-насекомым. Так, ряд продуктов так называемого вторичного обмена растений (алкалоиды, гликозиды, терпены, сапонины и др.) оказывает токсическое действие на пищеварительный аппарат, эндокринную и нейрогуморальную системы насекомых и других вредителей растений.
В селекции растений на устойчивость к заболеваниям и вредителям наибольшее значение имеет гибридизация (внутрисортовая, межвидовая и даже межродовая). Исходным материалом для селекции служат авто- и амфиполиплоиды, на основе которых получают гибриды между разнохромосомными видами. Такие
созданы, например, советским селекционером М. Ф. Терновским при получении сортов табака, устойчивых к мучнистой росе. Для создания устойчивых сортов можно использовать искусственный
, а у перекрёстноопыляемых растений — отбор среди гетерозиготных популяций. Таким способом советские селекционеры Л. А. Жданов и В. С. Пустовойт получили сорта подсолнечника, устойчивые к заразихе. Для длительного сохранения устойчивости сортов предложено: 1) создание многолинейных сортов путём скрещивания хозяйственно ценных сортов с сортами, несущими разные гены устойчивости. При этом вследствие разнообразия генов устойчивости у полученных гибридов новые расы паразитов не могут накопиться в достаточном количестве; 2) сочетание в одном сорте R-генов с генами полевой устойчивости. Повышению устойчивости способствует также периодическая смена сортового состава в том или ином районе или хозяйстве.
Лит.:Дунин М. С., Иммуногенез и его практическое использование. Рига, 1946; Гойман Э., Инфекционные болезни растений, пер. с нем., М., 1954; Стэкмен Э., Харрар Д., Основы патологии растений, пер. с англ., М., 1959; Горленко М. В., Краткий курс иммунитета растений к инфекционным болезням, 2 изд., М., 1962; Вавилов Н. И., Избр. труды, т. 4, М. — Л., 1964; Гешеле Э. Э., Основы фитопатологической оценки в селекции, М., 1964; Вердеревский Д. Д., Иммунитет растений к инфекционным болезням, Кишинев, 1968; Метлицкий Л. В., Озерецковская О. Л., Фитоиммунитет, М., 1968; Рубин Б. А., Арциховская Е. В., Биохимия и физиология иммунитета растений, 2 изд., М., 1968; Жуковский П. М., Культурные растения и их сородичи, 3 изд., Л., 1971.
М. В. Горленко. Б. А. Рубин.
Иммуногенетика
Иммуногене'тика,комплексная научная дисциплина, сочетающая методы иммунологии, молекулярной биологии и генетики для изучения наследственных факторов
, внутривидового разнообразия и наследования тканевых
, генетических и популяционных аспектов взаимоотношений макро- и микроорганизма и
. Начало И. положили работы немецких учёных П. Эрлиха и Ю. Моргенрота, обнаруживших в начале 20 в. группы крови у коз, и открытие К. Ландштейнером
у человека. Термин «И.» предложен американским учёным М. Ирвином в 1930.
Индивидуальная и видовая устойчивость растений и животных к бактериальным и вирусным инфекциям обеспечивается сложной многоступенчатой системой защитных сил организма. В борьбе между защитными силами и инфекционными агентами «преимущество» часто остаётся на стороне последних, так как микроорганизмы быстро размножаются, образуя многомиллионные популяции, в которых рано или поздно возникают мутантные формы с более агрессивными свойствами, чем у исходного штамма. Вероятно, как ответное защитное средство на определённом этапе эволюции позвоночных животных возникла система адаптивного иммунитета (антителообразование) — наиболее мощная линия обороны организма, особенно при повторных контактах с инфекционными агентами. Способность (или неспособность) вырабатывать антитела — наследственный признак. Генетическая регуляция биосинтеза антител имеет характерные особенности. Так, образование одной полипептидной цепи молекулы антитела контролируется двумя разными
. Один из них контролирует образование части цепи, участвующей в построении
; строение этой части различно у антител разной специфичности. Другой ген контролирует образование части цепи, строение которой одинаково у антител, относящихся к данному классу
.
Помимо групповых антигенов, существуют наследуемые их варианты, специфичные для отдельных типов клеток, например для лейкоцитов. Различия в строении лейкоцитарных антигенов у донора и реципиента — одна из причин несовместимости при пересадке органов и тканей. Наследственные внутривидовые различия в строении многих белков сыворотки крови (
,
и др.) контролируются, как правило, аллельными генами, причём частота каждой
в популяции высока (20% и выше), что указывает на «давление» естественного отбора. Одна из важнейших задач И. — установление факторов, обусловливающих распространение в популяциях новых аллелей. Таким фактором может служить сходство в строении антигенов у болезнетворных микроорганизмов и макроорганизма. Животные в норме не вырабатывают
к собственным антигенам, поэтому сходство в антигенном строении между каким-либо компонентом микробной клетки и той или иной молекулой макроорганизма приведёт к тому, что последний не сможет синтезировать антитела, обезвреживающие данный вид микроба. В связи с этим снижаются защитные силы макроорганизма. Поэтому отбор будет подхватывать появление видоизменённых молекул белков (или полисахаридов), повышая тем самым иммунную устойчивость организма. Распространение в популяции новых аллелей может происходить также и в тех случаях, когда в результате
соответствующего гена молекула макроорганизма изменяется так, что ферментативные системы микроба уже не могут её использовать в качестве субстрата. Иногда для этого достаточно замены одной аминокислоты в полипептидной цепи, как это имеет место у некоторых мутантных форм
. Такие формы распространились в районах земного шара, где высока заболеваемость малярией: носители мутантного гемоглобина не болеют малярией, так как малярийный плазмодий неспособен использовать его в качестве субстрата. В ряде случаев распространяются мутации, которые изменяют биохимию клетки или органа в целом и тем самым нарушают приспособленность паразита. По-видимому, существуют и другие механизмы наследственного иммунитета, благодаря которым достигается наследственная гетерогенность вида-хозяина, препятствующая распространению паразитического штамма микроорганизма.
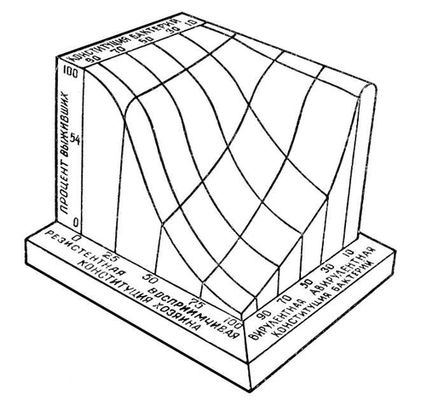
Таким образом, степень естественной устойчивости к заболеванию животных данного вида определяется многими факторами, суммарно отражая особенности конституции и животного, и возбудителя заболевания. Трёхмерная модель этих взаимоотношений представлена на
рис.
, где показано, что процент особей, выживших после инфекции, зависит как от наследственной устойчивости организма к возбудителю заболевания, так и от вирулентности последнего.
Наследственная устойчивость к заболеваниям, как правило, специфична, так как физиологические основы устойчивости к разным заболеваниям обычно неодинаковы. Так, африканский скот зебу, прекрасно переносящий жару и устойчивый к туберкулёзу очень чувствителен к трипаносомозу; линия белых леггорнов, устойчивая к моноцитозу кур, чувствительна к куриному лейкозу; линии мышей, устойчивые к мышиному тифу, чрезвычайно восприимчивы к вирусу ложного бешенства. С древнейших времён генетическая устойчивость отдельных особей, пород, рас и т. д. к заболеваниям служила предпосылкой для
. Так были выведены овцы породы ромни-марш, устойчивые к трихостронгилидам, раса кроликов, устойчивая к миксоматозу, и медоносные пчёлы, устойчивые к американскому гнильцу. Естественный отбор на устойчивость существовал и среди людей. Так, после открытия Нового Света оказалось, что индейцы Северной Америки более чувствительны к кори и ветряной оспе, чем европейцы, для которых эти заболевания были привычны и легко переносимы.
В основе генетической устойчивости к заболеваниям лежат разнообразные механизмы, в том числе и неиммунологические. Белые леггорны, например, устойчивы к белому поносу потому, что имеют более совершенную терморегуляцию; устойчивость скота зебу к клещевым заболеваниям обусловлена более толстой кожей и особенностями кожных выделений, которые отпугивают клещей. Чувствительность к оспе у лиц с группами крови А и AB связана с общностью антигена А человека и антигенов вируса оспы. Поэтому лица с группами крови В и О(Н) легче переносят оспу.
Перенесение генетических представлений в область иммунологии позволило советскому учёному В. П. Эфроимсону сформулировать эволюционно-генетическую концепцию иммуногенеза, объясняющую внутривидовое антигенное разнообразие и гетерогенность антител по специфичности. Каждая здоровая зрелая в иммунологическом отношении особь способна к иммунному ответу на тканевые антигены особи с другим генотипом. Таким образом, тканевая несовместимость — универсальная биологическая закономерность. Лишь однояйцевые близнецы и животные одной
не разделены барьером тканевой несовместимости, выраженность которой зависит от степени несходства генотипов донора и реципиента. Для успешных пересадок органов и тканей, переливаний крови и клеток костного мозга очень важно снизить до минимума величину этого несходства путём подбора совместимого донора. Изучение клеточных антигенов, их наследования и разнообразия, их обнаружение (типирование) — это те разделы И. , которые особенно важны для трансплантологии, трансфузиологии, иммуногематологии и клинической иммунологии. См. также
.
Лит.:Медведев Н. Н., Линейные мыши, Л., 1964; Хатт Ф., Генетика животных. пер. с англ., М., 1969; Эфроимсон В. П., Иммуногенетика, М., 1971; Hildemann W. Н., Immunogenetics, San Francisco, 1970.
А. Н. Мац, О. В. Рохлин.
Трёхмерное изображение зависимости жизнеспособности макроорганизма от его устойчивости к патогенным агентам и от вирулентности возбудителя.
Иммуноглобулины
Иммуноглобули'ны(Ig), глобулярные белки, содержащиеся в сыворотке крови позвоночных животных и человека. И. образуют группу близких по химической природе соединений, в состав которых входят также углеводы. По-видимому, все И. являются
к каким-либо
. Известно 5 классов И. человека: G, М, A, D, Е (
см. табл.
). Наиболее полно изучены И. класса G (IgG). Их молекулы построены из двух идентичных лёгких (молекулярная масса 22000) и двух идентичных тяжёлых (молекулярная масса 55000—70000) полипептидных цепей, скрепленных дисульфидными связями (
см. рис.
). При расщеплении протеолитическими ферментами (например, папаином) молекула И. распадается на три части: два одинаковых фрагмента (обозначаются Fab), каждый из которых сохраняет способность к связыванию с антигеном, и фрагмент (обозначается Fc), способствующий прохождению И. через
. Все три фрагмента соединены короткими гибкими участками, расположенными в середине тяжёлой цепи. Гибкость позволяет молекулам И. оптимально присоединяться к антигенам, имеющим разное пространственное строение. Участки молекулы, ответственные за связывание с антигеном (
), образованы N-кoнцевыми (несут на конце аминогруппу — NH
2) отрезками тяжёлых и лёгких цепей. Последовательность аминокислот в этих отрезках специфична для каждого IgG, в других участках цепей она почти не варьирует. На основании различий в строении тяжёлых цепей И. относят к определённым классам.
Особенности разных классов иммуноглобулинов здорового человека
Класс иммуноглобулина
Молекулярная масса
Содержание углеводов, %
Содержание в сыворотке,
мг %
lgG
140 000
2
800-1680
lgM
900 000
10
50-190
lgA
170 000 и выше
7
140-420
lgD
180 000
12
3-40
lgE
196 000
10
0,01-0,14
Большинство антител находится главным образом среди IgG (применяемые в лечебных целях препараты
состоят преимущественно из IgG). IgM эволюционно наиболее древние И.; они синтезируются на первых стадиях иммунной реакции. Их молекулы состоят из 5 мономерных субъединиц, каждая из которых напоминает молекулу IgG. Для IgA характерна способность проникать в различные секреты (слюну, молозиво, кишечный сок), где они встречаются в полимерной форме. Антитела, участвующие в аллергических реакциях (см.
), относятся к недавно открытым IgE.
И. синтезируются лимфатическими клетками. При некоторых поражениях этих клеток в крови и моче накапливается большое количество так называемых миеломных И., которые, в отличие от И. здорового организма, однородны по составу. См. также
и
.
Лит.:Гауровиц Ф., Иммунохимия и биосинтез антител, пер. с англ., М., 1969: Незлин Р. С., Биохимия антител, М., 1966; Портер Р., Структура антител, в сборнике: Молекулы и клетки, в. 4, пер. с англ., М., 1969; Kabat Е. A., Structural concepts in immunology and immunochemistry, N. Y., 1968.
Р. С. Незлин.
Схема молекулы иммуноглобулина G. Показаны две тяжёлые и две лёгкие полипептидные цепи, соединённые межцепьевыми дисульфидными связями. Лёгкая цепь состоит из 2, тяжёлая — из 4 структурных единиц (петель), образованных внутрицепьевыми дисульфидными связями. Жирными линиями обозначены N-кoнцевые участки цепей, стрелкой — участок, чувствительный к протеолитическому расщеплению, в результате которого молекула распадается на два Fab —фрагмента, сохраняющих активность антител, и на Fc —фрагмент.
Иммунодиагностика
Иммунодиагно'стика(от
и
), раздел практической
, задача которого — распознавание инфекционных болезней при помощи серологических реакций (бактериолиза, агглютинации, преципитации и др.), а также
. Серологическими реакциями пользуются также при определении
и в судебной медицине для выяснения принадлежности крови человеку или тому или иному виду животных.
И. используется в ветеринарной практике для распознавания многих инфекционных болезней животных, а также выявления больных животных и микробоносителей. Для диагностики туберкулёза, бруцеллёза, сапа И. осуществляется систематически, в плановом порядке.
Иммунология
Иммуноло'гия(от
и
), наука о защитных реакциях организма, направленных на сохранение его структурной и функциональной целостности и биологической индивидуальности. И. — быстро развивающаяся дисциплина широкого биологического профиля, выросшая как отрасль медицинской микробиологии. Теоретические направления в И. — изучение на клеточном и молекулярном уровне механизма образования антител, их патогенетической роли, филогенеза и онтогенеза иммунной системы — всё чаще объединяют термином иммунобиология.
И. берёт своё начало из следующего наблюдения: люди, перенёсшие заразное заболевание, обычно могут без опасности для себя ухаживать за больными во время эпидемий данного заболевания. В 1796 Э.
разработал способ искусственной иммунизации против оспы путём заражения человека коровьей оспой. Начало И. как самостоятельной науке положило открытие Л.
(1880), обнаружившего, что иммунизация кур старой холерной культурой создаёт у них устойчивость к заражению высоковирулентным возбудителем куриной холеры. Пастер сформулировал основной принцип создания
и получил вакцины против сибирской язвы и бешенства. И. И.
(1887) открыл феномен
и создал клеточную (фагоцитарную) теорию иммунитета. К 1890 работами немецкого бактериолога Э. Беринга и его сотрудников было показано, что в ответ на введение микробов и их ядов в организме вырабатываются защитные вещества —
. Немецкий учёный П. Эрлих (1898, 1900) выдвинул гуморальную теорию иммунитета. В 1898—99 бельгийский учёный Ж. Борде и русский учёный Н. Н. Чистович обнаружили образование антител в ответ на введение чужеродных эритроцитов и сывороточных белков. Это открытие положило начало неинфекционной И. В 1900 австрийский иммунолог К. Ландштейнер открыл
человека и создал основу учения о тканевых изоантигенах (см.
). Новое, предсказанное австралийским учёным Ф.
направление в И. — учение об иммунологической толерантности — возникло после экспериментального воспроизведения этого феномена английским учёным П. Медаваром (1953).
Начало отечественной И. положили работы И. И. Мечникова, А. А. Безредки, Г. Н. Габричевского, Н. Ф. Гамалеи, Л. А. Тарасевича. Советская И. 20—30-х гг. наряду с решением практических вопросов плодотворно занималась теоретическими исследованиями (работы И. Л. Кричевского, В. А. Барыкина, В. А. Любарского, С. И. Гинзбург-Калининой). В 40—60-е гг. проблемы И. успешно решались под руководством Л. А. Зильбера, П. Ф. Здродовского, Г. В. Выгодчикова, М. П. Покровской, В. И. Иоффе, А. Т. Кравченко, П. Н. Косякова и др.
И. развивается очень быстрыми темпами, особенно на стыках с химией, генетикой, физиологией, радиобиологией и др. отраслями биологии и медицины. И. состоит из ряда более или менее четко определившихся направлений
(
см. рис. 1), перечисленных ниже.
Иммуноморфология изучает анатомию, гистологию и цитологию иммунной системы организма. В ней используются гистологические и цитологические методы исследования, культивирование клеток вне организма, световая, флуоресцентная и электронная микроскопия, авторадиография и др. В последние годы весь процесс первичного иммунного ответа лимфоидных клеток удалось воспроизвести в пробирке. Установлено, что специфический иммунный ответ, а отчасти и естественная устойчивость организма обеспечиваются функцией его лимфоидной системы и рассеянных по всем тканям фагоцитирующих клеток (см.
). Свойством захватывать антиген обладают нейтрофильные и эозинофильные гранулоциты, моноциты и тромбоциты в крови; гистиоциты в соединительной ткани; микроглия в мозге; синусные клетки печени, селезёнки, надпочечников, костного мозга и передней доли гипофиза; ретикулярные клетки селезёнки, лимфатических узлов, костного мозга, тимуса (вилочковой, или зобной, железы) и небольшая часть циркулирующих лимфоцитов. Основная масса введённого во внутреннюю среду организма антигена захватывается, разрушается и устраняется этими клетками. Лишь доли процента антигенных молекул сохраняются долгое время, вызывая специфические иммунологические реакции. Особо важную роль приписывают тем молекулам антигена, которые оседают на поверхности ретикулярных клеток в лимфатических узлах. Иммунный ответ происходит при взаимодействии, по крайней мере, двух типов малых лимфоцитов
(
рис. 2), которые постоянно мигрируют в тканях, циркулируя по лимфатическим и кровеносным путям.