Гидраденит
Гидрадени'т(от греч. hidros — пот и aden — железа), сучье вымя, гнойное воспаление потовых желёз. Вызывается
; развивается обычно в подмышечных впадинах, реже — вокруг грудных сосков, половых органов (у женщин), кожи мошонки, заднего прохода. К заболеванию предрасполагают ослабление организма, потливость, опрелость, нечистоплотность. Г. начинается с воспаления потовой железы, к которому присоединяется воспаление окружающей подкожножировой клетчатки. В глубине кожи появляются один или несколько плотных болезненных узелков, кожа над ними краснеет. Затем узелки размягчаются и вскрываются с образованием гнойных свищевых ходов. Гной попадает в соседние железы и заражает их. Течение Г. длительное, часто с рецидивами. Женщины болеют чаще. Лечение: антибиотики, физиотерапия, специфическая вакцинация и неспецифическая иммунотерапия; иногда — хирургическая операция.
Лит.:Многотомное руководство по дермато-венерологии, под ред. С. Т. Павлова, т. 2, Л., 1961.
Гидразин
Гидрази'н, диамид, H
2N—NH
2, бесцветная, гигроскопичная, дымящая на воздухе жидкость;
t
kип113,5°С,
t
пл2°С, плотность 1,008
г/см
3(при 20°С). Г. неограниченно растворим в воде и низших спиртах. Нерастворим в углеводородах и др. органических растворителях. Водные растворы Г. обладают основными свойствами (

= 8,5 · 10
-7). С кислотами образует соли гидразония, например N
2H
5Cl, N
2H
6Cl
2. Г. характеризуется высокой диэлектрической проницаемостью (52,9 при 20°С) и способен растворять многие неорганические соли. Г. — эндотермическое соединение; теплота образования DH°
298(ж) = 50,24
кдж/моль(12,05
ккал/моль). При нагревании до 200—300° С Г. разлагается на N
2и NH
3. В присутствии Fe
2O
3воспламеняется при комнатной температуре. С воздухом пары Г. при содержании 4,67% по объёму и выше образуют взрывоопасные смеси. Жидкий Г. не чувствителен к удару, трению и детонации. Токсичен; предельно допустимая концентрация в воздухе 0,0001
мг/л. Получают Г. окислением NH
3или мочевины гипохлоритом. Применяют в органическом синтезе, производстве пластмасс, резины, инсектицидов, взрывчатых веществ, как горючий компонент в жидких
. См. также
.
Лит.:Одрит Л. и Огг Б., Химия гидразина, пер. с англ., М., 1954.
В. С. Лапик.
Гидразосоединения
Гидразосоедине'ния, органические соединения, содержащие гидразогруппу —NH—NH—, связанную с двумя углеводородными радикалами RNH—NHR.
Практическое значение имеют ароматические Г. Ar—NH—NH—Ar — кристаллические бесцветные вещества с очень слабыми основными свойствами, нерастворимые в воде, растворимые в спирте, эфире, бензоле. При действии сильных восстановителей ароматические гидразосоединения образуют амины: Ar—NH—NH—Ar+2H ® 2ArNH
2; кислородом Г. окисляются до
:Ar—NH—NH—Ar ® ArN = NAr. Под действием минеральных кислот ароматические Г. изомеризуются в диаминодифенилы (см.
). Ароматические Г. получают восстановлением нитросоединений в щелочной среде (цинковой пылью, электролитически). Наиболее простое ароматическое Г. — гидразобензол, C
6H
sNH—NHC
6H
5, открыто Н. Н. Зининым (1845). Ароматические Г. получают в больших количествах как промежуточные продукты при производстве
и его производных (толидина, дианизидина и др.), являющихся важными исходными веществами для получения
.
Гидрангиевые
Гидра'нгиевые(Hydrangeaceae), семейство двудольных растений. Небольшие деревья или кустарники, лианы, полукустарники и травы. Цветки в цимозных соцветиях. Плод — коробочка, редко ягодовидный. Около 20 родов и более 250 видов в умеренных и субтропических областях Северного полушария, главным образом в Северной Америке и в Восточной Азии. В СССР 7 видов — представители родов
,
и чубушник. Многие Г., дикорастущие и интродуцированные, часто разводят в садах и парках как декоративные и медоносные. Отнесение Г. к камнеломковым устарело. Г. следует сближать с семейством Escalloniaceae. Иногда род чубушник и близкие к нему роды выделяют в особое семейство Philadelphaceae.
Лит.:Заиконникова Т. И., О самостоятельности сем. Hydrangeaceae Dum., в сборнике: Новости систематики высших растений, М. — Л., 1964; Тахтаджян А. Л., Система и филогения цветковых растений, М. — Л., 1966.
Гидрангия
Гидра'нгия(Hydrangea), род растений семейства гидрангиевых. Главным образом листопадные кустарники, иногда древовидные лианы и небольшие деревья. Листья супротивные или расположенные мутовчато по 3, с зубчатыми краями. Цветки собраны в щитки или метёлки. Краевые, а иногда и все цветки соцветия бесплодны и имеют 4—5 крупных белых, голубых или розовых чашелистиков. Полноценные цветки обычно невзрачны. Плод — коробочка. Около 80 видов в Южной и Северной Америке, в Восточной и Юго-Восточной Азии; в СССР — 2. Некоторые виды Г. широко используются в цветоводстве под названием
.
Гидрант
Гидра'нт, см.
.
Гидранты
Гидра'нты(зоологическое), многочисленные бокаловидные особи, сидящие на общем стволе и составляющие колонии бесполого поколения (полипы) водных кишечнополостных животных —
.
Гидраргиллит
Гидраргилли'т(от греч. hydor —вода и argillos — белая глина), гиббсит, минерал, химический состав — А1[ОН]
3. Содержит 65,4% глинозёма (Al
2O
3); известны примеси Fe
3+и Ga
3+, замещающие в структуре A1
3+. Кристаллизуется в моноклинной системе; кристаллическая структура слоистая, сложена из двулистных пакетов (OH), в середине которых размещены ионы A1
3+. По слабым межпакетным связям проходит хорошая спайность. Г. образует мелкие тонкопластинчатые, обычно бесцветные с перламутровым блеском кристаллики, а также порошковатые массы и корочки с радиально-лучистой или чешуйчатой микроструктурой. Твёрдость по минералогической шкале 2,5—3,5; плотность 2300—2400
кг/м
3. Г. обычно образуется при выветривании пород, богатых глинозёмом. Вместе с др. гидроокислами алюминия (диаспор, бёмит) и железа Г. входит в состав бокситовых руд. Гидраргиллитовые бокситы относятся к лучшим алюминиевым рудам.
Гидрастис
Гидра'стис(Hydrastis), род травянистых многолетних растений семейства лютиковых, иногда выделяемый в семейство гидрастиевых. 2 вида на востоке Северной Америки и в Восточной Азии. Г. канадский, или желтокорень, золотая печать (Н. canadensis), — лекарственное северо-американское растение, культивируемое в средней полосе Европейской части СССР и на Украине. Корневище на изломе золотисто-жёлтое, снаружи со следами отмерших стеблей, имеющих вид печати. Стебель высотой до 30
см. Цветки одиночные, с чашечковидным околоцветником из 3 зеленовато-белых листочков; тычинки и пестики многочисленные. Плод ягодообразный, красный.
Корневище содержит
гидрастин, берберин и др., применяемые как кровоостанавливающие средства.
Лит.:Атлас лекарственных растений СССР, М., 1962.
Т. В. Егорова.
Гидрастис канадский; а — цветок.
Гидратация
Гидрата'ция(от греч. hydor — вода), процессы связывания воды химическими веществами. Различают несколько видов Г.
Г. окислов приводит к гидроокисям, представляющим собой щёлочи, кислоты или амфотерные соединения. Так, присоединение воды к окиси кальция даёт гидроокись кальция (в технике этот процесс называется «гашение извести»):
СаО + H
2O = Ca (OH)
2.
Г. серного ангидрида в промышленности чают серную кислоту, а окислов азота — азотную кислоту:
SO
2+ H
2O = H
2SO
4,
3NO
2+ H
2O = 2HNO
3+ NO.
При Г. трёхокиси мышьяка образуется слабая мышьяковистая кислота, имеющая амфотерные свойства:
As
2O
3+ 3H
2O = 2H
3AsO
3.
Г. органических соединений происходит по кратным связям; в случае циклических соединений Г. приводит к раскрытию циклов. Обычно эти реакции происходят в присутствии щелочей, кислот или гетерогенных катализаторов (каталитическая Г.). Г. этого типа играет огромную роль в препаративной органической химии и промышленности органического синтеза. Так, в результате прямой Г. олефинов получают спирты, например этиловый спирт из этилена:
CH
2= CH
2+ H
2O ® CH
3CH
2OH.
Г. ацетилена приводит к ацетальдегиду (реакция Кучерова) (промежуточный продукт — неустойчивый виниловый спирт):
CH є CH + H
2O ® [СН
2=СН—ОН] ® CH
3CHO.
В результате Г. кетена образуется уксусная кислота, а окиси этилена — этиленгликоль:

В перечисленных примерах вода реагирует таким образом, что происходит разрыв связи между атомом водорода и группой OH.
Многие неорганические и некоторые органические вещества образуют с водой твёрдые
, постоянного состава, которые ведут себя как индивидуальные химические соединения. Так, безводный сульфат меди CuSO
4бесцветен; из его водных растворов кристаллизуется ярко-синий гидрат CuSO
4·5H
2O — медный купорос, при нагревании которого образуется сначала голубой CuSO
4·3H
2O, затем CuSO
4·H
2O белого цвета; при 258°С соль полностью обезвоживается. К этому же типу относится Г. молекул в растворах с образованием гидратов различного состава, находящихся в равновесии друг с другом и водой; например, при растворении спирта образуются гидраты с 3,4 и 8 молекулами H
2O. При растворении электролитов происходит Г. ионов, затрудняющая ассоциацию последних. Энергия Г. в значительной степени компенсирует энергию диссоциации электролита; т. о., Г. ионов является одной из главных причин
в водных растворах. Образование кристаллогидратов и Г. молекул и ионов в растворах являются частными случаями
, т. е. присоединения молекул растворителя. К Г. относят также процессы, приводящие к связыванию воды за счёт адсорбционных сил (см.
). См. также
.
В биологических системах при Г. происходит присоединение (связывание) воды различными субстратами организма. Вода, входящая в образующиеся при Г. гидратные оболочки, составляет основное количество т. н. связанной воды протоплазмы клетки. С Г. связаны многие биологические процессы. Так, Г. ионов влияет на их проникновение в клетку, а Г. белков изменяет некоторые их свойства — в частности ферментативную активность.
Процесс, обратный Г., т. е. потеря связанной веществами воды, называется дегидратацией. Г. и дегидратация постоянно происходят в процессах обмена веществ, в частности обмена воды, в организмах.
Гидратообразование
Гидратообразова'ниев природном газе. Многие компоненты природного газа (метан, этан, пропан, изобутан, углекислый газ, азот, сероводород) в соединении с водой образуют т. н. газовые гидраты — твёрдые кристаллические вещества (напоминающие по внешнему виду спрессованный снег), которые при высоких давлениях существуют при положительных температурах.
По структуре «газовые гидраты» —
(клатраты), которые образуются путём внедрения в пустоты кристаллических структур, составленных из молекул H
2O, молекул газа (М). Общая формула газовых гидратов — М·
nH
2O, где значение
nизменяется от 5,75 до 17 в зависимости от состава газа и условий образования гидратов.
При добыче газа гидраты могут образовываться в стволах скважин, промысловых коммуникациях и магистральных газопроводах. Отлагаясь на стенках труб, гидраты резко уменьшают их пропускную способность. Для борьбы с Г. на газовых промыслах вводят в скважины и трубопроводы различные ингибиторы (метиловый спирт, гликоли, 30%-ный раствор CaCl
2), а также поддерживают температуру потока газа выше температуры Г. с помощью подогревателей, теплоизоляцией трубопроводов и подбором режима эксплуатации, обеспечивающего максимальную температуру газового потока. Для предупреждения Г. в магистральных газопроводах наиболее эффективна газоосушка. Г. используется для опреснения морской воды (см.
). Запатентован также ряд способов хранения природных и инертных (Ar, Kr, Xe) газов в виде гидратов. В 1970 советскими учёными доказана принципиальная возможность существования в районах распространения многолетней мерзлоты месторождений природного газа в виде гидратов. Создание эффективных методов поисков и эксплуатации таких месторождений позволит значительно увеличить газовые ресурсы.
Лит.:Макогон Ю. Ф., Саркисьянц Г. А,, Предупреждение образования гидратов при добыче и транспорте газа, М., 1966.
Б. В. Дегтярев.
Гидратцеллюлоза
Гидратцеллюло'за, одна из структурных модификаций целлюлозы, имеет тот же химический состав, что и природная целлюлоза, но отличается от неё по свойствам. Г. получают из природной целлюлозы: осаждением из раствора; обработкой целлюлозы концентрированными (17—35%-ными) растворами щелочей и разложением образовавшейся щелочной целлюлозы; этерификацией целлюлозы и последующим омылением сложных эфиров; механическим размолом целлюлозы.
При образовании Г. происходит ослабление межмолекулярных связей, а следовательно и изменение свойств природной целлюлозы. Г., в отличие от природной целлюлозы, обладает более высокой гигроскопичностью, накрашиваемостью, растворимостью и реакционной способностью. Перевод целлюлозы в Г. — одна из стадий получения
и
.
Гидратцеллюлозные волокна
Гидратцеллюло'зные воло'кна, искусственные волокна, получаемые из хлопковой или древесной целлюлозы по вискозному или медноаммиачному способу. Подробнее см.
,
.
Гидратцеллюлозные плёнки
Гидратцеллюло'зные плёнки, плёнки, формуемые из щелочных растворов ксантогената целлюлозы (вискозы) или получаемые омылением готовой ацетилцеллюлозной плёнки. Промышленность производит в основном Г. п. из вискозы (т. н. целлофан) целлофановым, транспаритовым или сухим методами.
Наиболее распространён целлофановый метод. Он включает следующие стадии: получение вискозы, формование, отделку и сушку плёнки. Формование, а также последующие стадии проводят на одном агрегате — плёночной машине. Вискозу через тарельчатый фильтр равномерно подают в чугунную фильеру с щелевидным отверстием. Из фильеры вискоза попадает в осадительную ванну (смесь растворов сульфата натрия и серной кислоты), где и происходит формование плёнки. После этого плёнка проходит через последовательно расположенные ёмкости (барки), в которых циркулируют растворы различных реагентов, предназначенных для отделки, крашения, пластификации и промывки. Затем плёнку сушат и сматывают в рулоны.
Транспаритовый метод заключается в формовании плёнки вискозы с помощью разливочного приспособления. Вискозу наносят на поверхность вращающегося барабана диаметром около 3
м, нижняя часть которого погружена в осадительную ванну. По выходе из ванны плёнка сматывается с барабана и подвергается тем же обработкам, что и при целлофановом методе.
Транспаритовый метод позволяет получать плёнку с высокой степенью прозрачности и без «полосатости» (штрихов). К недостаткам метода относят низкую производительность и технологические затруднения при изготовлении основного технологического оборудования.
Сухой метод называют также двухванным, т.к. коагуляцию ксантогената проводят в воздушной среде, а омыление — в растворах кислот или органических растворителях. Вискозу подают тонким слоем на вращающийся барабан, где испаряется основное количество влаги и образуется плёнка, которая подсушивается на барабане различное время (в зависимости от её толщины). Затем плёнку омыляют, промывают горячей водой и сушат.
Г. п. нетоксичны, обладают низкой паро- и влагопроницаемостью, а также высокой стойкостью к действию жиров и микроорганизмов. Г. п., полученная сухим способом, обладает высокими эластичными свойствами. В мокром состоянии прочность Г. п. снижается на 65—70%. Свойства Г. п. из вискозы сильно зависят от способа получения.
Модификация проводится с целью получения Г. п., обладающих большей водостойкостью и пониженной паро- и влагопроницаемостью. Кроме того, модификация облегчает переработку Г. п. в изделия методом тепловой сварки и предотвращает слипание Г. п. при хранении в рулонах. Г. п. модифицируют методами т. н. дублирования (нанесение на Г. п. другого полимера, например полиэтилена, в расплавленном состоянии) и лакирования (нанесение другого полимера в виде лака).
Применение. Лакированную плёнку широко используют в качестве упаковочного материала для жирных мясо-молочных продуктов, очищенных фруктов, кондитерских изделий, сигар и пр. Обычная плёнка используется для упаковки непищевых товаров, а также технических продуктов.
Лит.:Козлов П. В., Брагинский Г. И., Химия и технология полимерных пленок, М., 1965; Роговин З. А., Основы химии и технологии производства химических волокон, 3 изд., т. 1, М., 1964, с. 520.
Гидраты
Гидра'ты, продукты присоединения воды к неорганическим и органическим веществам. Термин «Г.» употребляется главным образом по отношению к соединениям, содержащим кристаллизационную воду (
); он сохранился также в некоторых традиционных названиях, например CC1
3CH (OH)
2называется хлоральгидрат. Раньше широко применялось название «гидраты окислов металлов», например NaOH — гидрат окиси натрия, и т.д. В настоящее время для этих соединений употребительно название «гидроокиси металлов» (поскольку, в отличие от кристаллогидратов, они не содержат отдельных молекул H
2O). См.
.
Гидремия
Гидреми'я(от греч. hydor — вода и haima — кровь), разжижение крови, увеличение содержания воды в крови. Различают собственно Г. и гидремическое полнокровие. Собственно Г. — увеличение жидкой части крови без возрастания общей массы крови; возникает обычно при кровопотерях, когда некоторое время объём крови уменьшен, но в результате быстрого поступления в кровеносное русло воды из тканей процентное содержание её в крови увеличивается. Гидремическое полнокровие, сопровождающееся значительным увеличением массы крови, развивается вследствие чрезмерного введения жидкости в организм, при нарушении выделительной функции почек, в период рассасывания больших отёков, асцита, а также при некоторых формах анемий.
Гидриды
Гидри'ды, соединения водорода с другими элементами. В зависимости от характера связи водорода различают три типа Г.: ионные, металлические и ковалентные.
К ионным (солеобразным) Г. относятся Г. щелочных и щёлочноземельных металлов. Это белые кристаллические вещества, устойчивые в обычных условиях и лишь при нагревании разлагающиеся без плавления на металл и водород (кроме LiH, плавящегося при 680°С). Водой энергично разлагаются с выделением водорода. Получаются при взаимодействии металлов с водородом при 200—600°С. LiH и NaH применяются в органическом синтезе как восстановители и конденсирующие агенты. CaH
2— для высушивания и определения воды в органических растворителях, при получении порошков металлов из окислов, а также водорода. Раствором NaH в расплавленной щёлочи снимают окалину с металлических изделий. Ионное строение имеют и двойные Г. —
МеВН
4и алюмогидриды MeA1H
4(см.
), широко используемые в органическом синтезе в качестве эффективных восстановителей.
Г. переходных металлов принадлежат к типу металлических, т.к. по характеру химических связи они сходны с металлами. Эти Г. в большинстве случаев являются соединениями переменного состава, и приводимые ниже формулы дают лишь предельное содержание в них водорода. Многие металлы способны поглощать значительное количество водорода с образованием твёрдых растворов, сохраняющих кристаллическую структуру данного металла. Напротив, истинные Г. имеют структуру иную, чем исходный металл. Для металлов III группы периодической системы (подгруппа Sc и лантаноиды) характерно образование двух типов Г. — MeH
2и MeH
3. Металлы IV группы (подгруппа Ti) образуют Г. MeH
2, а металлы V группы (подгруппа ванадия) — MeH. Г. металлов этих групп — хрупкие твёрдые вещества серого или чёрного цвета, получаются при действии водорода на мелкораздробленные металлы при повышенных температурах. Металлы VI, VII и VIII групп (кроме палладия) при поглощении водорода не дают определённых химических соединений.
Г. переходных металлов служат катализаторами различных химических реакций. Способность металлов образовывать Г. используется в высоковакуумной технике для связывания водорода. В результате образования Г., например при действии паров воды на раскалённый металл и при электролитическом выделении металлов, ухудшается качество металлов (появляется т. н. водородная хрупкость).
Г. переходных металлов I и II групп периодической системы, а также Г. III группы (подгруппа A1) не образуются при взаимодействии металла с водородом. Они получаются, например, при восстановлении соединений этих металлов алюмогидридом лития LiAlH в эфирном растворе. Все они при нагревании легко разлагаются на металл и водород.
Ковалентные Г. образуются неметаллами IV, V, VI и VII групп периодической системы, а также бором. Кроме простейших соединений этого типа (метана CH
4, силана SiH
4и т.п.), являющихся газами, известны Г. с большим числом атомов элемента, соединённых друг с другом в виде цепей, например силаны Si
nH
2n+2. Простейший Г. бора ВН
3не существует,
имеют сложное строение. Г. элементов первых периодов очень стабильны, Г. тяжёлых элементов крайне неустойчивы. Многие Г. (B
2H
6, SiH
4, PH
3) легко воспламеняются на воздухе. B
2H
6и SiH
4разлагаются водой с выделением водорода. Г. элементов V, VI и VII групп водой не разлагаются. Известны многочисленные производные ковалентных Г., в которых часть атомов водорода замещена на атомы галогена или металла, а также на алкильные и др. группы. Ковалентные Г. получают непосредственным взаимодействием элементов, разложением металлических соединений водой или кислотами, восстановлением галогенидов и др. соединений гидридами, борогидридами и алюмогидридами щелочных металлов. Термическое разложение Г. служит одним из методов получения особо чистых элементов (например, кремния, германия).
Лит.:Херд Д., Введение в химию гидридов, пер. с англ., М., 1955; Жигач А. Ф., Стасиневич Д. С., Химия гидридов, Л., 1969; Михеева В. И., Гидриды переходных металлов, М., 1960; Маккей К., Водородные соединения металлов, пер. с англ., М., 1968; Галактионова Н. А., Водород в металлах, 2 изд., М., 1967.
Д. С. Стасиневич.
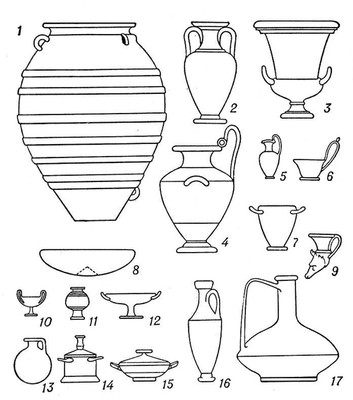
Гидрия
Ги'дрия(греч. hydria, от hydor — вода), древнегреческий сосуд для воды (чаще керамический). Г. имеет две горизонтальные ручки по бокам, за которые её удобно поднимать и поддерживать при переноске на плече, и одну вертикальную, при помощи которой Г. легко наклонять. По форме Г. близка
, но её яйцевидное тулово сильно расширяется кверху, а горло уже и выше. Благодаря этому силуэт Г. более динамичен и наделён более напряжённым ритмом. Г. часто украшались росписью.
Арибалл.
Гидро...
Гидро...(от греч. hydor — вода), начальная часть сложных слов, указывающая на отношение их к воде, водоёмам и т.п., например
,
.
Гидроагрегат
Гидроагрега'т(от
и
), агрегат, состоящий из
и
. Различают горизонтальные осевые и вертикальные Г. Горизонтальные осевые Г. делятся на
и погруженные. К последним относятся
и шахтные с верховым и низовым расположением генератора.
Гидроаккумулирующая электростанция
Гидроаккумули'рующая электроста'нция(ГАЭС), насосно-аккумулирующая электростанция,
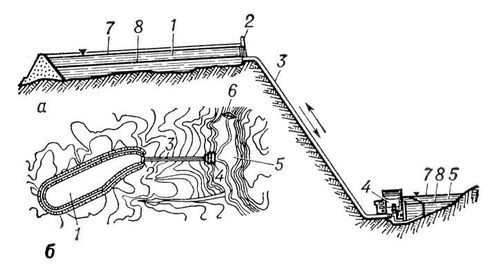
, принцип действия (аккумулирования) которой заключается в преобразовании электрической энергии, получаемой от др. электростанций, в потенциальную энергию воды; при обратном преобразовании накопленная энергия отдаётся в энергосистему главным образом для покрытия пиков нагрузки. Гидротехнические сооружения ГАЭС (
рис.
) состоят из двух бассейнов, расположенных на разных уровнях, и соединительного трубопровода. Гидроагрегаты, установленные в здании ГАЭС у нижнего конца трубопровода, могут быть трёхмашинными, состоящими из соединённых на одном валу обратимой электрической машины (двигатель-генератор), гидротурбины и насоса, или двухмашинными — обратимая электромашина и обратимая гидромашина, которая в зависимости от направления вращения может работать как насос или как турбина. В конце 60-х гг. 20 в. на вновь вводимых ГАЭС стали устанавливать более экономичные двухмашинные агрегаты.
Электроэнергия, вырабатываемая недогруженными электростанциями энергосистемы (в основном в ночные часы суток), используется ГАЭС для перекачивания насосами воды из нижнего водоёма в верхний, аккумулирующий бассейн. В периоды пиков нагрузки вода из верхнего бассейна по трубопроводу подводится к гидроагрегатам ГАЭС, включенным на работу в турбинном режиме; выработанная при этом электроэнергия отдаётся в сеть энергосистемы, а вода накапливается в нижнем водоёме. Количество аккумулированной электроэнергии определяется ёмкостью бассейнов и рабочим напором ГАЭС. Верхний бассейн ГАЭС может быть искусственным или естественным (например, озеро); нижним бассейном нередко служит водоём, образовавшийся вследствие перекрытия реки плотиной. Одно из достоинств ГАЭС состоит в том, что они не подвержены воздействию сезонных колебаний стока. Гидроагрегаты ГАЭС в зависимости от высоты напора оборудуются поворотно-лопастными, диагональными, радиально-осевыми и ковшовыми гидротурбинами. Время пуска и смены режимов работы ГАЭС измеряется несколькими минутами, что предопределяет их высокую эксплуатационную манёвренность. Регулировочный диапазон ГАЭС, из самого принципа её работы, близок двукратной установленной мощности, что является одним из основных её достоинств.
Способность ГАЭС покрывать пики нагрузки и повышать спрос на электроэнергию в ночные часы суток делает их действенным средством для выравнивания режима работы энергосистемы и, в частности, крупных паротурбинных энергоблоков. ГАЭС могут быть с суточным, недельным и сезонным полными циклами регулирования. Наиболее экономичны мощные ГАЭС с напором в несколько сотен
м, сооружаемые на скальном основании. Общий кпд ГАЭС в оптимальных расчётных условиях работы приближается к 0,75; в реальных условиях среднее значение кпд с учётом потерь в электрической сети не превышает 0,66.
ГАЭС целесообразно строить вблизи центров потребления электроэнергии, т.к. сооружение протяжённых линий электропередачи для кратковременного использования экономически не выгодно. Обычный срок сооружения ГАЭС около 3 лет.
В СССР разработано несколько проектов сооружения ГАЭС на территории Европейской части страны, в том числе в районе Москвы; первая ГАЭС с обратимыми гидроагрегатами общей мощностью 200
Мвт(200 тыс.
квт) сооружается (1971) в зоне верхнего
Киевской ГЭС. ГАЭС сооружаются (1971) в ФРГ, США, Великобритании, Австрии, Франции, Японии, ГДР и др. Среди крупных действующих зарубежных ГАЭС: Круахан (Великобритания) — 400
Мвт, напор 440
м, введена в 1966; Том-Сок (США) — 350
Мвт, в двух агрегатах по 175
Мвт, напор 253
м(1963); Хоэнварте-11 (ГДР) — 320
Мвт, напор 305
м(1965); Вианден (Люксембург) — 900
Мвт, напор 280
м(1964). Общая мощность ГАЭС в странах мира к 1970 превысила 15
Гвт(15 млн.
квт).
Лит.:Методы покрытия пиков электрической нагрузки, под ред. Н. А. Караулова, М., 1963; Саввин Ю. М., Гидроаккумулирующие электростанции, М. — Л., 1966; Доценко Т. П., Киевская ГЭС на р. Днепре, «Гидротехническое строительство», 1963, № 5.
Н. А. Караулов, В. А. Прокудин.
Гидроаккумулирующая электростанция (схема): а — вертикальный разрез; б — план: 1 — верхний аккумулирующий бассейн; 2 — водоприёмник; 3 — напорный водовод; 4 — здание электростанции; 5 — нижнее питающее водохранилище; 6 — плотина с водосбросом; 7 — нормальный подпорный уровень воды; 8 — уровень сработки.
Гидроакустика
Гидроаку'стика(от
и
), раздел акустики, изучающий распространение звуковых волн в реальной водной среде (в океанах, морях, озёрах и т.д.) для целей подводной локации, связи и т.п. Существенная особенность подводных звуков — их малое затухание, вследствие чего под водой звуки могут распространяться на значительно большие расстояния, чем, например, в воздухе. Так, в области слышимых звуков для диапазона частот 500—2000
гцдальность распространения под водой звуков средней интенсивности достигает 15—20
км, а в области ультразвука — 3—5
км. Если исходить из величин затухания звука, наблюдаемых в лабораторных условиях в малых объёмах воды, то можно было бы ожидать значительно больших дальностей. Однако в естественных условиях, кроме затухания, обусловленного свойствами самой воды (т. н. вязкого затухания), сказываются ещё
звука и его рассеяние и поглощение различными неоднородностями среды.
Рефракция звука, или искривление пути звукового луча, вызывается неоднородностью свойств воды, главным образом по вертикали, вследствие трёх основных причин: изменения гидростатического давления с глубиной, изменения солёности и изменения температуры вследствие неодинакового прогрева массы воды солнечными лучами. В результате совокупного действия этих причин скорость распространения звука, составляющая около 1450
м/секдля пресной воды и около 1500
м/секдля морской, изменяется с глубиной, причём закон изменения зависит от времени года, времени дня, глубины водоёма и ряда др.

 = 8,5 · 10
-7). С кислотами образует соли гидразония, например N
2H
5Cl, N
2H
6Cl
2. Г. характеризуется высокой диэлектрической проницаемостью (52,9 при 20°С) и способен растворять многие неорганические соли. Г. — эндотермическое соединение; теплота образования DH°
298(ж) = 50,24
кдж/моль(12,05
ккал/моль). При нагревании до 200—300° С Г. разлагается на N
2и NH
3. В присутствии Fe
2O
3воспламеняется при комнатной температуре. С воздухом пары Г. при содержании 4,67% по объёму и выше образуют взрывоопасные смеси. Жидкий Г. не чувствителен к удару, трению и детонации. Токсичен; предельно допустимая концентрация в воздухе 0,0001
мг/л. Получают Г. окислением NH
3или мочевины гипохлоритом. Применяют в органическом синтезе, производстве пластмасс, резины, инсектицидов, взрывчатых веществ, как горючий компонент в жидких
. См. также
.
= 8,5 · 10
-7). С кислотами образует соли гидразония, например N
2H
5Cl, N
2H
6Cl
2. Г. характеризуется высокой диэлектрической проницаемостью (52,9 при 20°С) и способен растворять многие неорганические соли. Г. — эндотермическое соединение; теплота образования DH°
298(ж) = 50,24
кдж/моль(12,05
ккал/моль). При нагревании до 200—300° С Г. разлагается на N
2и NH
3. В присутствии Fe
2O
3воспламеняется при комнатной температуре. С воздухом пары Г. при содержании 4,67% по объёму и выше образуют взрывоопасные смеси. Жидкий Г. не чувствителен к удару, трению и детонации. Токсичен; предельно допустимая концентрация в воздухе 0,0001
мг/л. Получают Г. окислением NH
3или мочевины гипохлоритом. Применяют в органическом синтезе, производстве пластмасс, резины, инсектицидов, взрывчатых веществ, как горючий компонент в жидких
. См. также
.