 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Раззаков Федор :: Азимов Айзек :: Чехов Антон Павлович :: Грин Александр :: Борхес Хорхе Луис :: Горький Максим :: Андреев Леонид Николаевич :: Сименон Жорж Популярные книги:: Ожерелье Иомалы :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: О «Двух душах» М. Горького :: Магия луны (Том 1) :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер :: Вторая книга Царств |
Большая Советская Энциклопедия (БР)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (БР) - Чтение (стр. 22)
Плотность жидкого Б. (при 20°С) 3,1
г/см
3. В воде Б. растворим ограниченно, но лучше других галогенов (3,58
гБ. в 100
гH
2O при 20°С). Ниже 5,84°С из воды осаждаются гранатово-красные кристаллы Br
2·8H
2O. Особенно хорошо растворим Б. во многих органических растворителях, чем пользуются для извлечения его из водных растворов. Б. в твёрдом, жидком и газообразном состоянии состоит из 2-атомных молекул. Заметная диссоциация на атомы начинается при температуре около 800 °С; диссоциация наблюдается и при действии света.
Конфигурация внешних электронов атома Б. 4 s 24 p 5Валентность Б. в соединениях переменна, степень окисления равна - 1 (в бромидах, например KBr), + 1 (в гипобромитах, NaBrO), + 3 (в бромитах, NaBrO 4), + 5 (в броматах, KBrO 3) и + 7 (в перброматах, NaBrO 4). Химически Б. весьма активен, занимая по реакционной способности место между хлором и йодом. Взаимодействие Б. с серой, селеном, теллуром, фосфором, мышьяком и сурьмой сопровождается сильным разогреванием, иногда даже появлением пламени. Так же энергично Б. реагирует с некоторыми металлами, например калием и алюминием. Однако многие металлы реагируют с безводным Б. с трудом из-за образования на их поверхности защитной плёнки бромида, нерастворимого в Б. Из металлов наиболее устойчивы к действию Б., даже при повышенных температурах и в присутствии влаги, серебро, свинец, платина и тантал (золото, в отличие от платины, энергично реагирует с Б.). С кислородом, азотом и углеродом Б. непосредственно не соединяется даже при повышенных температурах. Соединения Б. с этими элементами получают косвенным путём. Таковы крайне непрочные окислы Br 2O, BrO 2и Br 3O 8(последний получают, например, действием озона на Б. при 80°С). С галогенами Б. взаимодействует непосредственно, образуя BrF 3, BrF 5, BrCl, IBr и др. (см. Межгалогенные соединения ). Б. - сильный окислитель. Так, он окисляет сульфиты и тиосульфаты в водных растворах до сульфатов, нитриты до нитратов, аммиак до свободного азота (3Вr 2+ 8MH 3= N 2+ 6NH 4Br). Б. вытесняет йод из его соединений, но сам вытесняется хлором и фтором. Свободный Б. выделяется из водных растворов бромидов также под действием сильных окислителей (KMnO 4, K 2Cr 2O 7) в кислой среде. При растворении в воде Б. частично реагирует с ней 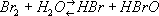
с образованием бромистоводородной кислоты HBr и неустойчивой бромноватистой кислоты HBrO. Раствор Б. в воде называется бромной водой . При растворении Б. в растворах щелочей на холоду происходит образование бромида и гипобромита (2NaOH + Br 2= NaBr + NaBrO + H 2O), а при повышенных температурах (около 100°С) - бромида и бромата (6NaOH + 3Br 2= 5NaBr + NaBrO 3+ ЗН 2О). Из реакций Б. с органическими соединениями наиболее характерны присоединение по двойной связи С=С, а также замещение водорода (обычно при действии катализаторов или света). Получение и применение.Исходным сырьём для получения Б. служат морская вода, озёрные и подземные рассолы и щелока калийного производства, содержащие Б. в виде бромид-иона Br -(от 65 г/м 3 в морской воде до 3-4 кг/м 3 и выше в щелоках калийного производства). Б. выделяют при помощи хлора (2Вг -+ Cl 2= Br 2+ 2С1 -) и отгоняют из раствора водяным паром или воздухом. Отгонку паром ведут в колоннах, изготовленных из гранита, керамики или иного стойкого к Б. материала. Сверху в колонну подают подогретый рассол, а снизу - хлор и водяной пар. Пары Б., выходящие из колонны, конденсируют в керамиковых холодильниках. Далее Б. отделяют от воды и очищают от примеси хлора дистилляцией. Отгонка воздухом позволяет использовать для получения Б. рассолы с его низким содержанием, выделять Б. из которых паровым способом в результате большого расхода пара невыгодно. Из получаемой бромовоздушной смеси Б. улавливают химическими поглотителями. Для этого применяют растворы бромистого железа (2 FeBr 2+ Br 2= 2FeBr 3), которое, в свою очередь, получают восстановлением FeBr 3железными стружками, а также растворы гидроокисей или карбонатов натрия или газообразный сернистый ангидрид, реагирующий с Б. в присутствии паров воды с образованием бромистоводородной и серной кислот (Br 2+ 3O 2+ 2H 2O = 2HBr + H 2SO 4). Из полученных полупродуктов Б. выделяют действием хлора (из FeBr 3и HBr) или кислоты (5NaBr + NaBrO 3+ 3Н 2SO 4= 3Вr 2+ 3Na 2SO 4+ 3Н 2О). В случае необходимости полупродукты перерабатывают на бромистые соединения, не выделяя элементарного Б. Вдыхание паров Б. при содержании их в воздухе 1 мг/м 3и более вызывает кашель, насморк, носовое кровотечение, головокружение, головную боль; при более высоких концентрациях - удушье, бронхит, иногда смерть. Предельно допустимые концентрации паров Б. в воздухе 2 мг/м 3. Жидкий Б. действует на кожу, вызывая плохо заживающие ожоги. Работы с Б. следует проводить в вытяжных шкафах. При отравлении парами Б. рекомендуется вдыхать аммиак, используя для этой цели сильно разбавленный раствор его в воде или в этиловом спирте. Боль в горле, вызванную вдыханием паров Б., устраняют приёмом внутрь горячего молока. Б., попавший на кожу, смывают большим количеством воды или сдувают сильной струей воздуха. Обожжённые места смазывают ланолином. Б. применяют довольно широко. Он - исходный продукт для получения ряда бромистых солей и органических производных. Большие количества Б. расходуют для получения бромистого этила и ди-бромэтана - составных частей этиловой жидкости, добавляемой к бензинам для повышения их детонационной стойкости (см. Антидетонаторы ). Соединения Б. применяют в фотографии, при производстве ряда красителей, бромистый метил и некоторые другие соединения Б. - как инсектициды. Некоторые органические соединения Б. служат эффективными огнетушащими средствами. Б. и бромную воду используют при химических анализах для определения многих веществ. В медицине используют бромиды натрия, калия, аммония, а также органические соединения Б., которые применяют при неврозах, истерии, повышенной раздражительности, бессоннице, гипертонической болезни, эпилепсии и хорее. Лит.:Ксензенко В. И., Стасиневич Д. С., Технология брома и йода, М., 1960; Позин М. Е., Технология минеральных солей, 2 изд., Л., 1961; Bromine and its compounds, ed. Z. Е. Jolles, L., 1966. В. К. Бельский, Д. С. Стасиневич. Бром в организме.Б. - постоянная составная часть тканей животных и растений. Наземные растения содержат в среднем 7·10 -4% Б. на сырое вещество, животные ~1·10 -4%/ Б. найден в различных секретах (слезах, слюне, поте, молоке, желчи). В крови здорового человека содержание Б. колеблется от 0,11 до 2,00 мг%. С помощью радиоактивного Б. ( 82Br) установлено избирательное поглощение его щитовидной железой, мозговым слоем почек и гипофизом. Введённые в организм животных и человека бромиды усиливают концентрацию процессов торможения в коре головного мозга, содействуют нормализации состояния нервной системы, пострадавшей от перенапряжения тормозного процесса. Одновременно, задерживаясь в щитовидной железе, Б. вступает в конкурентные отношения с йодом , что влияет на деятельность железы, а в связи с этим - и на состояние обмена веществ. Лит.:Войнар А. И., Биологическая роль микроэлементов в организме животных и человека, 2 изд., М., 1960; Верховская И. Н., Бром в животном организме и механизм его действия, М., 1962. В. В. Ковальский. Броматы Брома'ты,соли бромноватой кислоты , напримерKBrO 3. Бромбензилцианид Бромбензилциани'д,бесцветное органическое вещество, C 6H 5CHBrCN; t nл 25,4°С, плотность 1516 кг/ м 3(при 20°С), плохо растворим в воде, хорошо - в органических растворителях. Б. устойчив к действию воды и окислителей; разлагается при нагревании выше 120°С, а также при действии ряда металлов, которые при этом интенсивно корродируют; быстро реагирует со спиртовым раствором сернистого натрия, что можно использовать для разложения Б. Получают Б. действием цианистого натрия или цианистого калия на хлористый бензил с последующим бромированием образующегося при этом цианистого бензила. Б. сильно действует на слизистые оболочки глаз, вызывая их раздражение и сильное слезотечение; предложен как слезоточивое отравляющее вещество в конце 1-й мировой войны. Бромбутил каучук Бромбутил каучу'к,продукт бромирования бутилкаучука . Бромелиевые Броме'лиевые,ананасные (Bromeliaceae), семейство однодольных, большей частью травянистых многолетних растений. Около 50 родов и до 2000 видов, распространённых в тропической и субтропической Америке. Стебли, как правило, укороченные, с розетками длинных, часто шиповатых по краям и пёстрых листьев; у основания они обычно сильно расширены и, плотно охватывая друг друга, образуют водосборные воронки. Соцветия - колосья, кисти, головки, метёлки, у многих Б. с ярко окрашенными кроющими листьями. Цветки правильные, обоеполые, большей частью ярко окрашенные, с трёхчленными чашечкой и венчиком. Тычинок 6, пестик 1 с трёхгнёздной завязью; плод - коробочка или ягода. Лишь немногие Б. растут на почве, остальные - эпифиты . В воронковидных розетках листьев Б. скапливаются вода, органические остатки и даже фауна и флора; отсюда листья своими основаниями всасывают воду и питательные вещества. У многих Б. имеется особая водоносная ткань - специальные волоски для поглощения влаги. Из широко культивируемых растений к Б. относится ананас . Другие Б. разводят в оранжереях и комнатах из-за красивых листьев, ярких цветков и продолжительного цветения. К Б. относится также так называемый луизианский мох , длинные безлистные нитевидные стебли которого, свешивающиеся с деревьев, используются для набивки матрацев, мебели и т.д. Лит.:Тахтаджян А. Л., Система и филогения цветковых растений, М.- Л., 1966. Бромиды Броми'ды,химические соединения брома с др. элементами. Б. большинства металлов представляют собой соли бромистоводородной кислоты (см. Калия бромид , Натрия бромид , Серебра бромид и др.). Б. неметаллов (например, CBr 4и SiBr 4), а также металлов III и IV групп периодической системы (например, AlBr 3, SnBr 4, TiBr 4), как правило, легкоплавкие, легколетучие вещества; некоторые из них (например, PBr 3и BBr 3) - бромангидриды кислот (т. е. при взаимодействии с водой образуют соответствующие кислоты, см. Галогенангидриды ). Б. получают непосредственным соединением элементов, взаимодействием HBr с металлами, окислами, гидроокисями, карбонатами и так далее, а также др. методами. Бромиды природные Броми'ды приро'дные,группа редких минералов, относящихся к галогенным соединениям. Известные в природе минералы ограничиваются бромидами серебра, кристаллизующимися в кубической системе. Структуры относятся к типу каменной соли. Чистый бромид серебра - минерал бромирит химического состава AgBr. Теоретический состав бромирита: Ag 57,44%; Br 42,56%. Другие минералы - эмболит Ag (Cl, Br) и йодэмболит (или йодобромит) Ag (Cl, Br, I) представляют собой галогенные соединения серебра, где Br в значительной мере (до 10-14%) замещается хлором и йодом. Физические свойства минералов группы очень близки. Б. и. образуют мелкие, с ярким алмазным блеском кристаллики кубического или октаэдрического облика, а также зёрна жёлтого и жёлто-зелёного цвета; мягкие, отчасти пластичные. Твердость по минералогической шкале 2-2,5; плотность (в кг/ м 3) от 5660 (эмболит) до 6350 (бромирит). Б. п. встречаются исключительно в зонах окисления сульфидных серебросодержащих месторождений, формирующихся в засушливых пустынных областях. Г. П. Барсанов. Бромизовал Бромизова'л,бромурал, лекарственный препарат, оказывающий успокаивающее и снотворное действие. Применяют как снотворное средство ; детям Б. назначают также при хорее, коклюше. Броминдиго Броминди'го,бромзамещённые индиго , кубовые красители ярких тонов от красно-фиолетового до зеленовато-синего цвета. Цвет зависит от количества атомов галогена и их положения в молекуле. Один из красителей класса Б. - 6,6'-диброминдиго - краситель красно-фиолетового цвета, оказался идентичным «античному пурпуру», применявшемуся для окраски тканей и пряжи за 1400-1500 лет до н. э. и имевшему огромную ценность. Древний пурпур добывали из раковин пурпурной улитки Murex brandaris (из 12 тыс. улиток можно было получить 1,4 гкрасителя). 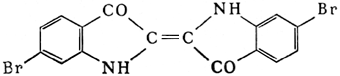
При бромировании индиго в концентрированной серной кислоте или в ледяной уксусной кислоте образуется синий краситель 5,5',7,7' - тетраброминдиго, называется также «броминдиго», превосходящий индиго по яркости и устойчивости окрасок к действию хлора; он широко применяется для окраски хлопчатобумажных и вискозных тканей. Лит.:Коган И. М., Химия красителей, 3 изд., М., 1956. Л. С. Поваров. Бромистоводородная кислота Бромистоводоро'дная кислота',раствор бромистого водорода в воде. Бромистое серебро Бро'мистое серебро',AgBr; то же что серебра бромид . Бромистые металлы Бро'мистые мета'ллы,бромиды, химические соединения металлов с бромом; соли бромистоводородной кислоты; см. Бромистый водород . Бромистый водород Бро'мистый водоро'д,HBr, соединение брома с водородом; бесцветный газ с резким запахом и кислым вкусом. t kип- 68,7°C, t пл- 87,9°С. При 10°C в 1 объёме воды растворяется около. 350 объёмов Б. в. Водный раствор Б. в. называется бромистоводородной кислотой. Это бесцветная (иногда желтоватая из-за присутствия следов брома) жидкость с резким запахом. При концентрации 47,6% HBr образуется азеотропная смесь , кипящая при 124,3°С. Бромистоводородная кислота - одна из самых сильных минеральных кислот. В промышленности Б. в. получают взаимодействием паров брома с водородом при высокой температуре. Температуру реакции можно понизить катализатором - активированным углем или платинированным асбестом. В лаборатории Б. в. можно получить обработкой бромидов 50%-ной серной кислотой (более концентрированная кислота частично окисляет HBr до Br 2) и др. способами. Б. в. применяют для получения бромидов, органических бромпроизводных и для др. целей. Бромистый калий Бро'мистый ка'лий,КВr, тоже, что калия бромид . Бромистый натрий Бро'мистый на'трий,NaBr, то же, что натрия бромид . Бромлей Юлиан Владимирович Бромле'йЮлиан Владимирович (р. 21.2.1921, Москва), советский историк, специалист по средневековой истории Хорватии, член-корреспондент АН СССР (1966). Член КПСС с 1944. Окончил исторический факультет Московского университета (1950). Доктор исторических наук (1965). В 1952-58 ученый секретарь по координации Отделения истории АН СССР, в 1958-1966 ученый секретарь Отделения истории АН СССР. С 1966 директор Института этнографии АН СССР. С 1968 заместитель академика-секретаря Отделения истории АН СССР. Автор работ «Крестьянское восстание 1573 года в Хорватии» (1959) и «Становление феодализма в Хорватии» (1964). Бромли Бро'мли(Bromley), новый административный район в составе Большого Лондона в Великобритании. 304,2 тыс. жителей (1968). Пищевые, мебельные предприятия; газовый завод. Бромная вода Бро'мная вода',раствор брома в воде. При стоянии на свету постепенно выделяет O 2в результате разложения присутствующей в ней HBrO. Б. в. применяют как окислитель и как бромирующее средство - при химических анализах и при синтезе некоторых органических препаратов. Бромноватая кислота Бромнова'тая кислота',HBrO 3, неорганическая кислота. В свободном состоянии не получена, существует в водных растворах с максимальной концентрацией 50,6%. На воздухе при стоянии и особенно при нагревании растворы Б. к. разлагаются. Получают Б. к. разложением её бариевой соли серной кислотой или пропусканием хлора через бромную воду: 5CL 2+ Br 2+ 6H 2O = 2HBrO 3+ 10HCL. Соли Б. к. - броматы - при обычных условиях устойчивы, а при нагревании разлагаются с выделением кислорода: 2KBrO 3= 2KBr + 3O 2. Получаются путём электрохимического окисления соответствующих бромидов. В кислых растворах б. к. и её соли проявляют сильные окислительные свойства, восстанавливаясь до иона Вr -или до свободного брома; применяются как окислители. Бромноватистая кислота Бромнова'тистая кислота',HBrO, неорганическая кислота. Существует только в водных растворах (желтоватая окраска, своеобразный запах), под действием света разлагается на HBr и кислород; обладает слабыми кислотными свойствами и является сильным окислителем. Некоторые соли Б. к. - гипобромиты (KBrO, NaBrO) - получены в свободном состоянии в виде кристаллогидратов. Все они очень неустойчивы, при нагревании (или подкислении растворов) тотчас распадаются на бромид и бромат: 3КВrO = 2KBr + KBrO 3. Бромо Бро'мо(Bromo), действующий вулкан в Индонезии, в восточной части о. Ява, на С. горного массива Тенгер. Высота 2614 м. До 1967 зафиксировано 37 извержений Б. (первое датированное - в 1804). Бромофос Бромофо'с,один из фосфорорганических инсектицидов . Бромурал Бромура'л,лекарственный препарат; то же, что бромизовал . Бронеавтомобиль Бронеавтомоби'ль,боевая бронированная, вооружённая, колёсная машина, предназначенная для разведки, охранения и связи. Первые Б., вооружённые пушками и пулемётами, были построены в Англии в 1900-02 и применены в англо-бурской войне 1899-1902. В русской армии к концу 1-й мировой войны 1914-18 насчитывалось около 160 Б. В 1918 Красная Армия имела 37 бронеотрядов - 148 машин. Во 2-й мировой войне 1939-45 Б. применялись в различных армиях. В послевоенное время получили развитие Б. узкого назначения: в Советской Армии, например, бронированная разведывательно-дозорная машина (БРДМ). Б. подразделяются на лёгкие - до 4 т, средние и тяжёлые - свыше 8 т. Вооружение Б. составляют пушки и пулемёты, что позволяет вести борьбу с живой силой, огневыми средствами и лёгкими бронеобъектами. Экипаж 3-4 человек. Максимальная скорость 90-100 км/ч. Запас хода 500-750 км. Современные Б. - либо плавающие, либо приспособленные к преодолению глубоких бродов (до 1,4 м). Имеется система централизованного регулирования давления воздуха в шинах, обеспечивающая высокую проходимость. Б. имеют дополнительное оборудование: оптические смотровые приборы, приборы ночного видения, радиостанции, отопители и др. См. рис. 1 и 2. 
Английский бронеавтомобиль «Саладин». 
Советская бронированная разведывательно-дозорная машина. Бронебойный снаряд Бронебо'йный снаряд,один из видов специальных артиллерийских снарядов, предназначенный для пробивания (разрушения) брони танков, самоходно-артиллерийских установок и др. бронированных целей. См. Снаряды артиллерийские . Броневая башня Бронева'я ба'шня,закрытая со всех сторон броневая конструкция, устанавливаемая на танках, боевых машинах пехоты, бронетранспортёрах, бронеавтомобилях, некоторых самоходных артиллерийских установках, бронепоездах, военных кораблях и долговременных железобетонных сооружениях. Предназначается для установки вооружения и защиты размещенного в Б. б. экипажа, вооружения и внутреннего оборудования от средств поражения. На танках и др. боевых машинах башня, как правило, может поворачиваться на 360°, обеспечивая круговой обстрел. Для уменьшения сопротивления вращению Б. б., масса которой в танках исчисляется тоннами, а на военных кораблях - десятками и сотнями тонн, её устанавливают на специальных опорах: шариковых, роликовых или катковых. Горизонтальная наводка на цель вооружения, размещенного в Б. б., производится с помощью механизма поворота башни, вертикальная - подъёмным механизмом, имеющим моторные и ручные приводы. Броневая сталь Бронева'я сталь,легированная сталь для изготовления броневой защиты военных объектов. Применяется также для технической надобностей (например, для защиты электрических кабелей от ударных нагрузок). Легирующими элементами в Б. с. являются главным образом хром, никель, молибден, ванадий, марганец, кремний. Б. с. для военных объектов используется преимущественно в виде плит - катаных, катано-кованых или литых толщиной 20-200 мм. Б. с. для невоенных объектов выпускается, как правило, в виде лент и проволоки. Броневые стальные плиты подвергают специальной термической или химико-термической обработке для придания им твёрдости, вязкости и др. свойств либо одинаковых по всему сечению (так называемая гомогенная Б. с.), либо различных по слоям (так называемая гетерогенная Б. с.). Гетерогенную Б. с. получают односторонней закалкой на некоторую глубину, а в ряде случаев односторонней цементацией плит, придающим их лицевой стороне большую твёрдость (до 600 HB), тыльные же слои остаются вязкими. Броневский Владислав Броне'вский(Broniewski) Владислав (17.12.1897, Плоцк, - 10.2.1962, Варшава), польский поэт. Участник 1-й мировой войны. В 1921-24 изучал философию в Варшавском университете. Первый сборник стихов - «Ветряные мельницы» (1925). В 1925 издал совместно с В. Вандурским и С. Р. Станде программный поэтический бюллетень «Три залпа». В основе творчества Б. 20-30-х гг. лежат идеи революционной борьбы, пролетарского интернационализма, антифашизма: «Дымы над городом» (1926), поэма «Парижская Коммуна» (1929, конфискована цензурой), «Печаль и песня» (1932), «Последний крик» (1939). В творчестве Б., одного из крупнейших представителей социалистической поэзии, неразрывны лирический дневник и история борьбы польского народа за социализм. В 1939 эмигрировал в СССР; в 1942-45 жил в Ираке и Палестине, издал сборники патриотической и интимной лирики: «Примкнуть штыки!» (1943), «Дерево отчаяния» (1945). Творчество Б. после возвращения в народную Польшу в 1946 было разнообразно: публицистическая лирика, проникнутая идеями социалистического строительства, рефлективная и пейзажная лирика, содержащая раздумья над судьбами Польши, интимная поэзия. Автор сборников «Надежда» (1951), «Анка» (1956), цикла «Новые стихи» (1957-62), поэм «Мазовия» (1951) и «Висла» (1953). Б. - переводчик произведений русских классиков и советских писателей. Государственная премия (1950 и 1955). Соч.: Wiersze i poematy, 5 wyd., Warsz., 1967; в рус. пер.- Избранное, М., 1961; Стихи, М., 1968. Лит.:Хорев В. А., В. Броневский, М., 1965; Пиотровская А., Лирическая исповедь века, в сборнике: Поэзия социализма, М., 1969; Matuszewski R., О poezji Wl. Broniewskiego, Warsz., 1955; Wtadystaw Broniewski. Wstp, wybor materiatow i przypisy F. Lichodziejewska, Warsz., 1966; Wladyslaw Broniewski. Praca zbiorowa, Warsz., 1967. В. А. Хорев. 
В. Броневский. Бронедрезина Бронедрези'на,боевая бронированная дрезина . Б. применялись в 1-й и 2-й мировых войнах на железных дорогах для разведки пути, а иногда и для выполнения самостоятельной задачи вдоль железнодорожного пути. Лёгкие Б. имели пулемётное вооружение, установленное в броневых листах корпуса; тяжёлые - малокалиберную пушку, установленную в орудийной башне, и 2-4 пулемёта. 
Рис. к ст. Бронедрезина. Бронеколпак Бронеколпа'к,броневое закрытие с амбразурами и щелями для наблюдения и ведения огня. Б. устанавливается неподвижно в долговременном фортификационном сооружении как неотъемлемая его часть или может быть переносным, временно устанавливаемым в полевом сооружении. Щели и амбразуры Б. закрывают бронезаслонками. Броненосец Бронено'сец,основной класс боевого корабля во 2-й половине 19 - начале 20 вв. с башенной артиллерией крупного калибра и сильной броневой защитой. Б. были самыми крупными и сильными кораблями флота своего времени и предназначались для ведения морского боя с бронированными кораблями противника и действий против приморских крепостей. Идея бронирования кораблей основных классов возникла давно. Но лишь после Синопского боя (1853), в котором русская эскадра под командованием адмирала П. С. Нахимова зажигательными бомбами уничтожила турецкий флот, во всех флотах окончательно пришли к убеждению в необходимости замены деревянных кораблей с парусным вооружением кораблями из железа с паровыми машинами. Строительство корпусов военных кораблей из железа привело к широкому применению брони для защиты тонкого железного борта и палуб от пробивания артиллерийскими снарядами. Б. развились из кораблей класса монитор , впервые появившихся в 1862 во время Гражданской войны в Северной Америке. Мониторы обычно вооружались 2 крупнокалиберными (до 280 мм) пушками, размещенными во вращающейся бронированной башне, и имели очень низкий, но сильно забронированный надводный борт. Последующее развитие шло по линии увеличения калибра и числа пушек, а также высоты надводного борта. В России первый крупный Б. « Петр Великий » был заложен в 1869 и спущен на воду в 1872. Он имел водоизмещение 10100 ти считался самым мощным и мореходным Б. своего времени. В русском флоте различали Б. эскадренные (для боя в открытом море) и Б. береговой обороны (для действий в прибрежных районах). К числу эскадренных Б. принадлежал известный своим участием в Революции 1905-07 « Потемкин ». Одним из сильнейших эскадренных Б. был «Андрей Первозванный» (заложен в 1905, спущен на воду в 1906; водоизмещение 17 400 т, скорость 18 узлов, четыре 305- мморудия главного калибра, бортовая броня 70-216 мм). Типичным Б. береговой обороны был «Адмирал Сенявин» (вступил в строй в 1896; водоизмещение 4790 т, скорость 16 узлов, четыре 25- мморудия главного калибра, бортовая броня 152-254 мм). Опыт русско-японской войны 1904-05 выявил недостаточность числа орудий главного калибра, большую разнокалиберность вспомогательной артиллерии, слабость бронирования Б. и низкую их живучесть. Поэтому строительство Б. после русско-японской войны прекратилось, взамен их во многих флотах мира стали строить линейные корабли . В некоторых флотах, главным образом скандинавских стран, Б. в небольшом количестве сохранялись до конца 2-й мировой войны, а в ВМС Швеции до середины 50-х гг. 20 в. Некоторые Б., например ВМС Норвегии, участвовали в боевых действиях в прибрежных районах в начале 2-й мировой войны. Н. М. Короткин. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32 |
|||||||