 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Раззаков Федор :: Азимов Айзек :: Чехов Антон Павлович :: Грин Александр :: Борхес Хорхе Луис :: Горький Максим :: Андреев Леонид Николаевич :: Сименон Жорж Популярные книги:: Ожерелье Иомалы :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: О «Двух душах» М. Горького :: Магия луны (Том 1) :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер :: Вторая книга Царств |
Большая Советская Энциклопедия (АЗ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (АЗ) - Чтение (стр. 17)
Лит.:Некрасов Б. В., Основы общей химии, т. 1, М., 1965; Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1963: Химия и технология связанного азота, [М.- Л.], 1934; КХЭ, т. 1, М.,1961. Азот в организме Азо'т в органи'зме,один из основных ,входящих в состав важнейших веществ живых клеток - белков и нуклеиновых кислот. Однако количество А. в о. невелико (1 - 3% на сухую массу). Находящийся в атмосфере молекулярный азот могут усваивать лишь некоторые микроорганизмы и сине-зеленые водоросли (см. ). Значительные запасы азота сосредоточены в почве в форме различных минеральных (аммонийные соли, нитраты) и органических соединений (азот белков, нуклеиновых кислот и продуктов их распада, т. е. ещё не вполне разложившиеся остатки растений и животных). Растения усваивают азот из почвы как в виде неорганических, так и некоторых органических соединений. В природных условиях для питания растений большое значение имеют почвенные микроорганизмы (аммонификаторы), которые минерализуют органический азот почвы до аммонийных солей. Нитратный азот почвы образуется в результате жизнедеятельности открытых С. Н. Виноградским в 1890 ,окисляющих аммиак и аммонийные соли до нитратов. Часть усвояемого микроорганизмами и растениями нитратного азота теряется, превращаясь в молекулярный азот под действием . Растения и микроорганизмы хорошо усваивают как аммонийный, так и нитратный азот, восстанавливая последний до аммиака и аммонийных солей. Микроорганизмы и растения активно превращают неорганический аммонийный азот в органические соединения азота - амиды (аспарагин и глутамин) и . Как показали Д. Н. Прянишников и В. С. Буткевич, азот в растениях запасается и транспортируется в виде аспарагина и глутамина. При образовании этих амидов обезвреживается аммиак, высокие концентрации которого токсичны не только для животных, но и для растений. Амиды входят в состав многих белков как у микроорганизмов и растений, так и у животных. Синтез глутамина и аспарагина путём ферментативного глутаминовой и аспарагиновой кислот осуществляется не только у микроорганизмов и растений, но в определённых пределах и у животных. Синтез аминокислот происходит путём восстановительного ряда и , возникающих в результате окисления углеводов (В. Л. Кретович), или путём ферментативного (А. Е. Браунштейн и М. Г. Крицман, 1937). Конечными продуктами усвоения аммиака микроорганизмами и растениями являются , входящие в состав протоплазмы и ядра клеток, а также отлагающиеся в виде запасных белков. Животные и человек способны лишь в огранической мере синтезировать аминокислоты. Они не могут синтезировать 8 незаменимых аминокислот (валин, изолейцин, лейцин, фенилаланин, триптофан, метионин, треонин, лизин), и потому для них основным источником азота являются белки, потребляемые с пищей, т. е., в конечном счёте, - белки растений и микроорганизмов. Белки во всех организмах подвергаются ферментативному распаду, конечными продуктами которого являются аминокислоты. На следующем этапе в результате дезаминирования органический азот аминокислот вновь превращается в неорганический аммонийный азот. У микроорганизмов и особенно у растений аммонийный азот может использоваться для нового синтеза амидов и аминокислот. У животных обезвреживание аммиака, образующегося при распаде белков и нуклеиновых кислот, осуществляется путём синтеза мочевой кислоты (у пресмыкающихся и птиц) или мочевины (у млекопитающих, в том числе и у человека), которые затем выводятся из организма. С точки зрения обмена азота растения, с одной стороны, и животные (и человек), с другой, отличаются тем, что у животных утилизация образующегося аммиака осуществляется лишь в слабой мере - большая часть его выводится из организма; у растений же обмен азота «замкнут» - поступивший в растение азот возвращается в почву лишь вместе с самим растением. Лит.:Прянишников Д. Н., Азот в жизни растений и в земледелии СССР, М. - Л., 1945; Браунштейн А. Е., Главные пути ассимиляции и диссимиляции азота у животных, «Баховские чтения», 1957, т. 12; Кретович В. Л., Биохимия автотрофной ассимиляции азота, там же, 1961, т. 16; Фердман Д. Л., Биохимия, 3 изд., М., 1966; Кретович В. Л. и Каган 3. С., Усвоение и превращение азота у растений, в кн.: Физиология сельскохозяйственных растений, т. 2, М., 1967. В. Л. Кретович, З. С. Каган. Азота окислы Азо'та о'кислы,соединения азота с кислородом. Известны N 2O, NO, N 2O 3 ,NO 2(и его димер N 2O 4), N 2O 5; есть сведения о существовании NO 3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе - при электроразряде из смеси азота с кислородом образуется окись азота NO, которая при охлаждении переходит в NO 2. Другие А. о. получают косвенным путём. N 2O 5- твёрдое вещество; остальные окислы при обычных условиях газообразны. Закись азота N 2O - бесцветный газ со слабым приятным запахом и сладковатым вкусом; вдыхание смеси воздуха с N 2O вызывает состояние, напоминающее опьянение (отсюда название - веселящий газ). Плотность при 0°С и 101 325 н/м 2(760 мм рт. ст.) 1,9804 кг/м 3, t кип- 89,5°С, t пл- 102,4°С. 1 объём N 2O при 5°C растворяет 1,048 объёма N 2O. Химически N 2O с водой, растворами кислот и щелочей не реагирует, кислородом не окисляется. Выше 500°C разлагается: 2N 2O = 2N 2+ O 2; поэтому при повышенных температурах действует как сильный окислитель и поддерживает горение. Получают N 2O термическим разложением нитрата аммония: NH 4NO 3=N 2O+ 2H 2O. В медицине служит для общей анестезии. Окись азота NO - бесцветный газ, буреющий при соприкосновении с воздухом вследствие окисления до NO 2. Плотность при 0°С и 101 325 н/м 2(760 мм рт ст) 1,3402 кг/м 3, t кип-151,8°С, t пл -163,6°С. В воде мало растворима (0,0738 объёма в 1 объёме H 2O при 0°С). С водой, кислотами и щелочами химически не взаимодействует. Образует многочисленные продукты присоединения, например нитрозилхлорид NOCI. Получают NO действием разбавленной азотной кислоты на некоторые металлы, например: 3Cu + 8HNO 3= 3Cu(NO 3) 2+ 4H 2O + 2NO. Окись азота - важный полупродукт окисления аммиака при получении . Азотистый ангидрид (трёхокись азота) N 2O 3- в обычных условиях неустойчивое соединение. Разлагается уже при 0°С: 
Около 3,5°С кипит с разложением, при 25°C содержит только 10% недиссоциированного N 2O 3. При низкой температуре может быть получен в виде тёмно-голубой жидкости, при сильном охлаждении - светло-голубой массы с t пл-102°С. С водой образует : N 2O 3+ H 2O = 2HNO 2, со щелочами - соли (см. ). N 2O 3получают по реакции: N 2O 4+ 2NO = 2N 2O 3; практического применения не находит. Двуокись азота NO 2- бурый газ с удушливым запахом, при 21,15°C - буро-красная жидкость, бледнеющая при дальнейшем охлаждении из-за образования четырёхокиси азота N 2O 4, t отв-11,2°С. Взаимодействует с водой с образованием азотной кислоты и окиси азота: 3NO 2+ H 2O = 2HNO 3+ NO; со щелочами образует нитраты и нитриты. Двуокись азота - сильный окислитель; в токе NO 2энергично сгорают уголь, сера, фосфор, органические соединения. В промышленности NO 2получают окислением NO при производстве азотной кислоты, в лаборатории - термическим разложением некоторых нитратов: 2Pb(NO 3) 2= 2PbO + O 2+ 4NO 2. Применяют NO 2как нитрующий агент (см. органических соединений). Азотный ангидрид (пятиокись азота) N 2O 5- бесцветные очень летучие кристаллы. Крайне неустойчив и взрывоопасен. Взаимодействует с водой, давая азотную кислоту: N 2O 5+Н 2O = 2HNO 3, со щелочами образует соли - .В лаборатории получают по реакции: 2HNO 3+ P 2O 5= N 2O 5+ 2HPO 3. Практического применения не находит. Все А. о. физиологически активны. Лит.см. при ст. , . Азотирование Азоти'рование,насыщение поверхности металлических деталей азотом с целью повышения твёрдости, износоустойчивости, предела усталости и коррозионной стойкости. А. подвергают сталь, титан, некоторые сплавы, наиболее часто - легированные стали, особенно хромоалюминиевые, а также сталь, содержащую ванадий и молибден. Азотирование стали происходит при t500-650 °С в среде аммиака. Выше 400 °С начинается диссоциация аммиака по реакции NH 3® 3H + N. Образовавшийся атомарный азот диффундирует в металл, образуя азотистые фазы. При температуре А. ниже 591 °С азотированный слой состоит из трёх фаз (рис.): e - нитрида Fe 2N, g' - нитрида Fe 4N, a - азотистого феррита, содержащего около 0,01% азота при комнатной температуре. При температуре А. 600-650° С возможно образование ещё и g-фазы, которая в результате медленного охлаждения распадается при 591°C на эвтектоид a + g 1. Твёрдость азотированного слоя увеличивается до HV = 1200 (соответствует 12 Гн/м 2) и сохраняется при повторных нагревах до 500-600°C, что обеспечивает высокую износоустойчивость деталей при повышенных температурах. Азотированные стали значительно превосходят по износоустойчивости цементированные и закалённые стали. А. - длительный процесс, для получения слоя толщиной 0,2-0,4 ммтребуется 20-50 ч.Повышение температуры ускоряет процесс, но снижает твёрдость слоя. Для защиты мест, не подлежащих А., применяются лужение (для конструкционных сталей) и никелирование (для нержавеющих и жаропрочных сталей). Для уменьшения хрупкости слоя А. жаропрочных сталей иногда ведут в смеси аммиака и азота. Азотирование титановых сплавов проводится при 850-950 °С в азоте высокой чистоты (А. в аммиаке не применяется из-за увеличения хрупкости металла). При А. образуется верхний тонкий нитридный слой и твёрдый раствор азота в a-титане. Глубина слоя за 30 ч - 0,08 ммс поверхностной твёрдостью HV = 800-850 (соответствует 8-8,5 Гн/м 2) .Введение в сплав некоторых легирующих элементов (Al до 3%, Zr 3-5% и др.) повышает скорость диффузии азота, увеличивая глубину азотированного слоя, а хром уменьшает скорость диффузии. А. титановых сплавов в разреженном азоте [100-10 н/м 2(1-0,1 мм рт ст.)] позволяет получать более глубокий слой без хрупкой нитридной зоны. А. широко применяют в промышленности, в том числе для деталей, работающих при tдо 500-600 °С (гильз цилиндров, коленчатых валов, шестерён, золотниковых пар, деталей топливной аппаратуры и др.). Лит.:Минкевич А. Н., Химико-термическая обработка металлов и сплавов, 2 изд., М., 1965: Гуляев А. П..Металловедение, 4 изд., М., 1966. Д. И. Браславский. 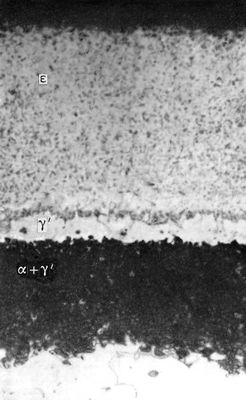
Макроструктура азотированного слоя железа при 650°C (увеличено в 500 раз). Азотистая кислота Азо'тистая кислота',HNO 2, одноосновная, нестойкая, довольно слабая кислота, существующая только в разбавленных холодных водных растворах. Структурная формула HO-N = О. Константа диссоциации А. к. 4,5Ч10 -4при 18°C. Образуется наряду с азотной кислотой при растворении NO 2в воде: 2NO 2+ H 2O = HNO 2+ HNO 3. При нагревании и действии сильных кислот или окислителей А. к. разлагается с образованием окиси азота: 3HNO 2= HNO 3+ 2NO + H 2O. Восстановлением А. к. могут быть получены N 2O,NO, NH 2OH, NH 3и др. Соли А. к. ( ) получают восстановлением . Наиболее важное свойство А. к .- способность к ароматических аминов. Поэтому в производстве азокрасителей широко применяют NaNO 2; при действии на эту соль кислот образуется свободная А. к.: NaNO 2+HCI = NaCI+HNO 2. А. к. и её соли при попадании внутрь ядовиты. Профессиональные отравления редки. Нитрит натрия применяют в медицине при стенокардии и спазмах сосудов головного мозга (см. ). Азотистоводородная кислота Азотистоводоро'дная кислота',азоимид, HN 3, соединение азота с водородом, бесцветная летучая жидкость с резким запахом. Структурная формула Н-N = N є N. Плотность 1130 кг/м 3, t кип37° С, t пл-80° С. Безводная А. к. при нагревании или при сотрясении сосуда взрывается, разлагаясь на азот и водород; в разбавленных водных растворах устойчива. В водных растворах А. к. диссоциирует на ионы Н +и N -3, причём по силе она близка к уксусной. Помимо кислотной функции, для А. к. характерна и окислительная: смесь А. к. с крепкой соляной кислотой растворяет золото и платину, т. е. ведёт себя аналогично . А. к. получают действием на её соли разбавленной серной кислоты. Практическое применение имеют только соли А. к. - . Азотистое равновесие Азо'тистое равнове'сие,состояние животного организма, при котором количество выводимого (с мочой и калом) азота равно количеству азота, получаемому с пищей. Взрослый организм в норме находится в состоянии А. р. Средняя потребность взрослого человека в азоте - 16 гв сутки, что соответствует 100 гбелка. Если количество поступающего с пищей азота ниже , то организм начинает разрушать белки собственного тела и А. р. нарушается (отрицательный азотистый баланс: количество выводимого азота больше поступающего с пищей). Длительный недостаток белка (см. ) ведёт к истощению. Растущий организм нуждается в положительном азотистом балансе, т. е. в превышении количества вводимого азота над количеством выводимого из организма. Азотистокислые соли Азотистоки'слые со'ли,соли азотистой кислоты HNO 2. Более употребительное название А. с. - . См. также . Азотистые иприты Азо'тистые ипри'ты,см. . Азотистый ангидрид Азо'тистый ангидри'д,N 2O 3см. . Азотная кислота Азо'тная кислота',HNO 3, одноосновная сильная кислота, при обычных условиях бесцветная жидкость; один из наиболее важных продуктов химической промышленности. Структурная формула: 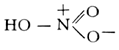
Физические и химические свойства.Плотность безводной А. к. 1522 кг/м 3, t пл- 41,15°С, t кип84° С. С водой смешивается во всех отношениях, причём образует , содержащую 69,2% А. к. с t кип121,8°C. Известны кристаллогидраты HNO 3ЧH 2O с t пл-37,85° С и HNO 3Ч3H 2O c t пл -18,5°С. В отсутствии воды А. к. неустойчива, разлагается на свету с выделением кислорода уже при обычных температурах (4HNO 3 =4NO 2+ 2H 2O + O 2), причём выделяющейся двуокисью азота окрашивается в жёлтый, а при высоких концентрациях NO 2- в красный цвет. А. к. - сильный окислитель, окисляет серу до серной кислоты, фосфор - до фосфорной кислоты. Только золото, тантал и некоторые платиновые металлы не реагируют с А. к. С большинством металлов А. к. взаимодействует преимущественно с выделением окислов азота: ЗСu + 8HNO 3= 3Cu(NO 3) 2+ 2NO + 4H 2O. Некоторые металлы, например железо, хром, алюминий, легко растворяющиеся в разбавленной А. к., устойчивы к воздействию концентрированной А. к., что объясняется образованием на поверхности металла защитного слоя окисла. Такая особенность позволяет хранить и перевозить концентрированную А. к. в стальных ёмкостях. Смесь концентрированной А. к. и соляной кислоты (1:3), называется царской водкой, растворяет даже золото и платину. Органические соединения под действием А. к. окисляются или нитруются, причём в последнем случае остаток А. к. - нитрогруппа - NO 2 +замещает в органических соединениях водород (см. ). Соли А. к. называютя , а соли с Na,K, Са, NO 4 +также . Получение и применение.В 13 в. было описано получение А. к. нагреванием калиевой селитры с квасцами, железным купоросом и глиной. В середине 17 в. И. Р. Глаубер предложил получать А. к. при умеренном (до 150°C) нагревании калиевой селитры с концентрированной серной кислотой: KNO 3+ H 2SO 4 =HNO 3+ KHSO 4До начала 20 в. этот способ применяли в промышленности, заменяя калиевую селитру более дешёвой природной чилийской селитрой NaNO 3. Современный способ производства А. к. основан на каталитическом окислении кислородом воздуха. Основные стадии процесса: контактное окисление аммиака до окиси азота: 4NH 3+ 5O 2= 4NO + 6H 2O; окисление окиси азота до двуокиси и поглощение смеси так называемых «нитрозных газов» водой: 2NO + O 2= 2NO 2; 3NO 2+ H 2O = 2HNO 3+NO. Смесь аммиака (10 - 12% ) с воздухом пропускают через нагретую до 750 - 900° С сетку катализатора, которым служат сплавы платины - тройной (93% Pt, 3% Rh, 4% Pd) или двойной (90 - 95% Pt, 10 - 5% Rh). Используют также двухступенчатый катализатор (1-я ступень - платиноидная сетка, 2-я - неплатиновый катализатор), что позволяет на 25 - 30% сократить расход платины. Время контакта воздушно-аммиачной смеси с катализатором не должно превышать 1 мсек,иначе образовавшаяся окись азота разлагается. Вторая стадия процесса - окисление NO до N0 2 и растворение NO 2в воде - может быть проведена при атмосферном давлении, под давлением до 1 Мн/м 2(10 кгс/см 2) или комбинированным способом, при котором под давлением происходит только поглощение нитрозных газов водой. Получают А. к. с концентрациями 45 - 49% или (при использовании давления) 55 - 58% . Дистилляцией таких растворов может быть получена А. к. азеотропного состава. Более концентрированную кислоту (до 100% ) получают перегонкой растворов А.к. с концентрированной H 2SO 4 или прямым синтезом - взаимодействием N 2O 4с водой (или разбавленной А. к.) и кислородом: 2N 2O 4+ 2H 2O + O 2 ==4HNO 3. В СССР производят 97 - 98%-ную А. к. Важнейшие области применения А. к. - производство азотных и комбинированных удобрений, взрывчатых веществ (тринитротолуола и др.), органических красителей. В органическом синтезе широко применяют смесь концентрированной А. к. и серной кислоты - «нитрующую смесь». А. к. используют в камерном способе производства серной кислоты, для получения фосфорной кислоты из фосфора, как окислитель ракетного топлива. В металлургии А. к. применяют для травления и растворения металлов, а также для разделения золота и серебра. Вдыхание паров А. к. приводит к отравлению, попадание А. к. (особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание А. к. в воздухе промышленных помещений равно 50 мг/м 3в пересчёте на N 2O 5 .Концентрированная А. к. при соприкосновении с органическими веществами вызывает пожары и взрывы. Лит.:Атрощенко В. И., Каргин С. И., Технология азотной кислоты, М. - Л., 1949; Миниович М. А., О современном состоянии и о перспективах развития производства разбавленной азотной кислоты, «Журнал прикладной химии», 1958, т. 31, в. 8; Миниович М. А., Азотная кислота, КХЭ, т. 1, М., 1961, с. 74-79. Э. Б. Шиллер. Азотная промышленность Азо'тная промы'шленность,см. в ст. . Азотной кислоты эфиры Азо'тной кислоты' эфи'ры,см. . Азотнокислые соли Азотноки'слые со'ли,соли азотной кислоты HNO 3, например KNO 3. Более употребительное название А.с. - . Об отдельных наиболее важных А. с. см. , , и т. д. Нитраты калия, натрия, аммония и кальция часто называют. (например, ) . Азотные удобрения Азо'тные удобре'ния,минеральные и органические вещества, применяемые как источник азотного питания растений. Подразделяются на (навоз, торф, компост), содержащие, кроме азота, и др. элементы питания растений; , выпускаемые промышленностью, и зелёные удобрения (люпин, сераделла и др., см. ). А. у. применяли уже в глубокой древности. В Древней Руси широко использовали навоз. В поливном земледелии Средней Азии давно известно зелёное удобрение. Значительно позднее стали применять минеральные удобрения, первым из которых были натриевая селитра, добываемая с середины 19 в. из природных залежей в Чили (Южная Америка). Потребление её в 1900 составляло около 300 тыс. т(в пересчёте на азот). В последующие годы промышленность стала выпускать сульфат аммония, цианамид кальция и кальциевую селитру. К 1913 мировое производство А. у. достигло почти 700 тыс. т(в пересчёте на азот). Освоение в промышленном масштабе синтеза аммиака из азота воздуха и водорода (1914 - 18) позволило резко повысить мировое производство А. у., которое в 1966 возросло до 19 200 тыс. т(в пересчёте на азот), в том числе в США 6400, ФРГ 1449, Франции 1082, Польше 462, ГДР 343 тыс. т.В России в 1913 производили 3 тыс. т(в пересчёте на азот) А. у. Крупная азотно-туковая промышленность в СССР начала создаваться в годы 1-й пятилетки. В 1928 сельскому хозяйству страны было поставлено А. у. (в тыс. тв пересчёте на азот) 2, в 1940 - 199, 1945 - 75, 1950 - 307, 1960 - 1003, 1965 - 2712, 1966 - 3188, 1967 - 3753 и в 1968 - 4177. В минеральных А. у. азот может находиться в аммиачной (NHз), аммиачно-нитратной (NH 3и N0 3), нитратной (NO 3) и амидной (NH 2) формах. К аммиачным удобрениямотносятся: сульфат аммония, хлористый аммоний, бикарбонат аммония, жидкие А. у. Сульфат аммония и хлористый аммоний наиболее эффективны на почвах, насыщенных основаниями (чернозёмы, карбонатные серозёмы, каштановые), которые обладают способностью нейтрализовать подкисляющее действие этих удобрений. Систематическое удобрение сульфатом аммония и хлористым аммонием кислых почв вызывает повышение кислотности; этот недостаток может быть устранён известкованием. Аммиачный азот менее подвержен вымыванию, чем нитратный, поэтому аммиачные удобрения можно вносить до посева, осенью. Менее пригодны они для поверхностного (при подкормках озимых) и местного (в рядки, лунки и гнёзда) внесения. Избыток хлора в хлористом аммонии отрицательно влияет на размер и качество урожая многих с.-х. культур (картофель, лён, масличные, табак, виноград и др.). Бикарбонат аммония, производство которого пока ограничено объёмом экспериментальных исследований, обладает щелочной реакцией, но в почве подвергается нитрификации (см. в почве). Среди аммиачных форм А. у. большое значение имеют - жидкий безводный аммиак, водный аммиак, аммиакаты. К аммиачно-нитратным удобрениямотносятся: (нитрат аммония, азотнокислый аммоний), сульфонитрат аммония (лейна-селитра, монтан-селитра, нитросульфат аммония). Аммиачную селитру выпускают преимущественно в гранулированном виде; она слабо подкисляет почву. Сульфонитрат аммония обладает относительно высокой подкисляющей способностью. Нитратные удобрения - (нитрат натрия, азотнокислый натрий, чилийская селитра), кальциевая селитра (нитрат кальция, азотнокислый кальций, известковая селитра, норвежская селитра), калийная селитра (нитрат калия, азотнокислый калий). Натриевая селитра - удобрение физиологически щелочное, поэтому лучше применять его на кислых почвах, особенно под сахарную свёклу, пшеницу, ячмень и др. чувствительные к почвенной кислотности культуры. Кальциевую селитру выпускают в гранулированном виде, обычно с примесью аммиачной селитры; она также подщелачивает почву. Калийная селитра, кроме азота, содержит калий и является источником азотно-калийного питания растений (см. ). Вносят её под чувствительные к хлору культуры. Все нитратные формы азота не поглощаются почвой. В районах избыточного увлажнения на лёгких почвах со слабой водоудерживающей способностью нитратные удобрения вымываются, поэтому в качестве основного удобрения здесь целесообразно применять аммиачные. Амидные удобрения- (карбамид), цианамид кальция, мочевино-формальдегидные А. у. Наиболее ценна мочевина. В почве она легко переходит в карбонат аммония; вначале несколько подщелачивает, а затем слабо подкисляет почву. Рекомендуется вносить заблаговременно. Используется также в качестве белковой подкормки жвачных животных. Цианамид кальция обладает свойством снижать кислотность почвы. Эффективен на рыхлых, богатых органическими веществами нейтральных почвах, если удобряют им осенью. Непригоден для местного внесения. Цианамид кальция используют также как для предуборочного удаления листьев у хлопчатника. Мочевино-формальдегидные удобрения не вымываются из почвы; они особенно эффективны в районах избыточного увлажнения и поливного земледелия. Можно применять высокие дозы этих удобрений, обеспечив растения азотом на несколько лет. Характеристика минеральных А. у. приведена в таблице. Свойства основных минеральных азотных удобрений
А. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||