 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Азимов Айзек :: Раззаков Федор :: Чехов Антон Павлович :: Грин Александр :: Горький Максим :: Борхес Хорхе Луис :: Сименон Жорж :: Андреев Леонид Николаевич Популярные книги:: Ожерелье Иомалы :: Магия луны (Том 1) :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: Ночной орёл :: О «Двух душах» М. Горького :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер |
Большая Советская Энциклопедия (АТ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (АТ) - Чтение (стр. 11)
Противоречия модели Резерфорда оказалось возможным разрешить, лишь отказавшись от ряда привычных представлений классической физики. Важнейший шаг в построении теории атома был сделан датским физиком Н. Бором (1913).
Постулаты Бора и модель атома Бора. В основу квантовой теории атома Бор положил 2 постулата, характеризующих те свойства атома, которые не укладывались в рамки классической физики. Эти постулаты Бора могут быть сформулированы следующим образом: 1. Существование стационарных состояний. Атом не излучает и является устойчивым лишь в некоторых стационарных (неизменных во времени) состояниях, соответствующих дискретному (прерывному) ряду «дозволенных» значений энергии E 1 , E 2 , E 3 , E 4,... Любое изменение энергии связано с квантовым (скачкообразным) переходом из одного стационарного состояния в другое. 2. Условие частот излучения (квантовых переходов с излучением). При переходе из одного стационарного состояния с энергией E iв другое с энергией E kатом испускает или поглощает свет определённой частоты vв виде кванта излучения (фотона) hv,согласно соотношению hv = E i - E k .При испускании атом переходит из состояния с большей энергией E iв состояние с меньшей энергией E k, при поглощении, наоборот, из состояния с меньшей энергией E kв состояние с большей энергией E i . Постулаты Бора сразу позволяют понять физический смысл комбинационного принципа Ритца (см. выше); сравнение соотношений hv= E i - E kи v = T k - T i показывает, что спектральные термы соответствуют стационарным состояниям, и энергия последних должна равняться (с точностью до постоянного слагаемого) E i= - hT i , E k= - hT k . При испускании или поглощении света изменяется энергия атома, это изменение равно энергии испущенного или поглощённого фотона, т. е. имеет место закон сохранения энергии. Линейчатый спектр атома является результатом дискретности возможных значений его энергии. Для определения дозволенных значений энергии атома — квантования его энергии — и для нахождения характеристик соответствующих стационарных состояний Бор применил классическую (ньютоновскую) механику. «Если мы желаем вообще составить наглядное представление о стационарных состояниях, у нас нет других средств, по крайней мере сейчас, кроме обычной механики», — писал Бор в 1913 («Три статьи о спектрах и строении атомов», М.—Л., 1923, с. 22). Для простейшего атома — атома водорода, состоящего из ядра с зарядом + е(протона) и электрона с зарядом - e, Бор рассмотрел движение электрона вокруг ядра по круговым орбитам. Сравнивая энергию атома Есо спектральными термами T n= R/n 2для атома водорода, найденными с большой точностью из частот его спектральных линий, он получил возможные значения энергии атома E n= - hT n= -hR/n 2( где n= 1, 2, 3,...). Они соответствуют круговым орбитам радиуса а n= а 0n 2,где a 0= 0,53·10 -8 см —боровский радиус — радиус наименьшей круговой орбиты (при n= 1). Бор вычислил частоты обращения vэлектрона вокруг ядра по круговым орбитам в зависимости от энергии электрона. Оказалось, что частоты излучаемого атомом света не совпадают с частотами обращения v n, как этого требует классическая электродинамика, а пропорциональны, согласно соотношению hv = E i - E k ,разности энергий электрона на двух возможных орбитах. Для нахождения связи частоты обращения электрона по орбите и частоты излучения Бор сделал предположение, что результаты квантовой и классической теорий должны совпадать при малых частотах излучения (для больших длин волн; такое совпадение имеет место для теплового излучения, законы которого были выведены Планком). Он приравнял для больших nчастоту перехода v= ( E n+1- E n)/ hчастоте обращения v nпо орбите с данным nи вычислил значение постоянной Ридберга R,которое с большой точностью совпало со значением R,найденным из опыта, что подтвердило боровское предположение. Бору удалось также не только объяснить спектр водорода, но и убедительно показать, что некоторые спектральные линии, которые приписывались водороду, принадлежат гелию. Предположение Бора о том, что результаты квантовой и классической теорий должны совпадать в предельном случае малых частот излучения, представляло первоначальную форму т. н. принципа соответствия. В дальнейшем Бор успешно применил его для нахождения интенсивностей линий спектра. Как показало развитие современной физики, принцип соответствия оказался весьма общим (см. ) . В теории атома Бора квантование энергии, т. е. нахождение её возможных значений, оказалось частным случаем общего метода нахождения «дозволенных» орбит. Согласно квантовой теории, такими орбитами являются только те, для которых момент количества движения электрона в атоме равен целому кратному h/2p.Каждой дозволенной орбите соответствует определённое возможное значение энергии атома (см. ) . Основные положения квантовой теории атома — 2 постулата Бора — были всесторонне подтверждены экспериментально. Особенно наглядное подтверждение дали опыты немецких физиков Дж. Франка и Г. Герца (1913—16). Суть этих опытов такова. Поток электронов, энергией которых можно управлять, попадает в сосуд, содержащий пары ртути. Электронам сообщается энергия, которая постепенно повышается. По мере увеличения энергии электронов ток в гальванометре, включенном в электрическую цепь, увеличивается; когда же энергия электронов оказывается равной определённым значениям (4,9; 6,7; 10,4 эв), ток резко падает ( рис. 5 ). Одновременно можно обнаружить, что пары ртути испускают ультрафиолетовые лучи определённой частоты. Изложенные факты допускают только одно истолкование. Пока энергия электронов меньше 4,9 эв,электроны при столкновении с атомами ртути не теряют энергии — столкновения имеют упругий характер. Когда же энергия оказывается равной определённому значению, именно 4,9 эв,электроны передают свою энергию атомам ртути, которые затем испускают её в виде квантов ультрафиолетового света. Расчёт показывает, что энергия этих фотонов равна как раз той энергии, которую теряют электроны. Эти опыты доказали, что внутренняя энергия атома может иметь только определённые дискретные значения, что атом поглощает энергию извне и испускает её сразу целыми квантами и что, наконец, частота испускаемого атомом света соответствует теряемой атомом энергии. Дальнейшее развитие А. ф. показало справедливость постулатов Бора не только для атомов, но и для других микроскопических систем — для молекул и для атомных ядер. Эти постулаты следует рассматривать как твёрдо установленные опытные квантовые законы. Они составляют ту часть теории Бора, которая не только сохранилась при дальнейшем развитии квантовой теории, но и получила своё обоснование. Иначе обстоит дело с моделью атома Бора, основанной на рассмотрении движения электронов в атоме по законам классической механики при наложении дополнительных условий квантования. Такой подход позволил получить целый ряд важных результатов, но был непоследовательным: квантовые постулаты были присоединены к законам классической механики искусственно. Последовательной теорией явилась созданная в 20-х гг. 20 в. .Её создание было подготовлено дальнейшим развитием модельных представлений теории Бора, в ходе которого выяснились её сильные и слабые стороны. Развитие модельной теории атома Бора.Весьма важным результатом теории Бора было объяснение спектра атома водорода. Дальнейший шаг в развитии теории атомных спектров был сделан немецким физиком А. Зоммерфельдом. Разработав более детально правила квантования, исходя из более сложной картины движения электронов в атоме (по эллиптическим орбитам) и учитывая экранирование внешнего (т. н. валентного) электрона в поле ядра и внутренних электронов, он сумел дать объяснение ряда закономерностей спектров щелочных металлов. Теория атома Бора пролила свет и на структуру т. н. характеристических спектров рентгеновского излучения. Рентгеновские спектры атомов так же, как и их оптические спектры, имеют дискретную линейчатую структуру, характерную для данного элемента (отсюда и название). Исследуя характеристические рентгеновские спектры различных элементов, английский физик Г. Мозли открыл следующую закономерность: квадратные корни из частот испускаемых линий равномерно возрастают от элемента к элементу по всей периодической системе Менделеева пропорционально атомному номеру элемента. Интересно то обстоятельство, что закон Мозли полностью подтвердил правоту Менделеева, нарушившего в некоторых случаях принцип размещения элементов в таблице по возрастающему атомному весу и поставившего некоторые более тяжёлые элементы впереди более лёгких. На основе теории Бора удалось дать объяснение и периодичности свойств атомов. В сложном атоме образуются электронные оболочки, которые последовательно заполняются, начиная от самой внутренней, определёнными числами электронов (физическая причина образования оболочек стала ясна только на основании принципа Паули, см. ниже). Структура внешних электронных оболочек периодически повторяется, что обусловливает периодическая повторяемость химических и многих физических свойств элементов, расположенных в одной и той же группе периодической системы. На основе же теории Бора немецким химиком В. Косселем были объяснены (1916) химического взаимодействия в т. н. гетерополярных молекулах. Однако далеко не все вопросы теории атома удалось объяснить на основе модельных представлений теории Бора. Она не справлялась со многими задачами теории спектров, позволяла получать лишь правильные значения частот спектральных линий атома водорода и водородоподобных атомов, интенсивности же этих линий оставались необъяснёнными; Бору для объяснения интенсивностей пришлось применить принцип соответствия. При переходе к объяснению движений электронов в атомах, более сложных, чем атом водорода, модельная теория Бора оказалась в тупике. Уже атом гелия, в котором вокруг ядра движутся 2 электрона, не поддавался теоретической интерпретации на её основе. Трудности при этом не исчерпывались количественными расхождениями с опытом. Теория оказалась бессильной и в решении такой проблемы, как соединение атомов в молекулу. Почему 2 нейтральных атома водорода соединяются в молекулу водорода? Как вообще объяснить природу валентности? Что связывает атомы твёрдого тела? Эти вопросы оставались без ответа. В рамках боровской модели нельзя было найти подхода к их решению. Квантовомеханическая теория атома.Ограниченность боровской модели атома коренилась в ограниченности классических представлений о движении микрочастиц. Стало ясно, что для дальнейшего развития теории атома необходимо критически пересмотреть основные представления о движении и взаимодействии микрочастиц. Неудовлетворительность модели, основанной на классической механике с добавлением условий квантования, отчётливо понимал и сам Бор, взгляды которого оказали большое влияние на дальнейшее развитие А. ф. Началом нового этапа развития А. ф. послужила идея, высказанная французским физиком Л. де Бройлем (1924) о двойственной природе движения микрообъектов, в частности электрона (см. ) .Эта идея стала исходным пунктом ,созданной в 1925—26 трудами В. Гейзенберга и М. Борна (Германия), Э. Шрёдингера (Австрия) и П. Дирака (Англия), и разработанной на её основе современной квантовомеханической теории атома. Представления квантовой механики о движении электрона (вообще микрочастицы) коренным образом отличаются от классических. Согласно квантовой механике, электрон не движется по траектории (орбите), подобно твёрдому шарику; движению электрона присущи также и некоторые особенности, характерные для распространения волн. С одной стороны, электрон всегда действует (например, при столкновениях) как единое целое, как частица, обладающая неделимым зарядом и массой; в то же время электроны с определённой энергией и импульсом распространяются подобно плоской волне, обладающей определённой частотой (и определённой длиной волны). Энергия электрона Екак частицы связана с частотой vэлектронной волны соотношением: E=hv,а его импульс р —с длиной волны lсоотношением: р = h/l. Устойчивые движения электрона в атоме, как показал Шрёдингер (1926), в некотором отношении аналогичны ,амплитуды которых в разных точках различны. При этом в атоме, как в колебательной системе, возможны лишь некоторые «избранные» движения с определёнными значениями энергии, момента количества движения и проекции момента электрона в атоме. Каждое стационарное состояние атома описывается при помощи некоторой ,являющейся решением волнового уравнения особого типа — уравнения Шрёдингера; волновой функции соответствует «электронное облако», характеризующее (в среднем) распределение плотности электронного заряда в атоме (см. ,там же на рис. 3 показаны проекции «электронных облаков» атома водорода). В 20—30-х гг. были разработаны приближённые методы расчёта распределения плотности электронного заряда в сложных атомах, в частности метод Томаса — Ферми (1926, 1928). Эта величина и связанное с ней значение т. н. важны при исследовании электронных столкновений с атомами, а также рассеяния ими рентгеновских лучей. На основе квантовой механики удалось путём решения уравнения Шрёдингера правильно рассчитать энергии электронов в сложных атомах. Приближённые методы таких расчётов были разработаны в 1928 Д. Хартри (Англия) и в 1930 В. А. Фоком (СССР). Исследования атомных спектров полностью подтвердили квантовомеханическую теорию атома. При этом выяснилось, что состояние электрона в атоме существенно зависит от его —собственного механического момента количества движения. Было дано объяснение действия внешних электрических и магнитных полей на атом (см. , ) .Важный общий принцип, связанный со спином электрона, был открыт швейцарским физиком В. Паули (1925) (см. ) ,согласно этому принципу, в каждом электронном состоянии в атоме может находиться только один электрон; если данное состояние уже занято каким-либо электроном, то последующий электрон, входя в состав атома, вынужден занимать другое состояние. На основе принципа Паули были окончательно установлены электронных оболочек в сложных атомах, определяющие периодичность свойств элементов. Исходя из квантовой механики, немецкие физики В. Гейтлер и Ф. Лондон (1927) дали теорию т. н. гомеополярной химической связи двух одинаковых атомов (например, атомов водорода в молекуле H 2), не объяснимой в рамках боровской модели атома. Важными применениями квантовой механики в 30-х гг. ив дальнейшем были исследования связанных атомов, входящих в состав молекулы или кристалла. Состояния атома, являющегося частью молекулы, существенно отличаются от состояний свободного атома. Существенные изменения претерпевает атом также в кристалле под действием внутрикристаллического поля, теория которого была впервые разработана Х. Бете (1929). Исследуя эти изменения, можно установить характер взаимодействия атома с его окружением. Крупнейшим экспериментальным достижением в этой области А. ф. было открытие Е. К. Завойским в 1944 ,давшего возможность изучать различные связи атомов с окружающей средой. Современная атомная физика.Основными разделами современной А. ф. являются теория атома, атомная (оптическая) спектроскопия, рентгеновская спектроскопия, радиоспектроскопия (она исследует также и вращательные уровни молекул), физика атомных и ионных столкновений. Различные разделы спектроскопии охватывают разные диапазоны частот излучения и, соответственно, разные диапазоны энергий квантов. В то время как рентгеновская спектроскопия изучает излучения атомов с энергиями квантов до сотен тыс. эв,радиоспектроскопия имеет дело с очень малыми квантами — вплоть до квантов менее 10 -6 эв. Важнейшая задача А. ф. — детальное определение всех характеристик состояний атома. Речь идёт об определении возможных значений энергии атома — его уровней энергии, значений моментов количества движения и других величин, характеризующих состояния атома. Исследуются тонкая и сверхтонкая структуры уровней энергии (см. ) ,изменения уровней энергии под действием электрических и магнитного полей — как внешних, макроскопических, так и внутренних, микроскопических. Большое значение имеет такая характеристика состояний атома, как время жизни электрона на уровне энергии. Наконец, большое внимание уделяется механизму возбуждения атомных спектров. Области явлений, исследуемых разными разделами А. ф., перекрываются. Рентгеновская спектроскопия измерением испускания и поглощения рентгеновских лучей позволяет определить главным образом энергии связи внутренних электронов с ядром атома (энергии ионизации), распределение электрического поля внутри атома. Оптическая спектроскопия изучает совокупности спектральных линий, испускаемых атомами, определяет характеристики уровней энергии атома, интенсивности спектральных линий и связанные с ними времена жизни атома в возбуждённых состояниях, тонкую структуру уровней энергии, их смещение и расщепление в электрическом и магнитном полях. Радиоспектроскопия детально исследует ширину и форму спектральных линий, их сверхтонкую структуру, сдвиг и расщепление в магнитном поле, вообще внутриатомные процессы, вызываемые очень слабыми взаимодействиями и влияниями среды. Анализ результатов столкновений быстрых электронов и ионов с атомами даёт возможность получить сведения о распределении плотности электронного заряда («электронного облака») внутри атома, об энергиях возбуждения атома, энергиях ионизации. Результаты детального исследования строения атомов находят самые широкие применения не только во многих разделах физики, но и в химии, астрофизике и других областях науки. На основании изучения уширения и сдвига спектральных линий можно судить о местных (локальных) полях в среде (жидкости, кристалле), обусловливающих эти изменения, и о состоянии этой среды (температуре, плотности и др.). Знание распределения плотности электронного заряда в атоме и её изменений при внешних взаимодействиях позволяет предсказать тип химических связей, которые может образовывать атом, поведение иона в кристаллической решётке. Сведения о структуре и характеристиках уровней энергии атомов и ионов чрезвычайно важны для устройств .Поведение атомов и ионов при столкновениях — их ионизация, возбуждение, перезарядка — существенно для физики .Знание детальной структуры уровней энергии атомов, особенно многократно ионизованных, важно для астрофизики. Таким образом, А. ф. тесно связана с другими разделами физики и другими науками о природе. Представления об атоме, выработанные А. ф., имеют и важное мировоззренческое значение. «Устойчивость» атома объясняет устойчивость различных видов вещества, непревратимость химических элементов в естественных условиях, например при обычных на Земле температурах и давлениях. «Пластичность» же атома, изменение его свойств и состояний при изменении внешних условий, в которых он существует, объясняет возможность образования более сложных систем, качественно своеобразных, их способность приобретать различные формы внутренней организации. Так находит разрешение то противоречие между идеей о неизменных атомах и качественным многообразием веществ, которое существовало и в древности, и в новое время и служило основанием для критики . Лит.:Бор Н., Три статьи о спектрах и строении атомов, пер. с нем., М.—П., 1923; Борн М., Современная физика, пер. с нем., М., 1965; Бройль Л., Революция в физике, пер. с франц., М., 1963; Шпольский Э. В., Атомная физика, 5 изд., т. 1, М., 1963. М. А. Ельяшевич. Р. Я. Штейнман.  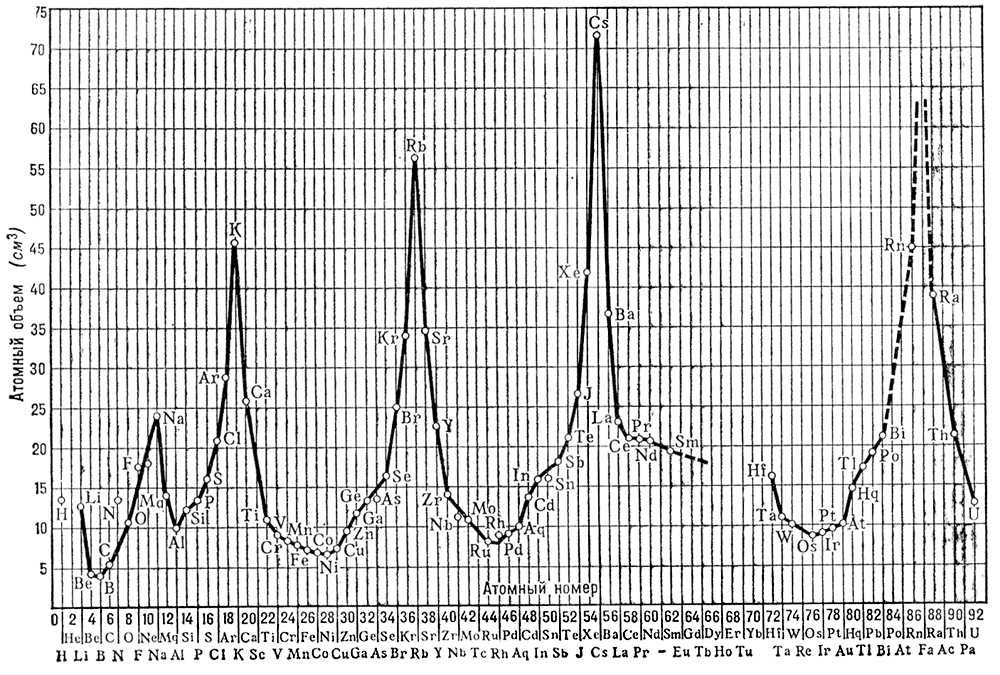  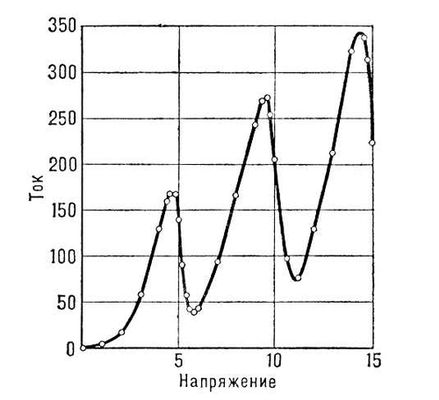 
Атомная электростанция (АЭС)
|
|||||||