 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Раззаков Федор :: Азимов Айзек :: Чехов Антон Павлович :: Грин Александр :: Борхес Хорхе Луис :: Горький Максим :: Андреев Леонид Николаевич :: Сименон Жорж Популярные книги:: Ожерелье Иомалы :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: О «Двух душах» М. Горького :: Магия луны (Том 1) :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер :: Вторая книга Царств |
Большая Советская Энциклопедия (АМ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (АМ) - Чтение (стр. 10)
Аммиак Аммиак,NH 3, простейшее химическое соединение азота с водородом. Один из важнейших продуктов химической промышленности; синтез А. из азота воздуха и водорода - основной метод получения т. н. связанного . В природе А. образуется при разложении азотсодержащих органических веществ. Название «А.» - сокращенное от греч. hals ammoniakos или лат. sal ammoniacus; так назывался нашатырь ( ), который получали в оазисе Аммониум (ныне Сива) в Ливийской пустыне. Физические и химические свойства. А. - бесцветный газ с резким удушливым запахом и едким вкусом. Плотность газообразного А. при 0°С и 101,3 кн/м 2(760 мм рт. ст.) 0,7714 кг/м 3, t кип-33,35°С, t пл-77,70°С, t кpит132,4°С, давление критическое 11,28 Мн/м 2(115,0 кгс/см 2), плотность критическая 235 кг/м 3, теплота испарения 23,37 кдж/моль(5,581 ккал/моль). Сухая смесь А. с воздухом способна взрываться; границы взрывчатости при комнатной температуре лежат в пределах 15,5-28% А., с повышением температуры границы расширяются. А. хорошо растворим в воде (при 0°С объём воды поглощает около 1200 объёмов А., при 20 °С - около 700 объёмов А.). При 20°С и 0,87 Мн/м 2(8,9 кгс/см 2) А. легко переходит в бесцветную жидкость с плотностью 681,4 кг/м 3, сильно преломляющую свет. Подобно воде, жидкий А. сильно ассоциирован, главным образом за счёт образования . Жидкий А. практически не проводит электрический ток. Жидкий А. - хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый А. - бесцветные кубические кристаллы. Молекула А. имеет форму правильной тригонометрической пирамиды с атомом N в вершине; углы между связями H-N-H 108°, межатомные расстояния H-N-H 1,015
Интересным свойством молекул А. является их способность к структурной инверсии, т. е. к «выворачиванию наизнанку» путём прохождения атома азота сквозь образованную атомами водорода плоскость основания пирамиды. Инверсия связана с излучением строго определённой частоты, на основе чего была создана аппаратура для очень точного определения времени (молекулярные генераторы). Такие «молекулярные часы» позволили, в частности, установить, что продолжительность земных суток ежегодно возрастает на 0,43 мсек. Дипольный момент молекулы А. равен 1,43 D. Благодаря отсутствию неспаренных электронов А. диамагнитен. А. - весьма реакционноспособное соединение. За счёт наличия неподелённой электронной пары у атома N особенно характерны и легко осуществимы для А. реакции присоединения. Наиболее важна реакция присоединения протона к молекуле А., ведущая к образованию иона NH + 4, который в соединениях с анионами кислот ведёт себя подобно ионам щелочных металлов. Такие реакции происходят при растворении А. в воде с образованием слабого основания - NH 4OH, а также при непосредственном взаимодействии А. с кислотами. Распространённый тип реакций присоединения - образование при действии газообразного или жидкого А. на соли. Для А. характерны также реакции замещения. Щелочные и щёлочноземельные металлы реагируют с жидким и газообразным А., образуя в зависимости от условий (Na 3N) или амиды (NaNH 2). А. реагирует также с серой, галогенами, углем, CO 2и др. К окислителям в обычных условиях А. довольно устойчив, однако, будучи подожжён, он горит в атмосфере кислорода, образуя воду и свободный азот. Каталитическим окислением А. получают окись азота, превращаемую затем в . Получение и применение. В лабораторных условиях А. может быть получен вытеснением его сильными щелочами из аммониевых солей по схеме: 2NH 4CI + Ca(OH) 2= 2NH 3+ CaCl 2+ 2H 2O. Старейший промышленный способ получения А. - выделение его из отходящих газов при угля. Основной современный способ промышленного получения А. - синтез из элементов - азота и водорода, предложенный в 1908 немецким химиком Ф. Габером. Наиболее распространённым и экономичным методом получения технологического газа для синтеза А. является конверсия углеводородных газов. Исходным сырьём в этом процессе служит природный газ, а также попутные нефтяные газы, газы нефтепереработки, остаточные газы производства ацетилена. Сущность конверсионного метода получения азото-водородной смеси состоит в разложении при высокой температуре метана и его гомологов на водород и окись углерода с помощью окислителей - водяного пара и кислорода. К конвертированному газу при этом добавляют атмосферный воздух или воздух, обогащенный кислородом. Синтез А. из простых веществ 
протекает с выделением тепла и уменьшением объёма. Наиболее благоприятными, с точки зрения равновесия, условиями образования А. являются возможно более низкая температура и возможно более высокое давление. Без катализаторов реакция синтеза А. вообще не происходит. В промышленности для синтеза А. используют исключительно железные катализаторы, получаемые восстановлением сплавленных окислов железа Fe 3O 4с активаторами (Al 2O 3, K 2O, CaO, SiO 2, а иногда и MgO). Важный этап процесса синтеза - очистка газовой смеси от каталитических ядов (к ним относятся вещества, содержащие S, O 2, Se, P, As, пары воды, CO и др.). Способы производства синтетического А. различаются по применяемому давлению: системы низкого (10-15 Мн/м 2), среднего (25-30 Мн/м 2) и высокого (50-100 Мк/л 2) давления. Наиболее распространены системы среднего давления (30 Мн/м 2и 500°С) (1 Мн/м 2( 10 кгс/см 2). Для увеличения степени использования газа в современных системах синтеза А. применяют многократную циркуляцию азото-водородной смеси - круговой аммиачный цикл (см. рис.). Свежий газ (азото-водородная смесь) и непрореагировавшие, т. н. циркуляционные газы поступают сначала в фильтр 1, где они очищаются от посторонних примесей, затем в межтрубное пространство конденсационной колонны 2, отдавая своё тепло газу, движущемуся по трубкам колонны. Далее газы проходят через испаритель 3, в котором происходят их дальнейшее охлаждение и конденсация А., увлечённого циркуляционными газами. Охлажденная смесь газов и сконденсировавшийся А. из испарителя направляются в разделительную часть (сепаратор) конденсационной колонны, где жидкий А. отделяется и как готовый продукт выводится по трубе в резервуар 9. Газообразный А., выходящий из испарителя, проходя брызгоуловитель 4, освобождается от капель жидкого А. и направляется в цех переработки или в холодильную установку на сжижение. Газы, освобожденные от А., из сепаратора поступают в колонну синтеза 5. Колонна синтеза внутри имеет катализаторную коробку с трубчатой или полочной насадкой и теплообменник. Газы, проходя через колонну синтеза, реагируют между собой; выходящая из колонны газовая смесь содержит 15 - 20% А. Далее эти газы поступают в конденсатор 6, где и происходит сжижение А. Жидкий А. отделяется в сепараторе 7и поступает в резервуар 9, а непрореагировавшие газы подаются циркуляционным насосом 8в фильтр 1для смешения со свежей азото-водородной смесью. А. используется для получения азотной кислоты, азотсодержащих солей, , , по аммиачному методу. Так как жидкий А. имеет большую теплоту испарения, то. он служит рабочим веществом холодильных машин. Жидкий А. и его водные растворы применяют как . Большие количества А. идут на аммонизацию и туковых смесей. А. ядовит. Он сильно раздражает слизистые оболочки. Острое отравление А. вызывает поражения глаз и дыхательных путей, одышку, воспаление лёгких. Предельно допустимой концентрацией А. в воздухе производственных помещений считается 0,02 г/м 3. А. хранят в стальных баллонах, окрашенных в жёлтый цвет, с чёрной надписью - А. Лит.:Технология связанного азота, М., 1966. В. К. Бельский. 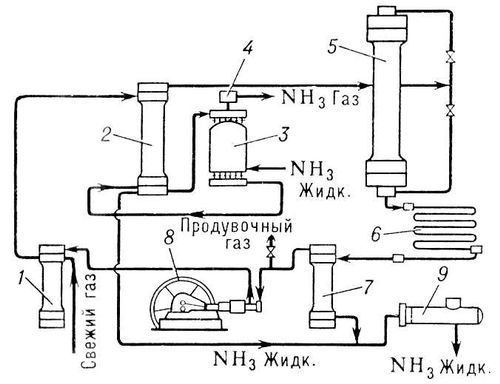
Агрегат синтеза аммиака (технологическая схема). Аммиакаты Аммиака'ты, ,продукты присоединения аммиака к др. веществам. Например, при действии аммиака МН 3на водный раствор хлористой меди CuCl 2образуется А. [Cu(NH 3) 4]C 2. В сельском хозяйстве А., получаемые при насыщении водных растворов мочевины, аммиачной селитры и др. азотных удобрений аммиаком, применяют как .Эти А. бесцветные, иногда желтоватые жидкости с резким запахом аммиака; содержание азота в них от 35 до 45%, давление пара 0,02-0,07 Мн/м 2(0,2-0,7 кгс/см 2) . Аммиан Марцеллин Аммиа'н Марцелли'н(Ammianus Marcellinus) (около 330 - около 400), римский историк. Автор сочинения «Деяния» (31 книга), которое было задумано как продолжение «Анналов» и «Историй» ;охватывало события от правления императора Нервы (96-98) до 378 (в дошедших до нас книгах 14-31-й описываются события с 353 по 378). В центре внимания А. М. - войны, дворцовые интриги, борьба претендентов за власть. В «Деяниях» даны яркие картины упадка Римской империи и социальных движений 4 в. Большую ценность представляют сведения о племенах Юго-Восточной и Центральной Европы. В своих сочинениях А. М. выступает горячим сторонником политики императора .А. М. широко использовал свидетельства очевидцев и личные наблюдения. Язык сочинений труден для понимания. Соч. в рус. пер.: История, пер. Ю. Кулаковского и А. Сонни, в. 1-3, К., 1906-1908. Лит.:Соколов В.С., Аммиан Марцеллин как последний представитель античной историографии, «Вестник древней истории», 1959, № 4. Аммиачная вода Аммиа'чная вода',водный раствор, содержащий 18-25% аммиака. А. в. получают растворением синтетического аммиака в воде или поглощением его водой из отходящих газов в коксохимическом производстве. В последнем случае А. в., наряду с (18-20%), содержит примеси углекислого газа (70-100 г/л), сероводорода (30-50 г/л), незначительные количества цианистых соединений и др. А. в. применяют как ,в производстве соды, промышленности органического синтеза, для аммонизации кормов в сельском хозяйстве и др. Аммиачная селитра Аммиа'чная сели'тра,азотнокислый аммоний, аммония нитрат, NH 4NO 3, аммонийная соль азотной кислоты. Бесцветные гигроскопические кристаллы. А. с. - сильный окислитель; в сухом виде взрывается от детонаторов. В СССР выпускают трёх марок: А, Би В.Первые две марки используют в промышленности; применяют во взрывчатых смесях ( ) .Марка В -эффективное и наиболее распространённое в СССР азотное удобрение, содержащее около 34% азота; обладает физиологической кислотностью. Для уменьшения гигроскопичности и слёживаемости в А. с. марки Ввводят различные кондиционирующие добавки. А. с. вносят под все культуры, на всех типах почв как основное удобрение и при подкормке. См. . А. В. Соколов. Аммон Аммо'н,небольшое государство, созданное на В. от Палестины в 14-13 вв. до н. э. семитическим народом аммонитянами, пришедшими сюда, по-видимому, из Аравии. Столица - Раббат-Аммон (греч. Филадельфия, современный Амман - столица Иордании). А. упорно боролся за плодородные земли Галаада с аморитами(14-13 вв.), а затем с израильтянами и иудеями. В 10 в. А. был завоёван .В конце 10 в. А. вернул себе независимость, в 8-7 вв. подчинялся ассирийским царям. В конце 6-4 вв. А. находился под властью персов, в 3 в. подчинялся Птолемеям, а во 2 в. - Селевкидам, с 63 до н. э. - Риму (сохраняя при этом автономию). От римского периода сохранились замечательные памятники античной архитектуры (термы, портики, театр и др.). Д. Г. Редер. Аммоналы Аммона'лы,взрывчатые смеси, относящиеся к аммиачно-селитренным взрывчатым веществам (см. ). Аммонизация кормов Аммониза'ция кормо'в, обработка кормов аммиаком для повышения содержания в них азота. Соединяясь с органическими кислотами кормов, аммиак образует аммонийные соли, небелковый азот которых используется микрофлорой преджелудков жвачных для построения микробного белка - источника аминокислот для животных. Азотом аммиака можно заменить до 30% протеина в рационе жвачных. Аммонизируют обычно кукурузный силос, кислый или сухой жом, мелассу, барду, солому и др. Процесс А. к. заключается в обработке кормов аммиачной водой различной концентрации (чаще - с 25% аммиака). Аммиачную воду предварительно разбавляют (1 лна 3-4 лводы) и вносят: на 1 ткукурузного силоса 12-15 л, на 1 тсухого жома 70-80 л, на 1 тсоломы 120 л. Обрабатывают корма в буртах, траншеях, чанах, баках (солому - в скирдах). Скармливают аммонизированные корма после исчезновения запаха аммиака. Аммоний Аммо'ний, ион NH 4 +; входит во многие соединения, где играет роль одновалентного металла; таковы -NH 4OH и соли А.: (NH 4) 2SO 4, NH 4CI и др. При диссоциации соединений А. в водных растворах А. присутствует в виде катиона, например NH 4CI = NH 4 ++ Cl -. Большинство солей иона А. - бесцветные кристаллические вещества, хорошо растворимые в воде и легко разлагающиеся при нагревании с выделением NH 3. При попытке получения в свободном виде А. распадается на аммиак и водород. Реакция для обнаружения А. - выделение аммиака при действии едких щелочей на соли А.: NH 4CI + NaOH = NH 3+ H 2O + NaCI. См. также . Аммониты (биол.) Аммони'ты(Ammonoidea) (по имени древнеегипетского бога ,изображавшегося с закрученными рогами барана, которые напоминает спиральнозавитая раковина многих А.), надотряд вымерших беспозвоночных животных класса головоногих моллюсков. Жили с девонского периода по меловой включительно по всему земному шару; имели наружную (часто скульптированную) раковину различной формы ( рис. 1 ), разделённую поперечными перегородками на ряд камер ( рис. 2 ). Края перегородок обычно сильно гофрированы, что увеличивало прочность раковин. В последней камере, кончающейся устьем, находилось мягкое тело животного. Остальные камеры были наполнены газом и играли роль гидростатического аппарата. Они соединялись друг с другом шнуровидным выростом мягкого тела (сифоном) с кровеносными сосудами, обеспечивавшими нормальный газовый режим в камерах. Диаметр раковины до 2 м.А. были широко распространены в морях. Хищники. Одни из них хорошо плавали, другие преимущественно ползали. Всего известно около 1500 родов и очень много видов, быстро сменявших друг друга во времени; в связи с этим А. являются одной из важнейших групп «руководящих» ископаемых. А. интересны также для выяснения закономерностей индивидуального развития организма ( ) и соотношения его с ,т. к. все части раковины А. в процессе онтогенеза сильно изменялись. Лит.:Основы палеонтологии. Моллюски - головоногие, [т. 1], М., 1962. В. Н. Шиманский. 
Рис. 2. Схематическое строение раковины в продольном разрезе: П- перегородка; К- камера; С- сифон. 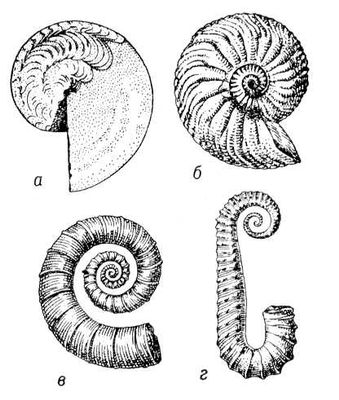
Рис. 1. Аммониты: а - Timanites keyserlingi; б - Cardioceres cordatum; в - Crioceratites nolani; г - Fncyloceras matheroni. Аммониты (взрывчатые вещества) Аммони'ты,аммиачно-селитренные взрывчатые вещества, взрывчатые смеси аммиачной селитры с горючими и .А. - вторичные (бризантные) взрывчатые вещества. В качестве горючего в А. применяют органические (древесная мука, торф, жмыхи, нефтяные масла) или неорганические (порошкообразный алюминий, ферросилиций) вещества. Из взрывчатых веществ применяют и др. нитроэфиры, тротил ( ) , ,тен ( ). Смеси селитры с горючим называют динамонами, с тротилом - амматолами, с порошкообразным алюминием и тротилом - аммоналами, с гексогеном, алюминием и тротилом - скальными А. Смеси со значительным содержанием жидких нитроэфиров относят к .Эксплуатационные характеристики А.: теплота взрыва от 2,1 до 8,4 Мдж/кг(от 500 до 2000 ккал/кг) ,скорость детонации от 1,5 - 2 до 5 - 6 км/ сек,плотность заряда от 0,8 до 1,5 г/см 3.Производство А. сводится к подготовке исходных компонентов (сушка, измельчение, просеивание) и их смешиванию. Полученные смеси укупориваются в тару или идут на изготовление патронов. А. применяют при различных видах открытых взрывных работ, для снаряжения различных типов боеприпасов (мин, бомб, снарядов), для военно-инженерных подрывных работ; А. являются составной частью предохранительных взрывчатых веществ. Преимущества А. по сравнению с др. взрывчатыми веществами - малая чувствительность к механическим воздействиям (удар, трение), высокая химическая стойкость, относительная безопасность в производстве, хранении и обращении; недостатки - гигроскопичность, низкая водоустойчивость, способность к слёживанию. Лит.:Яременко Н. Е., Светлов Б. Я., Теория и технология промышленных взрывчатых веществ, М., 1957. Аммонификация Аммонифика'ция(от и лат. facio - делаю), процесс разложения содержащих азот органических веществ с выделением аммиака. А. имеет большое значение в круговороте азота в природе и питании растений. В процессе А. трудно-усвояемый азот органических соединений почвы (гумуса, органических удобрений, растительных остатков, отмерших тел животных и микроорганизмов) переходит в доступную для растений форму. А. белков осуществляется широко распространёнными в почве гнилостными бактериями, а также некоторыми актиномицетами и грибами. Выделяющийся при А. аммиак частично используется самими микроорганизмами, а большая часть его нейтрализуется в почве органическими и неорганическими кислотами с образованием аммонийных солей. Остатки молодых растений аммонифицируются быстрее, чем старых, одревесневших. А. происходит как при свободном доступе воздуха, так и при его недостатке; в анаэробных условиях А. приводит к образованию вредных для растений восстановленных промежуточных продуктов. Лит.:Федоров М. В., Микробиология, 7 изд., М., 1963; Пошон Ж. и Баржак Г., Почвенная микробиология, пер. с франц., М., 1960. Аммония гидроокись Аммо'ния гидроо'кись,NH 4OH, соединение, образующееся при растворении в воде. Благодаря отщеплению в водном растворе ионов OH -обладает щелочными свойствами (более слабыми, однако, чем NaOH или KOH). Процесс растворения аммиака в воде может быть представлен уравнением: 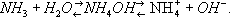
А. г. - один из важнейших химических реактивов. Его разбавленные растворы называются нашатырным спиртом; последний применяют в домашнем хозяйстве - при стирке белья и выведении пятен, в медицине - для возбуждения дыхания при обморочном состоянии (осторожно подносят к носу смоченную раствором ватку). Нашатырный спирт, выпускаемый в продажу, содержит обычно около 10% аммиака. Аммония карбонат Аммо'ния карбона'т,углекислый аммоний, (NH 4) 2CO 3, соль, бесцветные кристаллы. Хорошо растворим в воде. Очень неустойчив как на воздухе, так и в растворе, т. к. уже при комнатной температуре выделяет аммиак, превращаясь в бикарбонат аммония NH 4HCO 3. При t 60°С быстро распадается на NH 3, CO 2и H 2O. На этом процессе, связанном с выделением газов, основано применение А. к. вместо дрожжей в хлебопечении и кондитерской промышленности. Получают А. к. взаимодействием газообразных NH 3, CO 2и H 2O при быстром охлаждении продуктов реакции. Технический продукт содержит наряду с (NH 4) 2CO 3соединение NH 4HCO 3с карбаминатом аммония NH 4HCO 3ЧNH 4COONH 2. Аммония нитрат Аммо'ния нитра'т,то же, что . Аммония персульфат Аммо'ния персульфа'т,аммония пероксосульфат, надсернокислый аммоний, (NH 4) 2S 2O 8, соль, бесцветные кристаллы. В присутствии влаги медленно разлагается с выделением кислорода, содержащего озон. Хорошо растворим в воде (65 гв 100 гH 2O при 20°С). В водных растворах, подкисленных серной кислотой, разлагается на бисульфат аммония NH 4HS0 4и перекись водорода H 2O 2. При температуре выше 120°С разлагается на сульфат аммония (NH 4) 2SO 4, SO 2и O 2. Сильный окислитель. В промышленности А. п. получают анодным окислением насыщенного раствора (NH 4) 2SO 4при температуре ниже 30°С. Применяют как инициатор в процессах полимеризации, как средство для отбеливания и дезинфицирования, в фотографии, аналитической химии и др. См. также . Аммония сульфат Аммо'ния сульфа'т,сернокислый аммоний, (NH 4) 2SO 4, соль, бесцветные кристаллы с плотностью 1770 кг/м 3.При нагревании до 357°С частично разлагается с выделением аммиака и образованием кислого А. с., последний плавится при 251 °С, кипит при 490°С (без разложения). Хорошо растворим в воде (76,9 гв 100 гH 2O при 25°С); в водных растворах имеет кислую реакцию. Практический интерес представляет растворимость А. с. в водном растворе аммиака, что применяется для производства ,с повышением концентрации NH 3растворимость А. с. падает: так, при 10°С в 100 г15%-ного раствора NH 3растворяется 36 г А. с., а в 100 г24,5%-ного раствора - только 18 г. В промышленности А. с. получают взаимодействием серной кислоты с аммиаком, содержащимся в газе коксовых печей, или с синтетическим аммиаком. А. с. - более концентрированное ,чем навоз. Аммония фосфаты Аммо'ния фосфа'ты, см. . Аммония хлорид Аммо'ния хлори'д,хлористый аммоний, нашатырь, NH 4CI, соль, бесцветные кристаллы, плотность 1526 кг/м 3.При нагревании до 338°С полностью распадается на NH 3и HCl. В воде А. х. хорошо растворим (37,2 гв 100 г H 2O при 20°С), растворы имеют слабокислую реакцию; хорошо растворим в жидком аммиаке. А. х. получают как побочный продукт в производстве соды по аммиачному способу и др. методами. Применяют в производстве сухих гальванических элементов, при паянии и лужении, а также в медицине (при сердечных отёках и для усиления действия ртутных мочегонных препаратов). Аммонолиз Аммоно'лиз,обменное разложение органических соединений с участием аммиака, например CH 3COOC 2H 5+ NH 3® CH 3CONH 2+ C 2H 5OH. Аммосов Максим Кирович Аммо'совМаксим Кирович [11(23). 10.1897 - 28.7.1938], советский государственный и партийный деятель, активный участник борьбы за установление Советской власти в Якутии. Член Коммунистической партии с 1917. Родился в Нанском улусе Хатырицкого наслега Якутского округа в семье оленевода. В революционном движении с 1916. С 1918 секретарь Якутского совета, затем на подпольной работе в Сибири. В 1920, после разгрома белогвардейцев, был уполномоченным по организации органов Советской власти в Якутии. В 1921 председатель ревкома, с 1922 секретарь областного Якутского бюро РКП(б). С 1923 председатель Якутского представительства в Москве. В 1925-28 председатель Совнаркома и ЦИК Якутской АССР. В 1928-30 - в аппарате ЦК ВКП(б). С 1932 секретарь Западно-Казахстанского, с 1934 первый секретарь Карагандинского, с 1936 Северо-Казахстанского, затем Киргизского обкомов ВКП(б). С марта 1937 первый секретарь ЦК КП(б) Киргизии. Делегат 11, 13, 16 и 17-го съездов партии. Избирался членом ЦИК СССР. Аммофила Аммофи'ла,род перепончатокрылых насекомых; см. . Аммофос Аммофо'с,двойное азотно-фосфорное концентрированное минеральное удобрение. Состоит в основном из моноаммоний-фосфата NH 4H 2PO 4с примесью диаммонийфосфата (NH 4) 2HPO 4. Содержит 45-52% фосфорного ангидрида и 10-12% азота. Применяется на разных почвах в качестве основного удобрения и для подкормок. См. . Амнезия Амнези'я(от греч. а - отрицательная частица и mnm - память), нарушение памяти; см. . Амнион Амнио'н(греч. amnнon), одна из зародышевых оболочек у ряда позвоночных (пресмыкающихся, птиц и млекопитающих) и беспозвоночных животных. По признаку наличия или отсутствия А. позвоночных делят на две группы: ,или высшие, и ,или низшие. А. развивается вокруг зародыша в виде складок внезародышевой эктодермы и париетального листка боковых пластинокмезодермы, т. е. наружного и среднего .После срастания краев складок зародыш оказывается в двух оболочках - внутренней, или А., и наружной, или серозной (у млекопитающих называется ) .У пресмыкающихся А. лишён сосудов; у птиц и млекопитающих в нём развиваются сосуды и сократительные мышечные элементы; полость А. наполняется большим количеством выпота из сосудов, т. н. амниотической, или плодной, жидкостью, которая предохраняет зародыш от механических повреждений и высыхания. Она содержит органические соединения (белки, мочевина, сахара, гормоны), а также неорганические соли. При родах А. лопается, амниотическая жидкость вытекает; остатки А. на теле новорождённого называется «рубашечкой». А. называют также зародышевую оболочку у насекомых, скорпионов, немертин и морских ежей. Амниоты Амнио'ты(Amniota), высшие позвоночные животные, у которых на ранних стадиях развития образуются особые зародышевые оболочки, в том числе (отсюда название). К А. относятся пресмыкающиеся, птицы и млекопитающие. В отличие от (круглоротые, рыбы, земноводные), эмбриональное развитие которых происходит в воде, А. приспособлены к развитию на суше, в том числе вторично в утробе матери (млекопитающие). Амнистия Амни'стия(от греч. amnstнa - забвение, прощение), полное или частичное освобождение от наказания лиц, совершивших преступления, либо замена этим лицам назначенного судом наказания более мягким наказанием. А. может также предусматривать снятие судимости с лиц, ранее отбывших наказание. Иногда акт об А. предусматривает и освобождение лиц, совершивших проступки, наказуемые в административном либо дисциплинарном порядке, от соответствующих мер взыскания. А. может быть общей (распространяется на всех совершивших преступления, предусмотренные определёнными статьями уголовного кодекса, при соблюдении других условий акта об А.) или частичной, т. е. относящейся к отдельным лицам (осуществляется в форме помилования). Категории лиц, которые подлежат А., устанавливаются в каждом конкретном случае в самом акте об А. По общему правилу А. распространяется лишь на те преступления, которые были совершены до издания (вступления в силу) данного акта. Право А. обычно предоставляется высшему представительному органу страны или главе государства. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 |
|||||||
 , H-H 1,64
, H-H 1,64
 .
.