 |
|
Популярные авторы:: БСЭ :: Толстой Лев Николаевич :: Азимов Айзек :: Раззаков Федор :: Чехов Антон Павлович :: Грин Александр :: Горький Максим :: Борхес Хорхе Луис :: Сименон Жорж :: Андреев Леонид Николаевич Популярные книги:: Ожерелье Иомалы :: Магия луны (Том 1) :: Истина — страна без дорог (Заявление Дж. Кришнамурти о роспуске Ордена Звезды) :: Огненная река :: Ночной орёл :: О «Двух душах» М. Горького :: Русь (Часть 2) :: Роковые кости :: Звезды в их руках :: Лет за триста до братьев Люмьер |
Большая Советская Энциклопедия (АК)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (АК) - Чтение (стр. 14)
Лит.:Еникеев X. К., Шашкин И. Н., Восточноазиатские виды косточковых и актинидий, М., 1937; Деревья и кустарники СССР, т. 4, М. - Л., 1958. 
Актинидия острозубчатая: 1 - ветвь с цветками; 2 - цветок; 3 - плод. Актиниды Актини'ды,то же, что актиноиды . Актинии Акти'нии(Actiniaria), морские анемоны, отряд морских кишечнополостных животных класса коралловых полипов (Anthozoa). А. - одиночные полипы, редко - колониальные. Тело А. цилиндрическое (от нескольких ммдо 1,5 мв поперечнике), мешковидное, с мускулистой подошвой, при помощи которой животное может медленно передвигаться. На верхнем конце тела имеется рот, окруженный венчиком щупалец. Известны также виды, ведущие прикрепленный, роющий и плавающий образ жизни. Обычно ярко окрашены. Распространены широко, однако большинство обитает в тропических и субтропических водах; в СССР - в Чёрном, северных и дальневосточных морях. А. - хищники, питаются различными мелкими животными и даже мелкими рыбами; имеются также илоядные формы. Добычу схватывают щупальцами, вооружёнными стрекательными клетками,«выстрелы» которых парализуют или убивают жертву, а у человека могут вызвать болезненные ожоги. Некоторые А. живут в симбиозе с раками-отшельниками и др. беспозвоночными. Лит.:Догель В. А., Зоология беспозвоночных, 5 изд., М., 1959; Жизнь животных, т. 1, М., 1968, с. 299-306. Ф. А. Пастернак. 
Обыкновенная, или конская, актиния. Актиний Акти'ний(лат. Actinium, от греч. aktнs, род. падеж aktнnos - луч), Ac, радиоактивный химический элемент III группы периодической системы Менделеева, атомный номер 89. Стабильных изотопов не имеет. Открыт в 1899 французским химиком А. Дебьерном при изучении отходов от переработки урановой руды. Известно 10 радиоактивных изотопов А. с массовыми числами от 221 до 230. Наиболее долгоживущий 227Ac (период полураспада T 1/ 2= 21,8 года) испускает b-частицы (98,8% ) и a-частицы (1,2%). Изотопы 227Ac и 228Ac (T 1/ 2= 6,13 ч;его называют также мезоторий II, MsThll) встречаются в природе в рудах урана и тория как члены естественных радиоактивных семейств.Поверхностный слой земной коры толщиной 1,6 кмсодержит 11 300 т 227Ac ,но по сравнению с другими элементами содержание А. в земной коре очень мало (6Ч10 -10% по массе). Элементарный А. - серебристо-белый металл с гранецентрированной кубической решёткой, t пл1050±50°C, t kип, вероятно, около 3300°C; из-за высокой радиоактивности слабо светится в темноте. На влажном воздухе покрывается белой плёнкой окиси, препятствующей дальнейшему окислению металла. В соединениях А. 3-валентен. Почти все соли А. белого цвета, в растворах - бесцветны. Большинство из них (кроме AcP0 4) изоморфно с соответствующими соединениями лантана. А. образует те же нерастворимые соединения, что и La (гидроокись, фосфат, оксалат, карбонат, фторсиликат). Гидроокись А. Ac(OH) 3имеет более основной характер, чем гидроокись лантана La(OH) 3. Из-за чрезвычайной близости химических свойств А. и лантана выделение А. в чистом виде из природных объектов (содержащих La и др. редкоземельные элементы) связано с громадными трудностями, и поэтому миллиграммовые количества А. ( 227Ac) получают искусственно при облучении нейтронами радия 226Ra. Вероятность распада 227Ac с испусканием a-частиц невелика, а энергия его b-частиц очень мала (46 кэв) ,поэтому обнаружить какое-либо излучение, которое бы сопровождало радиоактивный распад 227Ac ,долгое время не удавалось, и до 1935 считалось, что радиоактивный распад 227Ac не сопровождается излучением. Современные приборы позволяют идентифицировать такое мягкое b-излучение, но проводить его количественные измерения и сейчас довольно трудно, поэтому в опытах с микроколичествами 227Ac за его поведением следят, как правило, по измерению активности дочерних продуктов. В смеси с бериллием 227Ac служит для приготовления нейтронных источников,в которых нейтроны образуются при облучении ядер бериллия 9Be a-частицами, испускаемыми дочерними продуктами 227Ac. Лит.:Сиборг Г., Кац Дж., Химия актинидных элементов, пер. с англ., М., 1960; Бэгнал К., Химия редких радиоактивных элементов, полоний - актиний, пер. с англ., М., 1960. С. С. Бердоносов. Актиничность Актини'чностьфотографическая, способность излучения оказывать фотографическое действие на светочувствительный материал. В случае неизменного во времени излучения мерой относительной А. служит отношение освещённостей, создаваемых в плоскости фотографического материала излучающим источником и источником сравнения, которые при одинаковых выдержках и последующей химико-фотографической обработке дают одинаковый фотографический эффект. Актино... Актино...(от греч. aktнs - луч), составная часть сложных слов, соответствующая по значению: 1) слову «лучистый» (например, актинолит ); 2) словосочетанию «лучистая энергия» (например, актинометрия ). Актинобациллёз Актинобациллёз,проактиномикоз, псевдоактиномикоз, инфекционное хроническое заболевание животных, характеризующееся гнойными поражениями мягких тканей головы (губ, языка, щёк), шеи, лимфатических узлов. Возбудитель А. - микроскопический грибок. К А. восприимчивы рогатый скот, свиньи, олени. Возбудитель болезни проникает в организм через поврежденные ткани, чаще с кормом. А. возникает зимой или весной, обычно среди молодняка. Экономический ущерб от А. невелик. А. человека встречается редко, обычные меры личной гигиены предупреждают болезнь. Лечение больных животных, меры профилактики А. см. в ст. Актиномикоз . Актинограф Актино'граф(от актино... и греч. grбphM - пишу), прибор для непрерывной автоматической записи интенсивности солнечной радиации. Состоит из приёмника - чаще всего термоэлектрического актинометра , -вращаемого за солнцем гелиостатом , и регистрирующей части - гальванографа (самопишущего высокочувствительного гальванометра). Актиноиды Актино'иды,актиниды, семейство из 14 химических элементов с атомными номерами Z 90 - 103, расположенных в 7 периоде системы Менделеева за актинием Ac и относящихся, как и актиний, к III группе системы. К А. принадлежат: торий Th (Z=90), протактиний Pa(91), уран U (92), нептуний Np(93), плутоний Pu (94), америций Am (95), кюрий Cm(96), берклий Bk (97), калифорний Cf (98), эйнштейний Es (99), фермий Fm (100), менделевий Md (101), элемент № 102, не имеющий пока общепринятого названия, и лоуренсий Lr (103). Все А. радиоактивны, т. е. не имеют стабильных изотопов. Th, Pa и U принадлежат к естественно-радиоактивным элементам, встречающимся в природе, и открытым ранее др. А. Остальные А., часто называемые трансурановыми элементами,получены в 1940-63 искусственным путём при помощи ядерных реакций. Из них только Np и Pu обнаружены в ничтожно малых количествах в некоторых радиоактивных рудах, более «тяжёлые» А. (т. е. А. с большими атомными номерами) в природе не найдены. Огромная заслуга в изучении А. принадлежит американскому химику Г. Т. Сиборгу,который выдвинул гипотезу о существовании группы А. (1942) и под руководством или при участии которого было впервые синтезировано девять А. Выделение А. в специальное семейство связано со схожестью химических свойств этих элементов между собой и с актинием, что объясняется сходным строением наружных электронных оболочек их атомов (см. ниже). Название А. (от актиний и греч. йidos - вид) означает - подобные актинию. Оно дано А. по аналогии с лантаноидами-семейством из 14 элементов, также относящихся к III группе системы Менделеева и следующих в 6-м периоде за лантаном. Свойства элементов обоих семейств во многом сходны друг с другом. Близость химических свойств А. между собой и их сходство с лантаноидами связаны с особенностями строения электронных оболочек атомов этих семейств. Как известно, атом состоит из ядра и электронных оболочек, число которых равно номеру периода элемента в таблице Менделеева (у А. электронных оболочек 7). Отличие А. (и соответственно лантаноидов) от др. элементов состоит в том, что при переходе от первого А. - Th (Z = 90) ко второму - Pa (Z = 91) и т. д. вплоть до последнего А. - Lr (Z =103), каждый новый электрон, появляющийся в атомах параллельно с увеличением атомного номера (Z), попадает не на внешние оболочки (6-ю и 7-ю от ядра), как это бывает обычно, а заполняет более близкую к ядру 5-ю оболочку. У лантаноидов (число оболочек 6) также заполняется электронами более близкая к ядру 4-я оболочка (а не наружные - 5-я и 6-я). Таким образом, у элементов обоих семейств происходит заполнение 3-й снаружи электронной оболочки, а строение 2 наружных оболочек оказывается сходным. Число электронов на этих наружных оболочках у А. и лантаноидов, как правило, не отличается более чем на 1, причём почти во всех случаях представители каждого из семейств, равноудалённые соответственно от лантана и актиния, содержат на 2 наружных оболочках строго одинаковое число электронов. (Здесь изложен лишь принцип заполнения электронных оболочек у атомов обоих семейств; во многих случаях, особенно у А., порядок заполнения сложнее. См. Атом и Периодическая система элементов Д. И. Менделеева ) .Электронные конфигурации атомов А. даны в таблице.
Химические свойства элемента зависят в основном от числа электронов на наружных слоях и размера атомных и ионных радиусов, поэтому не удивительно, что во-первых, свойства А. близки между собой, и, во-вторых, химическое поведение А. и лантаноидов обладает большим сходством. Это сходство особенно заметно тогда, когда элементы находятся в одинаковом валентном состоянии. Так, 3-валентные А. образуют те же нерастворимые соединения (гидроокиси, фториды, карбонаты, оксалаты и др.), что и 3-валентные лантаноиды; трифториды, трихлориды и другие аналогичные соединения 3-валентных А. образуют изоструктурные ряды [другими словами, соединения, входящие в такие ряды, например в ряд MeCl 3, где Me - атом А., обладают сходными кристаллическими решётками, параметры которых постепенно уменьшаются по мере роста атомного номера (Z) атома А.]. Такие же изоструктурные ряды образуют двуокиси, тетрафториды, гексафториды и другие соединения А. По склонности к гидролизу соединения 5-валентных А., например пентахлориды, очень близки между собой. В растворах 6-валентные А. существуют в виде МеО 2 2+-ионов и т. д. Приведённые примеры далеко не исчерпывают всех случаев сходства А., пои на них можно убедиться в его наличии. Однако, кроме общих черт, между А. и лантаноидами имеется и существенная разница. Так, А. часто образуют соединения в состояниях окисления, значительно более высоких, чем +3, что не характерно для лантаноидов. В своих соединениях А. проявляют следующие валентности (наиболее типичная выделена жирным шрифтом): Th (3, 4), Pa (3, 4, 5), U (3, 4, 5, 6), Np (3, 4, 5, 6, 7), Pu (3, 4,5, 6, 7), Am ( 3, 4, 5, 6), Cm ( 3, 4), Bk ( 3,4), Cf (2, 3), Es ( 3), Fm ( 3), Md (2, 3), № 102 ( 2, 3). Таким образом, валентность 3 характерна для А. только после Am. Первые члены семейства А. (Th, Pa и U) в своих соединениях чаще бывают соответственно 4-, 5- и 6-валентными. А. в большей степени, чем лантаноиды, склонны к комплексообразованию. Указанные особенности А. объясняются тем, что «вновь пришедшие» на 5-ю от ядра оболочку электроны (т. н. 5f-электроны или электроны 5f-подуровня) по энергии связи с ядром очень близки к электронам 6-й оболочки (т. н. 6d-электронам или электронам 6 d-подуровня); эти 6 d-электроны и могут проявлять себя как дополнительные валентные (см. табл.). У лантаноидов же «вновь пришедшие» 4f-электроны всегда связаны с ядром значительно прочнее, чем 5 d-электроны. Близость энергии связи с ядром 5f- и 6 d-электронов у Th, Pa и U приводит к тому, что f-электроны 5-й оболочки также могут проявлять себя как валентные. Валентность 3 оказывается для этих элементов не характерной, и по многим своим признакам они похожи на элементы не III, а, соответственно, IV, V и VI групп периодической системы (и долгое время в эти группы и помещались). В 1930-х и в начале 1940-х гг. считалось, что и следующие за U элементы Np и Pu также должны относиться соответственно к VII и VIII группам периодической системы, или, вследствие обнаруженных у Np и Pu черт сходства с U, их следует разместить вместе с U в VI группе. Однако анализ закономерностей изменения химических свойств элементов 7-го периода, особенно после открытия следующих за Pu А., а также найденное экспериментально сходство кристаллографических, спектроскопических и магнитных характеристик соединений элементов, следующих за актинием, с соответствующими характеристиками лантаноидов, навели Сиборга на мысль, что трансурановые элементы должны рассматриваться как аналоги актиния, в результате чего и была выдвинута гипотеза о существовании семейства А. Актиноидная гипотеза в значительной мере способствовала успехам открытия Am, Cm и последующих А., т. к. из неё следовало, что наиболее характерная валентность этих элементов должна быть равна 3, а не 4 и 6, как первоначально предполагали, и, следовательно, в этом валентном состоянии их и надо искать. Электронные конфигурации атомов актиноидов
Свойства элементов, отнесённых Сиборгом к числу А., по рассмотренным выше причинам, значительно сильнее различаются между собой, чем свойства лантаноидов, и поэтому вопрос о том, существует ли в действительности в 7-м периоде семейство А. (аналогичное семейству лантаноидов 6-го периода), или строение 7-го периода в этой его части более сложное, долгое время не был решен до конца. Решающее значение для окончательного вывода о строении 7-го периода имело изучение химических свойств 104-го элемента - курчатовия (открытого Г. Н. Флёровым с сотрудниками в 1964), проведённое в 1966 под руководством чешского химика И. Звары в Дубне (СССР). Оказалось, что по своим свойствам курчатовий резко отличается от предшествующих элементов и представляет собой аналог гафния, принадлежащего уже к IV группе периодической системы. Теоретические же расчёты показывают, что число элементов, у которых заполняется f-подуровень 3-й снаружи электронной оболочки, должно быть равно 14, и поэтому следует принять, что семейство 14 А. начинается с Th и завершается у Lr. В настоящее время все А., как и лантаноиды, принято размещать в отдельном ряду внизу периодической системы. Из-за близости химических свойств А., особенно трансурановых, отделить их друг от друга крайне сложно. Для разделения А. очень полезным оказался метод ионообменной хроматографии,которым широко пользуются и для разделения лантаноидов. Поскольку этот метод сыграл важную роль в открытии и изучении А. и, кроме того, даёт ясное представление о работе с этими элементами, с ним стоит познакомиться подробнее. Стеклянную трубку, расположенную вертикально, заполняют специальным органическим полимером или смолой, а затем на этот полимер подают раствор, содержащий, например, 3-валентные ионы А. Ионы реагируют с полимером и оказываются связанными с ним химически. Для извлечения А. из трубки колонки через неё пропускают раствор, который содержит вещества, способные образовывать с ионами А. более прочные связи, чем органический полимер. Порядок выхода А. из колонки зависит, в основном, от ионного радиуса элементов, причём можно подобрать такие условия, что быстрее всего колонку покинут ионы с наименьшими радиусами. Т. к. радиусы ионов от Th к Lr постепенно уменьшаются, то выход ионов А. будет происходить в последовательности, обратной их атомным номерам Z. Порядок в выходе А. выполняется столь строго, что даёт возможность по наличию радиоактивных атомов в той или иной порции раствора, прошедшего через колонку, сделать вывод, какие именно элементы присутствуют в смеси, и точно определить их порядковые номера. Метод обладает высокой избирательностью, требует небольших затрат времени и пригоден даже тогда, когда в наличии имеется лишь несколько атомов элемента. Он был использован, в частности, при открытии Bk, Cf, Es, Fm и Md. Из всех А. к настоящему времени практическое. применение находят главным образом Th, U и Р . Изотопы 233U, 235U и 239Pu служат как ядерное горючее в атомных реакторах и играют роль взрывчатого вещества в атомных бомбах. Некоторые изотопы А. ( 238Pu, 242Cm и др.), испускающие a-частицы высокой энергии, могут служить для создания источников тока со сроком службы до 10 лет и более, необходимых, например, для питания навигационной радиоаппаратуры спутников. В таких источниках тока тепловая энергия, выделяющаяся при радиоактивном распаде, при помощи специальных устройств преобразуется в электрический ток. Изучение свойств А. имеет большое теоретическое значение, т. к. позволяет расширить знания о свойствах атомных ядер, химическом поведении элементов и т. д. Лит.:Хайд И., Сиборг Г. Т., Трансурановые элементы, пер. с англ., М., 1959; Сиборг Г., Кац Дж., Химия актинидных элементов, пер. с англ., М., 1960; Гольданский В. И., Новые элементы в Периодической системе Д. И. Менделеева, 3 изд., М., 1964; Лапицкий А. В., Цисурановые и трансурановые элементы, в сборнике: Рассказывают ученые-химики, М., 1964; Сиборг Г., Искусственные трансурановые элементы, пер. с англ., М., 1965; Хайд Э., Перлман И., Сиборг Г., Ядерные свойства тяжелых элементов, в. 1, Трансурановые элементы, пер. с англ., М., 1967. С. С. Бердоносов. Актинолит Актиноли'т,лучистый камень, минерал из группы амфиболов.Химический состав Ca 2(Mg, Fe) 5[Si 40 11] 2(OH) 2. Иногда имеет примесь MnO (манганактинолит). Кристаллизуется в моноклинной системе. Образует вытянутые, игольчатые и нитевидные кристаллы, собранные в радиально-лучистые, спутанно-волокнистые (нефрит) агрегаты. Цвет зелёный, блеск стеклянный, твердость по минералогической шкале 5,5-6; плотность 3170-3300 кг/м 3.А. породообразующий минерал метаморфических сланцев и контактовых скарнов,где он встречается вместе с хлоритом, эпидотом, тальком, кварцем, гранатом и др. Г. П. Барсанов. Актинометр Актино'метр(от актино... и греч. metrйM - измеряю), прибор для измерения интенсивности прямой солнечной радиации. Принцип действия А. основан на поглощении падающей радиации зачернённой поверхностью и превращении её энергии в теплоту. А. является относительным прибором, т.к. об интенсивности радиации судят по различным явлениям, сопровождающим нагревание, в отличие от пиргелиометров-приборов абсолютных. Например, принцип действия актинометра Михельсона основан на нагревании солнечными лучами зачернённой сажей биметаллической пластинки 1, спрессованной из железа и инвара ( рис. 1 ). При нагревании железо удлиняется, а инвар почти не испытывает теплового расширения, поэтому пластинка изгибается. Величина изгиба служит мерой интенсивности солнечной радиации. С помощью микроскопа 3наблюдают перемещение кварцевой нити 2,расположенной на конце пластинки 1. В термоэлектрическом актинометре Савинова - Янишевского приёмной частью служит тонкий зачернённый с наружной стороны серебряный диск 1( рис. 2 ), к внутренней стороне которого приклеены центральные спаи 2термоэлементов, состоящих из зигзагообразно соединённых полосок манганина и константана (т. н. звёздочка Савинова). Периферийные спаи 3приклеены к медному кольцу в корпусе А. При падении на приёмную поверхность солнечных лучей центральные спаи нагреваются, в то время как периферийные затенены; в результате возникает термоэлектрический ток, пропорциональный разности температур центральных и периферийных спаев, которая в свою очередь пропорциональна измеряемому потоку радиации. Лит.:Кондратьев К. Я., Актинометрия, Л., 1965; Кедроливанский В. Н. и Стернзат М. С., Метеорологические приборы, Л., 1953. 
Рис. 2. Приёмная часть актинометра Савинова - Янишевского («звёздочка» Савинова). 
Рис. 1. Приёмная часть актинометра Михельсона. Актинометрия Актиноме'трия,раздел геофизики, в котором изучаются перенос и превращения излучения в атмосфере, гидросфере и на поверхности Земли; в узком смысле слова А. - совокупность методов измерений радиации Земли в метеорологии. Источником энергии процессов, происходящих на Земле и в атмосфере, является Солнце. При прохождении коротковолновой радиации Солнца (электромагнитное излучение в области длин волн 0,3-3 мкм) через атмосферу Земли, в верхних слоях происходят химические реакции, ионизация,диссоциация молекул; поглощение радиации, главным образом озоном, водяным паром и земной поверхностью приводит к нагреванию атмосферы. С другой стороны, Земля, как всякое нагретое тело, излучает энергию в мировое пространство. Приход-расход энергии излучения атмосферы и подстилающей поверхности является конечной причиной появления различных климатических зон на Земле и смены погоды. В связи с этим основной задачей А. является количественное и качественное исследование прямой, рассеянной и отражённой солнечной радиации, длинноволновой радиации земной поверхности и атмосферы (см. Длинноволновое излучение ) , радиационного баланса атмосферы,разработка приборов и методов измерений превращений лучистой энергии в атмосфере, гидросфере и на земной поверхности. А. тесно связана с атмосферной оптикой и спектроскопией,имеет много общего с гелиофизикой,физикой высоких слоев атмосферы и физикой приземного слоя. Результаты экспериментальных и теоретических работ по А. применяют в климатологии, сельском хозяйстве и промышленности, в медицине, архитектуре, транспорте, в аэрологии и метеорологии. Развитие А. началось ещё в 17 в. Первые измерения солнечного тепла (в некоторых относительных единицах) были произведены английским учёным Э. Галлеем в 1693. В 1896 русский учёный Р. Н. Савельев впервые провёл измерения прямой солнечной радиации с воздушного шара, положив этим начало актинометрическим исследованиям в свободной атмосфере. Однако лишь после создания пиргелиометра (1887) и пиргеометра (1905) шведским учёным К. Ангстремом и биметаллического актинометра (1905) русским физиком В. А. Михельсоном исследования солнечной и земной радиации приобрели строго количественный характер. История нового периода А. в России тесно связана с именем С. И. Савинова и Павловской обсерваторией. В СССР в 1925 при Главной Геофизической обсерватории (ГГО) была создана постоянная актинометрическая комиссия под руководством которой началось расширение сети актинометрических станций. ГГО - одна из старейших обсерваторий мира, практически руководит в СССР всеми работами в области актинометрических измерений на поверхности Земли и климатологических исследований теплового баланса. Впервые в СССР в 1948 в ГГО начались радиационные измерения с самолёта. Обширные исследования в области А. проводились в Центральной Аэрологической обсерватории и Ленинградском государственном университете. С 1954 в ФРГ, США, СССР и в Японии начались исследования свободной атмосферы при помощи актинометрических радиозондов (АРЗ) - приборов, поднимаемых на одной-двух небольших оболочках до 30-35 кми дающих распределение по высоте нисходящих и восходящих потоков длинноволновой радиации и эффективного излучения с достаточной для решения многих задач геофизики точностью. С 1963 впервые в мире в СССР начала работать сеть актинометрического радиозондирования, проводящая регулярные выпуски АРЗ. Кроме того, актинометрические исследования свободной атмосферы при помощи АРЗ проводят с кораблей погоды и в Антарктиде. Теоретические работы в А. охватывают широкий круг задач, в особенности вопрос о связи радиации с температурой атмосферы, облачностью, изменениями погоды и климата. Ведущее место среди исследований связи радиации с облачностью занимают работы Физики атмосферы института АН СССР, а по теории климата - ГГО и Гидрометеорологического научно-исследовательского центра СССР . Особенно большие возможности получила А. в связи с запуском искусственных спутников Земли (ИСЗ). По измерениям радиации в области 8-12 мкм,где атмосфера слабо влияет на излучение земной поверхности, определяют радиационную температуру этой поверхности, что позволяет устанавливать во многих случаях наличие или отсутствие облачности; измерения уходящей коротковолновой (отражённой) и длинноволновой радиации дают баланс системы Земля - атмосфера, который играет большую роль при климатологических исследованиях. Возможности спектральных радиационных исследований с ИСЗ вызвали постановку так называемых обратных задач А., в которых по результатам измерений энергий излучения делается попытка найти температурный профиль атмосферы и распределение её основных поглощающих компонентов (водяного пара, углекислого газа, озона) по высоте. Эти задачи поставили новые проблемы в математике, спектроскопии, технике актинометрического приборостроения и теории переноса лучистой энергии, что явилось новым толчком для развития А. Большую роль в развитии А. играет объединение усилий ряда стран при проведении исследований по международным программам в периоды Международного года спокойного Солнца, Международного года геофизического сотрудничества, Международного геофизического годаи т. д. Основные материалы по А. публикуются в журналах по физике атмосферы, аэрологии и метеорологии, в трудах научно-исследовательских организаций. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 То обстоятельство, что при переходе от Th к Lr число электронов на 2 внешних оболочках, как правило, не изменяется, а положительный заряд ядра постепенно возрастает, вызывает более сильное притяжение внешних электронов к ядру и приводит к т. н. актиноидному сжатию: у нейтральных атомов и ионов А. одинаковой валентности при увеличении атомного номера радиусы не увеличиваются, как это обычно бывает, а даже несколько уменьшаются (например, радиус U
3+равен 1,03
То обстоятельство, что при переходе от Th к Lr число электронов на 2 внешних оболочках, как правило, не изменяется, а положительный заряд ядра постепенно возрастает, вызывает более сильное притяжение внешних электронов к ядру и приводит к т. н. актиноидному сжатию: у нейтральных атомов и ионов А. одинаковой валентности при увеличении атомного номера радиусы не увеличиваются, как это обычно бывает, а даже несколько уменьшаются (например, радиус U
3+равен 1,03
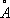 , Np
3+- 1,01
, Np
3+- 1,01
 , Pu
3+- 1,00
, Pu
3+- 1,00
 , Am
3+- 0,99
, Am
3+- 0,99
 и т. д.).
и т. д.).