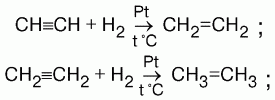Шпаргалка по органической химии
ModernLib.Net / Химия / Титаренко Алена / Шпаргалка по органической химии - Чтение
(Ознакомительный отрывок)
(стр. 2)
1.
Горение углеводородов на воздухе и выделение большого количества теплоты.
Продукты горения подтверждают наличие углерода и водорода в метане. Если поджечь газ, собранный в стеклянном цилиндре, то после прекращения горения стенки внутри цилиндра становятся влажными.
При добавлении в цилиндр известковой воды она становится мутной.
При горении метана образуются вода и оксид углерода (IV).
2.
Смесь метана с кислородом или воздухом при поджигании может взрываться.
Наиболее сильный взрыв получается, если смешать метан с кислородом в объемном отношении 1:2. Оптимальное отношение объемов при взрыве метана с воздухом 1:10.
Взрыв меньшей силы может происходить и при некоторых других объемных отношениях газов.
Наиболее опасными являются смеси метана с воздухом в каменноугольных шахтах, заводских котельных, квартирах.
Для обеспечения безопасности работы в шахтах устанавливают автоматические приборы – анализаторы, сигнализирующие о появлении газа.
Горение углеводородов, которые имеют значительную молекулярную массу.
Парафин – это смесь твердых углеводородов.
Если поместить в фарфоровую чашечку кусочек парафина, расплавить и поджечь его, то при горении образуется много копоти.
Когда горят газообразные вещества, они хорошо смешиваются с воздухом и поэтому сгорают полностью.
При горении расплавленного парафина кислорода не хватает для сгорания всего углерода и углерод выделяется в свободном виде.
3.
При сильном нагревании углеводороды разлагаются на простые вещества – углерод и водород.
Эти реакции могут служить подтверждением молекулярной формулы вещества: при разложении метана образуется двойной, а при разложении этана – тройной объем водорода по сравнению с объемом исходного газа (объем углерода как твердого вещества в расчет не принимается).
4.
Реакция с галогенами (хлором).
Если смесь метана с хлором в закрытом стеклянном цилиндре выставить на рассеянный солнечный свет (при прямом солнечном освещении может произойти взрыв), то произойдет постепенное ослабление желто-зеленой окраски хлора при взаимодействии его с метаном.
Химическая реакция заключается в разрыве одних связей и образовании новых.
Атомы хлора имеют в наружном слое по одному неспаренному электрону, становятся свободными радикалами.
Когда атом-радикал, который обладает высокой химической активностью, сталкивается с молекулой метана, его электрон начинает взаимодействовать с электронным облаком атома водорода. Между этими атомами устанавливается
ковалентная связьи образуется молекула
хлороводорода.
13. Применение и получение предельных углеводородов
Сферы применения предельных углеводородов:
1)
метанв составе природного газа находит все более широкое применение в быту и на производстве;
2)
пропан и бутанприменяются в виде «сжиженного газа», особенно в тех местностях, где нет подвода природного газа;
3)
жидкие углеводородыиспользуются как горючее для двигателей внутреннего сгорания в автомашинах, самолетах;
4)
метанкак доступный углеводород в большей степени используется в качестве химического сырья;
5) реакция горения и разложения
метанаиспользуется в производстве сажи, идущей на получение типографской краски и резиновых изделий из каучука;
6) высокая теплота сгорания углеводородов обусловливает использование их в качестве топлива;
7)
метан– основной источник получения водорода в промышленности для синтеза аммиака и ряда органических соединений.
Наиболее распространенный способ получения водорода из метана – взаимодействие его с водяным паром.
Реакция хлорирования служит для получения хлорпроизводного метана.
Особенности хлорметана:1) это газ; 2) это вещество, которое легко переходит в жидкое состояние; 3) это вещество, которое поглощает большое количество теплоты при последующем испарении.
Особенности дихлорметана, трихлорметана и тетрахлорметана:1) это жидкости; 2) используются как растворители; 3) применяются для тушения огня (особенно когда нельзя использовать воду); 4) тяжелые негорючие газы этих веществ, которые образуются при испарении жидкости, быстро изолируют горящий предмет от кислорода воздуха.
Из гомологов метана при реакции изомеризации получаются углероводороды разветвленного строения.
Они используются в производстве каучуков и высококачественных сортов бензина.
Получение углеводородов:1) предельные углеводороды в больших количествах содержатся в природном газе и нефти; 2) из природных источников их извлекают для использования в качестве топлива и химического сырья.
Особенности синтеза метана:1) синтез метана показывает возможность перехода от простых веществ к органическим соединениям. Реакция идет при нагревании углерода с водородом в присутствии порошкообразного никеля в качестве катализатора; 2) синтез метана – реакция экзотермическая. Сильное нагревание не будет повышать выход продукта, равновесие сместится в сторону образования исходных веществ; 3) при слабом нагревании будет недостаточна скорость образования метана; 4) оптимальная температура синтеза метана примерно 500 °C; 5) для разложения метана необходима температура 1000 °C.
14. Алкины (ацетиленовые углеводороды)
Алкины– это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации и связаны друг с другом тройной связью. Общая формула: CnH2n–2, где n > 2. Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома. Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи. Первые два члена гомологического ряда –
этин и пропин –изомеров не имеют. Для
бутиноввозможен только один вид изомерии – изомерия положения тройной связи. Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен. Физические свойства алкинов: 1) С2Н2...С4Н6 – газы; 2) С5Н8...С15Н28 – жидкости; 3) С16Н30... – твердые вещества; 4) плохо растворимы в воде. Химические свойства алкинов: обладают большой реакционной способностью, характеризуются реакцией присоединения, тройная связь содержит две ?-связи.
Реакции присоединения:
1) присоединение водорода (гидрирование). На I ступени образуются алкены, на II ступени – алканы. 2) присоединение галогенов (галогенирование). HC?CH + HCl ? CH2=CHCl ? CH3-CHCl2; На I ступени образуются дигалогеналкены, на II – тетрагалогеналканы. Реакция алкинов с бромной водой – качественная реакция на алкины. Бромная вода обесцвечивается; 3) присоединение галогеноводородов (гидрогалогенирование). На I ступени образуются моногалогеналкены, на II – дигалогеналканы; 4) присоединение воды (гидратация). Ацетилен образует
альдегид,его гомологи –
кетоны (реакция М.Г. Кучерова):
Реакция окисления:1) горение (полное окисление): 2С2Н2 + 5O2 ? 4СO2 + 2Н2О; 2) неполное окисление (под действием окислителя типа КМnO4, К2Сr2О7). При действии сильных окислителей (КМnO4 в нейтральной среде, К2Сr2О7 в кислотной среде) алкины окисляются с разрывом молекулы по тройной связи (кроме ацетилена). Конечным продуктом реакции являются карбоновые кислоты: СН3-С?С-СН3 + 3[О] + Н2О ? 2СН3-СООН – этановая (уксусная) кислота. При неполном окислении ацетилена образуется двухосновная щавелевая кислота: СН?Н + 4[О] ? НООС-СООН.
15. Непредельные (ненасыщенные) углеводороды
Непредельные углеводороды– это углеводороды, в молекулах которых имеются атомы углерода, которые связаны между собой двойными или тройными связями.
Ненасыщенные углеводороды– это углеводороды, молекулы которых имеют меньшее число атомов водорода, чем насыщенные.
Особенности непредельных углеводородов:
1) первыми представителями гомологических рядов непредельных углеводородов являются этилен (с двойной связью) и ацетилен (с тройной связью);
2) двойная связь состоит из одной ?-связи и одной ?-связи;
3) по своей природе ?-связь резко отличается от ?-связи. Основные отличия ?-связи от ?-связи:
а) ?-связь менее прочная при перекрывании электронных облаков вне плоскости молекулы;
б) двойная связь изображается двумя одинаковыми черточками, но при этом учитывается их неравноценность;
4) тройная связь состоит из одной ?-связи и двух ?-связей.
Особенность тройной связи ацетилена и его гомологов: из электронного строения видно, что кратные связи (двойные и тройные) сравнительно легко (легче, чем одинарные) разрываются при химическом взаимодействии.
Гомологические ряды непредельных углеводородов и их особенности:
1) соединения гомологического ряда этилена выражаются общей формулой СnН2n;
2) названия гомологов по рациональной номенклатуре производятся от названий соответствующих предельных углеводородов путем замены окончаний (-ан на – илен);
3) по заместительной номенклатуре названия этиленовых углеводородов производятся от названий предельных углеводородов при замене окончаний – ан на – ен (-ен – двойная связь).
Общее международное название этиленовых углеводородов –
алкены.
Олефины– это непредельные углеводороды ряда этилена, которые содержат одну двойную связь;
4) гомологический ряд ацетилена выражается формулой СnН2n-2;
5) название ацетиленовых углеводородов по заместительной номенклатуре производятся от названий предельных углеводородов при замене окончаний
– анна
– ин.
Алкины– это общее название ацетиленовых углеводородов по заместительной номенклатуре.
Важным источником получения этилена и его гомологов служат газообразные и жидкие продукты крекинга углеводородов нефти.
Крекинг– это процесс расщепления углеводородов с длинными цепями на молекулы меньшей длины.
При крекинге наряду с предельными углеводородами всегда получаются и непредельные, которые образуются при крекинге, а также получаются дегидрированием предельных углеводородов, содержащихся в попутных газах нефтедобычи.
16. Этилен и его гомологи
Особенности строения этилена:1) это бесцветный газ; 2) немного легче воздуха; 3) почти не имеет запаха; 4) плотность этилена при нормальных условиях – 1,25 г/л; 5) молярная масса газа – 1,25 г/л х 22,4 л/моль = 28 г/моль; 6) относительная молекулярная масса этилена – 28 г/моль; 7) не может иметь более двух атомов водорода; 8) молекулярная формула этилена – С2Н4; 9) в его молекуле атомы углерода соединены с меньшим числом атомов водорода, чем в молекуле этана; 10) атомы соединяются в соответствии с валентностью; 11) молекула этилена симметрична, т. е. каждый атом углерода в ней связан с двумя атомами водорода. Четвертые единицы валентности атомов углерода не могут оставаться свободными, они соединяются друг с другом, образуя вторую связь между атомами углерода; 12) в молекуле этилена устанавливается двойная связь. Каждая валентность атома углерода обусловливается наличием неспаренного электрона в его наружном электронном слое; 13) в молекуле этилена сохраняется четырехвалентность углерода и правило электронного октета для его атомов.
Особенности sр2-гибридизации:
1) гибридные облака принимают одинаковую форму несимметричных, вытянутых в одну сторону объемных восьмерок;
2) при образовании химических связей они расходятся на наибольшее удаление друг от друга – это достигается тогда, когда угол между их осями будет составлять 120°;
3) у атомов углерода остается еще по одному р-электрону.
Облако этого электрона не затронуто гибридизацией, оно не изменило своей формы и также имеет вид объемной восьмерки с равномерным распределением электронной плотности по обе стороны ядра;
4) оси электронных облаков перпендикулярны плоскости атомных ядер и оказываются наиболее удаленными от электронных облаков, которые участвуют в образовании химических связей.
Сигма-связь– это первая, более прочная связь, которая образуется при перекрывании электронных облаков в направлении прямой, соединяющей центры атомов.
Сигма-связь – это обычные ковалентные связи атомов углерода с атомами водорода.
Молекулы предельных углеводородов содержат только сигма-связи.
Пи-связь– это менее прочная связь, которая образуется при перекрывании электронных облаков вне плоскости атомных ядер.
Электроны ?-связи и ?-связи теряют свою принадлежность к определенному атому.
Особенности ?-связи и ?-связи:
1) вращение атомов углерода в молекуле возможно в случае, если они соединены ?-связью;
2) появление ?-связи лишает атомы углерода в молекуле свободного вращения.
17. Строение и номенклатура углеводородов ряда этилена
Строение углеводородов:1)
этилен– первый представитель гомологического ряда веществ, в молекулах которых имеется двойная связь между атомами углерода; 2) ближайшие гомологи этилена –
пропилен и бутилен;3) названия углеводородов ряда этилена образуются путем изменения суффикса
– ансоответствующего предельного углеводорода на –
илен (этилен, пропилен и т. д.).
Особенности систематической (международной) номенклатуры:а) названия этих углеводородов принимают суффикс –
ен(этен, пропен, бутен и т. д.); б) гомологи этилена должны отличаться друг от друга по составу молекул на группу атомов СН2; в) в молекуле каждого непредельного углеводорода при образовании двойной связи на два атома водорода меньше, чем в молекуле соответствующего предельного углеводорода; г) состав углеводородов ряда этилена (этена) выражается формулой СnН2n; д) непредельные углеводороды могут образовывать
радикалы.
Реакция присоединения, характерная для всех алкенов:
1. Присоединение водорода.
Эта реакция протекает в присутствии катализатора – мелко раздробленного никеля, платины или палладия – при комнатной температуре.
Реакция гидрирования, или гидрогенизация,– это присоединение водорода к веществу.
При гидрогенизации олефины превращаются в предельные углеводороды.
2. Присоединение галогенов.
Реакция протекает при обычных условиях.
Дихлорэтан– это жидкость, которая хорошо растворяет органические вещества.
Реакция присоединения брома служит качественной реакцией на непредельные углеводороды.
3. Присоединение галогеноводородов.
Галогенопроизводные углеводороды можно получить двумя путями:
1) присоединение к этилену хлороводорода;
2) замещение водорода в этане на хлор.
4. Присоединение воды.
Реакция протекает в присутствии катализатора –
серной кислоты.
Сначала происходит присоединение серной кислоты к этилену по месту разрыва двойной связи с образованием
этилсерной кислоты.
Затем этилсерная кислота при взаимодействии с водой образует спирт и кислоту.
Реакция присоединения воды к этилену в присутствии твердых катализаторов используется для промышленного получения этилового спирта из непредельных углеводородов, которые содержатся в газах крекинга нефти (попутных газах), а также в коксовых газах.
Важным химическим свойством этилена и его гомологов является способность легко окисляться при обычной температуре.
Конец бесплатного ознакомительного фрагмента.
Страницы:
1, 2
|
|