 |
|
���������� ������:: ��� :: ����� ����� �������� :: ������ ����� :: ������� ��� ���������� :: ������� ������ :: ������ ����� ���� :: ������ ����� :: �������� ����� :: ���� ��������� :: ������ ���� ���������� �����:: ����� ���� :: ���������� �� ������� Windows XP :: ������ ����� :: ������ ��� ��������� :: "������ ����" :: ��� ���� :: ���� ��������� ������ :: ���� ������� :: ���������� III :: ����� ����� ������! |
������� ��������� ������������ (��)ModernLib.Net / ������������ / ��� / ������� ��������� ������������ (��) - ������ (���. 4)
Для проведения реакций, требующих механического перемешивания реагентов, особенно при средних и высоких давлениях, применяют Р. х. с экранированным приводом, освобождающим от сложных уплотняющих устройств (сальников). При расчёте Р. х. определяются необходимые для достижения заданной производительности объём, скорость потока, поверхность теплообмена, гидравлическое сопротивление, скорость замены катализатора, конструктивные параметры (особенно Р. х. высокого давления). Для расчёта используются экспериментальные данные по кинетике реакций и отравлению катализатора, скорости тепло- и массопереноса и пр. (см. Макрокинетика ). Наиболее полный расчёт, включая определение полей температуры и концентрации в Р. х., определение оптимальной схемы теплообмена и рециркуляции, анализ устойчивости режима Р. х. и выбор параметров регулирующих устройств, проводится с использованием ЭВМ (см. Моделирование ). В реакторостроении наблюдается тенденция создания аппаратов большой мощности. Лит.:Арис Р., Анализ процессов в химических реакторах, М., 1967; Левеншпиль О., Инженерное оформление химических процессов, пер. с англ., М., 1969; Иоффе Л. И., Письмен Л. М., Инженерная химия гетерогенного катализа, 2 изд., Л., 1972. Л. М. Письмен. 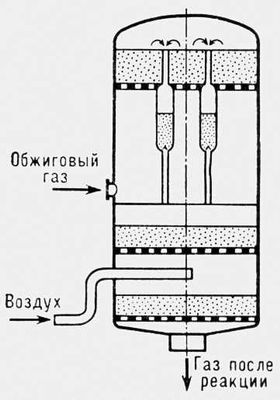
Рис. 2. Контактный аппарат с тремя ступенями контактирования и вводом воздуха между ступенями. 
Рис. 1. Колонна для синтеза аммиака под высоким давлением: 1 - корпус колонны; 2 - изоляционная труба; 3 - теплообменная труба; 4 - катализаторное пространство; 5 - центральная труба; 6 - спираль нагрева; 7 - стальной стержень. Движение реакционной смеси указанно стрелками. 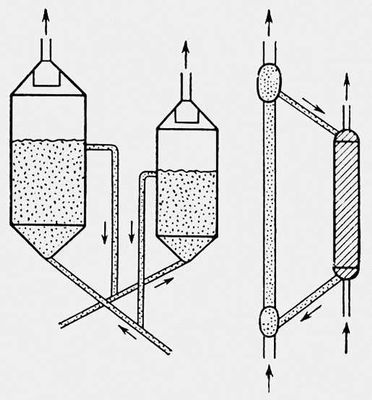
Рис. 4. Схемы установок с циркулирующим катализатором: а - реактор и регенератор с кипящим слоем; б - реактор с падающим слоем и регенератор с движущимся слоем в режиме пневмотранспортера: 1 - реактор; 2 - регенератор; 3 - фильтр или циклон; 4 - отработанный катализатор; 5 - регенерированный катализатор; 6 - сырье; 7 - регенерирующий газ. 
Рис. 3. Контактный аппарат для окисления нафталина во фталевый ангидрид: 1 - катализаторные трубки; 2 - расплав солей (селитрянная баня); 3 - пропеллерная мешалка; 4 - трубки для воздушного охлаждения; 5 - рубашка для воздушного охлаждения; 6 - коллектор отходящего воздуха. Реакции в электроразряде Реа'кции в электроразря'де,процессы химических превращений в низкотемпературной плазме; см. Плазмохимия. Реакции связей Реа'кции свя'зей,для связей, осуществляемых с помощью каких-нибудь тел (см. Связи механические ), - силы воздействия этих тел на точки механической системы. В отличие от активных сил, Р. с. являются величинами заранее неизвестными; они зависят не только от вида связей, но и от действующих на систему активных сил, а при движении - ещё и от закона движения системы и определяются в результате решения соответствующих задач механики. Направления Р. с. в некоторых случаях определяются видом связей. Так, если в силу наложенных связей точка системы вынуждена всё время оставаться на заданной гладкой (лишённой трения) поверхности, то Р. с. Rнаправлена по нормали nк этой поверхности ( рис. 1 ). На рис. 2 показаны гладкий цилиндрический шарнир (подшипник), для которого неизвестны две ( R xи R y), и гладкий сферический шарнир, для которого неизвестны все три ( R x, R y, R z) составляющие Р. с. Для шероховатой поверхности Р. с. имеет две составляющие: нормальную и касательную, называемую силой трения. В общем случае при решении задач динамики пользуются принципом освобождаемости, т. е. несвободную механическую систему рассматривают как свободную, прилагая к её точкам некоторые силы, подобранные так, чтобы во всё время движения системы выполнялись условия, налагаемые на неё связями; эти силы и называются Р. с. С. М. Тарг. 
Рис. 2. Примеры с неизвестными составляющими реакции связии: а - с двумя, б - с тремя. 
Рис. 1. Примеры связей, наложенных на тело P: а - гладкая поверхность; б - гладкая опора; в - нерастяжимая гибкая нить. Реакции химические Реа'кции хими'ческие,превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х. отличаются от ядерных реакций.Р. х. осуществляются при взаимодействии веществ между собой или при внешних воздействиях на них температуры, давления, электрического и магнитного полей и т.п. В ходе Р. х. одни вещества (реагенты) превращаются в другие (продукты реакции), что записывается в виде уравнений химических.Реагенты и продукты реакции часто носят общее название реактанты. Каждая Р. х. характеризуется стехиометрическим соотношением реактантов и скоростью химической реакции.Совокупность отдельных стадий Р. х., установленная экспериментально или предложенная на основе теоретических представлений, называется механизмом реакции. Любая Р. х. обратима, хотя скорости прямой и обратной реакций могут при этом существенно отличаться. Когда скорости прямой и обратной реакций равны, система находится в равновесии химическом.В положении равновесия или вблизи него поведение системы описывается законами и соотношениями термодинамики химической.В целом изучение механизмов и скоростей как обратимых, так и практически необратимых Р. х. составляет предмет химической кинетики, а при учёте также и физических процессов в системе (диффузия, теплопередача и др.) - предмет макрокинетики.При изучении Р. х. на молекулярном уровне используют представления о взаимодействии атомов и молекул при их столкновениях друг с другом, с электронами и др. частицами, о превращениях молекул при поглощении и испускании фотонов и т.п. Этот подход базируется, как правило, на квантовой теории и связан в основном с изучением элементарного акта Р. х., т. е. отдельного процесса столкновения молекул реактантов. Квантовомеханическое описание элементарного акта базируется на одном из двух подходов. При временном подходе элементарный акт рассматривается как процесс рассеяния подсистем (атомов, молекул, ионов) при их столкновении. Согласно стационарному подходу, исследуется движение конфигурационной точки (изображающей ядерную конфигурацию всей системы реактантов) по потенциальной поверхности, определяемой взаимодействием подсистем реактантов, в частности ядер молекул в усреднённом поле электронов. Начало стационарному подходу было положено введением представления об активированном комплексе.При сравнительном рассмотрении реакций, особенно в органической химии, пользуются обычно представлениями о наиболее вероятных механизмах реакций и об активности реагентов в определённых классах реакций, такими как реакционная способность , ориентации правила , нуклеофильные и электрофильные реагенты , принцип сохранения орбитальной симметрии (см. Симметрия в химии ) и т.п. Р. х. существенно зависят как от природы реактантов, так и от внешних условий реакции. Многие Р. х. возможны только под воздействием внешних источников энергии: тепловой, электромагнитной (фотохимические реакции), электрической (электрохимические реакции). При этом сама Р. х. может служить источником энергии. Количественное экспериментальное изучение Р. х. привело к установлению ряда основных законов химии, отражающих как стехиометрию, так и энергетику реакций. К таким законам относятся постоянства состава закон , Гесса закон и др. Классификация Р. х. проводится по различным признакам и различается в зависимости от того, в какой области химии они исследуются. Термодинамическая классификация использует в качестве таких признаков: энергетику реакций (экзотермические, т. е. идущие с выделением тепла, и эндотермические, т. е. идущие с поглощением тепла); количество фаз реактантов (гомогенные и гетерогенные реакции). Различают Р. х., идущие в объёме, на поверхности раздела фаз и т.д. Кинетическая классификация выделяет следующие признаки: скорость прямой и обратной реакций ( обратимые и необратимые реакции ); число взаимосвязанных реакций в системе (простая реакция, т. е. только одна, практически необратимая реакция, и сложная реакция , которую можно подразделить на несколько простых); молекулярность реакции (число молекул, одновременным взаимодействием между которыми осуществляется элементарный акт химического превращения); порядок реакции по каждому реагенту и в целом (см. Кинетика химическая ). Сложные Р. х. по форме связи простых реакций подразделяются на параллельные, последовательные, сопряжённые, обратимые и т.д. В отдельную группу выделяется обширный класс каталитических реакций (см. Катализ ). В зависимости от того, какие частицы участвуют в элементарном акте, реакции подразделяются на молекулярные, ионные, фотохимические и т.д., а также радикальные или цепные реакции.Детальное подразделение реакций проводится и по их механизму. В неорганической химии широко используется классификация Р. х. по типам участвующих в них соединений и по характеру их взаимодействия: реакции образования и разложения, гидролиза, нейтрализации реакции, реакции окисления-восстановления.Большую группу Р. х. составляют различные реакции комплексообразования. Органические реакции подразделяют на две большие группы: гетеролитические, при которых разрыв связи в молекуле происходит несимметрично и электроны остаются спаренными, и гомолитичные, в которых происходит симметричный разрыв связи, в результате чего образуются радикалы. В зависимости от типа атакующего реагента гетеролитические реакции могут быть нуклеофильными (обозначаются символом N) и электрофильными (символ Е). Основные три класса органических реакций включают замещения (обозначаются символом Sс индексами Nили Е), присоединения (символ А) и отщепления (элиминирования, символ Е). Каждая из этих реакций в зависимости от механизма может осуществляться как нуклеофильный, электрофильный или радикальный процесс. Особый класс реакций составляют реакции циклоприсосдинения. С учётом молекулярности лимитирующей стадии различают мономолекулярные (например, S E1) и бимолекулярные (например, S E2) реакции. Помимо указанных механизмов, присоединения и замещения реакции могут происходить в результате окислительно-восстановительного взаимодействия реагентов. Многие органические реакции включают ряд последовательных стадий, в том числе обратимых. Общая обратимость характерна для таких, например, реакций, как реакции металлирования и ароматического сульфирования. Возможны реакции, в которых промежуточные соединения вступают в параллельные реакции , что приводит к образованию смеси продуктов. Многочисленные превращения органических молекул включают процессы, происходящие без изменения состава, но приводящие к изменению химического строения (структуры) соединения, например различного типа изомеризации, молекулярные перегруппировки и таутомерные превращения (см. Органическая химия ). Понятие Р. х. является в известной степени условным. Так, к числу Р. х. обычно не относят образование ассоциатов в растворах, электронные возбуждения молекул (даже при существенном изменении равновесной геометрической конфигурации) и ряд др. процессов. Лит.:Эмануэль Н. М., Кнорре Д. Г., Курс химической кинетики, 2 изд., М., 1969; Курс физической химии, под общ. ред. Я. И. Герасимова, 2 изд., т. 2, М., 1973; Матье Ж., Панико Р., Курс теоретических основ органической химии, пер. с франц., М., 1975. Н. Ф. Степанов. Реакционная плавка Реакцио'нная пла'вка,способ получения металлов, в основе которого лежит взаимодействие между сульфидом и окислом извлекаемого металла ( MeS + 2 MeO = 3 Ме+ SO 2) или между сульфатом и окислом ( Me+ MeSO 4 = 2 Me+ 2SO 2). В металлургии свинца Р. п. называют также горновой. Процесс осуществляется в специальном горне, куда загружают богатый свинцовый концентрат и кокс. Шихту продувают сжатым воздухом. За счёт горения кокса и тепла, выделяющегося при окислении сульфидов, температура в горне поднимается до 700-900 °С; при этой температуре протекают основные взаимодействия Р. п., приводящие к вытапливанию чернового свинца. Шихта во время реакции должна находиться в рыхлом состоянии; контакт между компонентами достигается непрерывным перегребанием с помощью механического перегребателя. В черновой свинец переходит 70% металла из шихты, в т. н. серые шлаки 10-15%, в пыль 15-20%. Серые шлаки для доизвлечения свинца перерабатываются в шахтной печи, пыль возвращается в шихту Р. п. Принципы Р. п. используются в новых процессах получения свинца из частично обожжённых сульфидных концентратов: электроплавкой (Швеция), плавкой во взвешенном состоянии (Швеция, Финляндия), вдуванием концентратов в жидкую ванну конвертера (США). Взаимодействия, характерные для Р. п., используются в металлургии сурьмы при плавке окисленных и сульфидных концентратов, а также при конвертировании медных штейнов. В. Я. Зайцев. Реакционная способность Реакцио'нная спосо'бность,характеристика химической активности веществ, учитывающая как разнообразие реакций, возможных для данного вещества, так и их скорость. Например, благородные металлы (Au, Pt) и инертные газы (Не, Ar, Kr, Xe) химически инертны, т. е. у них низкая Р. с.; щелочные металлы (Li, Na, К, Cs) и галогены (F, Cl, Вг, I) химически активны, т. е. обладают высокой Р. с. В органической химии насыщенные углеводороды характеризуются низкой Р. с., для них возможны немногочисленные реакции (радикальное галогенирование и нитрование, дегидрирование, деструкция с разрывом С-С-связей и некоторые др.), происходящие в жёстких условиях (высокая температура, ультрафиолетовое облучение). Для галогенопроизводных насыщенных углеводородов уже возможны, кроме того, реакции дегидрогалогенирования, нуклеофильного замещения галогена, образования магнийорганических соединений и др., происходящие в мягких условиях. Наличие в молекуле двойных и тройных связей, функциональных групп (гидроксильной -ОН, карбоксильной -СООН, аминогруппы -NH 2и др.) приводит к дальнейшему увеличению Р. с. Количественно Р. с. выражают константами скоростей реакций (см. Кинетика химическая ) или константами равновесия в случае обратимых процессов (см. Равновесие химическое ). Современные представления о Р. с. основаны на электронной теории валентности (см. Валентность ) и на рассмотрении распределения (и смещения под действием реагента) электронной плотности в молекуле. Электронные смещения качественно описываются в терминах индуктивных и мезомерных эффектов (см. Мезомерия ), количественно - с применением квантовомеханических расчётов (см. Квантовая химия ). Главный фактор, определяющий относительную Р. с. в ряду родственных соединений, - строение молекулы: характер заместителей, их электронное и пространственное влияние на реакционный центр (см. Пространственные затруднения ), геометрия молекул (см. Конфигурация молекул, Конформация ). Р. с. зависит и от условий реакции (природы среды, присутствия катализаторов или ингибиторов, давления, температуры, облучения и т.п.). Все эти факторы оказывают на скорость реакций различное, а иногда противоположное влияние в зависимости от механизма данной реакции. Количественная связь между константами скорости (или равновесия) в пределах одной реакционной серии может быть представлена корреляционными уравнениями, описывающими изменения констант в зависимости от изменения какого-либо параметра (например, эффекта заместителя - уравнение Гаммета - Тафта, полярности растворителя - уравнение Брёнстеда и т.п.). См. также Реакции химические , Обратимые и необратимые реакции , Скорость химической реакции , Активированный комплекс , Катализ , Ориентации правила , Электронные теории в органической химии , Радикалы свободные. Реакция (в психологии) Реа'кцияв психологии, акт поведения, возникающий в ответ на определенное воздействие, стимул ; произвольное движение, опосредованное задачей и возникающее в ответ на предъявление сигнала. Необходимость исследования произвольной Р. возникла после того, как обнаружили, что астрономы, засекающие момент прохождения звезды через меридиан, дают разные показания, Ф. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106, 107 |
|||||||