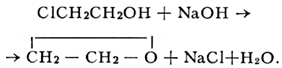|
|
Популярные авторы:: Кларк Артур Чарльз :: Горький Максим :: Чехов Антон Павлович :: Joyce James :: Борхес Хорхе Луис :: БСЭ :: Толстой Лев Николаевич :: Фармер Филип Хосе :: Азимов Айзек :: Лондон Джек Популярные книги:: The Boarding House :: Бурый волк :: Единственный способ :: Подземная Москва :: Чужое :: Справочник по реестру Windows XP :: Движущая сила :: Легенды о звездных капитанах :: Операция «Мэйфлауэр» :: На другой планете |
Большая Советская Энциклопедия (ЭТ)ModernLib.Net / Энциклопедии / БСЭ / Большая Советская Энциклопедия (ЭТ) - Чтение (стр. 3)
Этилбензол Этилбензо'л,C 6H 5CH 2CH 3, бесцветная жидкость; t kип136,2°С, t пл- 94,97°С, плотность 0,867 г/см 3(20°С); почти нерастворим в воде, растворяется в спирте, бензоле, эфире, четыреххлористом углероде. Э. содержится в нефти и каменноугольной смоле. В промышленности получают главным образом из бензола и этилена (по Фриделя - Крафтса реакции ) .При пропускании паров Э. над катализаторами образуется стирол,являющийся сырьем при производстве важных промышленных продуктов - некоторых видов пластмасс (см. Полистирол ) и каучуков синтетических.Э. используют также в органическом синтезе, например для получения ацетофенона жидкофазным каталитическим окислением, как растворитель и компонент высокооктановых бензинов. Предельно допустимая концентрация паров Э. в воздухе 0,05 мг/л. Этилбромид Этилброми'д,бромистый этил, бромэтан, C 2H 5Br, бесцветная жидкость со слабым эфирным запахом; t пл- 119°С, t kип38,3°С, плотность 1,459 г/см 3(20°С); плохо растворим в воде. Получают из этилового спирта: C 2H 5OH + KBr + H 2SO 4® C 2H 5Br + KHSO 4+ H 2O. Применяют в органическом синтезе для введения этильной группы C 2H 5- (см. Алкилирование ) .Входит в состав этиловой жидкости. Этилдихлорарсин Этилдихлорарси'н,C 2H 5AsCl 2, бесцветная маслянистая жидкость; t пл -65°С, t kип155,3°С, плотность 1,1420 г/см 3(14,5 °С). Э. применяли как отравляющее вещество в 1-ю мировую войну 1914-18. По токсическим свойствам аналогичен люизиту. Этилен Этиле'н,этен, H 2C=CH 2, ненасыщенный углеводород,первый член гомологического ряда олефинов,бесцветный газ со слабым эфирным запахом; t nл -169,5°С, t kип- 103,8°С, плотность 0,570 г/см 3(при t kип); практически нерастворим в воде, плохо - в спирте, лучше - в эфире, ацетоне. Температура воспламенения 540°С, горит слабокоптящим пламенем, с воздухом образует взрывоопасные смеси (3--34 объемных %). Э. весьма реакционноспособен. Наиболее характерно для него присоединение по двойной углерод-углеродной связи, например каталитическое гидрирование Э. приводит к этану: H 2C = CH 2+ H 2® H 3C-CH 3, хлорирование - к дихлорэтану: H 2C = CH 2+ Cl 2® ClH 2C-CH 2Cl, гипохлорирование (присоединение хлорноватистой кислоты) - к этиленхлоргидрину: H 2C=CH 2+ HOCl ® HOH 2C-CH 2Cl. Многие реакции Э. лежат в основе промышленных способов получения ряда важных продуктов; так, сернокислотной или прямой гидратацией из Э. получают этиловый спирт,каталитическим окислением - этилена окись и ацетальдегид,алкилированием бензола (по Фриделя - Крафтса реакции ) - этилбензол,полимеризацией, например в присутствии катализаторов Циглера - Натта,- полиэтилен, окислительным хлорированием - винилхлорид,сочетанием с уксусной кислотой - винилацетат,присоединением HCl- этилхлорид,взаимодействием с хлоридами серы - иприт и т. д. Основные промышленные методы получения Э.- высокотемпературный (700-850°С) пиролиз и крекинг жидких дистиллятов нефти и низших парафиновых углеводородов, главным образом этана и пропана (см. Газы нефтепереработки ) .Выделение и очистку Э. проводят ректификацией, дробной абсорбцией, глубоким охлаждением. В лабораторных условиях Э. можно получать дегидратацией этилового спирта, например нагреванием с серной или ортофосфорной кислотой. Этилен в организме. Э. образуется в незначительных количествах в тканях растений и животных как промежуточный продукт обмена веществ. Содержащийся в различных органах высших растений (плодах, цветках, листьях, стеблях, корнях) Э. антагонистически взаимодействует с гормонами растений - ауксинами (Э. и ауксины ингибируют биосинтез и функционирование друг друга). Сдвиг в сторону преобладающего действия Э. способствует замедлению роста, ускорению старения, созревания и опадения плодов, ускорению сбрасывания цветков или только их венчиков, завязей, листьев, а в сторону преобладающего действия ауксинов - замедляет старение, созревание и опадение плодов и т. п. Пути биосинтеза Э. и его метаболизм в растительных тканях окончательно не выяснены. Э. используют для ускорения созревания плодов (например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов), дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая. В высоких концентрациях Э. оказывает на человека и животных наркотическое действие. Лит.:Дженсен Ю., Этилен и полиацетилены, в кн.: Биохимия растений, пер. с англ., М., 1968; Стимуляция и торможение физиологических процессов у растений, в сборнике: История и современное состояние физиологии растений, М., 1967. Ю. В. Ракитин. Этилена окись Этиле'на о'кись,этиленоксид, оксиран,
гидрогалогенирование - к соответствующим этиленгалогенгидринам (например,
В этих и многих аналогичных реакциях Э. о. является эффективным алкилирующим агентом (с её помощью вводится b-оксиэтильная группа HOCH 2CH 2-), что широко используется в промышленности и лабораторной практике для получения ценных продуктов, например этиленциангидрина (взаимодействием с синильной кислотой ) , этиленгликоляи его моноэфиров - целлозольвов (гидратацией и алкоголизом), этаноламинов (реакцией с аммиаком), b-меркаптоэтанола HSC 2CH 2OH и (взаимодействием с сероводородом), b-фенил-этилового спирта ( Фриделя - Крафтса реакцией с бензолом). Для Э. о. характерна (также идущая с разрывом связи С-О) полимеризация. Так, при пропускании паров Э. о. при 110-160°С над NaHSO 4образуется её димер - диоксан;под каталитическим действием третичных аминов или хлорида олова (IV) Э. о. легко полимеризуется (иногда со взрывом) уже при обычной температуре. Полиэтиленоксиды [-CH 2-CH 2-O] nимеют широкий интервал молекулярных масс (от 10 2до 10 7). Различают низкомолекулярные полимеры, т. н. полиэтиленгликоли (молекулярная масса до 40 тыс.), и высокомолекулярные (от 500 тыс. до 10 млн.). Полиэтиленгликоли - жидкие или воскообразные продукты, получаемые каталитической полимеризацией Э. о. при 100 - 150°С и используемые в текстильной промышленности (как смачиватели, умягчители и антистатические агенты), в косметике и как компоненты моющих средств. Высокомолекулярные полимеры Э. о. в промышленности получают суспензионной каталитической полимеризацией при 20-50°С; они представляют собой твёрдые продукты с хорошими термопластическими и механическими свойствами, некоторой водорастворимостью; используются как флокулянты, для снижения гидродинамического сопротивления водных потоков, в текстильной промышленности (как загустители). В качестве эмульгаторов и компонентов моющих средств применяются продукты конденсации Э. о. с высшими спиртами (олеиловым, лауриловым, стеариловым), алкилфенолами, например с изооктилфенолом, с жирными карбоновыми кислотами, представляющие собой полиэтиленгликолевые эфиры типа RO (CH 2CH 2O) n-Н, где R - органический радикал, а
Циклические простые эфиры, получаемые из Э. о., - т. н. краунэфиры, широко применяют в органическом синтезе для разъединения ионных пар различных солей в апротонных биполярных растворителях, как, например, краун 18-6 для связывания иона калия. Основные промышленные методы получения Э. о. - каталитическое окисление этилена кислородом воздуха при 200-300°С над катализатором, содержащим металлическое серебро, и дегидрохлорирование этиленхлоргидрина.Важное значение Э. о. имеет также в тонком органическом синтезе: например реакцией её с ацетоуксусным эфиром получают ацетобутиролактон, используемый в производстве витамина B 1и являющийся промежуточным продуктом для получения противомалярийных препаратов. Э. о. токсична: в малых количествах она обладает наркотическим действием, в значительных - приводит к раздражению слизистых оболочек, удушью и отёку лёгких. Предельно допустимая концентрация Э. о. в воздухе - 0,001 мг/л. Этиленгликоль Этиленглико'ль,этандиол-1,2, HOCH 2CH 2OH, простейший гликоль,бесцветная вязкая жидкость со сладким вкусом; t пл-12,3°С, t kип196°С, плотность 1,113 г/см 3(20°С); смешивается во всех соотношениях с водой, спиртом, ацетоном, плохо растворим в эфире, не растворим в хлороформе, алифатических и ароматических углеводородах; гигроскопичен. Важным свойством Э. является его способность сильно понижать температуру замерзания воды (до - 25°С при 40%-ном содержании Э. в воде и до -40°С при 60%-ном), что широко используется для приготовления антифризов.Подобно другим двухатомным спиртам, Э. образует моно- и дигликоляты, например HOCH 2CH 2ONa и NaOCH 2CH 2ONa, эфиры (простые и сложные) и другие производные, среди которых наибольшую практическую ценность имеют простые моноэфиры HOCH 2CH 2OR (т. н. целлозольвы ) ,где R - углеводородный радикал, используемые в качестве растворителей, и сложные полиэфиры (-ОСН 2СН 2ОСО-R-CO-) n, например полиэтилентерефталат,применяемые для изготовления синтетического волокна типа лавсан (см. Полиэфирные волокна ) .Сложный эфир Э. и азотной кислоты, т. н. нитрогликоль-взрывчатое вещество. Основной промышленный метод получения Э.- гидратация этилена окиси при 10 ати 190-200°С или при 1 ати 50-100°С в присутствии 0,1-0,5% серной (или ортофосфорной) кислоты; в качестве побочных продуктов при этом образуются диэтиленгликоль и незначительное количество высших полимергомологов Э. В ограниченных масштабах Э. применяют также как растворитель печатных и некоторых других красок, в производстве чернил и паст для шариковых ручек, в органическом синтезе. Э. токсичен. М. К. Грачев. Этилендиамин Этилендиами'н,1,2-диаминоэтан, H 2NCH 2CH 2NH 2, бесцветная жидкость с аммиачным запахом; t kип 116,5°С, t пл8,5°С, плотность 0,899 г/см 3(20°С); растворим в воде, спирте, хуже - в эфире, нерастворим в бензоле. Сильное основание. Соли Э. с жирными кислотами используют в текстильной промышленности как смягчающие агенты; тартрат Э. обладает пьезоэлектрическими свойствами. Взаимодействием с хлоруксусной кислотой получают этилендиаминтетрауксусную кислоту. Э. применяют в производстве фунгицидов, красителей, стабилизаторов латексов, эмульгаторов, пластификаторов и др., как отвердитель эпоксидных смол. Получают главным образом действием аммиака на дихлорэтан. Э. токсичен; предельно допустимая концентрация его паров в воздухе 0,001 мг/л. Этилендиаминтетраацетат натрия Этилендиаминтетраацета'т на'трия,дигидрат двунатриевой соли этилендиаминтетрауксусной кислоты, трилон Б, комплексон III, бесцветные кристаллы, хорошо растворимые в воде и щелочах. Э. н. - важнейший представитель комплексонов;он образует устойчивые внутрикомплексные соединения со многими двух- и трехзарядными катионами, что используется в комплексонометрии для определения Са, Mo, Со, Cu, Ni, Zn, Fe, Mn, Al, Ga, редкоземельных элементов и косвенного определения некоторых анионов, например PO 4 3-, SO 4 2-,CN -, а также для связывания ионов, мешающих фотометрическим и титриметрическим определениям. На этом же свойстве Э. н. основано его применение для умягчения воды и удаления следов металлов в фармацевтических и химических препаратах. Получают Э. н. из этилендиамина и монохлоруксусной кислоты (см. Хлоруксусные кислоты ) . Этиленимин Этиленими'н,азиридин, бесцветная легкоподвижная жидкость с запахом аммиака; t kип56,7°С, t пл-73,9°С, плотность 0,837 г/см 3 хорошо растворим в воде и большинстве органических растворителей.
Получают Э. из этаноламина и серной кислоты с последующей обработкой образовавшегося сернокислого эфира щелочью, а также действием щелочи на b-бромэтиламин. Э. сильно ядовит; предельно допустимая концентрация паров Э. в воздухе 0,02 мг/м 3.В жидком состоянии обладает сильным кожным действием. Э. и его производные проявляют мутагенные свойства; некоторые из них (ТЭФ, Тио ТЭФ и др.) применяются в качестве противоопухолевых средств алкилирующего действия, в сельскохозяйственной и микробиологической селекции. Полимер Э. - полиэтиленимин - малотоксичен, используется как вспомогательный агент, например для повышения прочности резин и бумаги, для очистки сточных вод. Этиленовые углеводороды Этиле'новые углеводоро'ды,то же, что олефины. Этилен-пропиленовые каучуки Этиле'н-пропиле'новые каучу'ки,синтетические каучуки, продукты сополимеризации этилена с пропиленом или двух этих мономеров с диолефином, содержащим несопряженные двойные связи (например, с 1,4-гексадиеном CH 2=CH- CH 2- CH=CH- CH 3). Молекулярная концентрация звеньев пропилена в макромолекуле Э.-п. к. 20-60%, звеньев диолефина-0,5-3,0%. Молекулярная масса каучуков 80 000-250 000, плотность 0,85-0,87 г/см 2, температура стеклования от -55 до -70°С, удельное объемное электрическое сопротивление 5 Ч 10 15 омЧ см,электрическая прочность 28- 32 Мв/м,или кв/мм,тангенс угла диэлектрических потерь (1-2)Ч10 -3. Э.-п. к. получают координационноионной полимеризацией в среде углеводородных растворителей, например н-гексана. Каучуки, синтезируемые из смеси трех мономеров (отечественная марка СКЭПТ), содержат в макромолекуле ненасыщенные связи и поэтому способны к вулканизации обычными серусодержащими системами. Сополимеры этилена с пропиленом (СКЭП) вулканизуются органическими перекисями. В резинах на основе Э.-п. к. хорошие прочностные и эластичные свойства (см. Резина ) сочетаются с высокой озоно-, тепло- и морозостойкостью, устойчивостью к действию многих органических растворителей, щелочей и кислот, а также с отличными диэлектрическими характеристиками. Э.-п. к. типа СКЭП применяют главным образом для изоляции проводов и кабелей; типа СКЭПТ - в производстве различных резинотехнических изделий, например шлангов, уплотнителей. В шинной промышленности эти каучуки используют ограниченно из-за низкой прочности связи резин на их основе с кордом. Торговые марки Э.-п. к., выпускаемых за рубежом,- висталон, нордель, эпкар (США), дютрал (Италия), АРТК (ФРГ), келтан (Нидерланды), эспрен EPDM (Япония) и др. Мировое производство Э.-п. к. в 1976 составило около 390 тыс. т.
Лит.:Энциклопедия полимеров, т. 3, М., 1977. Этиленхлоргидрин Этиленхлоргидри'н,(b-хлорэтиловый спирт, b-хлорэтанол, CICH 2CH 2OH, бесцветная жидкость со слабым эфирным запахом; t пл. -67,5°С, t kип- 128,8°С, плотность 1,202 г/см 3(20°С); смешивается во всех отношениях с водой, растворяется в большинстве органических растворителей, образует азеотропные смеси с водой (41% Э., t kип98°С), толуолом, циклогексаном. Наиболее важным свойством Э. является его способность отщеплять HCl под действием щелочей:
Указанная реакция, открытая в 1859 Ш. Вюрцем,лежит в основе одного из способов получения этилена окиси.В промышленности Э. синтезируют гипохлорированием этилена CH 2=CH 2+ Cl 2+ H 2O ® ClCH 2CH 2OH + HCl, а в лабораторных условиях - присоединением хлористого водорода к окиси этилена. Э. хорошо растворяет многие органические вещества, например ацетат целлюлозы и этилцеллюлозу, однако применение его в качестве растворителя крайне ограничено вследствие токсичности (предельно допустимая концентрация его паров в воздухе 0,5 мг/м 3) . Этиленциангидрин Этиленциангидри'н,нитрил b-оксипропионовой кислоты, HOCH 2CH 2CN; бесцветная вязкая жидкость, t пл- 46°С, t kип227-228°С (с разложением), плотность 1,040 г/см 3(25°С); смешивается во всех отношениях с водой, спиртом, эфиром, ацетоном, нерастворим в бензоле: растворяет эфиры целлюлозы и некоторые соли неорганических кислот. Получают Э. главным образом реакцией этилена окиси с синильной кислотой (в присутствии каталитических количеств цианида натрия NaCN или других щелочных агентов):
и используют в производстве таких важных продуктов, как акрилонитрил (дегидратацией в паровой или жидкой фазе) и акрилаты (действием спиртов в присутствии разбавленной серной кислоты). Этилморфина гидрохлорид Этилморфи'на гидрохлори'д,дионин, лекарственный препарат, близкий по действию к кодеину . Применяют главным образом внутрь в порошках и таблетках для уменьшения кашля при хронических бронхитах и других заболеваниях, а также в глазной практике в виде капель и мазей. Этиловая жидкость Эти'ловая жи'дкость,маслянистая жидкость с характерным фруктовым запахом; плотность 1,5-1,7 г/см 3.Представляет собой смесь 50-62% по массе тетраэтилсвинца или тетраметилсвинца с этилбромидом, дибромэтаном и др., способствующими удалению свинца из двигателя в виде его летучих галогенсодержащих соединений. Э. ж. используется для повышения детонационной стойкости авиационных и автомобильных бензинов. Так, добавка 0,5-4 млЭ. ж. к 1 кгбензина повышает его октановое число на 4-15. Э. ж. высокотоксична, отравления возможны при загрязнении воздуха ее парами, попадании на кожу. В связи с этим применение Э. ж. сокращается. В. С. Азев. Этиловый спирт Эти'ловый спи'рт,этанол, винный спирт, C 2H 5OH; бесцветная подвижная жидкость с характерным запахом и жгучим вкусом; t пл-114,15°С, t kип78,39°С, плотность 0,794 г/см 3; смешивается с водой, эфиром, ацетоном и многими другими органическими растворителями; легко воспламеняется (температура вспышки 14°С), с воздухом образует взрывоопасные смеси (3,28-18,95% по объему). Э. с. обладает всеми характерными для одноатомных спиртов химическими свойствами, например с щелочными и щелочноземельными металлами образует алкоголяты, с кислотами - сложные эфиры, при окислении - ацетальдегид, при дегидратации - этилен и этиловый эфир. При хлорировании Э. с. образуется хлораль. По объему производства Э. с. занимает одно из первых мест среди органических продуктов. До начала 30-х гг. 20 в. его получали исключительно сбраживанием пищевого углеводсодержащего сырья, главным образом зерна (рожь, ячмень, кукуруза, овес, просо), картофеля, мелассы (см. Брожение, Спиртовая промышленность) .В 30- 50-е гг. было разработано несколько способов синтеза Э. с. из химического сырья (гидратация этилена, гидрирование ацетальдегида и др.). Основной современный способ - одностадийная (прямая) гидратация этилена (CH 2= CH 2+ H 2O ® C 2H 5OH), осуществляемая на фосфорнокислотном катализаторе при 280-300°С и 7,2-8,3 Мн/м 2(72-83 кгс/см 3) .Так, в США в 1976 было выработано около 800 тыс. тэтанола, в том числе 550 тыс. тпрямой гидратацией (остальное - сбраживанием пищевого сырья). В других странах (СССР, Франция и др.) Э. с. получают также двухстадийной (сернокислотной) гидратацией этилена: при 75-80°С и 2,48 Мн/м 2(24,8 кгс/см 3) этилен взаимодействует с концентрированной серной кислотой с образованием смеси моно- и диэтилсульфатов (C 2H 5OSO 2OH и (C 2H 5O) 2SO 2), которые затем, гидролизуясь при 100°С и 0,3- 0,4 Мн/м 2(3-4 кгс/см 3) ,дают Э. с. и H 2SO 4. В ряде стран Э. с. получают также сбраживанием продуктов гидролиза растительных материалов (см. Гидролизная промышленность ) и сульфитных щелоков. Очистку технического Э. с. проводят различными способами. Пищевой спирт-сырец, например, обычно освобождают от примесей ( сивушное масло и др.) ректификацией. Синтетический Э. с. очищают от этилового эфира, ацетальдегида и других ректификацией в присутствии щелочи и гидрированием в паровой фазе на никелевых катализаторах при 105°С и 0,52 Мн/м 2(5,2 кгс/см 3) .Спирт-ректификат представляет собой азеотропную смесь Э. с. с водой (95,57% спирта, t kип78,15°С). Для многих целей требуется обезвоженный, так называемый абсолютный, Э. с. Последний в промышленности готовят, удаляя воду в виде тройной азеотропной смеси вода - спирт - бензол (специальная добавка), а в лабораторных условиях - химическим связыванием воды различными реагентами, например окисью кальция, металлическим кальцием или магнием. Э. с., предназначенный для технических и бытовых целей, иногда денатурируют (см. Денатурированный спирт ) .Применяют Э. с. как растворитель (в лакокрасочной, фармацевтической и парфюмерно-косметической промышленности, в производстве взрывчатых веществ, кино- и фотоплёнки), в качестве сырья для получения многих промышленных продуктов, например бутадиена, этилацетата.Весьма перспективно использование Э. с. для получения белково-витаминного концентрата (см. Микробиологическая промышленность ) .Значительные количества Э. с., производимого из пищевого сырья, расходуются на приготовление ликёро-водочных изделий и водки. Э. с. - наркотическое вещество, вызывает характерное алкогольное возбуждение; в больших дозах угнетает функции центральной нервной системы. В медицине применяют главным образом как наружное антисептическое и раздражающее средство для обтираний, компрессов и т. п., а также для приготовления настоек, экстрактов и других лекарственных форм. Лит.:Стабников В. Н., Ройтер И. М., Процюк Т. Б., Этиловый спирт, М., 1976. Этиловый эфир Эти'ловый эфи'р,диэтиловый эфир, серный эфир, (C 2H 5) 2O; важнейший представитель эфиров простых,бесцветная легкоподвижная жидкость со своеобразным запахом, t пл- 116,2°С, t k ип34,6°С, плотность 0,713 г/см 3(20°С); смешивается во всех отношениях со спиртом и многими другими органическими растворителями, ограниченно растворим в воде (6,6% при 20°С), хорошо растворяет жиры; образует с водой азеотропную смесь (98,74% Э. э.; t kun34,25°С); легко воспламеняется; с воздухом образует взрывоопасные смеси (1,71-48,0% по объёму); при хранении медленно окисляется кислородом воздуха с образованием взрывчатых перекисных соединений. Получают Э. э. из этилового спирта действием серной кислоты (отсюда название «серный эфир») при 130-140°С или парофазной дегидратацией над окисью алюминия Al 2O 3(или алюмокалиевыми квасцами) при 200-250°С. Э. э. применяется как растворитель и экстрагент в промышленности (например, при производстве порохов, кино- и фотоплёнки) и лабораторной практике (например, в Гриньяра реакции ) .В медицине применяют 2 вида Э. э. - эфир медицинский (главным образом наружно, а также для изготовления настоек, экстрактов и др., иногда при рвоте - внутрь) и специально очищенный эфир для наркоза (в хирургической практике для ингаляционного наркоза,иногда для обезболивания родов в виде масляной клизмы). Предельно допустимая концентрация паров Э. э. в воздухе 0,3 мг/л. Этилсерная кислота Этилсе'рная кислота',кислый этиловый эфир серной кислоты, моноэтил-сульфат, C 2H 5OSO 2OH; сиропообразная гигроскопическая жидкость, плотность 1,316 г/см 3(17°С); хорошо растворима в воде, спирте, эфире. Э. к. - сильная одноосновная кислота, образует соли, например C 2H 5OSO 2ONa, эфиры C 2H 5OSO 2OR и другие производные. Э. к.- промежуточный продукт одного из промышленных способов получения этилового спирта . Получают взаимодействием спирта с серной кислотой, применяют главным образом для этилирования (введения в химические соединения этильной С 2Н 5-группы), например для получения этилбромида. Этилхлорид Этилхлори'д,монохлорэтан, C 2H 5Cl; бесцветная легко летучая жидкость с эфирным запахом, t kип12,5°С, t пл-140,85°С, плотность 0,903 г/см 3(15°С); плохо растворим в воде, смешивается с большинством органических растворителей. Горит, пределы взрывоопасных концентраций с воздухом 3,8-15,4% (по объёму). 1, 2, 3, 4, 5, 6, 7, 8 |
|||||||
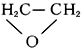 , простейший представитель эпоксидов (циклических простых эфиров с a-окисным трёхчленным кольцом), бесцветный газ с эфирным запахом;
t
пл
-111,3°С,
t
kип10,7°С, плотность 0,891
г/
см
3(4°С). Э. о. хорошо растворима в воде, спирте, эфире и многих других органических растворителях; легко воспламеняется; образует с воздухом взрывоопасные смеси (3-80% по объёму). Химические свойства Э. о. определяются наличием напряжённого и вследствие этого сравнительно легко размыкающегося (под действием высокой температуры и различных химических реагентов) эпоксидного цикла. Так, при нагревании до 400°С (в присутствии Al
2O
3- при 150-300°С) Э. о. изомеризуется в
ацетальдегид;гидрирование Э. о. (над никелем при 80°С) приводит к этиловому спирту
, простейший представитель эпоксидов (циклических простых эфиров с a-окисным трёхчленным кольцом), бесцветный газ с эфирным запахом;
t
пл
-111,3°С,
t
kип10,7°С, плотность 0,891
г/
см
3(4°С). Э. о. хорошо растворима в воде, спирте, эфире и многих других органических растворителях; легко воспламеняется; образует с воздухом взрывоопасные смеси (3-80% по объёму). Химические свойства Э. о. определяются наличием напряжённого и вследствие этого сравнительно легко размыкающегося (под действием высокой температуры и различных химических реагентов) эпоксидного цикла. Так, при нагревании до 400°С (в присутствии Al
2O
3- при 150-300°С) Э. о. изомеризуется в
ацетальдегид;гидрирование Э. о. (над никелем при 80°С) приводит к этиловому спирту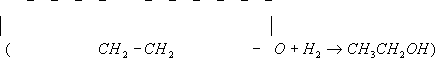
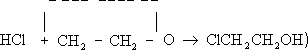
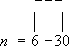 .
. ,
,